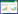扩展功能
文章信息
- 赵梓雯, 杨虹
- ZHAO Zi-Wen, YANG Hong
- 短双歧杆菌对鼠伤寒沙门氏菌的抑制
- Inhibition of Salmonella typhimurium by Bifidobacterium breve
- 微生物学通报, 2019, 46(10): 2673-2688
- Microbiology China, 2019, 46(10): 2673-2688
- DOI: 10.13344/j.microbiol.china.180862
-
文章历史
- 收稿日期: 2018-11-01
- 接受日期: 2019-02-21
- 网络首发日期: 2019-07-23
由食源性致病菌引发的食物中毒已经成为严重的公共卫生问题之一,在全球范围内得到了广泛关注。在各类细菌性感染中,由沙门氏菌引起的中毒在食源性中毒事件中占比较大,位居第三[1]。根据美国疾病预防控制中心(Centers for disease control and prevention,CDC)的统计,沙门氏菌在美国每年导致约120万例疾病,约450例造成死亡[2]。鼠伤寒沙门氏菌(Salmonella typhimurium,S. typhimurium)作为沙门氏菌最常见的血清型,是世界范围内分布最广泛的人畜共患食源性病原体之一,也是导致急性腹泻的主要致病因子,主要病症包括局部胃肠炎和全身性感染[3]。
沙门氏菌利用菌毛粘附在肠道上皮细胞表面,进而入侵细胞组织造成损伤,最终诱发严重感染甚至死亡。针对沙门氏菌所引起的感染,目前主要的治疗手段是应用氟喹诺酮类药物或广谱头孢菌素[4]。但是由于抗生素在人药和畜牧业的滥用,导致近年来沙门氏菌耐药性逐渐增强、耐药谱加宽等一系列严重问题[5]。另外抗生素对肠道菌群的破坏等问题也相继产生,这说明采用传统的抗生素疗法愈加困难。因此,在临床上有待开发新型绿色的抗感染药物来预防和治疗沙门氏菌感染,其中从微生物或植物中寻找抗生素替代品是当前的研究热点之一。
大量研究表明,益生菌作为人体肠道菌群的重要组成部分之一,在胃肠微生态环境保护、机体免疫力增强,以及抗菌治疗方面有优于药物的功效,许多研究相继证明了益生菌对肠道病原菌包括沙门氏菌属有良好的拮抗作用。如Kemgang等证明了鼠李糖乳杆菌S1K3的无细胞发酵上清液对沙门氏菌良好的抑菌活性,并且在小鼠模型中降低了粪便的沙门氏菌数量[6]。现阶段关于益生菌对病原微生物的拮抗作用已经提出了许多理论,包括竞争排斥[7]、病原体生长抑制[8]、宿主免疫调节[9]等。但益生菌的益生作用具有由属至种最后明确到单一菌株的特异性[10],而短双歧杆菌拮抗鼠伤寒沙门氏菌的确切机制尚不明确。
抑菌剂在临床应用上到达肠道时往往已被稀释,难以达到直接抑菌的效果,但某些药物和天然化合物已被证实,在亚抑制浓度(Sub-inhibitory concentrations,SIC)下即使无法抑制致病菌生长,也能对其毒力产生重要的影响。Li等发现了真菌聚酮化合物在SIC水平下可以对沙门氏菌Ⅰ型毒力岛(SPI-1)相关基因的表达起到显著抑制作用,最终降低沙门氏菌侵袭HeLa细胞的能力[11]。然而,也有部分学者发现SIC水平的某些化合物会使致病菌的毒性增加[12]。目前尚无益生菌在SIC水平下对S. typhimurium毒性影响的相关研究,基于此,本研究增加短双歧杆菌在SIC水平下对S. typhimurium的抑菌作用考察,这对实际应用中短双歧杆菌的剂量使用具有指导意义。
本研究从多株实验菌株中筛选到一株具有优良拮抗S. typhimurium能力的短双歧杆菌YH68,并基于它在体外的抑菌活性深入研究其对于S. typhimurium感染抗性的机制。同时,采用肠上皮细胞系模型研究YH68对S. typhimurium感染宿主细胞的影响,从分子、细胞多方面进行考察,为益生菌预防和治疗沙门氏菌感染提供更深入的理论基础。
1 材料与方法 1.1 材料 1.1.1 菌株与细胞株鼠伤寒沙门氏菌ATCC 14028购买自美国菌种保藏中心;实验用益生菌菌株(短双歧杆菌菌株)由嘉兴益诺康生物科技有限公司提供,益生菌菌株信息如表 1所示。人结肠癌细胞株HT29购买自中国科学院典型培养物保藏委员会细胞库。
| 菌株编号 Strains No. |
菌株来源 Origins |
| BB01 | Human |
| BB02 | Human |
| BB04 | Human |
| BB05 | Human |
| BB08 | Human |
| BB11 | Human |
| BB15 | Human |
| YH68 | Human |
LB培养基、琼脂糖、0.22 µm微孔滤膜,生工生物工程(上海)股份有限公司;MRSc培养基[加0.05% (质量体积比)的L-半胱氨酸],Oxford公司;无水乙醇(分析纯)、叔丁醇(分析纯)、戊二醛(优级纯),国药集团化学试剂有限公司;LIVE/DEAD™ BacLight™ Bacterial Viability Kit L13152、RevertAid First Strand cDNA Synthesis Kit、细胞培养液、胎牛血清、胰蛋白酶、庆大霉素、0.5% Triton X-100,赛默飞世尔科技公司;细菌总RNA提取试剂盒,天根生化科技有限公司;TransStart Top Green qPCR SuperMix,北京全式金生物技术有限公司;荧光定量聚合酶链式反应用引物由华大基因合成。
1.1.3 仪器与设备紫外分光光度计,上海尤尼科仪器有限公司;全波长酶标仪,PE公司;微机型电导率仪,上海般特仪器有限公司;荧光定量PCR仪,Eppendorf公司;高分辨场发射扫描电子显微镜,FEI公司;TCS SP8 STED 3X激光共聚焦显微镜,徕卡公司。
1.2 方法 1.2.1 菌株的筛选(1) 菌株的培养
将S. typhimurium接种于新鲜的LB培养基中,生长至对数期时再次转接于新鲜培养基,传代3次后,将菌液与25% (体积比)的甘油以等体积混合后存放在−80 ℃冰箱中。活化时将冻存的菌液解冻后1% (体积比)接种于LB培养基中,在恒温摇床中约45°角倾斜放置,37 ℃、150 r/min摇床振荡培养12 h,备用。
(2) 益生菌无细胞发酵上清液(Cell-free supernatant,CFS)的制备
将待筛选的益生菌菌株通过3次接种传代,按1%接种量重新接种于新鲜MRSc液体培养基中,37 ℃厌氧培养18−24 h。将菌液通过麦氏比浊法调整细胞数为3×109 CFU/mL,离心(10 000×g,10 min,4 ℃),收集上清液并用0.22 µm滤膜过滤除去菌体细胞,将滤液置于4 ℃下保存备用。
(3) 牛津杯扩散实验
将生长至对数中期的S. typhimurium浓度调节至106 CFU/mL,取200 μL菌液至LB平板上涂布均匀,用镊子将牛津杯小心地放置于平板上,取不同的益生菌上清液200 μL注入杯内,以MRSc液体培养基作为阴性对照。先在4 ℃冰箱扩散4 h,然后将平板转移至37 ℃培养箱培养,24 h后观察抑菌结果并用游标卡尺测量抑菌圈的直径。
1.2.2 抑菌有效成分分析(1) 有机酸排除试验
用1 mol/L的NaOH调节YH68 CFS的pH至7.0,取200 μL样品注入牛津杯中,37 ℃培养24 h后测量抑菌圈直径,以未处理的YH68 CFS作为对照,以此排除发酵液中有机酸的抑制作用,重复3次测定平均值。
(2) 过氧化氢排除试验
用1 mol/L的NaOH调节YH68 CFS的pH至过氧化氢酶最适pH 7.0,向其中加入终浓度为5 mg/mL的过氧化氢酶,37 ℃恒温水浴2 h后取出,将样品调至原pH 3.6,用牛津杯扩散法测定其抑菌效果,对照组为未经过氧化氢酶处理的YH68 CFS,重复3次测定平均值。
(3) 蛋白酶敏感试验
用1 mol/L的NaOH调节YH68 CFS的pH至蛋白酶K最适pH 8.0,加入酶母液至蛋白酶K最终质量浓度为1 mg/mL,37 ℃水浴2 h后取出,将样品调至原pH 3.6,用牛津杯扩散法测定其抑菌活性,对照组为未经蛋白酶K处理的YH68 CFS,重复3次测定平均值。
(4) 热处理试验
将YH68 CFS在121 ℃下加热20 min,取200 μL样品注入牛津杯中,37 ℃恒温培养24 h测定其抑菌效果,以4 ℃保存的YH68 CFS为对照,重复3次测定平均值。
1.2.3 YH68抑菌活性物质对鼠伤寒沙门氏菌的抑菌活性分析(1) 最小抑菌浓度(MIC)和亚抑制浓度(SIC)的确定
取1 mL细胞数为3×109 CFU/mL的YH68无细胞发酵上清液原液,通过最小二倍稀释法将上清液稀释为原来的5%−90% (体积比),从中取100 µL加入96孔板中,再接入100 µL的S. typhimurium菌液(1×106 CFU/mL),阴性对照为LB肉汤,阳性对照孔为未经处理的S. typhimurium菌液。37 ℃培养24 h后,用酶标仪测定在600 nm下的吸光度值,以未见指示菌生长的YH68 CFS的最小体积分数作为其对S. typhimurium的最小抑菌浓度(Minimum inhibitory concentration,MIC)[13],不抑制细菌生长的YH68 CFS最大体积分数作为亚抑制浓度(Sub-inhibitory concentrations,SIC)[14]。一式3份,重复3次。
(2) 生长曲线的绘制
将培养液调节为含有不同体积分数的YH68 CFS (0、SIC、MIC,其中空白组加入等体积的无菌水),接种等量的S. typhimurium使细菌浓度均为106 CFU/mL,37 ℃、150 r/min摇床振荡孵育,每隔1 h测定菌液OD600至16 h,绘制S. typhimurium在不同处理下的生长曲线。
(3) 时间-杀菌曲线的绘制
收集培养至对数生长期的S. typhimurium菌体细胞,制备浓度为106 CFU/mL的菌悬液,并向其中加入不同浓度的YH68抑菌活性物质,使其终浓度分别达到0、SIC、MIC,37 ℃培养24 h,在0、4、8、12、16、20、24 h分别从每个组别的离心管中吸取培养液,用LB肉汤进行10倍系列梯度稀释,并在LB平板上接种,37 ℃恒温培养24 h,通过肉眼对菌落进行计数以记录动力学增长信息,重复3次。以时间为横坐标,log10CFU/mL作为纵坐标,绘制时间与活菌数变化曲线。
1.2.4 YH68抑菌活性物质对鼠伤寒沙门氏菌抑制的机制研究(1) 不同处理下鼠伤寒沙门氏菌菌悬液的制备
收集培养至对数生长期的S. typhimurium菌体细胞,用0.1 mol/L pH 7.0的PBS缓冲液反复洗涤3次后,重悬于无菌水中,制备成菌悬液(106 CFU/mL),并向其中加入适量体积的YH68抑菌活性物质,使其最终浓度为SIC、MIC水平,以加入等体积无菌水的菌悬液作为空白对照,37 ℃恒温培养3 h。
(2) YH68抑菌活性物质对鼠伤寒沙门氏菌形态结构的影响
采用扫描电子显微镜(Scanning electron microscope,SEM)观察S. typhimurium菌体形态结构的变化,将1.2.3 (1)中的菌悬液离心(8 000×g,10 min,4 ℃),保留菌体细胞并用0.1 mol/L的PBS缓冲液反复清洗3遍,收集菌体;用2.5%的戊二醛(PBS稀释)固定3 h后,再用PBS洗3次,每次10 min;接着用体积分数为30%、50%、70%、80%、90%、100%的乙醇溶液对样品进行梯度洗脱处理,每次脱水时间为10 min;再用叔丁醇代替乙醇,将样品置于临界点干燥机中干燥;将干燥好的样品经离子溅射仪进行离子喷金,最后通过SEM观察并采集图像。
(3) YH68抑菌活性物质对鼠伤寒沙门氏菌细胞膜通透性的影响
通过测定空白对照组与处理组菌液相对电导率的变化来表示YH68 CFS对S. typhimurium细胞膜通透性的影响[15]。分别在0、0.5、1、2、3、4、5、6 h时间点取出1.2.2 (1)节中各组菌悬液5 mL,将样品进行离心(8 000×g,10 min,4 ℃)获得上清液,用电导率仪对上清液进行电导率的测定。
(4) YH68抑菌活性物质对鼠伤寒沙门氏菌细胞膜完整性的影响
1) 紫外吸收物质的测定
通过在260 nm和280 nm波长处监测细胞外紫外吸收物质的含量变化[16],初步分析YH68 CFS对S. typhimurium细胞膜完整性的影响作用。分别在0、30、60、90、120、150、180 min从对照组和处理组中的细胞悬液中取样。将样品离心(8 000×g,1 min,4 ℃),用0.22 μm微孔滤膜过滤。收集上清液进行10倍比稀释,取200 μL稀释液加入96孔板,用酶标仪测量OD260和OD280,重复3次。
2) 激光共聚焦显微镜观察
SYTO-9可以标记完整或受损的细胞膜,而PI染料只能标记受损的细胞膜。根据SYTO-9染料和PI染料竞争性绑定细菌核酸的原理,采用SYTO-9和PI荧光染料对S. typhimurium细胞进行双染,再次分析细胞完整性情况[17]。具体方法为:在暗室环境下打开LIVE/DEADTM BacLight L13152试剂盒,用A吸管吸取2.5 mL去离子水,配成2×SYTO-9储存液;用B吸管吸取2.5 mL去离子水,配成2×PI储存液,两管染料1:1混和后配成工作染料。在本实验中设置阳性对照组,即加入等体积的70%异丙醇处理3 h。将空白组、处理组、异丙醇阳性对照的菌悬液离心(10 000×g,2 min,4 ℃),并用无菌生理盐水重悬。然后按工作染料与菌悬液1:1 (体积比)的比例加入混匀,在37 ℃避光孵育15 min,再次离心(10 000×g,10 min,4 ℃),收集被标记的菌体细胞,无菌生理盐水重复漂洗3次并重悬。取3 μL悬液滴到载玻片上,加上盖玻片置于激光共聚焦显微镜下观察细胞染色情况并采集复合图片。
(5) YH68抑菌活性物质对鼠伤寒沙门氏菌致病相关毒力基因的影响
用试剂盒提取不同处理下的鼠伤寒沙门氏菌总RNA,用DNase去除污染的基因组DNA。将总RNA逆转录合成cDNA。逆转录体系:总RNA 1 μg,Oligo dT 1 μL,5×Buffer4μL,dNTPs (10 mmol/L) 2 μL,RNase Inhibitor 1 μL,ReverTraAce 1 μL,用ddH2O补足至20 μL。逆转录条件:65 ℃ 5 min;37 ℃ 15 min;98 ℃ 5 min。将RNA和逆转录的cDNA分别于−80 ℃和−20 ℃保存备用。采用荧光定量PCR方法通过特异性引物来检测S. typhimurium SPI-1相关基因的表达量,其中引物由Premier 5.0软件设计,由华大基因合成(引物序列见表 2)。PCR反应体系:cDNA 1μL,SYBR PremixExTaq (2×) 7.5 μL,正、反向引物(0.5 μmol/L)各0.3 μL,ddH2O 5.9 μL。以S. typhimurium的16S rRNA基因作为内参,PCR反应条件:95 ℃ 10 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,循环40次。通过2−ΔΔCt方法对数据进行处理,确定基因的相对表达量。
| 目的基因名称 Target genes name |
引物名称 Primers name |
引物序列 Primers sequence (5′→3′) |
| hilA | hilA-fw | TGACCATTACGAAGAACTG |
| hilA-rv | GGGAATACATCTGAGCAA | |
| fimA | fimA-fw | TACTATTGCGAGTCTGATGTT |
| fimA-rv | CAGGACGATGGAGAAAGG | |
| invF | invF-fw | TCGCCAAACGTCACGTAGAA |
| invF-rv | CATCCCGTGTATAACCCCCG | |
| sipA | sipA-fw | CCAACGCAATGGCGAGTCAC |
| sipA-rv | GCCGTCTCCGTTTGATGCGT | |
| sipB | sipB-fw | GTATGGCAGGCGATGATTGA |
| sipB-rv | ATAAACACTCTTGGCGGTATCC | |
| 16S rRNA | 16S rRNA-fw | CGATGTCTACTTGGAGGTTGTG |
| 16S rRNA-rv | CTCTGGAAAGTTCTGTGGATGTC |
(1) 细胞的培养
将人结肠癌细胞HT29按常规传代培养于含10%胎牛血清的RPMI-1640、100 U/mL链霉素和100 U/mL青霉素的细胞培养液中,于37 ℃的CO2培养箱(5% CO2,95%空气)中培养,每48 h换一次培养液。待细胞生长融合至70%−80%,用0.25%胰酶-EDTA消化传代,通常传代5次左右进行试验,调整浓度约为2.5×105 cells/mL备用。
(2) YH68抑菌活性物质对鼠伤寒沙门氏菌粘附肠上皮细胞的影响[18]
在24孔细胞培养板中加入细胞悬液(1 mL/孔),于5% CO2培养箱中37 ℃孵育,待细胞汇合成单层时(细胞数约为2.5×105 cells/孔),PBS清洗3次,将不同处理的S. typhimurium按照感染复数100:1与HT29细胞共培养2 h。孵育结束后,PBS洗涤细胞3次,洗去未载附至细胞的细菌。之后加入100 μL 0.5% Triton X-100作用5 min,反复吹打使细胞溶解。将裂解液用PBS缓冲液10倍比系列稀释,取适量稀释液涂布于LB平板上,37 ℃培养24 h进行菌落计数,设3个重复孔。通过吉姆萨染色法观察粘附情况,实验方法与上述操作相同,只需要培养前在孔板底加入无菌盖玻片,洗去未载附至细胞的细菌后用70%的甲醇固定10 min,用吉姆萨染液对细胞染色,对S. typhimurium粘附HT29细胞的情况拍照记录。
粘附率=CFUrec/CFUadded×100% (其中CFUrec表示细胞裂解后的细菌数,CFUadded表示加入孔中的细菌数)。
(3) YH68抑菌活性物质对鼠伤寒沙门氏菌侵袭肠上皮细胞的影响
侵袭实验采用庆大霉素保护法[19]。培养方法同1.2.4 (2),待S. typhimurium与细胞共孵育2 h后,用PBS冲洗3次以除去未粘附的细菌,再加入含有庆大霉素(100 μg/mL)的RPMI-1640培养液,于5% CO2细胞培养箱中37 ℃孵育2 h,以杀死粘附在细胞表面未侵入的S. typhimurium。PBS冲洗细胞3次,每孔加入100 μL 0.5% Triton X-100作用5 min,反复吹打使细胞裂解脱落。将裂解液进行10倍比系列稀释,取适量稀释液接种于LB平板进行活菌平板计数,设3个重复孔。对入侵情况进行吉姆萨染色,实验方法与上述操作相同,只需在培养前在孔底加入无菌盖玻片,待庆大霉素杀死粘附在细胞表面未侵入的S. typhimurium后70%的甲醇固定10 min,用吉姆萨染液对细胞染色,对S. typhimurium入侵细胞的情况拍照记录。
侵袭率=CFUintra/CFUadded×100% (其中CFUintra表示细胞内的细菌数,CFUadded表示加入孔中的细菌数)。
1.2.6 数据分析统计每个试验均重复3次,数据以
待筛选的益生菌CFS对S. typhimurium的抑菌圈直径如表 3中所示。可知所测试的短双歧杆菌对S. typhimurium都有不同程度的抑制作用,大多数菌株的抑菌圈直径平均值在11 mm−19 mm,其中YH68具有最强的抑菌能力,抑菌圈直径为22.27 mm,可作为后续试验菌株进行拮抗S. typhimurium的活性和机制研究。
| 菌株编号 Strains No. |
抑菌圈直径 Diamter of inhibition zone (mm) |
| MRS | 8.00±0.00f |
| BB01 | 17.47±0.18bc |
| BB02 | 18.29±0.36b |
| BB04 | 16.43±0.38cd |
| BB05 | 15.33±0.20d |
| BB08 | 16.38±0.75cd |
| BB11 | 16.01±0.32d |
| BB15 | 11.63±0.32e |
| YH68 | 22.27±0.44a |
| 注:不同字母代表组间差异显著(P < 0.05). Note: Different letters means significant difference between groups (P < 0.05). |
|
将实验组的发酵上清液pH调至7.0,以未处理的发酵上清液为对照,通过牛津杯法测定抑菌圈的大小。如表 4所示,实验组与对照组的抑菌圈直径相比明显减小(P < 0.05),说明无细胞发酵液中有机酸起到了很大的抑菌作用。但此时上清液仍具有一定的抑菌活性,说明排除有机酸的作用后,上清液中仍然存在其他的抑菌物质。
| 处理方式 Processing method |
抑菌圈直径 Diamter of inhibition zone (mm) |
| pH 7.0 | 12.56±0.27c |
| 过氧化氢酶处理Catalase treatment | 22.00±0.57a |
| 蛋白酶K处理Protease K treatment | 19.14±0.39b |
| 121 ℃加热处理121 ℃ heat treatment | 17.94±0.28b |
| 发酵原液The fermentation liquid | 22.14±0.52a |
| 注:不同字母代表组间差异显著(P < 0.05). Note: Different letters means significant difference between groups (P < 0.05). |
|
短双歧杆菌不含过氧化氢酶,产生的过氧化氢不断累积,可能会对致病菌产生抑制作用。过氧化氢排除实验的结果如表 4所示,经过氧化氢酶处理后的无细胞发酵液与对照组相比抑菌圈直径并没有显著变化,因此可以排除发酵上清液中过氧化氢的抑菌作用。
2.2.3 蛋白酶敏感试验由表 4可以看出,蛋白酶K处理后无细胞发酵液的抑菌圈大小与对照组相比有所减小,抑菌活性下降了13.6%,这说明上清液中的活性物质对蛋白酶敏感,可能存在抗菌类蛋白。
2.2.4 热处理试验将YH68无细胞发酵液经121 ℃加热处理后做抑菌活性检测,由表 4可知,热处理后提取物的抑菌活性有小幅度下降,但是其对指示菌的抑菌活性仍较高,由此可见YH68无细胞发酵液中的抑菌物质具有一定的热稳定性。
2.3 YH68对鼠伤寒沙门氏菌的抑菌活性分析 2.3.1 MIC和SIC的确定当3×109 CFU/mL细胞数对应的YH68 CFS稀释到≥50%原液时,菌悬液中OD600未见增大,由此确定YH68 CFS对S. typhimurium的最小抑菌浓度为250 μL/mL (体积比),而YH68 CFS稀释至≤12.5%原液时,菌悬液中OD600未见减小,确定亚抑制浓度为62.5 μL/mL (体积比)。
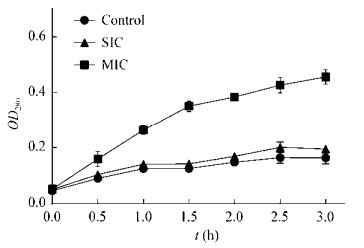
2.3.2 生长曲线的绘制在适宜生长条件下,细菌生长会表现出具有规律性的3个阶段:延滞期、对数期、稳定期[20]。空白组以及处理为SIC、MIC浓度时的生长曲线见图 1。结果发现,S. typhimurium在SIC剂量作用时与空白组的生长曲线基本一致,这也与微量稀释法的结果相同。空白组和SIC组的吸光度值都不断增加,在2−8 h内,吸光值成指数增加,在8−12 h内吸光值增长变得缓慢,12 h后趋于稳定,说明在有限的生存空间和营养条件下,细菌的数量达到了最大。而MIC处理组在0−3 h内S. typhimurium没有表现出明显的生长趋势,延滞期与空白组相比明显延长,在4 h进入指数期,4−9 h内吸光度值也在不断升高,但细菌生长速度要低于空白组,这说明YH68 CFS破坏了细菌正常的生长周期和细胞分裂。在9−16 h内吸光值趋于平稳,但吸光度峰值明显低于对照组,具有极显著性差异(P < 0.01)。这些都说明YH68 CFS在MIC浓度下对S. typhimurium生长起到了抑制作用,而在亚抑制浓度下对S. typhimurium生长几乎没有抑制作用。
|
| 图 1 YH68抑菌活性物质作用下鼠伤寒沙门氏菌的生长曲线 Figure 1 The growth curves of S. typhimurium on the effect of YH68 CFS |
|
|
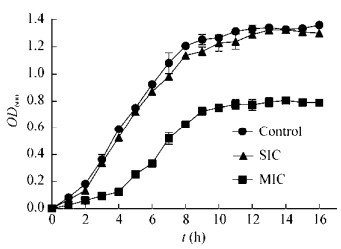
时间-杀菌曲线可以提供细菌生长动力学相关信息[21],结果见图 2。对照组、SIC剂量处理组菌落数在0−12 h呈现上升趋势,12−24 h趋于稳定或者略有下降,并且在SIC剂量作用下,曲线走势与对照组几乎一致,菌落数虽略有减少,但没有明显差异,可认为SIC剂量对S. typhimurium生长没有抑制作用。而在MIC剂量作用时,S. typhimurium的生长受到了明显的抑制作用,活菌数变化显著(P < 0.05)。前12 h菌落数呈现了快速下降的趋势,12 h时活菌数由6.1 log10CFU/mL减少至活菌数4.3 log10CFU/mL,下降了1.8 log10CFU/mL,经过24 h时菌落数下降量达最大值,下降了2.4 log10CFU/mL。
|
| 图 2 YH68抑菌活性物质作用下的的鼠伤寒沙门氏菌时间-杀菌曲线 Figure 2 Time-kill curves of S. typhimurium on the effect of YH68 CFS |
|
|
如图 3所示,可知未经处理的空白组和SIC剂量作用的S. typhimurium细胞表面光滑,细胞完整并且呈规则的短杆状形态;而经过MIC剂量的YH68 CFS处理3 h后,许多细胞形态发生不规则的改变,主要表现为细胞出现塌陷,形态扭曲,受损严重的细胞甚至出现破洞,取单个细胞放大50 000倍观察可以更加明显地看到其被破坏所形成的破洞。结果说明YH68 CFS在抑菌浓度下可以改变S. typhimurium细胞的外部形态,造成菌体细胞表面塌陷、破损,推测破坏所形成的破洞可能是造成S. typhimurium生长被抑制的直接原因,可能导致细胞内外物质非正常交换,影响细胞正常的代谢与增殖。

|
| 图 3 YH68抑菌活性物质作用下鼠伤寒沙门氏菌的SEM图 Figure 3 SEM of S. typhimurium treated with or without YH68 CFS 注:A:对照组(无菌水);B:YH68抑菌活性物质SIC剂量处理组;C:YH68抑菌活性物质MIC剂量处理组;箭头指向的鼠伤寒沙门氏菌的细胞形态已被改变. Note: A: Control cells (sterile water); B: Cells treated with YH68 CFS at SIC value; C: Cells treated with YH68 CFS at MIC value; And the cell morphology of S. typhimurium pointed by the arrows had been changed. |
|
|
细胞膜是细菌的保护屏障,如果菌体的保护屏障被打破,其内部电解质(如K+、Na+等)渗漏到细胞外的培养液中,使培养液的电导率上升。因此,电导率的变化可以反映YH68 CFS对S. typhimurium菌体细胞膜通透性的影响,排除代谢物自身的电导率影响(表 5),各组菌悬液的电导率如图 4所示。SIC剂量作用下和空白组的菌液电导率相比没有明显的差异,都呈现微小上升的趋势,空白组在6 h时的电导率值由0 h的11.69 ms/cm上升为12.11 ms/cm。而经YH68抑菌活性物质MIC剂量处理后的细胞上清液的电导率明显增大,且与对照组相比具有显著性差异(P < 0.05)。MIC剂量作用的前2 h,菌液的电导率迅速增大,时间点为2 h时电导率增长到13.41 ms/cm,之后的增长趋于平缓,电导率趋于稳定。结果显示YH68抑菌活性物质可以使S. typhimurium的细胞膜渗透性发生一定程度的改变,细胞内外渗透压的调节能力下降,胞内离子如K+、Na+等离子外泄增加,从而导致菌液的电导率增大。
| YH68无细胞发酵液 YH68 CFS |
电导率 conductivity (ms/cm) |
| MIC | 4.13±0.23 |
| SIC | 2.31±0.14 |

|
| 图 4 YH68抑菌活性物质作用下鼠伤寒沙门氏菌上清液电导率的变化 Figure 4 Effects of YH68 CFS on the extracellular conductivity of S. typhimurium |
|
|
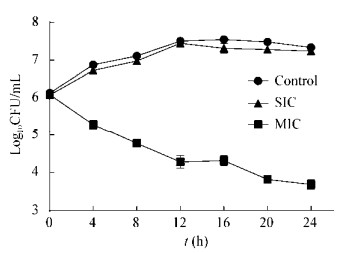
260 nm处主要为DNA、RNA的吸收峰,280 nm处主要是蛋白质的吸收峰,通过测定紫外吸收物质的浓度考察菌体核酸、蛋白等大分子内溶物质的释放情况[16],可以初步确定YH68 CFS对S. typhimurium细胞膜完整性的影响。由图 5可以看出核酸泄漏的情况,0 h时各组样品初始OD260均为0.093,空白组和SIC组在3 h内核酸含量没有明显的上升,而MIC处理组OD260逐渐增加,且在作用后的2 h达到最大值0.51,之后逐渐稳定。由图 6可以看出蛋白质泄漏的情况,空白组和SIC组蛋白质含量没有显著性差异,呈现微小的上升趋势。而经MIC剂量作用后,胞外OD280具有相对明显的增长趋势。作用3 h后,OD280由0 h的0.05增加至0.456,与对照组相比具有显著性差异(P < 0.05),但其泄漏程度没有核酸明显。通过此实验初步确定YH68 CFS抑菌浓度下可以破坏S. typhimurium细胞膜的完整性,使细菌内部的核酸和蛋白质穿过细胞膜进入到细菌外液中。
|
| 图 5 YH68抑菌活性物质作用下鼠伤寒沙门氏菌上清液于260 nm处吸光度值的变化 Figure 5 Effects of YH68 CFS on the UV absorption at 260 nm of S. typhimurium |
|
|
|
| 图 6 YH68抑菌活性物质作用下鼠伤寒沙门氏菌上清液于280 nm处吸光度值的变化 Figure 6 Effects of YH68 CFS on the UV absorption at 280 nm of S. typhimurium |
|
|
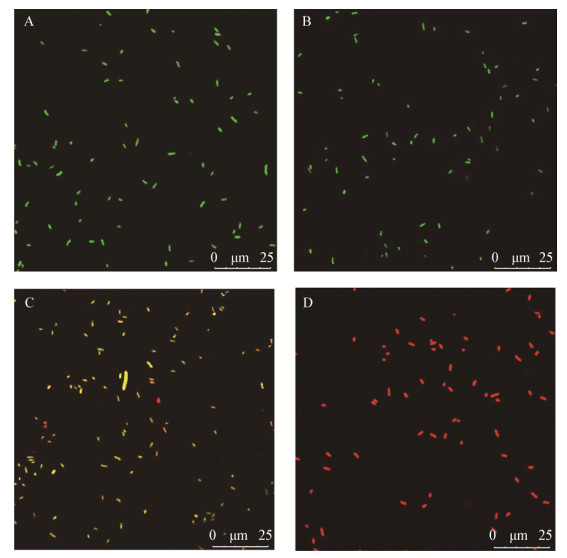
共聚焦显微镜观察不同处理下的S. typhimurium细胞膜完整性变化如图 7所示。通过SYTO-9和PI染色剂处理菌悬液,使细胞膜破损的死菌呈现红色,完整细胞膜的活菌呈现绿色,红色和绿色重叠显示为黄色[17]。在对照组中,S. typhimurium没经过处理,细菌全部呈现绿色,看不到红色死菌存在,此时S. typhimurium的细胞膜完整,排斥PI。在SIC剂量下对细胞膜也没有破坏作用,细胞同样发绿色荧光。而在MIC剂量处理下膜受损的细胞数量明显增多,绝大多数细胞呈现中间态的黄色荧光,也有少量细胞呈现红色。说明MIC处理下S. typhimurium的细胞膜完整性被破坏,PI进入细胞与SYTO-9竞争取代了结合位点。而异丙醇阳性对照组具有更显著的杀菌作用,完全破坏了细胞膜,使图像呈现红色。该结果可进一步证明,YH68 CFS在MIC剂量下增加S. typhimurium细胞膜通透性的同时,也破坏了细胞膜的完整性。
|
| 图 7 YH68抑菌活性物质作用下鼠伤寒沙门氏菌细胞的激光共聚显微镜图 Figure 7 CLSM of S. typhimurium cells with or without YH68 CFS 注:A:对照组(无菌水);B:YH68抑菌活性物质SIC剂量处理组;C:YH68抑菌活性物质MIC剂量处理组;D:阳性对照组(异丙醇). Note: A: Control cells (sterile water); B: Cells treated with YH68 CFS at SIC value; C: Cells treated with YH68 CFS at MIC value; D: Positive control cells (treated with isopropanol). |
|
|
RT-PCR所得数据利用2−ΔΔCt方法进行定量。将空白组相关基因的表达量标准化为1,S. typhimurium的毒力基因表达情况如图 8所示。与前面实验结果不同的是,与对照组相比无论是MIC浓度还是SIC浓度,YH68 CFS均能显著降低S. typhimurium主要毒力基因hilA、fimA、invF、sipA、sipB的mRNA转录水平(P < 0.01)。fimA基因编码Ⅰ型菌毛的结构蛋白[22],菌毛结构直接影响S. typhimurium的运动能力及其穿透肠粘液、粘附肠道上皮细胞的能力,影响了S. typhimurium的致病性;而入侵能力由SPI-1 Ⅲ型分泌系统(T3SS)的调控蛋白和效应蛋白控制:hilA基因编码S. typhimurium入侵宿主细胞关键的转录调控因子,在基因转录表达中起主导地位[22];invF基因编码侵袭蛋白,决定S. typhimurium入侵宿主上皮细胞的能力,在S. typhimurium入侵宿主细胞过程中起重要作用[23];sipA、sipB编码效应蛋白,S. typhimurium通过T3SS将效应蛋白注射到宿主细胞中导致感染[24]。S. typhimurium在加入YH68 CFS孵育3 h后,与空白试验组进行比较。当YH68 CFS以SIC剂量处理时,invF和sipB基因分别下调了3倍和7倍,而hilA、fimA、sipA均下调了10倍以上;当YH68 CFS以MIC剂量处理时,除了invF基因表达下调了8倍,基因hilA、fimA、sipA、sipB表达量下降幅度均超过了10倍,并且相比于SIC剂量作用组,所有基因的下调幅度明显更大,说明这种抑制作用呈剂量依赖性,高浓度时的抑制作用强于低浓度。更重要的是,YH68 CFS在SIC浓度下也可以显著抑制S. typhimurium致病相关毒力基因的表达,这提示YH68 CFS在SIC剂量下即使无法抑制细菌生长,也可能通过影响S. typhimurium相关毒力基因的表达来抑制其毒性。

|
| 图 8 YH68抑菌活性物质对鼠伤寒沙门氏菌毒力基因表达的影响 Figure 8 Expression of S. typhimurium's virulence genes in response to YH68 CFS 注:**:与对照组相比较具有极显著差异(P < 0.01). Note: **: P < 0.01, compared with the control group. |
|
|
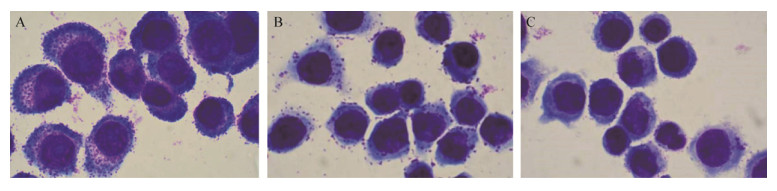
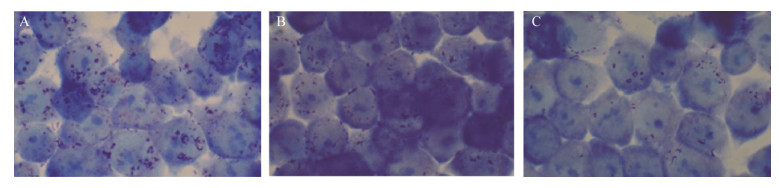
HT29细胞可以较好地模拟人体的肠道环境,在细菌的感染和定殖方面被广泛作为实验模型。细菌粘附和入侵宿主细胞是其感染的重要步骤,与S. typhimurium的致病性密切相关。S. typhimurium的粘附和侵袭能力可以在一定程度上反映其毒力的强弱。在对主要致病毒力基因的mRNA水平考察基础上,本实验从细胞水平进一步分析了YH68 CFS干预S. typhimurium粘附和侵袭肠上皮细胞的作用。YH68 CFS对S. typhimurium粘附、侵袭的抑制作用分别如图 9−12所示。平板计数法与吉姆萨染色结果一致,结果显示两种测试浓度的YH68 CFS均可以显著降低S. typhimurium对HT29细胞的粘附和入侵数目(P<0.01),两种浓度下YH68 CFS对S. typhimurium的粘附、侵袭抑制效果有所不同,呈剂量依赖性。相比于对照组(相对粘附率和侵袭率都设定为100%),MIC剂量表现出最佳的粘附、侵袭抑制能力,S. typhimurium的粘附率和侵袭率分别降低到7.73%±0.53%和3.41%± 0.16%;SIC剂量的抑制效果次之,S. typhimurium的粘附率和侵入率分别降低到31.32%±2.01%和6.32%±0.35%。本试验结果与RT-PCR一致,显示SIC浓度下的YH68 CFS也可以显著降低S. typhimurium的毒力。
|
| 图 9 YH68抑菌活性物质作用下鼠伤寒沙门氏菌粘附HT29细胞的情况(1 000×) Figure 9 Adhesion of S. typhimurium to HT29 cells by YH68 CFS (1 000×) 注:A:对照组(无菌水);B:YH68抑菌活性物质SIC剂量处理组;C:YH68抑菌活性物质MIC剂量处理组. Note: A: Control cells (sterile water); B: Cells treated with YH68 CFS at SIC value; C: Cells treated with YH68 CFS at MIC value. |
|
|

|
| 图 10 YH68抑菌活性物质对鼠伤寒沙门氏菌粘附HT29细胞比率的影响 Figure 10 Effect of YH68 CFS on the adhesion rate of HT29 cells by S. typhimurium 注:**:与对照组相比较具有极显著差异(P < 0.01). Note: **: P < 0.01, compared with the control group. |
|
|
|
| 图 11 YH68抑菌活性物质作用下鼠伤寒沙门氏菌侵袭HT29细胞的情况(1 000×) Figure 11 Invasion of S. typhimurium to HT29 cells by YH68 CFS (1 000×) 注:A:对照组(无菌水);B:YH68抑菌活性物质SIC剂量处理组;C:YH68抑菌活性物质MIC剂量处理组. Note: A: Control cells (sterile water); B: Cells treated with YH68 CFS at SIC value; C: Cells treated with YH68 CFS at MIC value. |
|
|

|
| 图 12 YH68抑菌活性对鼠伤寒沙门氏菌侵袭HT29细胞比率的影响 Figure 12 Effect of YH68 CFS on the invasion rate of HT29 cells by S. typhimurium 注:**:与对照组相比较具有极显著差异(P < 0.01). Note: **: P < 0.01, compared with the control group. |
|
|
临床研究表明,S. typhimurium感染患者在恢复初期体内活菌数在106−107之间[25]。本研究中,经MIC水平的YH68 CFS处理24 h后的致病菌活菌数由初始的6 log10CFU/mL下降为3.6 log10CFU/mL,表明S. typhimurium的生长受到了显著抑制,但这种作用方式是抑菌而不是杀菌,因为活菌数下降值小于3 log10CFU/mL,即致死率不足99.9%[26]。而SIC的CFS对S. typhimurium的生长没有抑制作用,说明此时CFS所含抑菌物质由于被稀释含量较低,无法对S. typhimurium造成影响,这一点在S. typhimurium的生长曲线上也有所体现(图 1)。
维持离子稳态是细胞保持能量状态、代谢调节所必不可少的,而细胞膜为小离子如K+、Na+提供了渗透性屏障,所以即使是很小的膜结构变化也会对细胞代谢产生不利影响并导致细菌死亡。当细菌细胞暴露于抗菌剂时,细胞膜可能会受到损伤,并且倾向于小离子先溢出,然后是核酸、蛋白质等大分子[16]。本研究中,SIC处理的S. typhimurium细胞膜仍保持完整性,这也解释了在活性研究试验中致病菌活菌数并未减少的原因。而MIC处理前2 h内电解质就已经泄漏,表明S. typhimurium的渗透性屏障已被快速破坏,紧接着就是蛋白质和核酸大分子的流出。周伟等表示膜破坏作用的进一步影响就是消耗质子动力势的成分Δψ和ΔpH,最终诱导细胞死亡[27]。本研究中MIC水平下的这种膜损伤机制与许多已报道的益生菌细菌素类似[28],然而与McAuliffe等报道的Lacticin 3147细菌素对单增李斯特菌破坏形成的只允许小分子通过的选择性孔洞不同的是[29],YH68 CFS作用S. typhimurium细胞膜后形成的是无选择性孔洞,这种孔洞既能够允许小分子电解质通过,也可以使大分子核酸和蛋白质泄漏。
S. typhimurium通过粘附、侵袭肠上皮细胞引起肠道感染,这一过程需要多种毒力基因参与。粘附由编码菌毛的基因控制,而侵袭由SPI-1控制。Hapfelmeier发现缺乏SPI-1的突变体无法诱导小鼠患胃肠炎疾病[30],这证明了SPI-1在沙门氏菌致病过程中的关键作用。SPI-1编码Ⅲ型分泌系统(T3SS)和相关的效应蛋白[25],效应蛋白通过T3SS装置转移到真核宿主的上皮细胞中,诱导肌动蛋白细胞骨架重排,导致上皮细胞膜产生褶皱并吞噬细菌,进而引发感染。当S. typhimurium受到环境影响时,这些毒力基因的表达也会产生变化,导致其粘附和侵袭能力的改变,进而影响致病性。已有研究发现了益生菌对S. typhimurium毒力的影响作用,Searle等发现两歧双歧杆菌无细胞发酵上清液在体内外均能显著降低S. typhimurium的粘附和侵袭能力[31],但他们未能揭示背后的实际机制。Bayoumi等在Searle研究的基础上证明了两歧双歧杆菌无细胞发酵上清液对S. typhimurium SPI中心调控子hilA的下调作用[32],从基因层面上阐述了益生菌的抑菌机制,但是仅通过hilA基因说明粘附和侵袭力的变化并不全面。短双歧杆菌与两歧双歧杆菌同属于双歧杆菌属,基于前人的研究结论基础,本研究增加了对粘附相关的鞭毛结构基因和SPI-1入侵相关基因的考察,并开展益生菌在亚抑制浓度下的相关研究,所筛选的YH68 CFS在MIC浓度下与预想一致,显著下调了S. typhimurium鞭毛结构基因fimA、转录调控基因hilA、侵袭基因invF和效应蛋白编码基因的表达。此外,SIC处理下尽管未能影响S. typhimurium的生长,也使致病基因的表达被显著下调,也相应地削弱了对宿主细胞的粘附、侵袭能力。这证明了亚抑制浓度下YH68 CFS对S. typhimurium感染的缓解作用并不是作为生长抑制剂而是毒力基因抑制剂来实现的。试验中还发现,所有组别中S. typhimurium的侵袭率都比粘附率要小得多,这一点Kusters等早在1993年进行过解释,他表示并不是所有粘附的S. typhimurium都具有入侵能力,这是由于入侵所涉及细胞因子的限量供应所致[33]。
在临床治疗中,抗菌药物进入肠道后由于被稀释可能在体内发生亚抑制浓度,但在不清楚抗菌药物在亚抑制浓度下的作用机制时,临床治疗往往会与预期效果有所出入,甚至会起反作用。Salaheen等发现亚抑制浓度的黑莓和蓝莓果渣提取物可以显著抑制S. typhimurium SPI-1主要毒力基因的转录,并降低其粘附、入侵肠上皮细胞的能力和在鸡盲肠中的定殖数目[23]。而Durant等却发现SIC水平的乙酸盐对沙门氏菌粘附喉癌细胞HEp-2的能力无影响,但使侵袭数目增加了2倍,导致致病菌毒性增加[12]。这从理论上证明,不同亚抑制浓度的药物与S. typhimurium组合可能会对其毒性产生诱导、抑制或无影响的不确定效果。据我们所知,关于益生菌在亚抑制浓度下对S. typhimurium的影响尚未见报道。本研究使用亚抑制YH68 CFS治疗S. typhimurium感染,其突出的治疗特点是在不影响病原体生长的情况下下调了S. typhimurium的关键致病基因,从而抑制了S. typhimurium感染肠上皮细胞能力,这种情况下S. typhimurium的选择性抗性机制未被激活[34],可以避免耐药性的产生。此外,这种非杀灭性抗病原体效应可降低S. typhimurium释放内毒素的风险。总而言之,对于目前由抗生素耐药性导致的S. typhimurium治疗瓶颈而言,YH68具有成为抗生素替代品的应用潜力。
益生菌在对抗致病菌感染的同时能起到提高机体免疫力、丰富肠道菌群多样性等功效,已被认可作为一种治疗肠病原菌感染的新方法[35],有益作用已被许多学者证实。Nature近期上线的一项研究通过人群分析和小鼠实验发现,肠道内的芽孢杆菌可通过生成脂肽芬荠素抑制金黄色葡萄球菌的群体感应,从而清除这种多重抗生素耐药细菌[36]。益生菌对病原菌的抑制作用依赖于其在生长过程中产生的一些初级和次级代谢产物,如有机酸、细菌素、过氧化氢等[37]。本研究中短双歧杆菌YH68无细胞发酵上清液的抑菌活性是多方面的,主要的抑菌物质为有机酸, 同时存在抗菌类蛋白二者共同起到对鼠伤寒沙门氏菌的拮抗作用,并且具有一定的热稳定性,在生产中具有良好的应用前景。下一步的研究方向应该对短双歧杆菌YH68的代谢产物进行分离、纯化,明确起到抑菌作用物质的具体成分和比例,在此基础上可以对纯化产物进行两两组合研究协同或拮抗机制存在的可能性。
本研究从致病菌生长活性、菌体细胞破坏、毒力表达,以及对肠上皮细胞感染能力的变化来阐明短双歧杆菌对鼠伤寒沙门氏菌的影响,为鼠伤寒沙门氏菌相关感染的治疗提供抗生素之外的新思路。我们认为短双歧杆菌YH68即使在亚抑制浓度下也是治疗鼠伤寒沙门氏菌感染的潜在益生菌株。
| [1] |
Wang C, Yan L, Zeng QZ. Detection technologies and methods of salmonella[J]. Modern Food Science and Technology, 2007, 23(5): 82-85, 75. (in Chinese) 王毳, 闫磊, 曾庆祝. 沙门氏菌的检测技术与方法[J]. 现代食品科技, 2007, 23(5): 82-85, 75. |
| [2] |
Silva AF, Dos Santos AR, Trevisan Coelho DA, et al. Cinnamaldehyde induces changes in the protein profile of Salmonella typhimurium biofilm[J]. Research in Microbiology, 2018, 169(1): 33-43. DOI:10.1016/j.resmic.2017.09.007 |
| [3] |
Coburn B, Grassl GA, Finlay BB. Salmonella, the host and disease: a brief review[J]. Immunology & Cell Biology, 2007, 85(2): 112-118. |
| [4] |
Zhang ZF, Meng XF, Yang BW, et al. Resistance of chickenborne Salmonella to quinolone and fluoroquinolones and related genes[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(3): 158-165. (in Chinese) 张增峰, 孟晓风, 杨保伟, 等. 鸡肉源沙门氏菌对(氟)喹诺酮类抗生素的耐药性及相关基因[J]. 中国食品学报, 2015, 15(3): 158-165. |
| [5] |
Zhang QH, Zhang DJ, Li JN, et al. Advances in Salmonella resistance[J]. Journal of Anhui Agricultural Sciences, 2018, 46(17): 27-29. (in Chinese) 张庆贺, 张丹俊, 李槿年, 等. 沙门氏菌耐药性研究进展[J]. 安徽农业科学, 2018, 46(17): 27-29. DOI:10.3969/j.issn.0517-6611.2018.17.008 |
| [6] |
Kemgang TS, Kapila S, Shanmugam VP, et al. Fermented milk with probiotic Lactobacillus rhamnosus S1K3 (MTCC5957) protects mice from Salmonella by enhancing immune and nonimmune protection mechanisms at intestinal mucosal level[J]. The Journal of Nutritional Biochemistry, 2016, 30: 62-73. DOI:10.1016/j.jnutbio.2015.11.018 |
| [7] |
Sherman PM, Johnson-Henry KC, Yeung HP, et al. Probiotics reduce enterohemorrhagic Escherichia coli O157:H7- and enteropathogenic E. coli O127:H6-induced changes in polarized T84 epithelial cell monolayers by reducing bacterial adhesion and cytoskeletal rearrangements[J]. Infection and Immunity, 2005, 73(8): 5183-5188. DOI:10.1128/IAI.73.8.5183-5188.2005 |
| [8] |
Coconnier MH, Liévin V, Bernet-Camard MF, et al. Antibacterial effect of the adhering human Lactobacillus acidophilus strain LB[J]. Antimicrobial Agents and Chemotherapy, 1997, 41(5): 1046-1052. DOI:10.1128/AAC.41.5.1046 |
| [9] |
Dahan S, Dalmasso G, Imbert V, et al. Saccharomyces boulardii interferes with enterohemorrhagic Escherichia coli-induced signaling pathways in T84 cells[J]. Infection and Immunity, 2003, 71(2): 766-773. DOI:10.1128/IAI.71.2.766-773.2003 |
| [10] |
Reid G, Jass J, Sebulsky MT, et al. Potential uses of probiotics in clinical practice[J]. Clinical Microbiology Reviews, 2003, 16(4): 658-672. DOI:10.1128/CMR.16.4.658-672.2003 |
| [11] |
Li JF, Lv C, Sun WY, et al. Cytosporone B, an inhibitor of the type Ⅲ secretion system of Salmonella enterica serovar typhimurium[J]. Antimicrobial Agents and Chemotherapy, 2013, 57(5): 2191-2198. DOI:10.1128/AAC.02421-12 |
| [12] |
Durant JA, Lowry VK, Nisbet DJ, et al. Short-chain fatty acids affect cell-association and invasion of HEp-2 cells by Salmonella typhimurium[J]. Journal of Environmental Science and Health, Part B, 1999, 34(6): 1083-1099. DOI:10.1080/03601239909373246 |
| [13] |
Oo TZ, Cole N, Garthwaite L, et al. Evaluation of synergistic activity of bovine lactoferricin with antibiotics in corneal infection[J]. Journal of Antimicrobial Chemotherapy, 2010, 65(6): 1243-1251. DOI:10.1093/jac/dkq106 |
| [14] |
Upadhyaya I, Upadhyay A, Kollanoor-Johny A, et al. Effect of plant derived antimicrobials on Salmonella enteritidis adhesion to and invasion of primary chicken oviduct epithelial cells in vitro and virulence gene expression[J]. International Journal of Molecular Sciences, 2013, 14(5): 10608-10625. DOI:10.3390/ijms140510608 |
| [15] |
Shen SX, Zhang TH, Yuan Y, et al. Effects of cinnamaldehyde on Escherichia coli and Staphylococcus aureus membrane[J]. Food Control, 2015, 47(47): 196-202. |
| [16] |
Chen CZ, Cooper SL. Interactions between dendrimer biocides and bacterial membranes[J]. Biomaterials, 2002, 23(16): 3359-3368. DOI:10.1016/S0142-9612(02)00036-4 |
| [17] |
Moussa M, Perrier-Cornet JM, Gervais P. Damage in Escherichia coli cells treated with a combination of high hydrostatic pressure and subzero temperature[J]. Applied and Environmental Microbiology, 2007, 73(20): 6508-6518. DOI:10.1128/AEM.01212-07 |
| [18] |
Das JK, Mishra D, Ray P, et al. In vitro evaluation of anti-infective activity of a Lactobacillus plantarum strain against Salmonella enterica serovar enteritidis[J]. Gut Pathogens, 2013, 5: 11. DOI:10.1186/1757-4749-5-11 |
| [19] |
Kohli N, Crisp Z, Riordan R, et al. The microbiota metabolite indole inhibits Salmonella virulence: Involvement of the PhoPQ two-component system[J]. PLoS One, 2018, 13(1): e0190613. DOI:10.1371/journal.pone.0190613 |
| [20] |
Yang AQ, Ai QJ, Zhang DQ, et al. Antibacterial activity of several Chinese herbal medicine extracts against salmonella[J]. Food Science and Technology, 2011, 36(3): 176-179. (in Chinese) 杨艾青, 艾启俊, 张德权, 等. 几种中草药提取液对沙门氏菌抑菌效果研究[J]. 食品科技, 2011, 36(3): 176-179. |
| [21] |
Lewis RE, Diekema DJ, Messer SA, et al. Comparison of Etest, chequerboard dilution and time-kill studies for the detection of synergy or antagonism between antifungal agents tested against Candida species[J]. Journal of Antimicrobial Chemotherapy, 2002, 49(2): 345-351. DOI:10.1093/jac/49.2.345 |
| [22] |
Salem WM, El-Hamed DMWS, Sayed WF, et al. Alterations in virulence and antibiotic resistant genes of multidrug-resistant Salmonella serovars isolated from poultry: The bactericidal efficacy of Allium sativum[J]. Microbial Pathogenesis, 2017, 108: 91-100. DOI:10.1016/j.micpath.2017.05.008 |
| [23] |
Salaheen S, Jaiswal E, Joo J, et al. Bioactive extracts from berry byproducts on the pathogenicity of Salmonella Typhimurium[J]. International Journal of Food Microbiology, 2016, 237: 128-135. DOI:10.1016/j.ijfoodmicro.2016.08.027 |
| [24] |
Li LT, Ma C, Zhao Q, et al. Inhibition effect of kaempferol on the invasion of Salmonella typhimurium to chicken intestinal epithelium cells at subinhibitory concenctions[J]. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(7): 534-539. (in Chinese) 李连涛, 马畅, 赵茜, 等. 亚抑菌浓度山奈酚对鼠伤寒沙门氏菌侵袭鸡肠道上皮细胞的抑制作用研究[J]. 中国预防兽医学报, 2017, 39(7): 534-539. |
| [25] |
Tanner SA, Chassard C, Rigozzi E, et al. Bifidobacterium thermophilum RBL67 impacts on growth and virulence gene expression of Salmonella enterica subsp. enterica serovar typhimurium[J]. BMC Microbiology, 2016, 16: 46. DOI:10.1186/s12866-016-0659-x |
| [26] |
LaPlante KL. In vitro activity of lysostaphin, mupirocin, and tea tree oil against clinical methicillin-resistant Staphylococcus aureus[J]. Diagnostic Microbiology and Infectious Disease, 2007, 57(4): 413-418. DOI:10.1016/j.diagmicrobio.2006.09.007 |
| [27] |
Zhou W, Liu GR, Li PL, et al. Mode of action of plantaricin L-1, an antilisteria bacteriocin produced by Lactobacillus plantarum[J]. Acta Microbiologica Sinica, 2007, 47(2): 260-264. (in Chinese) 周伟, 刘国荣, 李平兰, 等. 植物乳杆菌素L-1对单核细胞增生李斯特氏菌作用机理的研究[J]. 微生物学报, 2007, 47(2): 260-264. DOI:10.3321/j.issn:0001-6209.2007.02.015 |
| [28] |
Liu GR, Gao YK, Wang X, et al. Antibacterial activity and mechanism of Bifidocin A against Staphylococcus aureus[J]. Food Science, 2017, 38(17): 1-7. (in Chinese) 刘国荣, 郜亚昆, 王欣, 等. 双歧杆菌细菌素Bifidocin A对金黄色葡萄球菌的抑菌作用及其机制[J]. 食品科学, 2017, 38(17): 1-7. DOI:10.7506/spkx1002-6630-201717001 |
| [29] |
McAuliffe O, Ryan MP, Ross RP, et al. Lacticin 3147, a broad-spectrum bacteriocin which selectively dissipates the membrane potential[J]. Applied and Environmental Microbiology, 1998, 64(2): 439-445. |
| [30] |
Hapfelmeier S, Ehrbar K, Stecher B, et al. Role of the Salmonella pathogenicity island 1 effector proteins SipA, SopB, SopE, and SopE2 in Salmonella enterica subspecies 1 serovar typhimurium colitis in streptomycin-pretreated mice[J]. Infection and Immunity, 2004, 72(2): 795-809. DOI:10.1128/IAI.72.2.795-809.2004 |
| [31] |
Searle LEJ, Best A, Nunez A, et al. A mixture containing galactooligosaccharide, produced by the enzymic activity of Bifidobacterium bifidum, reduces Salmonella enterica serovar typhimurium infection in mice[J]. Journal of Medical Microbiology, 2009, 58: 37-48. DOI:10.1099/jmm.0.004390-0 |
| [32] |
Bayoumi MA, Griffiths MW. Probiotics down-regulate genes in Salmonella enterica serovar typhimurium pathogenicity islands 1 and 2[J]. Journal of Food Protection, 2010, 73(3): 452-460. DOI:10.4315/0362-028X-73.3.452 |
| [33] |
Kusters JG, Mulders-Kremers GA, Van Doornik CE, et al. Effects of multiplicity of infection, bacterial protein synthesis, and growth phase on adhesion to and invasion of human cell lines by Salmonella typhimurium[J]. Infection and Immunity, 1993, 61(12): 5013-5020. |
| [34] |
Park H, Yeo S, Ji Y, et al. Autoinducer-2 associated inhibition by Lactobacillus sakei NR28 reduces virulence of enterohaemorrhagic Escherichia coli O157:H7[J]. Food Control, 2014, 45: 62-69. DOI:10.1016/j.foodcont.2014.04.024 |
| [35] |
Leahy SC, Higgins DG, Fitzgerald GF, et al. Getting better with bifidobacteria[J]. Journal of Applied Microbiology, 2005, 98(6): 1303-1315. DOI:10.1111/j.1365-2672.2005.02600.x |
| [36] |
Piewngam P, Zheng Y, Nguyen TH, et al. Pathogen elimination by probiotic Bacillus via signalling interference[J]. Nature, 2018, 562(7728): 532-537. DOI:10.1038/s41586-018-0616-y |
| [37] |
Vuotto C, Longo F, Donelli G. Probiotics to counteract biofilm-associated infections: promising and conflicting data[J]. International Journal of Oral Science, 2014, 6(4): 189-194. DOI:10.1038/ijos.2014.52 |
 2019, Vol. 46
2019, Vol. 46