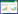扩展功能
文章信息
- 何山, 谭爱萍, 姜兰, 赵飞, 刘付翠, 张瑞泉, 邓玉婷
- HE Shan, TAN Ai-Ping, JIANG Lan, ZHAO Fei, LIU Fu-Cui, ZHANG Rui-Quan, DENG Yu-Ting
- 四株杂交鳢致病性舒伯特气单胞菌特性及致病性比较
- Comparative on characteristics and pathogenicity of four strains of Aeromonas schubertii isolated from snakehead hybrid
- 微生物学通报, 2019, 46(10): 2630-2644
- Microbiology China, 2019, 46(10): 2630-2644
- DOI: 10.13344/j.microbiol.china.180925
-
文章历史
- 收稿日期: 2018-11-18
- 接受日期: 2019-02-18
- 网络首发日期: 2019-04-02
2. 上海海洋大学水产与生命学院 上海 201306
2. College of Fishery and Life Science, Shanghai Ocean University, Shanghai 201306, China
舒伯特气单胞菌(Aeromonas schubertii)为革兰氏阴性短杆菌,属气单胞菌科气单胞菌属,是一种人-畜-鱼共患的条件性致病菌,同时也是引起鳢科鱼类内脏类结节病的主要病原菌之一[1-3]。舒伯特气单胞菌病发病急、死亡率高,2012年Liu等[4]首次报道乌鳢感染舒伯特气单胞菌导致大量死亡后,又相继有报道证实其对虹鳟、贻贝等水生动物存在潜在致病性[5-7]。目前,关于杂交鳢源舒伯特气单胞菌的研究大多集中在病原菌的分离鉴定、药物敏感性、快速检测等[4-11]方面,对不同杂交鳢源菌株之间的生物学特性、致病性等差异性比较研究却少有报道。
本研究针对4株杂交鳢源舒伯特气单胞菌(WL-4、ZL-1、ZL-13、D075)在生理生化、毒力因子等生物学特性和药物敏感性及致病性等方面进行了分析,以期比较不同杂交鳢源舒伯特气单胞菌在毒力基因、毒力因子以及致病性之间的差异,评估杂交鳢源舒伯特气单胞菌对常用渔用药物的敏感性,为水产动物舒伯特气单胞菌病的防治提供参考。
1 材料与方法 1.1 实验材料 1.1.1 实验菌株舒伯特气单胞菌ZL-1、ZL-13、D075菌株分别为2017年6月、7月及10月自广东省佛山市顺德地区不同养殖场患病濒死的杂交鳢分离,经生理生化、16S rRNA基因鉴定和回归感染证实其对杂交鳢具有致病性。舒伯特气单胞菌WL-4菌株由刘春[12]从广东省中山地区杂交鳢养殖场分离,并由中国水产科学研究院珠江水产研究所鱼病室保存。参考菌株ATCC43700 (人源舒伯特气单胞菌[13])购自美国菌种保藏中心(ATCC)。
1.1.2 实验鱼实验用鱼购自广东省佛山市顺德杂交鳢养殖场,体质量规格为50±5 g,在实验室暂养1个月后,采用镜检、抽血接菌、剖检等方式检测无病原感染后用于舒伯特气单胞菌人工感染实验。
1.1.3 渔用药物抗菌药物MIC (Minimum inhibitory concentration)药敏测试板在天津市金章科技发展有限公司定制。7类15种抗菌药物,其中包括:2种β-内酰胺类药物(氨苄西林、阿莫西林/克拉维酸)、2种氨基糖苷类药物(阿米卡星、新霉素)、3种喹诺酮类药物(恶喹酸、氟甲喹、恩诺沙星)、2种四环素类药物(四环素、多西环素)、2种酰胺醇类药物(甲砜霉素、氟苯尼考)、1种多粘菌素类药物(多粘菌素B)和3种磺胺类药物(复方新诺明、磺胺间甲氧嘧啶、磺胺二甲嘧啶/甲氧苄啶)。
1.2 主要试剂和仪器TIANamp Bacteria DNA Kit,天根生化科技(北京)有限公司;大豆酪蛋白琼脂(TSA)培养基、LB肉汤培养基、5%绵羊血平板,广东环凯微生物科技有限公司;革兰氏阴性菌细菌鉴定卡,法国生物梅里埃有限公司。
细菌鉴定分析仪、麦氏比浊仪,法国生物梅里埃有限公司;人工感染实验在室内1 m×1 m× 0.5 m玻璃水族箱进行,具充氧及控温设备。
1.3 细菌鉴定和聚类分析 1.3.1 形态学及生理生化特性分析经大豆酪蛋白琼脂(TSA)培养基[11]静置培养24 h的细菌菌株,观察其菌落特征并进行革兰氏染色,同时按仪器操作要求配制相关浓度的细菌悬液,使用革兰氏阴性菌鉴定卡,在VITEK 2 ComPACT60细菌鉴定仪上进行生理生化特性测试,测试结束打印记录测试结果。
1.3.2 gyrB和16S rRNA基因序列分析采用TIANamp Bacteria DNA Kit提取细菌的全基因组DNA,置于−20 ℃保存备用。16S rRNA基因的扩增引物为通用引物27F和1492R[14],gyrB的扩增引物参考Yáñez等[15],PCR反应条件参考Liu等[4] (表 1)。
| 目的基因 target gene |
引物序列 primer sequences (5′→3′) |
退火温度 Annealing temperature (℃) |
序列大小 Sequence size (bp) |
| 16S rRNA gene | F: AGAGTTTGATCATGGCTCAG | 55 | 1 500 |
| R: GGTTACCTTGTTACGACTT | |||
| gyrB | F: TCCGGCGGTCTGCACGGCGT | 58 | 1 130 |
| R: TTGTCCGGGTTGTACTCGTC |
PCR反应体系(25 μL):10×Taq buffer 2.5 μL,dNTP mix (2 mmol/L) 1.5 μL,MgCl2 (25 mmol/L) 2.5 μL,Taq DNA聚合酶(5 U/μL) 0.25 μL,上、下游引物(10 μmol/L)各1 μL,模板DNA 1 μL,加ddH2O至25 μL。反应结束后用1%琼脂糖凝胶电泳进行检测,扩增产物委托广州艾基生物科技有限公司测序。
测序结果与GenBank中已报道的核酸序列进行在线Blast比对分析,并运用DNAMAN 6.0进行多序列比对分析,MEGA 5.1软件包中的Neighbor-Joining (NJ)法构建系统进化树。
1.4 细菌毒力因子分析 1.4.1 菌株溶血性、蛋白酶活性与脂肪酶活性比较受试菌株分别用LB肉汤30 ℃、180 r/min振荡培养8 h,以0.65%的无菌生理盐水稀释菌液,使菌液达到0.5麦氏浓度,用于溶血性、蛋白酶活性和脂肪酶活性检测。
溶血性按照平板法[16]并进行改进,分别吸取1 μL菌液点种于5%绵羊血平板上,每株菌设3个平行,静置数分钟待菌液干燥,于30 ℃培养箱中恒温静置培养36 h,观察溶血圈并测量直径。
蛋白酶活性按照脱脂奶平板法[17]并进行改进,分别吸取1 μL菌液点种于含1%脱脂牛奶的TSA平板上,每株菌设3个平行,静置数分钟待菌液干燥,于30 ℃培养箱中恒温静置培养36 h,观察蛋白溶解圈并测量直径。
脂肪酶活性参考Vanmaele等[18]的方法,分别吸取1 μL菌液点种于含1%吐温-80的TSA平板上,每株菌设3个平行,静置数分钟待菌液干燥,于30 ℃培养箱中恒温静置培养36 h,观察脂肪酶水解圈并测量直径。
1.4.2 毒力基因扩增选取已报道气单胞菌的10种毒力基因,其中5种外毒素基因(溶血素编码基因hlyA、气溶素基因aer、热稳定性肠毒素基因ast、热不稳定肠毒素基因alt及细胞毒性肠毒素基因act),2种胞外蛋白酶基因(弹性蛋白酶基因ela、丝氨酸蛋白酶基因ahp)、2种转移酶基因(核酸酶基因exu,磷脂酶基因lip)和1种黏附素基因ahal,根据文献[9, 19-20]设计合成引物进行PCR扩增(表 2);PCR反应体系同1.3.2,扩增结束后用1%琼脂糖凝胶电泳进行检测。
| 目的基因 Target gene |
PCR引物序列 Primers sequence (5′→3′) |
退火温度 Annealing temperature (℃) |
产物大小 Sequence size (bp) |
| hlyA | F: CAGGCTTCCAGCACTGAATACT | 56 | 375 |
| R: CCAGTCCCACCACTTCACCT | |||
| aer | F: CCTATGGCCTGAGCGAGAAG | 60 | 431 |
| R: CCAGTTCCAGTCCCACCACT | |||
| act | F: AGAAGGTGACCACCAAGAACA | 55 | 231 |
| R: AACTGACATCGGCCTTGAACTC | |||
| alt | F: TGACCCAGTCCTGGCACGGC | 60 | 442 |
| R: GGTGATCGATCACCACCAGC | |||
| ast | F: TCTCCATGCTTCCCTTCCACT | 55 | 332 |
| R: GTGTAGGGATTGAAGAAGCCG | |||
| ela | F: ACACGGTCAAGGAGATCAACGG | 55 | 515 |
| R: GCTGGTGTTGGCCAGCAGGTAG | |||
| ahp | F: ATTGGATCCCTGCCTATCGCTTCAGTTC | 60 | 893 |
| R: GCTAAGCTTGCATCCGTGCCGTATTC | |||
| lip | F: CAYCTGGTKCCGCTCAAG | 63 | 247 |
| R: GTRCCGAACCAGTCGGAGAA | |||
| exu | F: RGACATGCACAACCTCTTCC | 53 | 323 |
| R: GATTGGTATTGCCYTGCAAS | |||
| ahal | F: GGC TATTGCTATCCCGGCTCTGTT | 62 | 1 082 |
| R: CGGTCCACTCGTCGTCCATCTTG |
取冻干保存的杂交鳢源舒伯特气单胞菌菌株(WL-4、ZL-1、ZL-13、D075),经复苏纯化培养,挑取单菌落接种于LB肉汤培养基中,30 ℃、180 r/min培养12 h,用麦氏比浊仪测定其浓度,用0.65%无菌生理盐水稀释菌液浓度至7.5×107、3×106、1.2×105、4.8×103 CFU/mL 4个浓度梯度。分别腹腔注射感染健康杂交鳢50±5 g 10尾,每尾注射0.2 ml,同时设等量0.65%无菌生理盐水作为空白对照,感染期间水温控制在29 ℃,连续观察7 d,记录结果。
1.6 药物敏感性检测 1.6.1 最小抑菌浓度(Minimum inhibitory concentration,MIC)参照美国临床和实验室标准协会(Clinical and laboratory standards institute,CLSI)推荐的琼脂二倍稀释法测定药物对受试菌株的最小抑菌浓度,根据CLSI抗菌药物敏感性判定标准判断受试菌株对抗菌药物的敏感性[11]。
1.6.2 耐药基因检测参考[21-26]文献设计合成引物进行PCR扩增(表 3),检测受试菌株中27种常见耐药基因的携带情况,其中包括:6种β-内酰胺类耐药基因(blaTEM、blaCTX-M、blaOXA-2a、blaSHV、blaCMY-2、blaDHA),7种四环素类耐药基因(tetA、tetB、tetC、tetD、tetE、tetG、tetX),3种酰胺醇类耐药基因(catA、cmlA、floR),3种磺胺类耐药基因(sul1、sul2、sul3),8种喹诺酮类耐药基因[qnrA、qnrB、qnrS、qnrC、qnrD、acc(6′)-Ib-cr、oqxAB、qepA];PCR反应体系同1.3.2,扩增结束后用1%琼脂糖凝胶电泳进行检测。
| 目的基因 Target gene |
PCR引物序列 Primers sequence (5′→3′) |
退火温度 Annealing temperature (℃) |
序列大小 Sequence size (bp) |
| β-内酰胺类β-lactams | |||
| blaTEM | F: AAGATGCTGAAGATCA | 56 | 425 |
| R: TTTGGTATGGCTTCATTC | |||
| blaCTX-M | F: GTGCAGTACCAGTAAAGTTATGG | 56 | 538 |
| R: CGCAATATCATTGGTGGTGCC | |||
| blaOXA-2a | F: AAGAAACGCTACTCGCCTGC | 55 | 478 |
| R: CCACTCAACCCATCCTACCC | |||
| blaSHV | F: ATAAAATTCTTGAAGACGAAA | 55 | 885 |
| R: GACAGTTACCAATGCTTAATC | |||
| blaCMY-2 | F: CACTCAAGGATGTATTGTG | 55 | 1 143 |
| R: TTAGCGTTGCCAGTGCTCG | |||
| blaDHA | F: ATGATGAAAAAATCGTTATGC | 56 | 387 |
| R: TTGCAGCTTTTCAAGAATGCG | |||
| 四环素类Tetracyclines | |||
| tetA | F: GCTACATCCTGCTTGCCTTC | 55 | 210 |
| R: CATAGATCGCCGTGAAGAGG | |||
| tetB | F: TTGGTTAGGGGCAAGTTTTG | 55 | 659 |
| R: GTAATGGGCCAATAACACCG | |||
| tetC | F: CTTGAGAGCCTTCAACCCAG | 55 | 418 |
| R: ATGGTCGTCATCTACCTGCC | |||
| tetD | F: AAACCATTACGGCATTCTGC | 55 | 787 |
| R: GACCGGATACACCATCCATC | |||
| tetE | F: GTTATTACGGGAGTTTGTTGG | 55 | 278 |
| R: AATACAACACCCACACTACGC | |||
| tetG | F: GCTCGGTGGTATCTCTGCTC | 55 | 468 |
| R: AGCAACAGAATCGGGAACAC | |||
| tetX | F: CAATAATTGGTGGTGGACCC | 58 | 468 |
| R: TTCTTACCTTGGACATCCCG | |||
| 酰胺醇类Amphenicols | |||
| cmlA | F: TGCCAGCAGTGCCGTTTAT | 59 | 900 |
| R: CACCGCCCAAGCAGAAGTA | |||
| catA | F: AAAAATTATATCCGACTCTCTTA | 60 | 420 |
| R: CTTGAATCGATAAGGGAATATAG | |||
| floR | F: TCCTGAACACGACGCCCGCTAT | 60 | 960 |
| R: TCACCGCCAATGTCCCGACGAT | |||
| 磺胺类Sulfonamaides | |||
| sul1 | F: CGGCGTGGGCTACCTGAACG | 69 | 433 |
| R: GCCGATCGCGTGAAGTTCCG | |||
| sul2 | F: GCGCTCAAGGCAGATGGCATT | 69 | 293 |
| R: GCGTTTGATACCGGCACCCGT | |||
| sul3 | F: TCCGTTCAGCGAATTGGTGCAG | 60 | 128 |
| R: TTCGTTCACGCCTTACACCAGC | |||
| 喹诺酮类Quinoloes | |||
| qnrA | F: ATTTCTCACGCCAGGATTTG | 58 | 516 |
| R: GATCGGCAAAGGTCAGGTCA | |||
| qnrB | F: GATCGTGAAAGCCAGAAAGG | 58 | 469 |
| R: ACGATGCCTGGTAGTTGTCC | |||
| qnrS | F: ACGACATTCGTCAACTGCAA | 56 | 417 |
| R: TAAATTGGCACCCTGTAGGC | |||
| qnrC | F: GGGTTGTACATTTATTGAATCG | 55 | 307 |
| R: CACCTACCCATTTATTTTCA | |||
| qnrD | F: CGAGATCAATTTACGGGAATA | 50 | 465 |
| R: AACAAGCTGAAGCGCCTG | |||
| acc(6′)-Ib-cr | F: TTGCGATGCTCTATGAGTGGCTA | 55 | 482 |
| R: CTCGAATGCCTGGCGTGTTT | |||
| oqxAB | F: CCCTGGACCGCACATAAAG | 57 | 523 |
| R: AAAGAACAAGATTCACCGCAAC | |||
| qepA | F: GCAGGTCCAGCAGCGGGTAG | 60 | 306 |
| R: CTTCCTGCCCGAGTATCGTG | |||
ZL-1、ZL-13、D075、WL-4与ATCC43700在TSA平板上30 ℃培养24 h后,均形成直径为0.7 mm−2.1 mm且具有相似形态的圆形半透明菌落,表面光滑,中部隆起,边缘整齐;革兰氏染色结果显示5株菌株均为革兰氏阴性菌,油镜下观察菌株呈短杆状。
菌株生理生化检测显示,ZL-1、ZL-13、D075、WL-4与ATCC43700的生理生化特性87.5% (42/48)一致,虽然在甘露糖、酪氨酸芳胺酶、乳酸盐产检碱等理化反应存在差异(表 4),但生理生化鉴定结果5株菌株均判定为舒伯特气单胞菌。
| 测试项目Item | ATCC 43700 | WL-4 | ZL-1 | ZL-13 | D075 | ||||||
| 丙氨酸-苯丙氨酸-脯氨酸芳胺酶 Ala-Phe-Pro-Arylamidase |
− | − | − | − | − | ||||||
| 侧金盏花醇 Adonitol |
− | − | − | − | − | ||||||
| 吡咯烷基芳胺酶 L-Pyrrolydonyl-arylamidase |
− | − | − | − | − | ||||||
| 阿拉伯醇 L-Arabitol |
− | − | − | − | − | ||||||
| 纤维二糖 D-Cellobiose |
− | − | − | − | − | ||||||
| β-半乳糖苷酶 β-Galactosidase |
− | − | − | − | − | ||||||
| H2S产生 H2S Production |
− | − | − | − | − | ||||||
| β-N-乙酰葡萄糖苷酶 Acetyl-β-glucosaninidase |
+ | + | + | + | + | ||||||
| 谷氨酰芳胺酶 Glutamyl arylamidase pNA |
− | − | − | − | − | ||||||
| 葡萄糖 D-Glucose |
+ | + | + | + | + | ||||||
| γ-谷氨酰转移酶 Glutamyl-γ-transferase |
− | − | − | − | − | ||||||
| 葡萄糖发酵 Fermentation/Glucose |
+ | + | + | + | + | ||||||
| β-葡萄糖苷酶 β-Glocosidase |
− | − | − | − | − | ||||||
| D-麦芽糖 D-Maltose |
+ | + | + | + | + | ||||||
| D-甘露醇 D-Mannitol |
− | − | − | − | − | ||||||
| D-甘露糖 D-Mannose |
+ | + | − | − | − | ||||||
| β-木糖苷酶 β-Xylosidase |
− | − | − | − | − | ||||||
| β-丙氨酸芳胺酶 β-Alanine arylamidase pNA |
− | − | − | − | − | ||||||
| L-脯氨酸芳胺酶 L-Proline arylamidase |
+ | + | + | + | + | ||||||
| 脂酶 Lipase |
+ | + | + | + | + | ||||||
| 古老糖 Palationse |
− | − | − | − | − | ||||||
| 酪氨酸芳胺酶 Tyrosine arylamidase |
+ | + | − | − | − | ||||||
| 尿素酶 Urease |
− | − | − | − | − | ||||||
| D-山梨醇 D-Sorbitol |
− | − | − | − | − | ||||||
| 蔗糖 Sucrose |
− | − | − | − | − | ||||||
| D-塔格糖 D-Tagatose |
− | − | − | − | − | ||||||
| D-海藻糖 D-Trehalose |
+ | + | + | + | + | ||||||
| 柠檬酸盐(钠) Citrate (Sodium) |
− | − | − | − | − | ||||||
| 丙二酸盐 Malonate |
− | − | − | − | − | ||||||
| 5-酮-葡萄糖苷 5-Keto-D-gluconate |
− | − | − | − | − | ||||||
| 乳酸盐产碱 L-Lactate alkalinisation |
+ | + | − | − | − | ||||||
| α-葡萄糖酶 α-Glucosidase |
− | − | − | − | − | ||||||
| 琥珀酸盐产碱 Succinate alkalinisation |
+ | − | − | − | − | ||||||
| N-乙酰-β-半乳糖氨酶 β-N-Acetyl-galactosaminidase |
− | − | − | − | − | ||||||
| α-半乳糖苷酶 α-Galactosidase |
− | − | − | − | − | ||||||
| 磷酸酶 Phosphatase |
− | − | − | − | − | ||||||
| 氨基乙酰芳胺酶 Glycine arylamidase |
− | − | − | − | − | ||||||
| 鸟氨酸脱羧酶 Ornithine decarboxylase |
− | − | − | − | − | ||||||
| 赖氨酸脱羧酶 Lysine decarboxylase |
− | − | − | − | − | ||||||
| 脱羧酶阴性控制 Decarboxylase base |
− | − | − | − | − | ||||||
| 组氨酸同化 L-Histidine assimilation |
− | − | − | − | − | ||||||
| β-葡萄糖苷酸酶 β-Glucoronidase |
− | − | − | − | − | ||||||
| O/129耐受 O/129 Resistance |
− | + | + | + | + | ||||||
| 谷氨酸-甘氨酸-精氨酸芳胺酶 Glu-Gly-Arg-ARY Lamidase |
+ | − | − | − | − | ||||||
| L-苹果酸盐同化 L-Malate assimilation |
− | − | − | − | − | ||||||
| L-乳酸盐同化 L-Lactate assimilation |
− | − | − | − | − | ||||||
| Courmarate | + | − | + | + | + | ||||||
| ELLMAN | − | − | − | − | − | ||||||
| 注:+:阳性;−:阴性. Note: +: Positive; −: Negative. |
|||||||||||
4株杂交鳢源的舒伯特气单胞菌菌株16S rRNA基因扩增均获得长度约1 407 bp的DNA片段;gyrB扩增也均获得约1 130 bp长度的DNA片段。多序列比对结果显示,4株杂交鳢源菌株的16S rRNA基因一致性为100%,gyrB一致性为99.57%。运用NJ法构建系统进化树,结果受试的4株菌株与舒伯特气单胞菌聚为一簇(图 1、2),确定菌株D075、ZL-1、ZL-13和WL-4均为舒伯特气单胞菌。
|
| 图 1 16S rRNA基因聚类分析 Figure 1 16S rRNA gene cluster analysis 注:括号中的数字代表GenBank登录号,每个分支点上的数字是软件输出的百分比,标线代表 0.2%的序列差别. Note: Those in parentheses are GenBank accession number; Numbers at each branch points indicated the percentage of software output; Bar: Nucleotide divergence is 0.2%. |
|
|

|
| 图 2 gyrB聚类分析 Figure 2 gyrB cluster analysis 注:括号中的数字代表GenBank登录号,每个分支点上的数字是软件输出的百分比,标线代表 1%的序列差别. Note: Those in parentheses are GenBank accession number; Numbers at each branch points indicated the percentage of software output; Bar: Nucleotide divergence is 1%. |
|
|
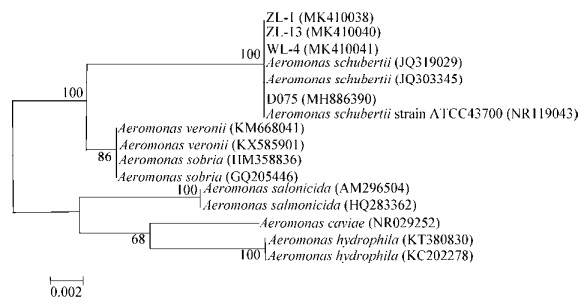
受试的ATCC43700、WL-4、ZL-1、ZL-13和D075菌株均具有溶血性、蛋白酶活性及脂肪酶活性(图 3);通过测量比较不同菌株的溶血圈、溶蛋白圈和脂肪水解圈直径,不同菌株间存在一定差异,但差异不显著(表 5)。
|
| 图 3 受试菌株的相关毒力因子表型 Figure 3 Phenotypic determination of virulence factors for tested bacterial strain 注:A:溶血性;B:蛋白酶活性;C:脂肪酶活性. Note: A: Hemolytic; B: Protease activity; C: Lipase activity. |
|
|
| 类别category | ATCC43700 | WL-4 | ZL-1 | ZL-13 | D075 |
| 溶血Hemolysis | 0.70±0.046 | 0.79±0.044 | 0.70±0.045 | 0.70±0.020 | 0.80±0.010 |
| 溶蛋白Lysin | 1.80±0.044 | 1.60±0.060 | 1.07±0.076 | 1.50±0.049 | 1.51±0.023 |
| 脂肪酶水解Lipase hydrolysis | 1.12±0.036 | 1.30±0.021 | 1.12±0.055 | 1.30±0.062 | 1.31±0.030 |
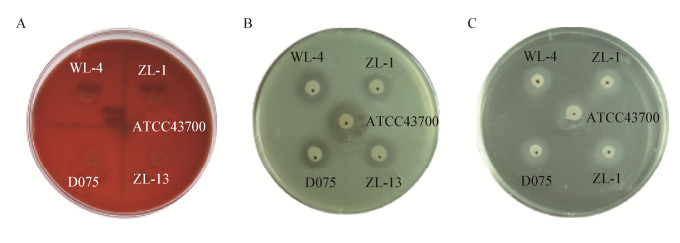
采用PCR方法对受试菌株的10种毒力基因(hlyA、aer、ast、alt、act、ela、ahp、exu、lip、ahal)进行扩增,结果显示,ATCC43700、WL-4、ZL-1、ZL-13和D075均携带有hlyA、ela、lip、ahal;act仅在ATCC43700中扩增到;aer只在WL-4、ZL-1、ZL-13和D075中扩增到;而alt、ast、ahp和exu在受试的5株舒伯特气单胞菌中均未扩增到(图 4)。
|
| 图 4 毒力基因PCR扩增结果 Figure 4 PCR amplification results of virulence genes Note: A: hlyA; B: ela; C: lip; D: ahal; E: aer; F: act. M: DNA marker; 1: ATCC43700; 2: WL-4; 3: ZL-1; 4: ZL-13; 5: D075; 6: Negative control. |
|
|
在水温29 ℃条件下,用4株杂交鳢源舒伯特气单胞菌对健康杂交鳢进行人工感染实验。高浓度(7.5×107 CFU/mL)组杂交鳢在感染后第1天均出现死亡,死亡鱼表现出注射部位及肛门充血,肝、脾、肾肿大等现象,但内脏并无明显类结节;感染后第2天,死亡杂交鳢内脏(肝、脾、肾)开始出现少量类结节;感染3 d后各组死亡杂交鳢内脏(肝、脾、肾)均出现大量明显类结节;观察至第7天,对各实验组未发病死亡的实验鱼进行剖检,发现部分实验鱼内脏有类结节,但空白对照组实验鱼均无此现象。感染死亡率显示,D075、ZL-13的致病力明显高于WL-4和ZL-1 (表 6)。
| 菌株 strains |
菌液浓度 Concentration (CFU/mL) |
数量(尾) Number |
累计死亡数(尾) Accumulative death number |
死亡率 Mortality (%) |
||||||
| 1 d | 2 d | 3 d | 4 d | 5 d | 6 d | 7 d | ||||
| WL-4 | 7.5×107 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 100 |
| 3.0×106 | 10 | 1 | 7 | 9 | 9 | 9 | 9 | 9 | 90 | |
| 1.2×105 | 10 | 0 | 0 | 0 | 3 | 3 | 3 | 3 | 30 | |
| 4.8×103 | 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 0 | 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| ZL-1 | 7.5×107 | 10 | 6 | 9 | 10 | 10 | 10 | 10 | 10 | 100 |
| 3.0×106 | 10 | 0 | 2 | 5 | 5 | 5 | 5 | 5 | 50 | |
| 1.2×105 | 10 | 0 | 0 | 2 | 3 | 3 | 3 | 4 | 40 | |
| 4.8×103 | 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| 0 | 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| ZL-13 | 7.5×107 | 10 | 7 | 9 | 10 | 10 | 10 | 10 | 10 | 100 |
| 3.0×106 | 10 | 3 | 6 | 7 | 7 | 7 | 7 | 8 | 80 | |
| 1.2×105 | 10 | 0 | 5 | 7 | 7 | 7 | 7 | 7 | 70 | |
| 4.8×103 | 10 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 10 | |
| 0 | 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| D075 | 7.5×107 | 10 | 7 | 10 | 10 | 10 | 10 | 10 | 10 | 100 |
| 3.0×106 | 10 | 0 | 6 | 8 | 8 | 8 | 8 | 9 | 90 | |
| 1.2×105 | 10 | 0 | 2 | 5 | 5 | 5 | 5 | 8 | 80 | |
| 4.8×103 | 10 | 0 | 0 | 0 | 1 | 1 | 1 | 1 | 10 | |
| 0 | 10 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
ATCC43700除对氨苄西林耐药外,对其他受试药物均敏感;而杂交鳢源菌株WL-4、ZL-1、ZL-13和D075均对磺胺类药物(复方新诺明、磺胺间甲氧嘧啶、磺胺二甲嘧啶/甲氧苄啶)耐药,对β-内酰胺类药物(氨苄西林、阿莫西林/克拉维酸)敏感,同时也对氨基糖苷类药物(新霉素、阿米卡星)敏感;除磺胺类及酰胺醇类药物(甲砜霉素)外,WL-4对受试的其他药物均敏感,而ZL-1、ZL-13和D075对四环素类药物也表现出耐药性(表 7)。
| 药物名称 Drug name |
ATCC43700 | WL-4 | ZL-1 | ZL-13 | D075 | ||||||||||||
| MIC (mg/L) | susceptibility | MIC (mg/L) | susceptibility | MIC (mg/L) | susceptibility | MIC (mg/L) | susceptibility | MIC (mg/L) | susceptibility | ||||||||
| 氨苄西林 AMP |
> 32.000 | R | ≤2.00 | S | ≤2.000 | S | ≤2.00 | S | ≤2.00 | S | |||||||
| 阿莫西林/克拉维酸 AMC |
≤2.000 | S | ≤2.00 | S | ≤2.000 | S | ≤2.00 | S | ≤2.00 | S | |||||||
| 阿米卡星 AMK |
≤2.000 | S | ≤2.00 | S | ≤2.000 | S | ≤2.00 | S | ≤2.00 | S | |||||||
| 新霉素 NEO |
≤1.000 | S | ≤1.00 | S | ≤1.000 | S | ≤1.00 | S | ≤1.00 | S | |||||||
| 恶喹酸 OAX |
≤0.120 | S | 0.25 | S | ≤0.120 | S | 0.25 | S | 0.12 | S | |||||||
| 氟甲喹 UB |
≤0.5000 | S | ≤1.00 | S | ≤0.500 | S | ≤1.00 | S | ≤1.00 | S | |||||||
| 恩诺沙星 ENR |
≤0.008 | S | 1.00 | I | ≤0.015 | S | 1.00 | I | 0.50 | S | |||||||
| 四环素 TE |
≤1.000 | S | ≤1.00 | S | 16.000 | R | 16.00 | R | 16.00 | R | |||||||
| 多西环素 DO |
≤0.500 | S | 2.00 | S | 16.000 | R | 16.00 | R | 16.00 | R | |||||||
| 甲砜霉素 THI |
≤2.000 | S | > 64.00 | R | 64.000 | R | ≤2.00 | S | ≤2.00 | S | |||||||
| 氟苯尼考 FFC |
≤1.000 | S | 4.00 | I | 2.000 | S | ≤1.00 | S | ≤1.00 | S | |||||||
| 多粘菌素 BPB |
2.000 | S | 1.00 | S | 1.000 | S | 1.00 | S | 1.00 | S | |||||||
| 复方新诺明 SXT |
≤20.000 | S | > 320.00 | R | > 320.000 | R | > 320.00 | R | > 320.00 | R | |||||||
| 磺胺间甲氧嘧啶 SMM |
≤16.000 | S | > 512.00 | R | > 512.000 | R | > 512.00 | R | 256.00 | R | |||||||
| 磺胺二甲嘧啶/甲氧苄啶 SM2/TMP |
≤2.500/0.500 | S | 20.00/ 4.00 | R | 20.000/ 4.000 | R | > 20.00/ 4.00 | R | > 20.00/ 4.00 | R | |||||||
| 注:R:低度敏感或者不敏感;I:中度敏感;S:高度敏感. Note: R: Low sensitivity or insensitivity; I: Moderately sensitive; S: Highly sensitive. |
|||||||||||||||||
耐药基因扩增结果显示,ATCC43700、WL-4、ZL-1、ZL-13和D075均携带了磺胺类耐药基因(sulⅠ和sulⅡ)、喹诺酮类耐药基因[acc(6′)-Ib-cr]以及β-内酰胺类耐药基因(blaTEM);ZL-1、ZL-13和D075携带有四环素类耐药基因(tetA);ZL-1、WL-4携带酰胺醇类耐药基因(floR);WL-4还携带喹诺酮类耐药基因(qnrS) (表 8)。
| 基因种类 Drug resistance gene |
ATCC 43700 | WL4 | ZL-1 | ZL-13 | D075 | ||
| 磺胺类 Sulfonamaides |
sul1 | + | + | + | + | + | |
| sul2 | + | + | + | + | + | ||
| sul3 | − | − | − | − | − | ||
| 酰胺醇类 Amphenicols |
cmlA | − | − | − | − | − | |
| catA | − | − | − | − | − | ||
| floR | − | + | + | − | − | ||
| 四环素类 Tetracyclines |
tetA | − | − | + | + | + | |
| tetB | − | − | − | − | − | ||
| tetC | − | − | − | − | − | ||
| tetD | − | − | − | − | − | ||
| tetE | − | − | − | − | − | ||
| tetG | − | − | − | − | − | ||
| tetX | − | − | − | − | − | ||
| β-内酰胺类 β-Lactam |
blaTEM | + | + | + | + | + | |
| blaCTX-M | − | − | − | − | − | ||
| blaOXA-2a | − | − | − | − | − | ||
| blaSHV | − | − | − | − | − | ||
| blaCMY-2 | − | − | − | − | − | ||
| blaDHA | − | − | − | − | − | ||
| 喹诺酮类 Quinoloes |
qnrA | − | − | − | − | − | |
| qnrB | − | − | − | − | − | ||
| qnrS | − | + | − | − | − | ||
| qnrC | − | − | − | − | − | ||
| qnrD | − | − | − | − | − | ||
| acc(6′)-Ib-cr | + | + | + | + | + | ||
| oqxAB | − | − | − | − | − | ||
| qepA | − | − | − | − | − | ||
| 注:+:阳性;−:阴性. Note: +: Positive; −: Negative. |
|||||||
4株杂交鳢源舒伯特气单胞菌菌株均显现出了与标准株ATCC43700基本相同的理化特性,但在甘露糖、酪氨酸芳胺酶、乳酸盐产碱等方面各菌株间存在差异,表明舒伯特气单胞菌菌株的来源、地域及个体差异都会造成部分理化特性的改变,但作为舒伯特气单胞菌生理生化鉴别的几项重要生理生化指标并未改变[13, 27]。通过对4株杂交鳢源菌株的gyrB和16S rRNA基因测序和聚类分析,4株菌株均与舒伯特气单胞菌聚为一簇。综合细菌生理生化检测和分子鉴定,确定菌株D075、ZL-1、ZL-13、WL-4和ATCC43700在分类上均为舒伯特气单胞菌。在GenBank上传D075、ZL-1、ZL-13、WL-4的gyrB和16S rRNA基因序列,登录号分别为MK105972、MK410039、MK105971、MK416159和MH886390、MK410038、MK410040、MK410041。
细菌的成功定殖是其发挥致病性的关键因素,ahal编码的黏附素被认为是气单胞菌重要的致病因子[28],本研究的5株舒伯特气单胞菌均扩增到ahal;溶血素基因hlyA编码的溶血素可结合到红细胞的细胞膜上使其形成亲水性蛋白孔道,最终导致红细胞的裂解死亡,因此溶血素被认为是引起宿主致病的主要毒力因子之一[29],本研究的5株舒伯特气单胞菌均携带了hlyA,且表现出溶血活性,表明受试的5株菌株均具有致病性。气溶素基因aer是气单胞菌的主要毒力基因之一,具有种属特异性[30]。本研究结果显示,4株杂交鳢源舒伯特气单胞菌均可扩增到该基因,而人源标准株ATCC43700则不携带该基因。莫金凤等[11]的实验结果表明WL-4可感染杂交鳢造成发病死亡,而造成人前额囊肿的菌株ATCC43700[13]对杂交鳢不具有致病性,表明aer可能与舒伯特气单胞菌对鳢的致病性密切相关。此外,在4株杂交鳢源舒伯特气单胞菌中首次扩增到与ATCC43700相似的磷脂酶编码基因lip,D075 lip序列已上传GenBank,登录号为MH886391。
气单胞菌菌株间存在的致病性差异与菌株携带的毒力基因及其表达的毒力因子密切相关[31-32]。对4株杂交鳢源舒伯特气单胞菌的致病性研究发现,相同浓度(1.2×105 CFU/mL)下,WL-4、ZL-1、ZL-13、D075对杂交鳢的感染致死率分别为30%、40%、70%和80%;溶血性、蛋白酶活性和脂肪酶活性检测结果显示,4株菌虽然差异不显著,但也存在差异,其中ZL-1株毒力因子活性均最低。虽然4株菌均含有相同的外毒素、胞外蛋白酶、转移酶和黏附素等毒力基因,但它们对杂交鳢的致病性和毒力因子活性均存在差异,表明舒伯特气单胞菌的致病性与菌株来源、毒力基因表达和毒力因子的活性有关,舒伯特气单胞菌携带的毒力基因的表达调控以及毒力因子的分泌活性等一系列问题还有待进一步研究。
药物敏感性实验结果显示,杂交鳢源菌株WL-4、ZL-1、ZL-13、D075的药物敏感性有差异,但均对磺胺类药物具有耐受性并检测到磺胺类耐药基因sul1、sul2,推测可能与水产养殖及畜牧业中大量长期使用磺胺类药物有关。ZL-1、ZL-13、D075均检测到四环素类耐药基因tetA,也显示出对四环素和多西环素的耐药性,与张德锋等[8]的研究结果相同,tetA能介导舒伯特气单胞菌对四环素类药物耐药。虽然在WL-4、ZL-1、ZL-13、D075中还检测到酰胺醇类耐药基因floR (WL-4、ZL-1)和喹诺酮类耐药基因acc(6′)-Ib-cr (ATCC43700、WL-4、ZL-1、ZL-13、D075),但5株受试菌对酰胺醇类药物氟苯尼考和氟喹诺酮类药物恩诺沙星仍表现敏感或中度敏感,这可能与气单胞菌对酰胺醇类药物和喹诺酮类药物均存在多种耐药机制有关,floR和acc(6′)-Ib-cr主要介导酰胺醇类和氟喹诺酮类药物低水平耐药[33]。多数研究表明,气单胞菌对氨苄西林存在固有耐药性[34],ATCC43700除对氨苄西林耐药外,对其余14种抗菌药物均敏感,与莫金凤等[11]的研究结果相同;但4株杂交鳢源舒伯特气单胞菌菌株却皆显示对氨苄西林敏感;而5株菌都只扩增到β-内酰胺类耐药基因blaTEM;4株杂交鳢源舒伯特气单胞菌为何对氨苄西林敏感值得进一步研究。研究结果显示,受试菌株对新霉素、氟苯尼考和恩诺沙星仍表现敏感,这些渔用药物可以用于鳢舒伯特气单胞菌的防控。
综上所述,舒伯特气单胞菌是造成近年来鳢内脏类结节病的主要病原菌,病原菌的致病性与菌株携带的毒力基因以及毒力因子活性有关,新霉素、氟苯尼考和恩诺沙星等国标渔药[35]仍对舒伯特气单胞菌具有良好的抑制作用。
| [1] |
Liu C, Li KB, Wang Q, et al. Isolation, identification and characterization of Aeromonas schubertii from hybrid snakehead (Channa maculate ♀×C. argus ♂)[J]. Journal of Fisheries of China, 2012, 36(7): 1119-1125. (in Chinese) 刘春, 李凯彬, 王庆, 等. 杂交鳢(斑鳢♀×乌鳢♂)内脏类结节病病原菌的分离、鉴定与特性分析[J]. 水产学报, 2012, 36(7): 1119-1125. |
| [2] |
Chen YF, Liang RS, Zhuo XL, et al. Isolation and characterization of Aeromonas schubertii from diseased snakehead, Channa maculata (Lacepède)[J]. Journal of Fish Diseases, 2012, 35(6): 421-430. DOI:10.1111/j.1365-2761.2012.01362.x |
| [3] |
Kao TL, Kao ML. A fatal case of necrotizing Aeromonas schubertii fasciitis after penetrating injury[J]. American Journal of Emergency Medicine, 2012, 30(1): 258.e3-258.e5. |
| [4] |
Liu JY, Li AH. First case of Aeromonas schubertii infection in the freshwater cultured snakehead fish, Ophiocephalus argus (Cantor), in China[J]. Journal of Fish Diseases, 2012, 35(5): 335-342. DOI:10.1111/j.1365-2761.2012.01350.x |
| [5] |
Akaylı T, Çanak , Başaran B. A study on Aeromonas schubertii infection in rainbow trout (Oncorhynchus mykiss Walbaum, 1792)[J]. Bi̇bad Biyoloji Bilimleri Araştırma Dergisi, 2011, 4(1): 99-106. |
| [6] |
Cao HP, Jian A, He S, et al. Aeromonas schubertii: a potential pathogen for freshwater cultured Whiteleg Shrimp, Penaeus vannamei[J]. Israeli Journal of Aquaculture - Bamidgeh, 2015, 67: 1104. |
| [7] |
Latif-Eugenín F, Beaz-Hidalgo R, Figueras MJ. First record of the rare species Aeromonas schubertii from mussels: phenotypic and genetic reevaluation of the species and a review of the literature[J]. Archives of Microbiology, 2016, 198(4): 333-345. DOI:10.1007/s00203-016-1189-5 |
| [8] |
Zhang DF, Liu C, Ke XL, et al. Isolation, identification and antimicrobial resistance of a multidrug-resistant Aeromonas schubertii isolated from snakehead fish[J]. Chinese Journal of Preventive Veterinary Medicine, 2017, 39(12): 981-986. (in Chinese) 张德锋, 刘春, 可小丽, 等. 一株多重耐药鳢源舒氏气单胞菌的分离、鉴定及其耐药性分析[J]. 中国预防兽医学报, 2017, 39(12): 981-986. |
| [9] |
Liu C, Li KB, Wang Q, et al. Establishment of duplex PCR for detection of pathogenic Aeromonas schubertii[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(1): 54-57. (in Chinese) 刘春, 李凯彬, 王庆, 等. 鱼致病性舒伯特气单胞菌双重PCR检测方法的建立[J]. 中国预防兽医学报, 2014, 36(1): 54-57. DOI:10.3969/j.issn.1008-0589.2014.01.14 |
| [10] |
Shen JY, Pan XY, Yin WL, et al. Rapid detection kit for Aeromonas schubertii and detection method: CN, 103571950B[P]. 2015-03-18 (in Chinese) 沈锦玉, 潘晓艺, 尹文林, 等.一种舒伯特气单胞菌快速检测试剂盒及其检测方法: 中国, 103571950B[P]. 2015-03-18 |
| [11] |
Mo JF, Jiang L, Wu ZH. Biological characteristics and drug susceptibility of Aeromonas schubertii WL-4 isolated from snakehead[J]. Journal of Fisheries of China, 2016, 40(3): 484-494. (in Chinese) 莫金凤, 姜兰, 吴灶和. 乌鳢源舒伯特气单胞菌生物学特性及其药物敏感性分析[J]. 水产学报, 2016, 40(3): 484-494. |
| [12] |
Liu C. Isolated, identification and characterization of Aeromonas schubertii from snakehead[A]//Papers of the Third Symposium of the Society of Veterinary Public Health, Chinese Society of Animal Husbandry and Veterinary Medicine[C]. Guangzhou: Chinese Veterinary Public Health Association, 2012: 7-8 (in Chinese) 刘春.鳢舒伯特气单胞菌内脏类结节病的研究[A]//中国畜牧兽医学会兽医公共卫生学分会第三次学术研讨会论文集[C].广州: 中国畜牧兽医学会兽医公共卫生学分会, 2012: 7-8 |
| [13] |
Hickman-Brenner FW, Fanning GR, Arduino MJ, et al. Aeromonas schubertii, a new mannitol-negative species found in human clinical specimens[J]. Journal of Clinical Microbiology, 1988, 26(8): 1561-1564. |
| [14] |
Borrell N, Acinas SG, Figueras MJ, et al. Identification of Aeromonas clinical isolates by restriction fragment length polymorphism of PCR-amplified 16S rRNA genes[J]. Journal of Clinical Microbiology, 1997, 35(7): 1671-1674. |
| [15] |
Yá ez MA, Catalán V, Apráiz D, et al. Phylogenetic analysis of members of the genus Aeromonas based on gyrB gene sequences[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(3): 875-883. DOI:10.1099/ijs.0.02443-0 |
| [16] |
Chen YF, Lin DJ. Detection and analysis of pathogenic Aeromonas in seafood[J]. Journal of Zhejiang Wanli University, 2009, 22(2): 62-66. (in Chinese) 陈永富, 林丹娟. 海产品致病性气单胞菌的毒力检测与分析[J]. 浙江万里学院学报, 2009, 22(2): 62-66. DOI:10.3969/j.issn.1671-2250.2009.02.015 |
| [17] |
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 18652-2002 Methods for detection of pathogenic Aeromonas hydrophila[S]. Beijing: China Standards Press, 2002: 16-20 (in Chinese) 中华人民共和国国家质量监督检验检疫总局. GB/T 18652-2002致病性嗜水气单胞菌检验方法[S].北京: 中国标准出版社, 2002: 16-20 |
| [18] |
Vanmaele S, Defoirdt T, Cleenwerck I, et al. Characterization of the virulence of Harveyi clade vibrios isolated from a shrimp hatchery in vitro and in vivo, in a brine shrimp (Artemia franciscana) model system[J]. Aquaculture, 2015, 435: 28-32. DOI:10.1016/j.aquaculture.2014.09.015 |
| [19] |
Nawaz M, Khan SA, Khan AA, et al. Detection and characterization of virulence genes and integrons in Aeromonas veronii isolated from catfish[J]. Food Microbiology, 2010, 27(3): 327-331. |
| [20] |
Sen K, Rodgers M. Distribution of six virulence factors in Aeromonas species isolated from US drinking water utilities: a PCR identification[J]. Journal of Applied Microbiology, 2004, 97(5): 1077-1086. DOI:10.1111/j.1365-2672.2004.02398.x |
| [21] |
Henriques IS, Fonseca F, Alves A, et al. Occurrence and diversity of integrons and β-lactamase genes among ampicillin-resistant isolates from estuarine waters[J]. Research in Microbiology, 2006, 157(10): 938-947. DOI:10.1016/j.resmic.2006.09.003 |
| [22] |
Jain A, Mondal R. TEM & SHV genes in extended spectrum β-lactamase producing Klebsiella species beta their antimicrobial resistance pattern[J]. Indian Journal of Medical Research, 2008, 128(6): 759-764. |
| [23] |
Pai H, Kang CI, Byeon JH, et al. Epidemiology and clinical features of bloodstream infections caused by AmpC-Type-β-lactamase-producing Klebsiella pneumoniae[J]. Antimicrobial Agents and Chemotherapy, 2004, 48(10): 3720-3728. DOI:10.1128/AAC.48.10.3720-3728.2004 |
| [24] |
Zhang RQ. Occurrence of antibiotic resistant bacteria and resistance genes in swine farms, aquaculture and receiving environments in China[D]. Beijing: Doctoral Dissertation of University of Chinese Academy of Sciences, 2013 (in Chinese) 张瑞泉.畜牧、水产养殖环境及纳污环境中抗生素耐药菌和耐药基因污染特征研究[D].北京: 中国科学院大学博士学位论文, 2013 |
| [25] |
Dai L, Lu LM, Wu CM, et al. Characterization of antimicrobial resistance among Escherichia coli isolates from chickens in China between 2001 and 2006[J]. FEMS Microbiology Letters, 2008, 286(2): 178-183. DOI:10.1111/j.1574-6968.2008.01272.x |
| [26] |
Guo XZ, Zhang RQ, Jiang L, et al. Detection and analysis of quinolone resistance and resistance-associated genes in bacteria isolated from tilapias sold in the supermarkets[J]. Journal of Fishery Sciences of China, 2018, 25(5): 1032-1039. (in Chinese) 郭学中, 张瑞泉, 姜兰, 等. 罗非鱼水产品中的喹诺酮类药物耐药菌和耐药基因检测分析[J]. 中国水产科学, 2018, 25(5): 1032-1039. |
| [27] |
Kokka RP, Lindquist D, Abbott SL, et al. Structural and pathogenic properties of Aeromonas schubertii[J]. Infection and Immunity, 1992, 60(5): 2075-2082. |
| [28] |
Xu R, Tian JX, Zhang DX, et al. Cloning, bioinformatic analysis and prokaryotic expression of aha1 gene of Aeromonas veronii TH0426 from yellow catfish[J]. Chinese Journal of Veterinary Science, 2017, 37(11): 2141-2146, 2150. (in Chinese) 许瑞, 田佳鑫, 张冬星, 等. 维氏气单胞菌TH0426株主要黏附素基因的克隆、生物信息学分析及原核表达[J]. 中国兽医学报, 2017, 37(11): 2141-2146, 2150. |
| [29] |
Locht C, Simonet M. Bacterial Pathogenesis: Molecular and Cellular Mechanisms[M]. Norfolk, Caister: Academic Press, 2012: 206-207.
|
| [30] |
Li SS, Guo LX, Jiang SX, et al. Cloning and nucleotide sequence analysis of aerolysin gene of Aeromonas hydrophila[J]. Microbiology China, 2008, 35(5): 700-704. (in Chinese) 李寿崧, 郭立新, 江树勋, 等. 嗜水气单胞菌气溶素基因的克隆与序列分析[J]. 微生物学通报, 2008, 35(5): 700-704. DOI:10.3969/j.issn.0253-2654.2008.05.010 |
| [31] |
Liu J, Huang YH, Huang J, et al. Studies on the correlation with pathogenicity and virulence genes of Aeromonas hydrophila by Truogx sinensis[J]. Journal of Fishery Sciences of China, 2015, 22(4): 698-706. (in Chinese) 刘杰, 黄艳华, 黄钧, 等. 黄沙鳖源嗜水气单胞菌的致病力与毒力基因型相关性[J]. 中国水产科学, 2015, 22(4): 698-706. |
| [32] |
Xiong J, Lai XJ, Yu Q, et al. Analysis of virulence genes, extracellular products and activities among seven Aeromonas strains isolated from eels[J]. Journal of Huazhong Agricultural University, 2017, 36(1): 76-85. (in Chinese) 熊静, 赖晓健, 余钦, 等. 7株鳗鲡致病性气单胞菌毒力基因胞外产物及其活性比较[J]. 华中农业大学学报, 2017, 36(1): 76-85. |
| [33] |
Zhang ZR, Xia MY, Ni YX. Basis and Clinic of Microbial Drug Resistance[M]. Beijing: People's Medical Publishing House, 2007: 170-174. (in Chinese) 张卓然, 夏梦岩, 倪语星. 微生物耐药的基础与临床[M]. 北京: 人民卫生出版社, 2007: 170-174. |
| [34] |
Li Q, Yang HJ, He Y, et al. Characterization and multilocus sequence typing of Aeromonas strains isolated in Tianjin area[J]. Microbiology China, 2013, 40(8): 1365-1374. (in Chinese) 李倩, 杨洪江, 何洋, 等. 天津地区气单胞菌分离株的鉴定与多位点序列分型[J]. 微生物学通报, 2013, 40(8): 1365-1374. |
| [35] |
Ministry of Agriculture of the People's Republic of China. NY 5071-2002 Guidelines for the use of non-polluted food and fishery drugs[S]. Beijing: Standards Press of China, 2002 (in Chinese) 中华人民共和国农业部. NY 5071-2002无公害食品渔用药物使用准则[S].北京: 中国标准出版社, 2002 |
 2019, Vol. 46
2019, Vol. 46