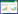扩展功能
文章信息
- 胡展, 雷平, 郭照辉, 杨华, 肖蓉, 罗瑢君, 黄军, 付祖姣
- HU Zhan, LEI Ping, GUO Zhao-Hui, YANG Hua, XIAO Rong, LUO Rong-Jun, HUANG Jun, FU Zu-Jiao
- 生防放线菌Ahn75的荧光标记及其在水稻中的定殖
- Fluorescent marker of biocontrol actinomycetes Ahn75 and its colonization in rice
- 微生物学通报, 2019, 46(10): 2612-2619
- Microbiology China, 2019, 46(10): 2612-2619
- DOI: 10.13344/j.microbiol.china.180987
-
文章历史
- 收稿日期: 2018-12-03
- 接受日期: 2019-04-02
- 网络首发日期: 2019-04-19
水稻稻瘟病由真菌梨孢霉菌(Magnaporthe oryzae)侵染引起,是全世界稻区危害最严重的水稻病害之一。每年因稻瘟病导致的水稻产量损失约占总产量的10%−30%[1]。目前,培育抗病新品种和喷施化学农药是防治稻瘟病的主要手段,但是抗病新品种的选育不仅周期长,而且存在抗性易丢失的问题,但大量使用化学农药不但会污染环境,还会导致有害物质残留在稻米中,影响人类健康[2-3]。因此,探索开发新的方法来控制稻瘟病越来越受到人们重视,其中生物防治成为重要的研究领域。
微生物源农药因为具有不易产生抗药性、与环境相容性好的特点[4-5],引起了生防专家极大的重视,并在稻瘟病生物防治方面开展了系列而深入的研究。目前,涉及稻瘟病生物防治的微生物主要有真菌[6-7]、芽胞杆菌[8-10]、假单胞菌[11-12]、放线菌[13-16]等。这些微生物能否在水稻中成功定殖,是检验其生防效果的重要指标。尤其是对于植物来源的内生放线菌来说,详细了解菌株与水稻之间的互作关系及在水稻中的定殖规律,对于提高和稳定菌剂的生防效果意义重大,同时也有助于制定科学有效的田间施用技术。
绿色荧光蛋白(GFP)是一种优质的动态活细胞标记分子,它稳定性好、易表达、对宿主细胞无毒害作用,且激发不需要消耗能量和其他辅助因子[17],因而成为研究靶标微生物与宿主或环境互作的重要工具[18],在炭疽菌[19]、芽胞杆菌[20]、木霉真菌[21]以及链霉菌[22]等多种生防微生物中均有应用。本研究选取的出发菌株Ahn75是从海南水稻稻瘟病发病区的未发病水稻茎组织中分离纯化的一株内生链霉菌(Streptomyces sp.)。前期研究表明,该菌株对稻瘟病原菌的菌丝生长和孢子萌发均具有较高的抑制作用,10%的发酵滤液对稻瘟病菌丝生长抑制率为80.8%,50%的发酵滤液对稻瘟病孢子萌发抑制率为78.3%。为了研究该生防菌在水稻中的定殖特性,本文首先以E. coli ET12567/pUZ8002为供体菌,通过接合转移将穿梭载体pIJ8655上的gfp基因导入到Ahn75中,随后对重组菌Ahn75-GFP在水稻中的定殖水平进行了荧光观察和定量分析,以期为探明生防菌株Ahn75对稻瘟病的生防机制及该菌在稻田中的施用方式提供可行性依据。
1 材料与方法 1.1 材料 1.1.1 供试菌株、质粒和品种生防链霉菌Ahn75由本实验室从水稻中分离获得;E. coli ET12567/pUZ8002由本实验室保存;质粒pIJ8655由Sun等[23]提供;稻瘟病病原菌TCYD1是本研究组从湖南益阳桃江地区的染病水稻植株上分离获得。水稻品种:超优一千。
1.1.2 引物用于扩增gfp序列的特异性引物由生工生物工程(上海)股份有限公司合成,序列为:EGFP-F:5′-TAACTTATGGTGAGCAAGGGCG-3′;EGFP-R:5′-GCGTTACTTGTACAGCTCGTCC-3′。
1.1.3 培养基细菌培养采用LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0;放线菌培养、平板对峙试验和内生菌重分离采用ISP2培养基(g/L):酵母提取物4.0,麦芽提取物10.0,葡萄糖4.0;接合转移试验采用2×YT培养基(g/L):胰蛋白胨16.0,酵母提取物10.0,NaCl 5.0。
1.1.4 主要试剂和仪器各种抗生素、细菌基因组提取试剂盒,生工生物工程(上海)股份有限公司;Taq酶试剂盒、DNA Marker DL2000,宝生物(大连)有限公司;Hoagland营养液,青岛海博生物技术有限公司;0.4%台盼蓝染液,北京索莱宝科技有限公司。荧光显微镜,蔡司公司;超声波清洗器,上海之信仪器有限公司;PCR仪,Eppendorf公司;人工气候箱,上海森信实验仪器有限公司;Gel Logic凝胶成像仪,柯达公司。
1.2 方法 1.2.1 放线菌Ahn75的荧光标记取37 ℃、800 r/min培养过夜的E. coli ET12567/pUZ8002菌液,接种到新的LB培养基中,培养至OD600为0.1,加入质粒pIJ8655,混匀后按照电激法[24]进行细胞转化;转化后的细胞37 ℃、800 r/min培养1 h后涂布于含有卡那霉素(25 μg/mL)、氯霉素(25 μg/mL)和安普霉素(50 μg/mL)的LB平板上,37 ℃培养16 h筛选阳性菌株。放线菌Ahn75与E. coli ET12567/pUZ8002/pIJ8655间的接合转移参考刘晓瑜等[22]的方法,在含有萘啶酮酸(50 μg/mL)和安普霉素(50 μg/mL)的ISP2平板上筛选可能的接合子,挑取单菌落纯化,确定菌株为链霉菌后用含50 μg/mL的安普霉素抗性平板培养,并将重组菌株命名为Ahn75-GFP。
1.2.2 Ahn75-GFP的分子及荧光检测采用细菌基因组提取试剂盒提取重组子Ahn75-GFP的基因组,以其为模板,利用引物EGFP-F/R进行特异性扩增,目的片段长度为720 bp。PCR反应体系(25 μL):模板(120 mg/L) 1 μL,引物EGFP-F/R (10 μmol/L)各0.5 μL,2×PCR Master Mix 12.5 μL,ddH2O 10.5 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,58 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min。PCR产物用1.5%琼脂糖凝胶电泳检测,并用凝胶图像分析系统拍照。插片法培养放线菌Ahn75-GFP,使用荧光显微镜对其发光表型进行检测。
1.2.3 Ahn75-GFP的抑菌活性及遗传稳定性检测生防菌对稻瘟病菌生长的抑制作用采用平板对峙法测定,方法参照蔡长平等[25]的方法,抑制率(%)=(对照组菌落直径−处理组菌落直径)/(对照组菌落直径−菌饼直径)×100。挑取第一代Ahn75- GFP转化子的单菌落于普通的ISP2液体培养基中转接20代,随后挑取菌液在荧光显微镜下观察菌丝及其荧光强度。
1.2.4 生防菌在水稻中的定殖取饱满健康的水稻种子,70%酒精表面消毒5 min,无菌水漂洗3次,而后将种子平铺于湿润滤纸表面,覆盖浸湿的6层纱布于暗处催芽48 h。取发芽的种子转接至平铺了塑料网格并装满Hoagland营养液(3 d更换一次营养液)的水培盒中,于人工气候培养箱培养,光照99%每天12 h,温度28 ℃,湿度80%,培养7 d。在培养水稻苗的同时,将菌株Ahn75-GFP接入含安普霉素的ISP2平板上28 ℃培养5 d,用0.1%吐温溶液冲洗下平板上的孢子,血球计数板计算孢子浓度,最后用0.05%的吐温水溶液稀释至108 CFU/mL。将配制好的孢子溶液喷施在水稻植株上,平均每株喷施0.5−0.8 mL溶液,对照喷施等量的0.05%吐温水溶液。喷施后的水稻幼苗转移至温室继续培养。
1.2.5 定殖观察及重分离喷施孢子溶液7 d后,取水稻幼苗的根、茎、叶等组织进行切片,制成临时装片,于荧光显微镜下观察Ahn75-GFP在组织中的定殖情况。另外,取水稻幼苗的根进行台盼蓝染色并制成临时装片,于荧光显微镜下观察Ahn75-GFP对水稻根部的侵染,方法参照费云舟[26]。在喷施孢子溶液后的第1、3、5、7、12、17、22、27天分别取10株水稻幼苗,对定殖于根、茎、叶组织中的Ahn75-GFP进行重分离,具体操作:将水稻组织洗净后剪成1 cm大小,室温下放置干燥过夜,称过干重后于超净工作台进行表面消毒;75%乙醇浸泡1 min,无菌水清洗3遍,5%次氯酸钠溶液浸泡3 min,无菌水清洗4遍,取最后一次清洗液100 μL涂布于普通ISP2平板上,28 ℃培养3−5 d无微生物长出说明消毒彻底;将消毒后的组织置于碾钵中磨成匀浆,并稀释10−100倍,分别取100 μL匀浆液和稀释浆液涂布于含安普霉素抗性的ISP2平板上,在28 ℃恒温箱中培养3−5 d后,统计目标菌数。
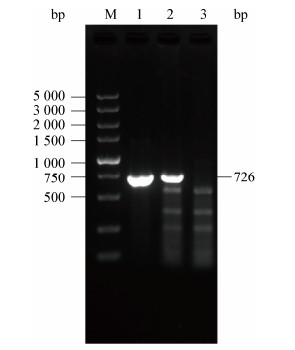
2 结果与分析 2.1 荧光标记菌株的鉴定质粒pIJ8655通过电激法转化到E. coli ET12567/pUZ8002中,转化子用含有卡那霉素、氯霉素和安普霉素的LB平板进行筛选,并采用菌落PCR进行鉴定(结果未显示)。然后,以E. coli ET12567/pUZ8002/pIJ8655作为供体菌,与放线菌Ahn75进行接合转移,用萘啶酮酸和安普霉素的抗性平板筛选接合子,挑取单菌落进行纯化。获得的接合菌株Ahn75-GFP,用试剂盒提取其基因组DNA并进行PCR鉴定(图 1)。与此同时,应用插片法培养Ahn75-GFP 5 d后,在荧光显微镜下观察到重组菌株的自发荧光(图 2)。因此,上述结果表明,荧光基因已成功导入到生防菌基因组中。
|
| 图 1 重组接合子的PCR鉴定 Figure 1 PCR identification of recombinant strain 注:M:DL5000 DNA marker;1:质粒pIJ8655;2:重组接合子Ahn75-GFP;3:放线菌Ahn75. Note: M: DL5000 DNA marker; 1: Plasmid pIJ8655; 2: Recombinant strain Ahn75-GFP; 3: Ahn75. |
|
|
|
| 图 2 重组接合子Ahn75-GFP的荧光鉴定 Figure 2 Fluorescence identification of recombinant strain Ahn75-GFP 注:A:荧光显微镜相差视野下观察Ahn75-GFP (400×);B:荧光显微镜暗视野下观察Ahn75-GFP (400×). Note: A: Ahn75-GFP observed under phase contrast field of fluorescence microscopy (400×); B: Ahn75-GFP observed under dark field of fluorescence microscopy (400×). |
|
|
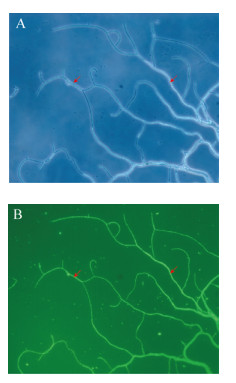
如图 3所示,标记菌株Ahn75-GFP与原始菌株Ahn75对稻瘟病病原菌都有较好的抑制活性。通过3组平行试验得出Ahn75-GFP和Ahn75对稻瘟病菌丝生长的平均抑制率分别为61.8%和63.1%,二者无明显差别,说明荧光标记基因的整合不会影响Ahn75的抑菌活性。此外,第一代Ahn75-GFP在ISP2培养液中传代20次后,在荧光显微镜下可以观察到菌丝正常发出荧光(图 4),表明gfp基因在Ahn75菌株中的遗传稳定。
|
| 图 3 重组接合子Ahn75-GFP的抑菌活性鉴定 Figure 3 Anti-blast activity identification of recombinant zygote Ahn75-GFP 注:A:Ahn75;B:稻瘟病原菌;C:Ahn75-GFP. Note: A: Ahn75; B: Magnaporthe grisea; C: Ahn75-GFP. |
|
|

|
| 图 4 Ahn75-GFP传代20次后的荧光鉴定 Figure 4 Fluorescence identification of Ahn75-GFP subcultured 20 times 注:A:荧光显微镜相差视野(200×);B:荧光显微镜暗视野(200×). Note: A: Under phase contrast field of fluorescence microscopy (200×); B: Under dark field of fluorescence microscopy (200×). |
|
|
Ahn75-GFP在水稻中定殖7 d后,取根、茎、叶组织制成临时切片,在荧光显微镜下进行观察。如图 5所示,虽然植物组织本身有部分背景荧光,但是在定殖的水稻幼苗根、茎、叶等组织中还是能比较明显地观察到Ahn75-GFP发出的绿色荧光,它们主要位于组织或细胞的间隙之间。此外,与空白对照相比(图 5G),定殖的水稻根组织经台盼蓝染色处理后,可以更清晰地观察到大量菌丝缠绕在根组织中或周围(图 5H)。这些结果表明,Ahn75生防菌株能在水稻植株中稳定地生存,这是其发挥抗稻瘟病作用的重要基础。

|
| 图 5 Ahn75-GFP在水稻根、茎、叶组织中的定殖观察 Figure 5 Colonization of Ahn75-GFP in the root, stem and leaf of rice 注:A、C、E:荧光显微镜相差视野下观察定殖后的根、茎、叶组织(200×);B、D、F:荧光显微镜暗视野下观察定殖后的根、茎、叶组织(200×);G、H:荧光显微镜相差视野下观察经台盼蓝染色处理的空白对照根和定殖根组织(200×). Note: A, C, E: The root, stem and leaf colonized by Ahn75-GFP under phase contrast field of fluorescence microscopy (200×); B, D, F: The root, stem and leaf colonized by Ahn75-GFP under dark field of fluorescence microscopy (200×); G, H: The blank control root and the colonized root treated with Trypan blue dye under phase contrast field of fluorescence microscopy (200×). |
|
|
为了研究Ahn75-GFP在水稻植株中的具体分布,经过组织表面消毒后,对定殖的菌株进行了重分离。结果如图 6所示,Ahn75-GFP在水稻各组织中的数量都呈现先快速增长,而后随着时间的推移逐渐下降,直至达到平缓状态。其中,根组织内的菌数变化最大,其原因可能在于最初喷施孢子时培养水稻的营养液促使了放线菌大量繁殖,而后不断更换营养液又导致根内部放线菌的快速逸出,而且随着时间的延长,根组织内部的放线菌也会沿着韧皮部组织导管往上迁移。茎组织中的菌数在前5天有一个大幅度的增长,到了后期其数量相对其他组织而言依然占据优势,这可能与Ahn75本身就是从水稻茎组织中分离获得有关,茎内部环境可能更适宜Ahn75的稳定生存。由此可以得出结论,相较于根和叶而言,Ahn-75在茎组织中的定殖能力更强。
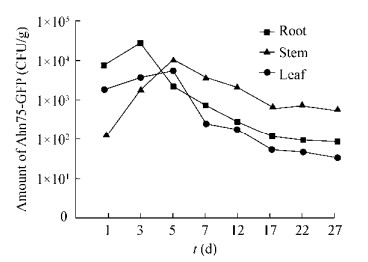
|
| 图 6 水稻中定殖Ahn75-GFP的定量分析 Figure 6 Quantity of Ahn75-GFP colonized in rice |
|
|
稻瘟病是当前水稻种植区威胁稻谷产量的三大病害之一。随着人们环保意识的增强,传统的稻瘟病防治方法已不能适应新型农业的发展,尤其在当前农业绿色转型发展的重要时期,迫切需要对环境友好且绿色无公害的新方法来解决这一重大问题。已有研究表明,内生放线菌在稻瘟病防治中具有极大潜力,而且它绿色安全,对环境不会造成任何污染[16, 27]。为此,本实验室从水稻植株中分离获得了几株对稻瘟病菌具有明显拮抗作用的内生放线菌。其中Ahn75对14个稻瘟病原菌生理小种的抑菌率超过50%,盆栽试验显示该菌株对叶瘟和穗颈瘟的生物防效显著,具有较大的潜在生防价值。
在自然环境下,生防微生物能否稳定生存并有效定殖于作物各组织中是发挥其生物防效的重要条件,定殖能力越强,防治病害的效果就越明显[28]。与根际和土壤微生物相比,内生菌由于与宿主植物长期协同进化,形成了互惠互利、相互依存的关系[29],因此它们定殖在植物组织间受环境的影响较小,作为生防因子能发挥出更大的优势。本研究所选用的Ahn75-GFP菌株能有效定殖于水稻植株各组织中,经27 d后,在每克茎组织中的菌数依然能达到103数量级,而每克根和叶组织中的数量也能达到或接近102数量级。而且,在第17天的时候,我们对定殖的水稻植株也做了无表面消毒处理来分离Ahn75-GFP:将水稻组织在无菌水中进行3次1 min的超声洗涤后,直接碾磨成匀浆进行涂布培养。我们发现其菌数含量比进行了表面消毒处理的植株至少多了2个数量级,说明Ahn75-GFP在水稻组织的表面也有很好的生存能力,这为菌株在水稻组织内部的稳定定殖奠定了基础。由此可以得出结论,在整个苗期,Ahn75-GFP都能在水稻植株中稳定生存,为植株免受稻瘟病菌的侵染起到保护作用。
外源基因gfp常被用于研究靶标微生物与宿主或环境之间的互作,它的便利为人们提供了一把打开微观世界大门的钥匙。不过,外源基因的大量表达有可能会对菌株造成额外的负担,影响原始菌株一些代谢功能[30]。本研究对工程菌株Ahn75-GFP的生长状态和抑菌活性与原始菌株Ahn75做了比对,发现它们之间没有明显变化;而且Ahn75-GFP在传代了20次以后,荧光表达依然稳定。这些结果充分肯定了对Ahn75遗传改造的可行性,也为同类型的研究提供了一种思路。
| [1] |
Dagdas YF, Yoshino K, Dagdas G, et al. Septin-mediated plant cell invasion by the rice blast fungus, Magnaporthe oryzae[J]. Science, 2012, 336(6088): 1590-1595. DOI:10.1126/science.1222934 |
| [2] |
Aktar W, Sengupta D, Chowdhury A. Impact of pesticides use in agriculture: their benefits and hazards[J]. Interdisciplinary Toxicology, 2009, 2(1): 1-12. DOI:10.2478/v10102-009-0001-7 |
| [3] |
Chuma I, Isobe C, Hotta Y, et al. Multiple translocation of the AVR-Pita effector gene among chromosomes of the rice blast fungus Magnaporthe oryzae and related species[J]. PLoS Pathogens, 2011, 7(7): e1002147. DOI:10.1371/journal.ppat.1002147 |
| [4] |
Hyakumachi M, Takahashi H, Matsubara Y, et al. Recent studies on biological control of plant diseases in Japan[J]. Journal of General Plant Pathology, 2014, 80(4): 287-302. DOI:10.1007/s10327-014-0524-4 |
| [5] |
Sha YX. Application of biopesticide against rice blast and analysis of its prospect[J]. Plant Protection, 2017, 43(5): 27-34. (in Chinese) 沙月霞. 生物农药在稻瘟病防治中的应用及前景分析[J]. 植物保护, 2017, 43(5): 27-34. DOI:10.3969/j.issn.0529-1542.2017.05.004 |
| [6] |
Wang YL, Liu SY, Mao XQ, et al. Identification and characterization of rhizosphere fungal strain MF-91 antagonistic to rice blast and sheath blight pathogens[J]. Journal of Applied Microbiology, 2013, 114(5): 1480-1490. DOI:10.1111/jam.12153 |
| [7] |
Liu LN, Tu YL, Zhang JZ. Biocontrol potential of Trichoderma virens strain TY009 against rice sheath blight and other main fungal diseases[J]. Scientia Agricultura Sinica, 2010, 43(10): 2031-2038. (in Chinese) 刘路宁, 屠艳拉, 张敬泽. 绿木霉菌株TY009防治纹枯病等水稻主要真菌病害的潜力[J]. 中国农业科学, 2010, 43(10): 2031-2038. DOI:10.3864/j.issn.0578-1752.2010.10.008 |
| [8] |
Chaiharn M, Chunhaleuchanon S, Lumyong S. Screening siderophore producing bacteria as potential biological control agent for fungal rice pathogens in Thailand[J]. World Journal of Microbiology and Biotechnology, 2009, 25(11): 1919-1928. DOI:10.1007/s11274-009-0090-7 |
| [9] |
Saikia R, Gogoi DK, Mazumder S, et al. Brevibacillus laterosporus strain BPM3, a potential biocontrol agent isolated from a natural hot water spring of Assam, India[J]. Microbiological Research, 2011, 166(3): 216-225. DOI:10.1016/j.micres.2010.03.002 |
| [10] |
Zhao LF, Xu YJ, Peng DH, et al. Screening and inhibitory effect of antagonistic endophytic bacteria associated with soybean root nodules against Magnaporthe grisea[J]. Microbiology China, 2016, 43(5): 998-1008. (in Chinese) 赵龙飞, 徐亚军, 彭顶华, 等. 稻瘟病菌拮抗性大豆根瘤内生细菌的筛选及抑制效果[J]. 微生物学通报, 2016, 43(5): 998-1008. |
| [11] |
Prathuangwong S, Chuaboon W, Chatnaparat T, et al. Induction of disease and drought resistance in rice by Pseudomonas fluorescens SP007s[J]. Chiang Mai University Journal of Natural Sciences, 2012, 11(1): 45-55. |
| [12] |
Gohel NM, Chauhan HL. Integrated management of leaf and neck blast disease of rice caused by Pyricularia oryzae[J]. African Journal of Agricultural Research, 2015, 10(19): 2038-2040. DOI:10.5897/AJAR12.1960 |
| [13] |
Oh HS, Lee YH. A target-site-specific screening system for antifungal compounds on appressorium formation in Magnaporthe grisea[J]. Phytopathology, 2000, 90(10): 1162-1168. DOI:10.1094/PHYTO.2000.90.10.1162 |
| [14] |
Li QL, Jiang YH, Ning P, et al. Suppression of Magnaporthe oryzae by culture filtrates of Streptomyces globisporus JK-1[J]. Biological Control, 2011, 58(2): 139-148. |
| [15] |
Khalil MS, Moubasher H, Hasan FF. Biological control of rice blast disease by Streptomyces flavotricini[J]. Research Journal of Pharmaceutical, Biological and Chemical Sciences, 2014, 5(5): 1453-1461. |
| [16] |
Wang ZZ, Xu T, Yuan SS, et al. Identification of an endophytic actinomyce OsiRt-1 isolated from rice and its effect against rice blast disease[J]. Microbiology China, 2016, 43(5): 1009-1018. (in Chinese) 王真真, 徐婷, 袁珊珊, 等. 水稻内生放线菌OsiRt-1的分离鉴定及对稻瘟病的防治作用[J]. 微生物学通报, 2016, 43(5): 1009-1018. |
| [17] |
Kong HG, Choi K, Heo KR, et al. Generation of a constitutive green fluorescent protein expression construct to mark biocontrol bacteria using P43 promoter from Bacillus subtilis[J]. The Plant Pathology Journal, 2009, 25(2): 136-141. |
| [18] |
Yang XR, Tian T, Sun SQ, et al. GFP-expressing Bacillus subtilis B579 strain and its colonization detection[J]. Acta Phytopathologica Sinica, 2013, 43(1): 82-87. (in Chinese) 杨秀荣, 田涛, 孙淑琴, 等. GFP标记生防细菌B579及其定殖能力检测[J]. 植物病理学报, 2013, 43(1): 82-87. DOI:10.3969/j.issn.0412-0914.2013.01.011 |
| [19] |
Horowitz S, Freeman S, Sharon A. Use of green fluorescent protein-transgenic strains to study pathogenic and nonpathogenic lifestyles in Colletotrichum acutatum[J]. Phytopathology, 2002, 92(7): 743-749. DOI:10.1094/PHYTO.2002.92.7.743 |
| [20] |
Shen XQ, Liu T, Hu XL, et al. Labeling Bacillus pumillus with green fluorescent protein (GFP) and its colonization in rice seedlings[J]. Scientia Agricultura Sinica, 2012, 45(24): 5024-5031. (in Chinese) 沈新迁, 刘通, 胡晓璐, 等. 短小芽孢杆菌转座突变株的GFP标记及在水稻上的定殖[J]. 中国农业科学, 2012, 45(24): 5024-5031. DOI:10.3864/j.issn.0578-1752.2012.24.007 |
| [21] |
Sarrocco S, Mikkelsen L, Vergara M, et al. Histopathological studies of sclerotia of phytopathogenic fungi parasitized by a GFP transformed Trichoderma virens antagonistic strain[J]. Mycological Research, 2006, 110(2): 179-187. DOI:10.1016/j.mycres.2005.08.005 |
| [22] |
Liu XY, Ma YC. Green fluorescent protein marker of biocontrol Streptomyces SSD49 and its colonization on the Populus tomentosa somaclone[J]. Biotechnology Bulletin, 2016, 32(9): 197-202. (in Chinese) 刘晓瑜, 马玉超. 生防链霉菌SSD49的绿色荧光蛋白标记及其在毛白杨组培苗中的定殖[J]. 生物技术通报, 2016, 32(9): 197-202. |
| [23] |
Sun J, Kelemen GH, Fernández-Abalos JM, et al. Green fluorescent protein as a reporter for spatial and temporal gene expression in Streptomyces coelicolor A3(2)[J]. Microbiology, 1999, 145: 2221-2227. DOI:10.1099/00221287-145-9-2221 |
| [24] |
Shen HX. Protocols and Techniques of Molecular Biology[M]. Guangzhou: Sun Yat-Sen University Press, 2010. (in Chinese) 申煌煊. 分子生物学实验方法与技巧[M]. 广州: 中山大学出版社, 2010. |
| [25] |
Cai CP, Huang J, Lei P, et al. Screening and identification of antagonistic actinomycete CZ133 against rice blast and analysis of its antimicrobial activity[J]. Hunan Agricultural Sciences, 2018(9): 1-5. (in Chinese) 蔡长平, 黄军, 雷平, 等. 稻瘟病拮抗放线菌CZ133的筛选、鉴定及抑菌活性分析[J]. 湖南农业科学, 2018(9): 1-5. |
| [26] |
Fei YZ. The effect of arbuscular mycorrhizal fungi on the growth of Astragalus sinicus. L and heavy metal uptake in sludge contaminated soil[D]. Wuhan: Master's Thesis of Huazhong Agricultural University, 2010 (in Chinese) 费云舟.污泥污染土壤中接种AM真菌对紫云英生长及重金属吸收的影响[D].武汉: 华中农业大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10504-1010010172.htm |
| [27] |
Qin S, Li J, Chen HH, et al. Isolation, diversity, and antimicrobial activity of rare actinobacteria from medicinal plants of tropical rain forests in Xishuangbanna, China[J]. Applied and Environmental Microbiology, 2009, 75(19): 6176-6186. DOI:10.1128/AEM.01034-09 |
| [28] |
Weller DM. Biological control of soilborne plant pathogens in the rhizosphere with bacteria[J]. Annual Review of Phytopathology, 1988, 26: 379-407. DOI:10.1146/annurev.py.26.090188.002115 |
| [29] |
Ryan P, Germaine K, Franks A, et al. Bacterial endophytes: recent developments and applications[J]. FEMS Microbiology Letters, 2008, 278(1): 1-9. DOI:10.1111/j.1574-6968.2007.00918.x |
| [30] |
Li XM, Xu ZG, Mew TW. Colonization of antagonistic bacteria on rice plants and their influence on native bacteria[J]. Acta Ecologica Sinica, 2008, 28(8): 3868-3874. (in Chinese) 李湘民, 许志刚, Mew TW. 稻株上拮抗细菌的定殖及其对土著细菌的影响[J]. 生态学报, 2008, 28(8): 3868-3874. DOI:10.3321/j.issn:1000-0933.2008.08.045 |
 2019, Vol. 46
2019, Vol. 46