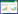扩展功能
文章信息
- 申永瑞, 向君亮, 王佳琦, 刘爽, 李章雷, 刘权, 殷奎德
- SHEN Yong-Rui, XIANG Jun-Liang, WANG Jia-Qi, LIU Shuang, LI Zhang-Lei, LIU Quan, YIN Kui-De
- 疮痂链霉菌拮抗菌株BU396的分离鉴定与抗菌性质分析
- Isolation, identification and antimicrobial properties of a biocontrol strain BU396 against Streptomyces scabies
- 微生物学通报, 2019, 46(10): 2601-2611
- Microbiology China, 2019, 46(10): 2601-2611
- DOI: 10.13344/j.microbiol.china.190269
-
文章历史
- 收稿日期: 2019-03-31
- 接受日期: 2019-05-28
- 网络首发日期: 2019-06-10
马铃薯作为我国主要粮食作物之一,在多个地区广泛种植,且逐渐成为云南、四川、甘肃和黑龙江等省份的重要经济来源。随着种植面积的扩大,马铃薯疮痂病的发生也日益严重[1]。该病是由疮痂链霉菌(Streptomyces scabies)引起的一种土传病害,其发病症状主要为薯块上产生褐色的凸起病斑[2],危害马铃薯的品质,严重时还会导致其产量的下降,对马铃薯产业造成了巨大的经济损失[3]。施用化学农药虽然能对病害产生一定的防治效果,但化学防治不仅会导致土壤微生态失衡,还会破坏环境,因此利用安全高效的生物学手段对马铃薯疮痂病进行防治显得十分重要。
目前越来越多的生防菌株被研究并初步应用到生物防治中[4-6]。芽孢杆菌是一类常见的生防细菌,其不仅具有耐高温、繁殖速度快、在自然界中普遍存在等优点[7],还能够在生态位竞争中占据有利的位置[8],对相关病害进行有效防治。因此,芽孢杆菌逐渐成为生防菌筛选的主要材料及研究热点,发展前景广阔。现阶段已经有多种具有生防作用的芽孢杆菌被研究和报道[9-12],如枯草芽孢杆菌(Bacillus subtilis)、贝莱斯芽孢杆菌(Bacillus velezensis)和解淀粉芽孢杆菌(Bacillus amyloliquefaciens)等。研究表明,芽孢杆菌产生的多种抗菌物成为影响其抗菌活性强弱的关键因素,其中丰原素(Fengycin)、表面活性素(Surfactin)、枯草菌素(Subtilin)和伊枯草菌素(Iturin)等抗菌肽已经被鉴定[13-16],但近年来又陆续发现了多种类型的抗菌蛋白,如EP-2和β-1, 3-1, 4-葡聚糖酶[17-19]等。但由于芽孢杆菌的种类众多,其生防效果及产生的抗菌物均存在较大差异,因此抗菌效果优良的芽孢杆菌及抗菌物仍有待进一步挖掘。
针对上述情况,本研究从马铃薯疮痂病病土中筛选到一株对疮痂链霉菌具有显著抗菌效果的生防细菌,对其进行形态特征、生理生化指标和分子生物学鉴定,并采用PCR法对该菌株的抗菌物合成基因进行分析,随后对抗菌物进行活性测试和稳定性分析,并通过盆栽试验检测该菌株对马铃薯疮痂病的防病效果。本文旨在寻找高效抑制马铃薯疮痂病的生防菌株,掌握其抗菌物的基本性质和作用条件,为马铃薯疮痂病害的生物防治提供参考和依据。
1 材料与方法 1.1 材料供试植物病原菌:疮痂链霉菌(S. scabies)、立枯丝核菌(Rhizoctonia solani)和稻瘟病菌(Magnaporthe grisea)均为本实验室保存。
供试动物病原菌:大肠杆菌CMCC44568 (Escherichia coli CMCC44568)、大肠杆菌K88 (Escherichia coli K88)、猪霍乱沙门氏菌(Salmonella choleraesuis)和金黄色葡萄球菌(Staphylococcus aureus)均由黑龙江八一农垦大学动物科学技术学院预防兽医学实验室提供。
生理生化鉴定所用对照菌株贝莱斯芽孢杆菌(B. velezensis)购自中国普通微生物菌种保藏管理中心(CGMCC1.923)。
LB培养基(g/L):酵母提取物5.0,胰蛋白胨10.0,氯化钠10.0,pH 7. 0。YME培养基(g/L):酵母提取物4.0,麦芽提取物10.0,葡萄糖4.0,pH 7.2。
PCR扩增试剂,合肥博美生物科技有限责任公司;细菌基因组提取试剂盒、DNA分子量标准和胶回收试剂盒,北京天根生化科技有限公司。PCR仪,上海超敏生物科技有限公司;凝胶成像系统,上海天能科技有限公司。
试验所用引物均由生工生物工程(上海)股份有限公司合成,引物序列详见表 1。
| 引物名称 Primers name |
引物序列 Primers sequence (5′→3′) |
片段大小 Size (bp) |
扩增基因 Amplification genes |
| 27F | AGAGTTTGATCCTGGCTCAG | 1 465 | 16S rRNA |
| 1492R | GGTTACCTTGTTACGACTT | ||
| srfAA-F | TCGGGACAGGAAGACATCAT | 201 | srfAA |
| srfAA-R | CCACTCAAACGGATAATCCTGA | ||
| fenD-F | GGCCCGTTCTCTAAATCCAT | 269 | fenD |
| fenD-R | GTCATGCTGACGAGAGCAAA | ||
| bacC1-F | CAGCTCATGGGAATGCTTTT | 498 | bacC1 |
| bacC1-R | CTCGGTCCTGAAGGGACAAG | ||
| ituD-F | GATGCGATCTCCTTGGATGT | 647 | ituD |
| ituD-R | ATCGTCATGTGCTGCTTGAG |
菌株的分离与筛选参照宋利沙等[20]方法,稍加改进。从黑龙江省大庆市红骥牧场按五点取样法采集马铃薯疮痂病的病害土壤,称取10.0 g置于内含玻璃珠和无菌水的三角瓶中,于28 ℃、170 r/min振荡40 min,以此为原液进行梯度稀释,取10−2、10−4和10−6梯度各涂布于LB固体平板上,于37 ℃培养24 h。观察菌落生长状况,选取密度适中的平板,挑取单一的菌落进行划线纯化,以疮痂链霉菌为指示菌株采用抑菌圈法[21]进行抑菌效果测试。比较各测试菌株的抑菌效果,随后进行复筛,选取最优的菌株进行后续试验。
1.3 目的菌株的鉴定 1.3.1 形态学及生理生化性质鉴定将筛选得到的最优拮抗菌株划线接种在LB固体培养基上,于37 ℃培养12 h后,对其菌落形态进行观察,并参照《常见细菌系统鉴定手册》[22]进行该菌株的生理生化性质鉴定。
1.3.2 分子生物学鉴定分子鉴定参照王春伟等[23]方法,稍加改进,根据细菌基因组DNA提取试剂盒的操作方法获取菌株的基因组DNA,并以基因组DNA为模板,采用通用引物27F和1492R进行16S rRNA基因扩增。PCR反应体系:2×EsTaq Master Mix 25 μL,基因组DNA 2 μL,上、下游引物(10 μmol/L)各1 μL,加dd H2O至50 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,35个循环;72 ℃ 10 min。随后将扩增产物进行纯化,连接到pGEM-T载体,转至E. coli DH5α感受态细胞后,将转化产物涂布于含有Amp (100 μg/mL)、X-Gal和IPTG的LB固体平板上,37 ℃培养16 h,挑取阳性克隆,送至上海生物工程股份有限公司进行测序,将测定的序列在NCBI上进行BLAST比对,运用MEGA 5.0软件进行序列分析并构建进化树,确定菌株的分类地位。
1.4 拮抗菌株的功能基因分析参照1.3.2的方法提取菌株基因组DNA,以基因组DNA为模板,根据Joshi等[24]方法,设计srfAA-F/R、fenD-F/R、bacC1-F/R和ituD-F/R四对引物(表 1),随后进行生防功能基因的PCR扩增。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 8 min。PCR反应体系同1.3.2。随后将扩增产物进行电泳检测,利用胶回收试剂盒进行PCR产物纯化后,送出测序。将得到的核苷酸序列在NCBI上进行BLAST比对,并进行功能基因的同源性分析。
1.5 抗菌物的制备与活性测试将生防菌接种在5 mL YME液体培养基中,于37 ℃、175 r/min培养过夜。将培养液按照1:100的比例再次接种至250 mL YME液体培养基中,于28 ℃、170 r/min培养22 h。4 ℃、12 000×g离心20 min,获得培养液上清。取100 mL培养液上清,向其中缓慢地加入硫酸铵固体颗粒进行梯度盐析至75%饱和度,随后10 000×g离心30 min得到沉淀,用20 mmol/L Tris-HCl缓冲液(pH 8.0)进行溶解,4 ℃下透析脱盐,收集粗提物。以疮痂链霉菌为指示菌株,采用牛津杯法[25]对抗菌粗提物进行活性检测。
1.6 抗菌物对链霉菌菌丝形态的影响采用牛津杯法进行抗菌试验,使用已灭菌的接种环刮取具有明显抑制条带的边缘菌丝,随后制成装片,在光学显微镜下观察菌丝变化并拍照。以链霉菌的正常菌丝作为对照。
1.7 抗菌物的抗菌谱测定为了综合检验抗菌物的活性,采用牛津杯法对其进行抗菌谱检测,以疮痂链霉菌、立枯丝核菌、稻瘟病菌、金黄色葡萄球菌、大肠杆菌CMCC44568、大肠杆菌K88和猪霍乱沙门氏菌为病原菌来进行抑菌试验,测量抑菌圈直径,观察抑菌情况并拍照。
1.8 抗菌物的稳定性检测 1.8.1 热稳定性检测将抗菌物分别在40、60、80、100 ℃下处理20 min,随后采用牛津杯法检测抗菌活性,并测量抑菌圈直径,以未进行温度处理的抗菌物作为对照。
1.8.2 蛋白酶稳定性检测在抗菌物中分别加入浓度为20、50、100、500和1 000 μg/mL的胰蛋白酶与胃蛋白酶,28 ℃条件下温育2 h后,用牛津杯法测定抗菌活性,并测量抑菌圈直径。以未进行蛋白酶处理的抗菌物作为对照。
1.8.3 金属离子稳定性检测在抗菌物中分别等体积加入0.1 mol/L KCl、NaCl、CaCl2、MgCl2和FeCl2溶液(Cl–对抗菌物无影响),充分混匀静置2 h后,检测抗菌效果,并测量抑菌圈直径。以未进行金属离子处理的抗菌物作为对照。
1.8.4 pH稳定性检测用0.1 mol/L HCl和0.1 mol/L NaOH对抗菌物的pH进行梯度调节至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0,30 ℃恒温水浴锅中温育2 h,随后将不同pH的抗菌物用HCl和NaOH调至中性,牛津杯法测定抗菌活性,并测量抑菌圈直径。
1.9 盆栽试验法验证生防菌株的功能盆栽试验根据宋烨等[26]方法,稍加改进,采用直径为20 cm的聚乙烯塑料盆,选取健康的马铃薯块茎,用75%乙醇溶液对其进行消毒处理,并用无菌水清洗,在28 ℃温箱中放置,进行催芽处理。将健康有芽的马铃薯块茎切成三角块,选择芽长相近的两个马铃薯薯块(牙尖向上)播至花盆中,室温下进行培养,马铃薯苗生长一段时间后,从中选取长势相同的植株进行试验。采用灌根法将30 mL疮痂链霉菌菌悬液(1×109 CFU/mL)分别接种于花盆中,10 d后接入菌株BU396的生防菌菌悬液(1×109 CFU/mL),试验共设置3组处理,每个处理重复8次,处理1中加入30 mL生防菌,处理2中加入60 mL生防菌(充分混匀),对照组不加生防菌(CK),待马铃薯成熟后,根据疮痂病的病害分级标准,统计各组的发病情况,计算发病率、病情指数和相对防效。

|
采用平板稀释法从马铃薯疮痂病的病害土壤中分离得到53株细菌,将分离得到的细菌进行抑菌试验,初步筛选得到5株对疮痂链霉菌具有抑制作用的菌株,随后进行复筛并从中选出一株生防效果突出的菌株,将其编号为BU396 (图 1)。
|
| 图 1 菌株BU396对疮痂链霉菌的抑制作用 Figure 1 The inhibition of strain BU396 against S. scabies 注:A:对照(疮痂链霉菌);B:BU396. Note: A: Control (S. scabies); B: BU396. |
|
|
将拮抗菌株BU396接种在LB固体培养基上培养12 h,随后对其进行形态学观察,发现BU396在LB培养基上的菌落形态为圆形、乳白色,不透明,表面有褶皱和凸起、无光泽,边缘整齐(图 1B)。生理生化性质鉴定结果显示BU396为革兰氏阳性菌,具有过氧化氢酶活性;在唯一碳源(葡萄糖、甘露醇和蔗糖)、唯一氮源(硫酸铵和硝酸钾)和厌氧条件下均能够生长,能够分解淀粉和明胶;硝酸盐还原、吲哚试验、产氨试验、甲基红试验和柠檬酸试验反应均呈阳性;糖酵解试验(葡萄糖,D-甘露糖,甘露醇和蔗糖)呈酸阳性,但在代谢过程中不产气;石蕊牛乳试验呈现酸凝状态。此外,从表 2中可以看出BU396与对照菌株贝莱斯芽孢杆菌[27]的生理生化性质相似,因此初步将该菌株归为芽孢杆菌属。
| 试验指标Test indexes | 大肠杆菌E. coli | 贝莱斯芽孢杆菌B. velezensis | BU396 |
| Only carbon source tests | |||
| Glucose | + | + | + |
| Mannitol | + | + | + |
| Sucrose | − | + | + |
| Only nitrogen source tests | |||
| Ammonium sulfate | − | + | + |
| Potassium nitrate | − | + | + |
| Glycolysis tests | |||
| Glucose | + | + | + |
| Mannitol | + | + | + |
| Sucrose | − | + | + |
| D-mannose | + | + | + |
| Indole test | + | − | − |
| M-R test | + | − | − |
| Gram stain | − | + | + |
| Citrate test | − | + | + |
| Contact enzyme test | − | + | + |
| Ammonia production test | + | + | + |
| Amylohydrolysis test | − | + | + |
| Anaerobic growth test | + | + | + |
| Nitrate reduction test | + | + | + |
| Gelatin liquefaction test | + | + | + |
| Litmus milk test | Enzyme coagulation | Acid coagulation | Acid coagulation |
| 注:+:阳性;−:阴性. Note: +: Positive; −: Negative. |
|||
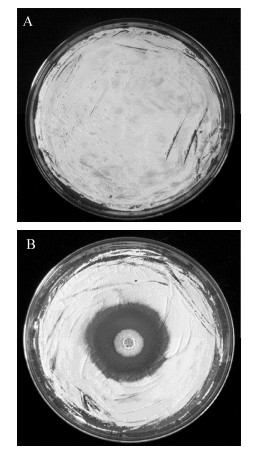
生防菌株BU396筛选完成后,通过试剂盒成功获取菌株基因组DNA,以基因组DNA为模板,采用通用引物对其进行PCR扩增,片段长度约为1 500 bp,PCR产物纯化后,进行连接和转化,挑取阳性克隆,将产物送出测序,将测序得到序列在NCBI上进行BLAST比对,通过MEGA 5.0软件构建系统发育树。菌株BU396 (MK743933)与B. velezensis CR-502T(MG846018)的相似性达到99%,亲缘关系最近(图 2)。因此,在结合形态学及生理生化性质分析结果的基础上最终鉴定BU396为贝莱斯芽孢杆菌(B. velezensis)。
|
| 图 2 基于菌株BU396 16S rRNA基因序列的系统发育树 Figure 2 The phylogenetic tree based on strain BU396 16S rRNA gene sequence 注:T:模式菌株;括号中数值为GenBank登录号;采用邻接法构建系统发育树;分支处标注有自展值,标尺0.005代表核苷酸替换率. Note: T means type strain; Numbers in parentheses are GenBank accession numbers; The phylogenetic tree is constructed by Neighbor-Joining method; The bootstrap values are shown at the node and the scale bar indicates 0.005 substitutions per nucleotide position. |
|
|
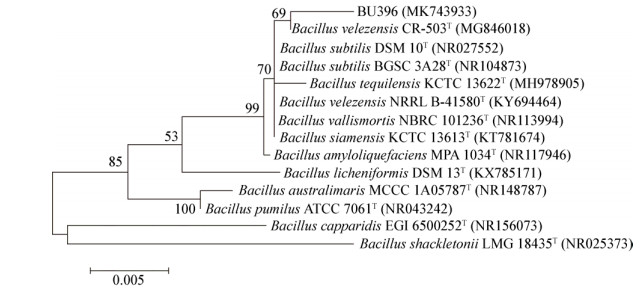
参照Joshi等[24]方法设计4对引物,以菌株BU396的基因组DNA为模板进行PCR扩增,对其是否含有抗菌物质合成的相关基因进行筛选,主要包括srfAA基因(表面活性素)、fenD基因(丰原素)、bacC1基因(溶杆菌素Bacilysin)和ituD基因(伊枯草菌素)。通过电泳检测分析,共得到4条DNA条带,目的片段大小正确,与预期相符(图 3),对扩增产物进行纯化并送出测序。将得到的核苷酸序列在NCBI上进行BLAST比对,对其进行同源性分析可知,菌株BU396的扩增产物srfAA与B. subtilis ATCC 55079 (KC454625)的表面活性素合成酶相关基因srfAA相似性达到98%,fenD与B. amyloliquefaciens Q-426 (JQ271536)的丰原素合成酶相关基因fenD相似性达到97%,bacC1与B. velezensis R1B (MK174675)的溶杆菌素合成酶相关基因bacA相似性达到99%,ituD与Bacillus sp. CY22 (AF534917)的伊枯草菌素合成酶相关基因ituD相似度达到97%。以上结果显示菌株BU396中含有丰原素、表面活性素、伊枯草菌素和溶杆菌素等抗菌物质的合成相关基因。
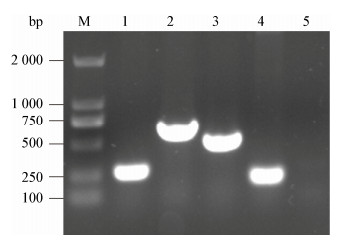
|
| 图 3 菌株BU396功能基因的检测分析 Figure 3 The detection of functional genes from strain BU396 注:M:DNA分子量标准;1:fenD基因;2:ituD基因;3:bacC1基因;4:srfAA基因;5:阴性对照(模板为ddH2O). Note: M: DNA marker; 1: fenD gene; 2: ituD gene; 3: bacC1 gene; 4: srfAA gene; 5: Negative control (ddH2O as template). |
|
|
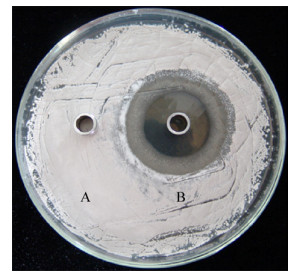
采用YME液体培养基对菌株BU396进行培养,发酵液离心后获得培养液上清,随后加入硫酸铵固体对上清液进行梯度盐析,当饱和度为75%时,抗菌物从沉淀中析出。透析脱盐后获得粗提液,将其浓度调整至1 mg/mL,随后取出150 μL样品加入牛津杯中进行抑菌检测,结果表明BU396的粗提物对疮痂链霉菌具有较好的拮抗作用(图 4)。
|
| 图 4 菌株BU396抗菌物对疮痂链霉菌的活性检测 Figure 4 The activity detection of strain BU396 antimicrobial substance against S. scabies 注:A:对照(20 mmol/L Tris-HCl缓冲液);B:75%的硫酸铵分离得到的抗菌物. Note: A: Control (20 mmol/L Tris-HCl buffer); B: Antimicrobial substance separated from 75% ammonium sulfate. |
|
|
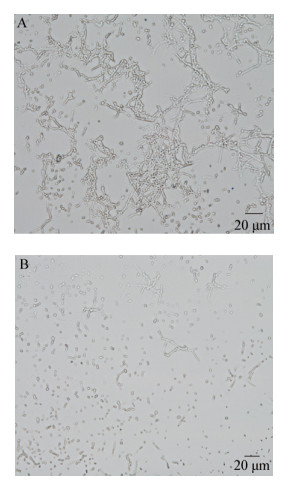
以疮痂链霉菌为病原菌,将BU396的抗菌物浓度调整至1 mg/mL,随后取出150 μL样品加入牛津杯中进行抑菌试验,于28 ℃培养20 h,随后使用接种环(已灭菌)刮取具有明显抑制条带的边缘菌丝,制成装片,并对菌丝变化进行观察(以未处理菌丝作为对照),如图 5所示,对照组菌丝生长正常,经BU396的抗菌物处理后的菌丝不能正常生长,呈现出自溶、断裂等现象,结果表明BU396的抗菌物对链霉菌的菌丝生长具有较强的抑制作用。
|
| 图 5 菌株BU396抗菌物对疮痂链霉菌菌丝生长的抑制情况 Figure 5 The inhibition of strain BU396 antimicrobial substance against S. scabies on the growth of hyphae 注:A:疮痂链霉菌正常菌丝;B:抗菌物处理后的菌丝. Note: A: Normal mycelia of S. scabies; B: Mycelia treated with antimicrobial substance. |
|
|
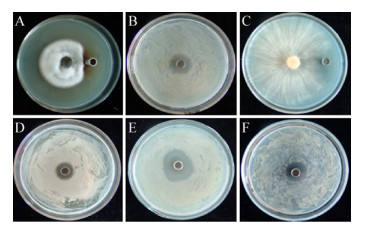
以稻瘟病菌等7种病原菌为指示菌株,将BU396的抗菌物浓度调整至1 mg/mL,随后取出150 μL样品加入牛津杯中进行抗菌谱检测(图 6),发现BU396的抗菌物对7种病原菌均具有拮抗作用(疮痂链霉菌见图 4),其中对猪霍乱沙门氏菌的抑制作用最好,抑菌直径达到28.42 mm (表 3)。抗菌谱试验结果表明BU396的抗菌粗提物具有比较广谱的抗菌活性,且在生防领域具有良好的应用前景。
|
| 图 6 菌株BU396抗菌物的抗菌谱分析 Figure 6 The antimicrobial spectrum analysis of antimicrobial substance from strain BU396 注:A:稻瘟病菌;B:大肠杆菌CMCC44568;C:立枯丝核菌;D:金黄色葡萄球菌;E:猪霍乱沙门氏菌;F:大肠杆菌K88. Note: A: M. grisea; B: E. coli CMCC44568; C: R. solani; D: S. aureus; E: S. choleraesuis; F: E. coli K88. |
|
|
| 病原菌 Pathogens |
抑菌圈直径 The diameter of inhibition zone (mm) |
|
| Plant pathogens | S. scabies | 24.00±0.23b |
| M. grisea | 13.19±0.35g | |
| R. solani | 14.43±0.25f | |
| Animal pathogens | E. coli CMCC44568 | 18.20±0.15d |
| E. coli K88 | 19.62±0.26c | |
| S. choleraesuis | 28.42±0.21a | |
| S. aureus | 17.15±0.44e | |
| 注:不同小写英文字母表示同列数据在P<0.05水平上差异显著. Note: The different small letters in the same column figures indicate significant difference at P<0.05 level. |
||
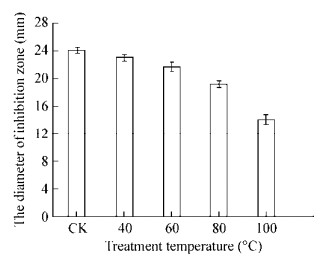
将盐析得到的抗菌物分别在不同温度下处理20 min后,以疮痂链霉菌作为指示菌株,检测其抗菌活性,并测量抑菌圈直径。图 7结果显示,处理温度在40−60 ℃之间粗提物的抑菌活性差异较小,80−100 ℃时虽然活性有所下降,但仍对疮痂链霉菌具有抑制作用,结果表明该抗菌物耐热效果较好。
|
| 图 7 不同处理温度下抗菌物的稳定性分析 Figure 7 The stability analysis of antimicrobial substance at different treatment temperature 注:CK:未进行温度处理的抗菌物. Note: CK: Antimicrobial substance not treated with temperature. |
|
|
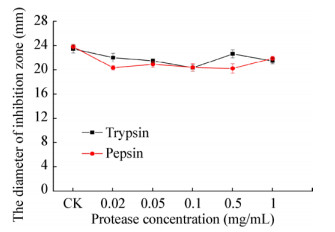
在抗菌物中分别加入不同浓度的胰蛋白酶和胃蛋白酶,37 ℃条件下温育2 h后,用牛津杯法检测抗菌活性,并测量抑菌圈直径。结果显示,经过不同浓度的蛋白酶处理后,抗菌物的活性变化不明显(图 8),进一步表明该抗菌物对胰蛋白酶和胃蛋白酶较不敏感。
|
| 图 8 不同浓度蛋白酶处理下抗菌物的稳定性分析 Figure 8 The stability analysis of antimicrobial substance treated with different concentrations of protease 注:CK:未进行蛋白酶处理的抗菌物. Note: CK: Antimicrobial substance not treated with protease. |
|
|
在抗菌物中分别等体积加入0.1 mol/L KCl和NaCl等溶液,充分混匀静置2 h后检测活性,观察抑菌情况。加入金属离子后,抗菌物活性变化不明显(图 9),这表明抗菌物对金属离子不敏感,进而推测该抗菌物不属于金属酶类。

|
| 图 9 不同金属离子处理下抗菌物的稳定性分析 Figure 9 The stability analysis of antimicrobial substance treated with different metal ions 注:CK:未进行金属离子处理的抗菌物. Note: CK: Antimicrobial substance not treated with metal ions. |
|
|
将盐析得到的抗菌物分别在不同pH下处理,然后将待测样品均调回中性,以疮痂链霉菌作为指示菌株,检测其抗菌活性,并测量抑菌圈直径。在pH<4.0或pH>10.0 (强酸强碱条件下)时,抗菌物完全失去活性,中性条件下抗菌物活性较为稳定,抗菌活性最高(图 10)。

|
| 图 10 不同pH处理下抗菌物的稳定性分析 Figure 10 The stability analysis of antimicrobial substance treated with different pH 注:CK:未进行pH处理的抗菌物. Note: CK: Antimicrobial substance not treated with pH. |
|
|
采用灌根法进行盆栽试验,将30 mL疮痂链霉菌菌悬液(1×109 CFU/mL)分别接种于花盆中,10 d后接入BU396的生防菌菌悬液(1×109 CFU/mL),处理1中加入30 mL,处理2中加入60 mL,对照组不加生防菌,每组处理重复8次。不同处理的马铃薯成熟后,对其进行发病率和相对防效分析。从表 4中可以看出,对照组中马铃薯疮痂病发病情况十分严重,发病率达到87.5%,病情指数为65.63%;处理组1中疮痂病的发病率为64.71%,病情指数为45.10%,发病情况低于对照组(P<0.05);处理组2中马铃薯疮痂病发病情况较轻,发病率和病情指数均达到最低,相对防效达到76.18%,防治效果显著(P<0.05),进一步说明马铃薯疮痂病得到了较好的控制。
| 不同处理 Different treatments |
发病率 Occurrence rate (%) |
病情指数 Disease index (%) |
相对防效 Relative control effects (%) |
| Control | 87.50±2.32a | 65.63±1.07a | |
| Treatment 1 | 64.71±0.48b | 45.10±2.45b | 31.28±2.96b |
| Treatment 2 | 25.00±1.36c | 15.63±1.54c | 76.18±2.04a |
| 注:不同小写英文字母表示同列数据在P<0.05水平上差异显著. Note: The different small letters in the same column figures indicate significant difference at P<0.05 level. |
|||
本研究从马铃薯疮痂病的病害土壤中分离得到多株细菌,经抑菌试验进行复筛后,最终获得一株对疮痂链霉菌具有显著拮抗效果的菌株BU396。随后,本研究结合形态学特征、生理生化性质和16S rRNA基因分子鉴定共3个方面的分析结果,确定生防菌株BU396为贝莱斯芽孢杆菌。芽孢杆菌能产生多种抗菌肽和抗菌蛋白,被认为是影响其抗菌效果的重要因素。本研究对菌株BU396进行了PCR扩增,发现BU396基因组中存在srfAA、fenD、bacA和ituD这4种抗菌物的合成关键基因,进而推测BU396在代谢过程中可能会分泌表面活性素、丰原素、溶杆菌素和伊枯草菌素等抗菌活性物质。抗菌物合成基因的PCR检测为后续BU396抗菌物的分离纯化、成分鉴定以及抑菌机理的研究提供了参考依据。
前期研究表明,菌株BU396产生的抗菌活性物质主要存在于培养液上清中。本研究采用硫酸铵沉淀法从培养液上清中初步分离得到了抗菌粗提物,并进行了抗菌活性检验。经抗菌物处理后,链霉菌的菌丝不能正常生长,呈现出断裂、自溶等现象,进一步印证了其对疮痂链霉菌具有良好的抑制作用,与前期研究结果相符。抗菌谱分析显示该抗菌物不仅对疮痂链霉菌等植物病原菌具有抗菌效果,对猪霍乱沙门氏菌等动物病原菌也具有良好的抑制作用。由此可见,BU396的抗菌谱广泛,不仅可以开发为应用于植物病害的生防菌剂,还具有动物病害防治的潜力,应用前景广阔。
稳定性试验显示,BU396抗菌物的耐热效果较好,对蛋白酶和多种金属离子均不敏感,有较宽泛的最适pH区间。这表明该抗菌物的性质相对稳定,不会因加热变性,不易被酶解,不依赖金属离子发挥功能,且对酸碱环境有一定的耐受能力。这些稳定的特性会为BU396后续的产品加工和田间应用提供便利条件。
通过盆栽试验来验证贝莱斯芽孢杆菌BU396对马铃薯疮痂病的生防作用,结果显示加入低浓度的生防菌(生防菌与病原菌的比例为1:1),马铃薯的发病率和病情指数明显降低,加入高浓度(生防菌与病原菌的比例为2:1)的生防菌,马铃薯表面几乎不产生明显的病斑,病情指数降至15.63%,相对防效达到76.18%,进一步证明了菌株BU396对马铃薯疮痂病具有良好的防治效果,为马铃薯疮痂病的有效防治奠定基础。
本研究分离并鉴定了一株对疮痂链霉菌具有显著拮抗作用的贝莱斯芽孢杆菌BU396,对其抗菌物合成相关基因进行了检测,初步分离获得了抗菌物,并对抗菌物的抗菌谱和稳定性进行了检测,最后通过盆栽试验再次验证菌株BU396对马铃薯疮痂病良好的防治效果。在今后的研究中,我们将对贝莱斯芽孢杆菌BU396的抗菌物进行进一步的分离和纯化,鉴定主要抗菌活性成分,为马铃薯疮痂病害的生物防治提供参考和依据。
| [1] |
Zhang JP, Liu J, Ha S, et al. Identification of Streptomyces spp. causing common scab[J]. Chinese Potato Journal, 2018, 32(5): 308-314. (in Chinese) 张建平, 刘佳, 哈斯, 等. 马铃薯疮痂病菌(Streptomyces spp.)的鉴定[J]. 中国马铃薯, 2018, 32(5): 308-314. DOI:10.3969/j.issn.1672-3635.2018.05.008 |
| [2] |
Ndowora TCR, Kinkel LL, Jones RK, et al. Fatty acid analysis of pathogenic and suppressive strains of Streptomyces species isolated in Minnesota[J]. Phytopathology, 1996, 86(2): 138-143. DOI:10.1094/Phyto-86-138 |
| [3] |
Li YC, Li BY, You XY, et al. Screening, identification and biocontrol effect of antagonistic bacteria on potato common scab[J]. Biotechnology Bulletin, 2018, 34(10): 116-121. (in Chinese) 李玉聪, 李滨影, 油心怡, 等. 马铃薯疮痂病拮抗菌的筛选鉴定及防治效果初探[J]. 生物技术通报, 2018, 34(10): 116-121. |
| [4] |
Zouari I, Jlaiel L, Tounsi S, et al. Biocontrol activity of the endophytic Bacillus amyloliquefaciens strain CEIZ-11 against Pythium aphanidermatum and purification of its bioactive compounds[J]. Biological Control, 2016, 100: 54-62. DOI:10.1016/j.biocontrol.2016.05.012 |
| [5] |
Gao XN, Gong YF, Huo YX, et al. Endophytic Bacillus subtilis strain E1R-J is a promising biocontrol agent for wheat powdery mildew[J]. Biomed Research International, 2015, 2015: 462645. |
| [6] |
Guardado-Valdivia L, Tovar-Pérez E, Chacón-López A, et al. Identification and characterization of a new Bacillus atrophaeus strain B5 as biocontrol agent of postharvest anthracnose disease in soursop (Annona muricata) and avocado (Persea americana)[J]. Microbiological Research, 2018, 210: 26-32. DOI:10.1016/j.micres.2018.01.007 |
| [7] |
Zheng SF, Tan SY, Tan WG, et al. Research progress of high cell density fermentation technology in biocontrol of Bacillus spp.[J]. Hunan Agricultural Sciences, 2017(3): 120-124. (in Chinese) 郑双凤, 谭石勇, 谭武贵, 等. 生防芽孢杆菌高密度发酵技术研究进展[J]. 湖南农业科学, 2017(3): 120-124. |
| [8] |
Bacon CW, Yates IE, Hinton DM, et al. Biological control of Fusarium moniliforme in maize[J]. Environmental Health Perspectives, 2001, 109(S2): 325-332. |
| [9] |
Sun PP, Cui JC, Jia XH, et al. Isolation and characterization of Bacillus amyloliquefaciens L-1 for biocontrol of Pear Ring Rot[J]. Horticultural Plant Journal, 2017, 3(5): 183-189. DOI:10.1016/j.hpj.2017.10.004 |
| [10] |
Chinheya CC, Yobo KS, Laing MD. Biological control of the rootknot nematode, Meloidogyne javanica (Chitwood) using Bacillus isolates, on soybean[J]. Biological Control, 2017, 109: 37-41. DOI:10.1016/j.biocontrol.2017.03.009 |
| [11] |
Reiss A, Jørgensen LN. Biological control of yellow rust of wheat (Puccinia striiformis) with Serenade® ASO (Bacillus subtilis strain QST713)[J]. Crop Protection, 2017, 93: 1-8. DOI:10.1016/j.cropro.2016.11.009 |
| [12] |
Nam MH, Kim HS, Lee HD, et al. Biological control of anthracnose crown rot in strawberry using Bacillus velezensis NSB-1[J]. Acta Horticulturae, 2014, 1049: 685-688. |
| [13] |
Hu LB, Shi ZQ, Zhang T, et al. Fengycin antibiotics isolated from B-FS01 culture inhibit the growth of Fusarium moniliforme Sheldon ATCC 38932[J]. FEMS Microbiology Letters, 2007, 272(1): 91-98. DOI:10.1111/j.1574-6968.2007.00743.x |
| [14] |
Peypoux F, Bonmatin JM, Wallach J. Recent trends in the biochemistry of surfactin[J]. Applied Microbiology and Biotechnology, 1999, 51(5): 553-563. DOI:10.1007/s002530051432 |
| [15] |
Spieß T, Korn SM, Kötter P, et al. Autoinduction specificities of the lantibiotics Subtilin and Nisin[J]. Applied and Environmental Microbiology, 2015, 81(22): 7914-7923. DOI:10.1128/AEM.02392-15 |
| [16] |
Arrebola E, Jacobs R, Korsten L. Iturin A is the principal inhibitor in the biocontrol activity of Bacillus amyloliquefaciens PPCB004 against postharvest fungal pathogens[J]. Journal of Applied Microbiology, 2010, 108(2): 386-395. DOI:10.1111/j.1365-2672.2009.04438.x |
| [17] |
Wang NN, Yan X, Gao XN, et al. Purification and characterization of a potential antifungal protein from Bacillus subtilis E1R-J against Valsa mali[J]. World Journal of Microbiology and Biotechnology, 2016, 32(4): 63. DOI:10.1007/s11274-016-2024-5 |
| [18] |
Wang NN, Gao XN, Yan X, et al. Purification, characterization, and heterologous expression of an antifungal protein from the endophytic Bacillus subtilis strain Em7 and its activity against Sclerotinia sclerotiorum[J]. Genetics and Molecular Research, 2015, 14(4): 15488-15504. DOI:10.4238/2015.November.30.27 |
| [19] |
Zhao XY, Zhao XM, Wei YM, et al. Isolation and identification of a novel antifungal protein from a rhizobacterium Bacillus subtilis strain F3[J]. Journal of Phytopathology, 2013, 161(1): 43-48. DOI:10.1111/jph.12015 |
| [20] |
Song LS, Jiang N, Miao JH, et al. Screening and identification of the bacteria antagonistic to Colletotrichum dematium of Sarcandra glabra[J]. Plant Protection, 2018, 44(6): 61-65, 72. (in Chinese) 宋利沙, 蒋妮, 缪剑华, 等. 肿节风炭疽病拮抗细菌的筛选与鉴定[J]. 植物保护, 2018, 44(6): 61-65, 72. |
| [21] |
Zhang ZJ, Liu Q. Screen and identification of a Serratia plymuthica BU09 and its inhibition effect against S. scabies[J]. Journal of Anhui Agricultural Sciences, 2017, 45(11): 123-124, 167. (in Chinese) 张竹君, 刘权. 普城沙雷氏菌BU09的分离鉴定及其对疮痂链霉菌的防治效果[J]. 安徽农业科学, 2017, 45(11): 123-124, 167. DOI:10.3969/j.issn.0517-6611.2017.11.040 |
| [22] |
Dong XZ, Cai MY. Handbook of Common Bacterial System Identification[M]. Beijing: Science Press, 2001. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [23] |
Wang CW, Wang Y, Zhang XQ, et al. Isolation, identification, optimization of fermentation conditions and biocontrol effects of antagonistic bacterium strain YJ15[J]. Acta Horticulturae Sinica, 2018, 45(10): 1905-1916. (in Chinese) 王春伟, 王燕, 张曦倩, 等. 拮抗细菌菌株YJ15的分离鉴定、发酵条件优化及对越橘灰霉病的防效[J]. 园艺学报, 2018, 45(10): 1905-1916. |
| [24] |
Joshi R, Gardener BBM. Identification and characterization of novel genetic markers associated with biological control activities in Bacillus subtilis[J]. Phytopathology, 2006, 96(2): 145-154. DOI:10.1094/PHYTO-96-0145 |
| [25] |
Liu PJ, Fu ZH, Sun D, et al. Separation and purification of Lectin from Morus alba L. and its antimicrobial activity[J]. Natural Product Research and Development, 2015, 27(3): 475-479. (in Chinese) 刘鹏举, 付志慧, 孙东, 等. 桑叶凝集素分离纯化及抑菌活性研究[J]. 天然产物研究与开发, 2015, 27(3): 475-479. |
| [26] |
Song Y, Xiang JL, Shen YR, et al. Screening and identification of Bacillus strain BU108 and bio-control effects on potato scab[J]. Journal of Zhejiang A&F University, 2018, 35(4): 757-764. (in Chinese) 宋烨, 向君亮, 申永瑞, 等. 芽孢杆菌BU108的分离鉴定及对马铃薯疮痂病的防治[J]. 浙江农林大学学报, 2018, 35(4): 757-764. |
| [27] |
Zong Y, Zhao YJ, Liu Y, et al. Study on the inhibitory effect of Bacillus velezensis on Fusarium graminearum[J]. Journal of Nuclear Agricultural Sciences, 2018, 32(2): 310-317. (in Chinese) 宗英, 赵月菊, 刘阳, 等. 一株贝莱斯芽孢杆菌抑制禾谷镰刀菌的研究[J]. 核农学报, 2018, 32(2): 310-317. |
 2019, Vol. 46
2019, Vol. 46