扩展功能
文章信息
- 王琦琦, 冯丽, 李杨, 褚贵新, 孙燕飞
- WANG Qi-Qi, FENG Li, LI Yang, CHU Gui-Xin, SUN Yan-Fei
- 新疆木碱蓬(Suaeda dendroides)根际耐盐促生细菌的筛选及鉴定
- Screening and identification of salt-tolerant promoting bacteria of the rhizosphere of Suaeda dendroides in Xinjiang
- 微生物学通报, 2019, 46(10): 2569-2578
- Microbiology China, 2019, 46(10): 2569-2578
- DOI: 10.13344/j.microbiol.china.180849
-
文章历史
- 收稿日期: 2018-10-30
- 接受日期: 2019-03-14
- 网络首发日期: 2019-03-22
2. 绍兴文理学院环境科学与工程系 浙江 绍兴 312000
2. Department of Environmental Science and Engineering, Shaoxing University, Shaoxing, Zhejiang 312000, China
新疆位于亚欧大陆腹地,属于温带大陆气候,远离海洋,年降水量少,蒸发强烈,使得地下水中盐分不断地表聚集,加之新疆农业发展中不合理的灌溉给土壤带来了巨大的压力,使新疆成为我国土壤盐渍化类型最多、沉积最严重、面积最大(约占全国盐渍化土壤1/3)的地区[1]。土壤发生盐渍化会抑制种子萌发,使植物细胞内渗透压降低,细胞失水,植物细胞膜通透性发生改变,对植物生长产生毒害作用[2]。
现阶段针对盐渍化土壤的治理,农业上主要通过节水灌溉、淋洗、土地深翻等,还可通过化学改良剂,如石膏、腐植酸类肥料的运用[3],但化学改良剂滥用会造成土壤的二次污染,因此还通过种植盐生植物进行改良,以防止化学改良存在的弊端。木碱蓬(Suaeda dendroides)是一种藜科的广适性盐生植物,其肉质化叶片可以储存大量的水分,使其能够在重盐渍化土壤中生存[4]。在新疆盐渍化土壤中种植木碱蓬具有改善土壤性状、提高土壤利用率、改善生态环境等重要作用。木碱蓬强有力的抗盐能力与其根际的微生物菌群有着密不可分的关系,尤其是根际的耐盐促生菌[5]。因此,碱蓬根际耐盐促生菌的分离筛选对微生物资源的开发具有重要意义。
植物根际促生菌(Plant growth-promoting rhizobacteria,PGPR)是指在植物根系周围土壤中或附着于根表面的一类可以通过直接或间接的方式促进植物生长的微生物。据研究发现PGPR可以通过固氮、解磷、解钾、产吲哚-3-乙酸(Indole-3-acetic acid,IAA)等方式促进植物对土壤中有效元素的吸收,提高植物抗病性及抗逆性[6-7],增加粮食作物产量[8]。目前,这种环境友好型生物改良剂——微生物菌肥被广泛应用,已有研究报道微生物菌肥能改良盐碱化土壤、提高土壤肥力、改善土壤质量[9],相比于化学改良剂,微生物菌肥更环保、安全且作用持久。
本研究以木碱蓬根际土壤为研究对象,采用传统的分离方法获得耐盐微生物,并通过促生菌的“三级筛选体系”获得耐盐促生菌菌株,并对具有优良促生效果的菌株进行分子鉴定。本研究为耐盐微生物的开发与利用提供了基础资料,也为将来微生物菌肥的研发和应用奠定了试验基础,同时为新疆盐渍化土壤的改良提供了有效的微生物资源。
1 材料与方法 1.1 材料 1.1.1 样品和培养基2017年5月于石河子周边盐碱地采集木碱蓬根际土样,4 ℃保存备用。拟南芥种子从石河子大学生命科学学院特色植物基因组学实验室获得。
主要培养基:牛肉膏蛋白胨培养基[6]、固氮菌筛选培养基(阿须贝氏无氮培养基)[10]、解磷菌筛选培养基[11]、解钾菌筛选培养基[12]、LB培养基[10]、1/2 MS培养基[13]。含有80 g/L NaCl的蛋白胨水。
1.1.2 主要试剂和仪器L-色氨酸,成都市科龙化工试剂厂;Nessler’s试剂,上海麦克林生化科技有限公司;吲哚乙酸(IAA),Sigma公司;Salkowski’s显色剂为35%高氯酸和0.5 mol/L氯化铁体积比为50:1,混匀,现配现用。双人单面净化无菌操作台,苏州净化设备有限公司;电热恒温光照培养箱,上海精宏实验设备有限公司;PCR仪,ABI ProFlex;电泳仪,北京六一生物科技有限公司;分光光度计,上海棱光技术有限公司;立式压力蒸汽灭菌锅,上海申安医疗器械厂;凝胶成像仪,Intas Gel Jet Imager公司。
1.2 方法 1.2.1 木碱蓬根际土壤中耐盐细菌的筛选取5 g土样于无菌水中,180 r/min室温培养30 min,静置30 s,将上清进行梯度稀释,取稀释了10−2、10−3、10−4、10−5的菌液各100 μL,采用稀释涂布法涂布于含有80 g/L NaCl的牛肉膏蛋白胨琼脂培养基上,28 ℃倒置培养24 h,挑取分离纯化获得的单菌落,接种于牛肉膏蛋白胨琼脂斜面培养基中,4 ℃保存备用。
1.2.2 “三级筛选体系”筛选耐盐促生菌第一级筛选:耐盐菌株促生功能的初筛
针对菌株的固氮、解磷、解钾、产IAA以及产氨几种促生活性进行检测。
(1) 菌株固氮、解磷、解钾活性的检测
将分离得到的耐盐菌株接种于均含有80 g/L NaCl的阿须贝氏无氮培养基、无机磷培养基、解钾菌培养基上,对菌株进行固氮、解磷、解钾活性检测。
(2) 菌株产IAA促生活性的检测
挑取耐盐菌单菌落接种于含质量浓度100 mg/L L-色氨酸的LB液体培养基中,28 ℃、180 r/min培养24 h。试验方法参考文献[6]。
(3) 菌株产氨促生活性的检测
挑取单菌落接种到5 mL蛋白胨水中,28 ℃、180 r/min培养5 d。菌液10 000 r/min离心5 min,取上清液与Nessler’s试剂以1׃1的体积比混合加入比色杯,用分光光度剂测量混合液OD450的值,初步判断菌株产氨活性的大小。
第二级筛选:拟南芥平板试验复筛
配制NaCl浓度为0、50、100 mmol/L的1/2 MS培养基,倾注直径为9 cm的平板,冷却凝固后,用直径为2 cm的打孔器在平板中心打孔,并注入1.5 mL 80 g/L NaCl的牛肉膏蛋白胨琼脂培养基,以提供菌株生长所需的营养物质;拟南芥种子消毒后种在1/2 MS培养基上,距中心约2.5 cm,置于18 ℃恒温光照培养箱,16 h光照8 h黑暗,生长4 d,待种子发芽长出两片嫩叶,将初筛得到促生活性较高的菌株接种于平板中央,接种无菌水的平板作为CK,将平板置于18 ℃恒温光照培养箱中,16 h光照8 h黑暗条件下生长30 d,观察拟南芥的生长情况,每处理3个重复。
第三级筛选:促生效果的盆栽试验验证
(1) 菌液制备:经过复筛得到促生效果较好的菌株接种于100 mL牛肉膏蛋白胨培养液中,置于摇床,28 ℃、180 r/min培养24 h至菌液浓度为108 CFU。
(2) 种子处理:从石河子市农贸市场采购小麦种子,用饱和NaCl溶液漂洗,过滤掉漂浮的种子,挑选大小相近、质粒饱满、完整健康的种子,置于湿润滤纸上暗处理过夜,待种子露白,用无菌水和菌液分别浸种1 h,作为对照组CK和处理组。
(3) 盆栽试验:将处理后露白的种子播种于直径13 cm、高10 cm的花盆中加入190 g已灭菌的蛭石为生长基质,播种深度为1 cm,每盆10粒,待出苗,每3 d分别浇灌一次100 mL的100、200、250 mmol/L NaCl的无菌水,以保持盆内的土壤湿度及相应的盐胁迫浓度,每隔7 d浇灌一次菌液以保证菌群稳定存在。每个处理3个重复,每种处理9盆。室温环境生长15 d,收获植株,测定小麦根长、株高、干重、鲜重、叶绿素含量、脯氨酸含量,作为促生菌促生效果评价指标。
1.2.3 数据处理及分析试验数据采用Microsoft Excel 2003处理,显著性分析采用IBM SPSS 19.0软件进行(P<0.05)。
1.2.4 耐盐促生菌的系统发育分析挑取筛选得到具有较好促生效果的菌株单菌落,接种于牛肉膏蛋白胨培养液中,28 ℃、180 r/min培养24 h。采用CTAB法提取菌株基因组DNA,选择细菌通用引物27F (5′-AGAGTTTGATCCTGG CTCAG-3′)和1492R (5′-GGTTACCTTGTTACGACT T-3′)对菌株16S rRNA基因进行PCR扩增[14],PCR反应体系:DNA模板1 μL,2×Taq PCR Master Mix 10 μL,5 μmol/L引物27F、1492R各1 μL,ddH2O 12 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。通过琼脂糖凝胶电泳检测目的片段,将PCR产物送至生工生物工程(上海)股份有限公司进行测序,将16S rRNA基因序列通过DNAMAN软件进行拼接组装处理后上传至NCBI获得登录号,并将其序列于www.ezbiocloud.net中进行比对,获得亲缘关系较近的模式菌株序列,使用MEGA 7.0用最大似然法进行系统发育树的构建。
2 结果与分析 2.1 “三级筛选体系”筛选耐盐促生菌经过加盐培养基的筛选,从土壤样本中共分离纯化得到耐盐细菌58株,将这些菌株通过“三级筛选体系”进行促生菌的筛选。
2.1.1 第一级筛选:菌株促生功能活性检测58株菌中具有固氮活性8株,解磷活性12株,解钾活性15株,产IAA活性的菌株3株,产氨活性较强的菌株2株。由表 1可以看出,MH-F与31-5均具有解钾活性和较高的产IAA活性,IAA产量均为9.52 mg/L,此外MH-F也有固氮活性和较高的产氨能力;菌株JH2-1除具有相对较高的产IAA活性外,同时也有解磷和产氨活性,菌株中GTZW50-5具有较强的产氨能力,也能产生IAA,产量为5.37 mg/L (表 1)。
| 菌株编号 Strain number |
IAA产量 IAA production (mg/L) |
固氮 Nitrogen fixation |
解磷 Phosphorus solution |
解钾 Potassium solution |
产氨 Ammonia production |
| WL-5 | 2.45±0.07f | − | − | − | + |
| GYZW50-6 | 2.66±0.03e | − | + | + | + |
| GTZW50-5 | 5.37±0.04d | + | + | + | +++ |
| JH2-1 | 8.47±0.04b | − | + | − | + |
| JH1-c | 7.21±0.03c | + | − | + | − |
| MH-F | 9.52±0.05a | + | − | + | +++ |
| 31-5 | 9.52±0.05a | − | − | + | − |
| 150ss-2 | 8.42±0.05b | − | − | − | − |
| 注:+:一般活性;++:中等活性;+++:强活性;−:没有活性.不同的小写字母表示具有极显著差异(P<0.01),相同字母表示没有显著差异(P>0.05). Note: +: General active; ++: Medium activity; +++: Strong activity; −: No activity. Different lowercase letters indicate extremely significant difference (P<0.01), the same letter indicates no significant difference (P>0.05). |
|||||
综合菌株促生活性的检测结果,对具有优良促生活性的菌株进行平板试验,在0、50、100 mmol/L NaCl盐胁迫下,观察菌株对拟南芥生长的影响,结果发现菌株GTZW50-5与MH-F对拟南芥的生长具有较好的促生效果(图 1)。

|
| 图 1 不同NaCl浓度下菌株GTZW50-5、MH-F对拟南芥生长的促生效果 Figure 1 Promoting effects of GTZW50-5 and MH-F on Arabidopsis thalina growth at different concentrations of NaCl 注:A、B、C分别为菌株GTZW50-5在0、50、100 mmol/L NaCl下对拟南芥的促生效果;D、E、F分别为菌株MH-F在0、50、100 mmol/L NaCl下对拟南芥的促生效果;左侧均为CK,右侧为处理组. Note: A, B and C are the growth promoting effects of strain GTZW50-5 on Arabidopsis thaliana at 0, 50 and 100 mmol/L NaCl respectively; D, E and F are the growth promoting effects of strain MH-F on Arabidopsis thaliana at 0, 50 and 100 mmol/L NaCl, respectively; CK is on the left, treatment group is on the right. |
|
|
在0 mmol/L和50 mmol/L NaCl浓度下,2株促生菌对拟南芥均具有较好的促生效果,随盐浓度增加,对照组拟南芥表现为生长受到抑制(图 1)。在100 mmol/L NaCl浓度下,GTZW50-5和MH-F能够生长,拟南芥表现出不发芽或发芽后便死亡的状态,促生作用较为微弱(图 1),可能是由于盐浓度过高,盐胁迫的毒害作用远远超过菌株的促生作用,不足以促进拟南芥生长,而发芽的种子则发生细胞严重失水,最终死亡。
2.1.3 第三级筛选:盆栽试验验证耐盐促生菌的促生效果(1) 耐盐促生菌在不同盐浓度下对小麦生物量的影响
在100、200、250 mmol/L NaCl浓度的盐胁迫下,菌株GTZW50-5和MH-F对小麦的含水量、干重、鲜重、根长、株高、叶绿素、脯氨酸含量产生不同的影响(图 2,表 2、3)。

|
| 图 2 在不同NaCl浓度下GTZW50-5与MH-F对小麦生长的影响 Figure 2 The effects of GTZW50-5 and MH-F on wheat growth at different concentrations of NaCl 注:A、C、E为菌株GTZW50-5在不同盐度下对小麦地上部分的促生效果,B、D、F为菌株GTZW50-5在不同盐度下对小麦地下部分的促生效果;G、I、K为菌株MH-F在不同盐度下对小麦地上部分的促生效果,H、J、L为菌株MH-F在不同盐度下对小麦地下部分的促生效果;左侧为处理组,右侧为CK. Note: A, C and E are the growth promoting effects of strain GTZW50-5 on the aboveground of wheat under different salinities; B, D and F are the promoting effects of strain GTZW50-5 on the underground part of wheat under different salinities; G, I and K are the promoting effects of strain MH-F on the aboveground of wheat under different salinities; H, J and L are the promoting effects of strain MH-F on the underground part of wheat under different salinities; The left is treatment group, the right is CK. |
|
|
| 指标 Item |
组别 Group |
不同浓度NaCl处理 Different concentration treatment of NaCl |
|||||
| 100 mmol/L | N (%) | 200 mmol/L | N (%) | 250 mmol/L | N (%) | ||
| 根长 Root length (cm) |
CK | 15.33±1.16a | − | 9.00±2.00b | − | 7.67±0.58a | − |
| GTZW50-5 | 15.67±1.15a | 2.2 | 7.83±2.57b | −13.0 | 8.10±0.62a | 5.6 | |
| MH-F | 16.20±1.68a | 5.7 | 12.43±0.51a | 24.0 | 6.83±1.04a | −10.9 | |
| 株高 Shoot length (cm) |
CK | 25.33±1.53a | − | 11.33±1.16c | − | 11.50±0.62b | − |
| GTZW50-5 | 24.67±2.52a | −2.6 | 14.23±1.97b | 25.6 | 15.73±0.45a | 36.8 | |
| MH-F | 22.93±1.94a | −9.5 | 17.67±2.08a | 55.9 | 12.43±0.51b | 8.1 | |
| 干重 Dry weight (g) |
CK | 0.05±0.01a | − | 0.07±0.01a | − | 0.05±0.02a | − |
| GTZW50-5 | 0.07±0.03a | 40.0 | 0.03±0.01a | −57.1 | 0.05±0.01a | 0.0 | |
| MH-F | 0.07±0.01a | 40.0 | 0.05±0.01a | −28.6 | 0.06±0.02a | 20.0 | |
| 鲜重 Fresh weight (g) |
CK | 0.35±0.04a | − | 0.45±0.02a | − | 0.44±0.12a | − |
| GTZW50-5 | 0.39±0.12a | 11.4 | 0.34±0.08a | −24.4 | 0.46±0.02a | 4.5 | |
| MH-F | 0.53±0.08a | 51.4 | 0.47±0.07a | 4.4 | 0.40±0.01a | −9.1 | |
| 含水量 Water content (g) |
CK | 0.30±0.04a | − | 0.39±0.02a | − | 0.39±0.09a | − |
| GTZW50-5 | 0.32±0.09a | 6.7 | 0.29±0.07a | −25.6 | 0.42±0.01a | 7.7 | |
| MH-F | 0.45±0.07a | 50.0 | 0.42±0.06a | 7.7 | 0.26±0.07a | −33.3 | |
| 注:不同小写字母均表示同一浓度下同一种生物量指标差异极显著(P<0.05);N表示处理组与CK相比的增长百分数. Note: Different lowercase letters indicate that the same biomass index is significantly different at the same concentration (P<0.05); N indicates the percentage increase of the treatment group compared with CK. |
|||||||
| 指标 Item |
组别 Group |
不同浓度NaCl处理 Different concentration treatment of NaCl |
|||||
| 100 mmol/L | N (%) | 200 mmol/L | N (%) | 250 mmol/L | N (%) | ||
| 叶绿素 Chlorophyll (mg/g) |
CK | 7.81±0.28b | − | 9.62±0.57b | − | 11.84±0.38a | − |
| GTZW50-5 | 9.77±0.45a | 25.1 | 10.75±0.43a | 11.8 | 9.78±0.49b | −17.4 | |
| MH-F | 8.88±0.22a | 13.7 | 9.33±0.67b | −3.0 | 10.86±0.64b | −8.3 | |
| 脯氨酸 Proline (mg/g) |
CK | 0.45±0.11b | − | 0.2±0.03b | − | 0.37±0.03b | − |
| GTZW50-5 | 3.30±0.34a | 633.3 | 1.19±0.02a | 495.0 | 0.63±0.01a | 70.3 | |
| MH-F | 0.25±0.08c | −44.4 | 0.20±0.02b | 0.0 | 0.58±0.09a | 56.8 | |
| 注:不同小写字母均表示同一浓度下同一生物量指标差异极显著(P<0.05);N表示处理组与CK相比的增长百分数. Note: Different lowercase letters indicate that the same biomass index is significantly different at the same concentration (P<0.05); N indicates the percentage increase of the treatment group compared with CK. |
|||||||
|
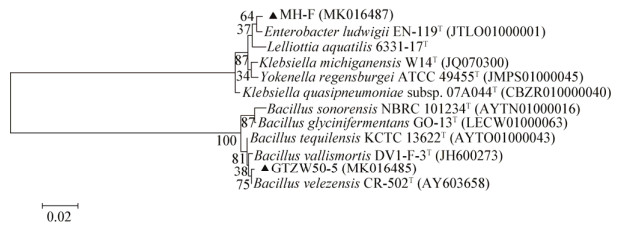
| 图 3 最大似然法构建菌株GTZW50-5和MH-F 16S rRNA基因系统发育树 Figure 3 Phylogenetic tree of 16S rRNA gene of strains GTZW50-5 and MH-F by maximum likelihood method |
|
|
如表 2所示,在100 mmol/L NaCl下,小麦的根长和株高经测量发现:这2株菌与CK相比对小麦的生物量并无显著影响。在200 mmol/L NaCl处理下,接种GTZW50-5与MH-F后小麦株高比CK分别增长了25.6%和55.9%;此外,菌株对小麦根系的生长产生了不同的作用,MH-F能显著促进小麦根系的生长,且比CK增长了24.0%,而GTZW50-5则表现出一定的抑制作用。在250 mmol/L NaCl浓度下,GTZW50-5在高盐度下对小麦株高产生了显著的促生效果,且增加了36.8%,而MH-F并无显著促生效果;接种这2株菌对小麦的干重、鲜重、根长及含水量均无显著的影响。
(2) 耐盐促生菌对小麦叶绿素及脯氨酸含量的影响
通过菌液浸种处理,菌株对小麦叶绿素与脯氨酸含量的影响如表 3所示,100 mmol/L NaCl条件下,接种GYZW50-5和MH-F的小麦叶绿素含量分别比CK极显著地提高25.1%和13.7%;在200 mmol/L NaCl条件下,接种MH-F对小麦的叶绿素含量并没有显著的影响,而接种GTZW50-5的小麦叶绿素含量比CK显著提高了11.8%;在250 mmol/L NaCl条件下,2株菌对小麦叶绿素含量的产生并无促进作用,反而使其含量有所降低。
接种GTZW50-5后的小麦产生脯氨酸的能力极显著提高,使其含量在100、200和250 mmol/L NaCl下分别提高了633.3%、495.0%和70.3%,接种菌株MH-F后,在250 mmol/L NaCl下能显著提高小麦的脯氨酸含量(表 3)。
2.2 优良促生菌株的分子鉴定采用最大似然法法对菌株16S rRNA基因序列进行系统发育分析,结果表明:GTZW50-5与Bacillus vallismortis (AY603658)序列相似度达到99.43%,鉴定属于Bacillus vallismortis,MH-F与Enterobacter ludwigii (JTLO01000001)具有较相近的进化距离,序列相似度为98.34%,鉴定属于Enterobacter属,疑似新种,鉴定结果有待于进一步深入的研究。将GTZW50-5与MH-F的16S rRNA基因序列上传至NCBI数据库中,获得登录号分别为MK016485和MK016487。
3 讨论与结论目前对于促生菌的筛选方法较多,但普遍存在筛选方法只针对某一种促生功能的问题,因此会造成一些潜在具有促生活性的菌株会被遗漏。盲目的筛选可能会存在工作量大、筛选周期较长等问题,而只针对一种植物验证促生效果,则不能充分验证菌株的促生效果这些问题。为了更有效、快捷地筛选出具有优良促植物生长效果的促生菌株,我们通过“三级筛选体系”筛选促生菌,第一级筛选是促生菌的初筛,对菌株自身优良促生活性的检测,如固氮、解磷、产IAA等活性,通过此方法筛选能快速地初步获得具有促生功能的菌株;第二级筛选是促生菌的复筛,拟南芥是一种模式植物,具有生长周期短的特点,而且不耐盐,通过平板种植拟南芥,接种具有促生活性的菌株,能缩短观察周期、提高筛选效率,并能有效地观察到菌株对拟南芥生长的影响,初步对菌株促生效果进行验证;第三级筛选是促生菌促生效果的验证,在平板中生长的拟南芥生长条件较稳定,而菌株的促生效果往往受许多因素影响,通过盆栽试验还原了植物原本的生长环境,更能真实地反映菌株的促生效果。
本研究以新疆木碱蓬根际土壤为研究对象,从土壤中共分离得到耐80 g/L NaCl的菌株58株,将这58株进行耐盐促生菌“三级筛选体系”筛选,通过第一级筛选发现得到的功能菌株大多同时具有多种促生活性。现已有报道表明,具有多种促生功能的菌株具有较强的促生效果。有研究发现一株巨大芽孢杆菌(Bacillus megaterium)既能解磷又能产IAA,而且能显著增加花生生物量[15]。有学者对菌株的促生活性与作物生长之间的相关性进行研究,发现促生活性越强促生效果越好,成正相关关系[16]。
鉴于前人的研究基础,本研究选择了GTZW50-5、JH2-1、JH1-c、MH-F、31-5、150ss-2共6株具有多种促生活性的菌株进行第二级筛选,试验发现菌株GTZW50-5和MH-F具有较为明显的促生效果,在0、50 mmol/L NaCl下能较为显著地促进拟南芥的生长,促进其发芽,增加其生物量。在100 mmol/L NaCl下,拟南芥明显受到盐分的抑制,种子不发芽,而菌株的促生作用此时过于微弱,可能是由于盐胁迫的毒害作用超过了菌株正向的促生作用。而菌株JH2-1、JH1-c、31-5、150ss-2在平板促拟南芥生长试验中并未表现出较好的促生效果。已有一些学者报道过Pseudomonas syringae pv.能产生野火菌毒素,抑制植物的谷氨酰胺合成酶,干扰植物正常代谢[17]。还有一些菌株能产生一些破坏植物组织的酶类,如果胶酶[18]、纤维素酶[19]等。但本研究中具有促生活性的菌株并不表现出促生效果的原因尚不清楚,有待于进一步研究。
经过拟南芥平板促生试验,选出菌株GTZW50-5与MH-F进行第三级筛选,对菌株促生效果进行验证。这两株菌在不同盐度下都有增加小麦根长、株高、干重、鲜重等效果。GTZW50-5在三种盐浓度下都显著增加小麦叶绿素和脯氨酸含量,MH-F在250 mmol/L NaCl下能显著促进植物产生脯氨酸的含量,在100、200 mmol/L NaCl浓度下增加小麦叶绿素含量。经分子鉴定,GTZW50-5属于B. vallismortis,MH-F属于Enterobacter属。已有学者研究发现B. vallismortis菌株BS07能够产生抗生素,是多种病原体潜在的生防菌,接种辣椒处理后能增加叶片中叶绿素含量,这与我们的研究结果相符[20]。Noh等最近也对B. vallismortis做了研究,证明其产生的环二肽(CDPs)可以诱导辣椒和拟南芥产生抗病性[21];也有学者对其同属的菌株进行研究,发现其对松树幼苗的生长具有促进作用[22]。芽孢杆菌属菌株如B. amyloliquefaciens[23]、B. pumilus[24]等促进小麦生长已有报道[25]。但对于B. vallismortis对小麦的促生作用并无研究,本研究对芽孢杆菌促生菌资源的开发和利用提供了基础资料。E. ludwigii对植物的促生作用也有研究,Shoebitz等发现E. ludwigii能增加黑麦草的根长及根表面积[26]。Yousaf等研究发现E. ludwigii在黑麦草、三叶草、苜蓿根部都能有效定殖,能降解烃类物质,并具有一定的促生作用[27]。E. ludwigii对植物根的影响较大,研究发现E. ludwigii菌株185-17具有解磷活性,可以显著增加亚麻的根表面积[28]。这些研究与本研究的结果相符,但本研究发现菌株MH-F除了对根的正向作用以外,在低浓度下显著增加叶绿素含量,250 mmol/L NaCl下显著增加脯氨酸含量,这可能与菌株其他促生活性的存在有着不可分割的关系,这种促生机制仍需进一步探究。
本研究通过“三级筛选体系”的筛选,获得了优良耐盐促生菌菌株GTZW50-5和MH-F,为新疆本土耐盐微生物资源的开发和利用提供基础资料,为微生物菌剂的研制提供了微生物资源,但耐盐促生菌的促生机制尚不明确,有待于进一步探究。
| [1] |
Lin J, Anwar M, Dilbar S. Investigation of the spatial variability of soil salts in saline soil in Xinjiang[J]. Research of Soil and Water Conservation, 2007, 14(6): 189-192. (in Chinese) 蔺娟, 艾尼瓦尔·买买提, 地里拜尔·苏力坦. 新疆盐渍化区土壤盐分离子的空间变异特征[J]. 水土保持研究, 2007, 14(6): 189-192. |
| [2] |
Liu XR. Overview of salinization of cultivated land in Xinjiang[J]. Chinese Science & Technology, 2011(11): 345, 251. (in Chinese) 刘湘茹. 概述新疆的盐碱化耕地整治[J]. 中国科技纵横, 2011(11): 345, 251. |
| [3] |
Jiazila AS, Wang XG, Yao WY. Preliminary study on soil salinization treatment technology in Xinjiang[J]. Water Saving Irrigation, 2011(11): 50-52. (in Chinese) 加孜拉·阿山, 王修贵, 姚宛艳. 新疆土壤盐碱化治理技术初步研究[J]. 节水灌溉, 2011(11): 50-52. |
| [4] |
Zhang AQ, Pang QY, Yan XF. Advances in salt-tolerance mechanisms of Suaeda plants[J]. Acta Ecologica Sinica, 2013, 33(12): 3575-3583. (in Chinese) 张爱琴, 庞秋颖, 阎秀峰. 碱蓬属植物耐盐机理研究进展[J]. 生态学报, 2013, 33(12): 3575-3583. |
| [5] |
Zhang LB, Xu HL, Zhao GX. Salt tolerance of Suaeda salsa and its soil ameliorating effect on coastal saline soil[J]. Soils, 2007, 39(2): 310-313. (in Chinese) 张立宾, 徐化凌, 赵庚星. 碱蓬的耐盐能力及其对滨海盐渍土的改良效果[J]. 土壤, 2007, 39(2): 310-313. |
| [6] |
Wu X, Gan BC, Huang ZQ, et al. Screening and identification of a IAA biosynthesis strain and optimization of its culture conditions[J]. Journal of Sichuan Agricultural University, 2014, 32(4): 432-435. (in Chinese) 吴翔, 甘炳成, 黄忠乾, 等. 一株产IAA菌株的筛选、鉴定及培养条件优化[J]. 四川农业大学学报, 2014, 32(4): 432-435. DOI:10.3969/j.issn.1000-2650.2014.04.013 |
| [7] |
Liao JW, Wen YC, Yang M. Effects of different nitrogen fixing bacteria on growth index of Eucalyptus[J]. South China Agriculture, 2016, 10(27): 78-79. (in Chinese) 廖静文, 闻玉昌, 杨蒙. 不同固氮菌对桉树生长指标的影响[J]. 南方农业, 2016, 10(27): 78-79. |
| [8] |
Jiang Y, Wang H, Wang SD, et al. Application potential of microorganism fertilizer in agricultural production[J]. Soybean Science & Technology, 2010(5): 25-27. (in Chinese) 姜妍, 王浩, 王绍东, 等. 微生物菌肥在农业生产中的应用潜力[J]. 大豆科技, 2010(5): 25-27. DOI:10.3969/j.issn.1674-3547.2010.05.008 |
| [9] |
Wu XW. Improvement of saline land by microorganism fertilization in Weibei Area[D]. Xi'an: Master's Thesis of Northwest University, 2015 (in Chinese) 吴晓卫.微生物菌肥改良渭北地区盐碱化土壤作用及效果研究[D].西安: 西北大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10697-1015328705.htm |
| [10] |
Wang Q, Li WT, Zhang PD, et al. Isolation and characterization of nitrogen-fixing bacteria in the rhizosphere of Zostera marina and optimization of its culture conditions[J]. Journal of Fishery Sciences of China, 2017, 24(4): 791-801. (in Chinese) 王琦, 李文涛, 张沛东, 等. 鳗草根际固氮菌的分离鉴定及培养条件的筛选[J]. 中国水产科学, 2017, 24(4): 791-801. |
| [11] |
Lv R, Jia FA, Liu C, et al. Isolation, identification and phosphate-dissolving ability of inorganic phosphorus degrading strains[J]. Jiangsu Agricultural Sciences, 2017, 45(20): 295-298. (in Chinese) 吕睿, 贾凤安, 刘晨, 等. 无机磷降解菌株的分离、鉴定及解磷能力[J]. 江苏农业科学, 2017, 45(20): 295-298. |
| [12] |
Zhang MY, Chen YF, Zhou DB, et al. Isolation, identification and fermentation conditions optimization of potassium bacteria in castor rhizosphere soil[J]. Chinese Journal of Tropical Crops, 2016, 37(12): 2268-2275. (in Chinese) 张妙宜, 陈宇丰, 周登博, 等. 蓖麻根际土壤解钾菌的筛选鉴定及发酵条件的优化[J]. 热带作物学报, 2016, 37(12): 2268-2275. DOI:10.3969/j.issn.1000-2561.2016.12.005 |
| [13] |
Yang J, Sun HY, Zhao YZ, et al. Influence of alanine stress on culture in vitro of Arabidopsis thaliana and Nicotiana tabacum Linn[J]. Biotechnology, 2009, 19(1): 81-84. (in Chinese) 杨靖, 孙海燕, 赵元增, 等. 丙氨酸胁迫对拟南芥和烟草离体培养的影响[J]. 生物技术, 2009, 19(1): 81-84. |
| [14] |
Pang FH, Huang SL, Wang T, et al. Isolation and identification of endogenous Bacillus megaterium and its biocontrol effect on wheat leaf rust[A]//Papers Collection of the Annual Meeting of the Chinese Society of Plant Pathology in 2015[C]. Haikou: Chinese Society for Plant Pathology, 2015: 1 (in Chinese) 庞发虎, 黄思良, 王坦, 等.内生性巨大芽孢杆菌的分离、鉴定及其对小麦叶锈病的生防效果[A]//中国植物病理学会2015年学术年会论文集[C].海口: 中国植物病理学会, 2015: 1 |
| [15] |
Zheng WB, Shen F, Yan XM, et al. Isolation and identification of the IAA-producing and phosphate-dissolving bacteria and its promoting effects on red soil[J]. Soil, 2015, 47(2): 361-368. (in Chinese) 郑文波, 申飞, 闫小梅, 等. 红壤中产吲哚乙酸并具解磷作用的促生菌筛选鉴定及促生效果研究[J]. 土壤, 2015, 47(2): 361-368. |
| [16] |
Wang KP, Zheng Y, Chu GY, et al. Screening of bacterial strains for phosphate solubilization, nitrogen fixation and IAA production and their promotive effects on plant growth[J]. Jiangsu Journal of Agricultural Sciences, 2013, 29(6): 1352-1359. (in Chinese) 王奎萍, 郑颖, 褚光耀, 等. 解磷、固氮、产吲哚乙酸微生物菌株的筛选及其对植物的促生效果[J]. 江苏农业学报, 2013, 29(6): 1352-1359. DOI:10.3969/j.issn.1000-4440.2013.06.026 |
| [17] |
Taguchi F, Suzuki T, Inagaki Y, et al. The siderophore pyoverdine of Pseudomonas syringae pv. tabaci 6605 is an intrinsic virulence factor in host tobacco infection[J]. Journal of Bacteriology, 2010, 192(1): 117-126. DOI:10.1128/JB.00689-09 |
| [18] |
Lalitha Kumari B, Lalitha R, Sudhakar P. Studies on isolation, purification and molecular identification of pectinase producing bacteria[J]. International Journal of Advanced Research, 2013, 1(5): 204-212. |
| [19] |
Chen LY, Zhang GX, Huang CP, et al. Isolation, identification and enzymatic characteristics of cellulose-producing strains with high cellulase activity[J]. Microbiology China, 2011, 38(4): 531-538. (in Chinese) 陈丽燕, 张光祥, 黄春萍, 等. 两株高产纤维素酶细菌的筛选、鉴定及酶学特性[J]. 微生物学通报, 2011, 38(4): 531-538. |
| [20] |
Park JW, Balaraju K, Kim JW, et al. Systemic resistance and growth promotion of chili pepper induced by an antibiotic producing Bacillus vallismortis strain BS07[J]. Biological Control, 2013, 65(2): 246-257. |
| [21] |
Noh SW, Seo R, Park JK, et al. Cyclic dipeptides from Bacillus vallismortis BS07 require key components of plant immunity to induce disease resistance in Arabidopsis against Pseudomonas infection[J]. The Plant Pathology Journal, 2017, 33(4): 402-409. DOI:10.5423/PPJ.OA.11.2016.0255 |
| [22] |
Probanza A, Lucas García JA, Palomino MR, et al. Pinus pinea L. seedling growth and bacterial rhizosphere structure after inoculation with PGPR Bacillus (B. licheniformis CECT 5106 and B. pumilus CECT 5105)[J]. Applied Soil Ecology, 2002, 20(2): 75-84. DOI:10.1016/S0929-1393(02)00007-0 |
| [23] |
Cao JJ, Yang HY, Xie XS, et al. Control effect of Bacillus amyloliquefaciens on wheat yellow mosaic disease[J]. Journal of Plant Protection, 2016, 43(4): 588-593. (in Chinese) 曹晶晶, 杨海艳, 谢咸升, 等. 解淀粉芽胞杆菌对小麦黄花叶病的生物防治[J]. 植物保护学报, 2016, 43(4): 588-593. |
| [24] |
Xiong WD, Liu Y, Wang GW, et al. Effects of plant growth-promoting rhizobacteria agents application on wheat in sandy soil[J]. Journal of Triticeae Crops, 2016, 36(7): 945-950. (in Chinese) 熊伟东, 刘晔, 王国文, 等. 促生菌剂在砂质潮土麦田的应用效果[J]. 麦类作物学报, 2016, 36(7): 945-950. |
| [25] |
Allaoua H, Silini A, Yahiaoui B, et al. Phylogenetic and plant-growth-promoting characteristics of Bacillus isolated from the wheat rhizosphere[J]. Annals of Microbiology, 2016, 66(3): 1087-1097. DOI:10.1007/s13213-016-1194-6 |
| [26] |
Shoebitz M, Ribaudo CM, Pardo MA, et al. Plant growth promoting properties of a strain of Enterobacter ludwigii isolated from Lolium perenne rhizosphere[J]. Soil Biology and Biochemistry, 2009, 41(9): 1768-1774. DOI:10.1016/j.soilbio.2007.12.031 |
| [27] |
Yousaf S, Afzal M, Reichenauer TG, et al. Hydrocarbon degradation, plant colonization and gene expression of alkane degradation genes by endophytic Enterobacter ludwigii strains[J]. Environmental Pollution, 2011, 159(10): 2675-2683. DOI:10.1016/j.envpol.2011.05.031 |
| [28] |
Sarron E, Clément N, Pawlicki-Jullian N, et al. Stimulating effects of two plant growth-promoting bacteria, Enterobacter ludwigii Ez-185-17 and Raoultella terrigena Ez-555-6, on flax culture[J]. AIP Conference Proceedings, 2018, 1954(1): 020003. |
 2019, Vol. 46
2019, Vol. 46