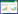扩展功能
文章信息
- 令利军, 焦正龙, 王军英, 马稳霞, 李子彬, 赵云花, 张玺, 冯娟娟
- LING Li-Jun, JIAO Zheng-Long, WANG Jun-Ying, MA Wen-Xia, LI Zi-Bin, ZHAO Yun-Hua, ZHANG Xi, FENG Juan-Juan
- 地衣芽孢杆菌TG116胞外蛋白酶产酶条件与酶学性质
- Production and characterization of extracellular protease from biocontrol strain Bacillus licheniformis TG116
- 微生物学通报, 2019, 46(10): 2559-2568
- Microbiology China, 2019, 46(10): 2559-2568
- DOI: 10.13344/j.microbiol.china.180798
-
文章历史
- 收稿日期: 2018-10-16
- 接受日期: 2018-12-13
- 网络首发日期: 2019-01-09
芽孢杆菌(Bacillus)是一种研究较为透彻的生防菌株资源,其中一些种类在微生物农药研发方面得到广泛应用。芽孢杆菌具有很强的适应性,对多种植物病原菌具有抗性,而且对环境与动植物都无毒、无污染、无残留,也不会使病原菌产生抗药性[1]。目前,国内外研发应用的菌株有解淀粉芽胞杆菌(Bacillus amyloliquefaciens) FZB42,枯草芽胞杆菌(Bacillus subtilis) GB03[2]、GB34[2]、RBl4[3]、NB22[3]、B-916[4]、BL03[5],短小芽胞杆菌(Bacillus pumilus) GB34[2]等。
芽孢杆菌目前已知的抗菌机制有竞争作用[6]、诱导植物抗病性[4]或产生拮抗作用,如抗生素Surfactin (表面活性素)、Iturin (伊枯草菌素)和Fengycin (丰宁素)等[7],细胞壁降解酶几丁质酶[8]、β-1,3-葡聚糖酶[9]、蛋白酶[10]等,以及其它抗菌物质,如抗菌蛋白[11]等。
生防微生物在拮抗病原真菌的过程中,其产生的活性成分首先需要突破病原真菌的细胞壁才能对病原真菌起到拮抗作用。大部分病原真菌细胞壁均含有几丁质、β-1,3-葡聚糖和蛋白质等成分[12],要突破细胞壁就需要多种水解酶的共同作用才能将其降解。杨合同等[13]研究表明,木霉菌产生的不同类型的葡聚糖酶(α-1,3、β-1,3、β-1,4和β-1,6-葡聚糖酶)可以水解真菌细胞壁葡聚糖层,破损细胞壁骨架,与几丁质酶或抗生素协同抗菌。
蛋白酶又称蛋白质水解酶,是一种重要的生物大分子,可以通过水解多肽链来降解蛋白质,在动物、植物和微生物中广泛存在。蛋白酶具有相当可观的经济价值和研究价值,在理论研究中,蛋白酶的生理功能涉及蛋白质的折叠、孢子的形成和释放、萌芽和营养、酶修饰和级联反应、细胞周期以及基因表达调控等;在商业领域,蛋白酶在洗涤剂、制革、丝绸食品以及制药等行业都有广泛的应用。
TG116菌株[14]从独角莲(Typhonium giganteum Engl)块茎中分离筛选得到,其对辣椒疫霉病菌(Phytophthora capsici)、辣椒炭疽病菌(Colletotrichum capsici)、马铃薯立枯丝核菌(Rhizoctonia solani)、小麦赤霉病菌(Fusarium graminearum)、黄瓜枯萎病菌(F. oxysporum)、黄瓜灰霉病菌(Botrytis cinerea)等6种供试植物病原菌均有良好的抑制作用,为广谱型抑制菌。
经生理生化分析和16S rRNA基因序列分析,将TG116菌株鉴定为地衣芽孢杆菌(B. licheniformis)。为了开发利用该菌,对菌株TG116蛋白酶的产酶条件与酶活性质展开深入研究。
1 材料与方法 1.1 菌株供试菌株为地衣芽孢杆菌(B. licheniformis) TG116菌株,自独角莲块茎内分离筛选得到。
1.2 培养基LB培养基(g/L)[15]:蛋白胨10.0,酵母膏5.0,NaCl 5.0,pH 7.2,1×105 Pa灭菌20 min。
GYP培养基(g/L)[15]:蛋白胨5.0,酵母粉5.0,葡萄糖20.0,1×105 Pa灭菌20 min。
牛奶琼脂培养基(g/L)[16]:脱脂牛奶10.0,酵母膏2.5,琼脂20.0,pH自然,1×105 Pa灭菌20 min。
产酶培养基(g/L)[17]:葡萄糖10.0,酵母粉5.0,酪蛋白10.0,MgSO4·7H2O 0.2,K2HPO4 1.0,pH 7.0,1×105 Pa灭菌20 min,略作改动。
1.3 主要试剂和仪器干酪素,上海中秦化学试剂有限公司;脱脂奶粉,广州赛国生物科技有限责任公司。紫外可见分光光度计,上海昂拉仪器有限公司。
1.4 酪氨酸酶活力定义和L-酪氨酸标准曲线制定 1.4.1 酶活力定义酶活力定义为:1 mL酶液在pH 7.2、温度40 ℃条件下水浴20 min后,以每分钟水解酪蛋白产生1 μg酪氨酸为1个蛋白酶活单位。
1.4.2 L-酪氨酸标准曲线制定按照李金鞠等[17]方法绘制标准曲线。
1.5 酶活力测定用牛奶琼脂培养基测定该菌株的蛋白水解能力。将菌株发酵液10 000 r/min离心5 min,0.2 μm水相滤膜过滤除菌后,用牛津杯法测定蛋白水解能力。具体为在牛奶琼脂培养平板上放置3个牛津杯,加入200 μL的无菌发酵液,37 ℃恒温培养箱放置12 h,然后观察它的水解圈大小,来判断它是否具有蛋白水解能力。
采用Folin-Phenol显色法来测定蛋白酶酶活。将发酵液离心取上清,以合适pH缓冲液按1׃2进行稀释后,取1 mL加入1.5 cm×15 cm的试管中,40 ℃预热5 min,加入1 mL pH 7.2的1%酪蛋白溶液,40 ℃水浴10 min,迅速加入2 mL 0.4 mol/L三氯乙酸来终止反应,室温静置10 min,10 000 r/min离心10 min,取上清1 mL,置于1.5 cm×15 cm试管中,加入5 mL 0.4 mol/L碳酸钠和1 mL 1 mol/L福林酚,混合均匀,40 ℃保温20 min,测定680 nm吸光度。对照先加2 mL 0.4 mol/L三氯乙酸,然后再加入1 mL pH 7.2的1%酪蛋白溶液,其他条件相同。
1.6 产酶条件优化 1.6.1 粗酶液的制备用GYP培养基活化菌株TG116,将种子液按2%接种量接种于蛋白酶产酶培养基中,30 ℃、170 r/min培养48 h后,10 000 r/min离心5 min,取上清液即为粗酶液。
1.6.2 最佳发酵温度筛选将种子液按2%接种量接种到起始pH 7.2的产酶培养基上,分别在30、40、50、60 ℃下170 r/min培养。培养48 h后取样,10 000 r/min离心5 min,取上清测定蛋白酶酶活力。将菌液稀释10倍后于600 nm处测定菌体浓度。
1.6.3 最佳发酵pH筛选将种子液按2%接种量接种到起始pH分别为5.0、6.0、7.0、8.0、9.0、10.0的产酶培养基中,于30 ℃、170 r/min培养48 h后,10 000 r/min离心5 min,测定上清中蛋白酶酶活。将菌液稀释10倍后于600 nm处测定菌体浓度。
1.6.4 最佳发酵时间筛选将种子液按2%接种量接种到起始pH 7.2的产酶培养基上,置于30 ℃、170 r/min振荡培养,每隔24 h取菌液10 000 r/min离心5 min,测定蛋白酶活力。将菌液稀释10倍后于600 nm处测定菌体浓度。
1.6.5 装液量优化在250 mL的三角瓶中分别加入25、50、100、150 mL产酶培养基,起始pH 7.2,接种2%的种子液,于30 ℃、170 r/min培养48 h,取菌液10 000 r/min离心5 min,测定上清中蛋白酶酶活。将菌液稀释10倍后于600 nm处测定菌体浓度。
1.7 响应曲面法优化发酵条件结合单因素发酵试验,应用Box-Behnken模型,以温度(℃)、pH、时间(h)为考察因子,以蛋白酶酶活为响应值,利用Design-Expert V.8.0.5.0软件设计3因素3水平的响应面法试验,共有17组试验,编码结果见表 1。
| 因素Factor | 编码水平Encoding Level | ||
| Temperature (℃) | 35 | 40 | 45 |
| Time (h) | 24 | 48 | 72 |
| pH | 7.0 | 8.0 | 9.0 |
将粗酶液用pH 7.2缓冲液稀释3倍,于30-70 ℃下,以5 ℃为梯度,以pH 7.2的1.0%酪蛋白为底物,按Folin-Phenol显色法分别测定蛋白酶酶活力。
1.8.2 pH对酶活力的影响将粗酶液分别用pH 5.5-10.5缓冲液稀释,以0.5为梯度,相应pH的1.0%酪蛋白为底物,按Folin-Phenol显色法于40 ℃测定蛋白酶酶活力。
1.8.3 温度稳定性将粗酶液在40、50、60 ℃的恒温水浴中分别保温0.5、1.0、1.5、2.0、2.5、3.0 h,处理结束后立即放入冰水中,按Folin-Phenol显色法于40 ℃测定剩余酶活力。
1.8.4 pH稳定性将粗酶液在pH 3.0-11.0的缓冲溶液中液稀释3倍,于25 ℃孵育1 h后按Folin-Phenol显色法于40 ℃测定剩余酶活力。
1.8.5 变性剂对蛋白酶的影响分别配制浓度为0.1、0.3、0.5、0.7、0.9、1.0 mmol/L的EDTA、Tris、SDS溶液,将变性剂SDS、Tris以及金属螯合剂EDTA以0.1:2的比例与酶液混合,于40 ℃反应10 min,按Folin-Phenol显色法于40 ℃测定蛋白酶酶活力。
1.8.6 金属离子对蛋白酶的影响配制0.001 mol/L的氯盐金属离子,将各种金属离子以0.1:2的比例与酶液混合,于40 ℃反应10 min,按Folin-Phenol显色法于40 ℃测定蛋白酶酶活力。
2 结果与分析 2.1 蛋白酶标准曲线与酶活力测定 2.1.1 蛋白酶标准曲线由图 1可见,酪蛋白标准曲线Y=0.010 29X+0.016 29,线性相关系数R2为0.998 3,线性良好,可用于蛋白酶酶活测定。
|
| 图 1 酪蛋白标准曲线 Figure 1 The standard curve of casein |
|
|
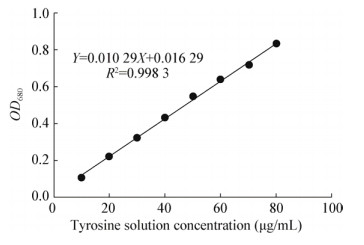
由图 2可知,该菌株发酵液具有明显的蛋白水解能力。按1.3方法测定TG116的蛋白酶活性,产酶量为57.46±1.67 U/mL。
|
| 图 2 菌株发酵液蛋白酶活力检测 Figure 2 Detection of protease activity in fermentation broth |
|
|
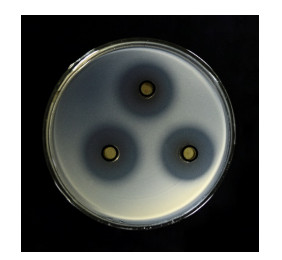
由图 3可知,该蛋白酶活力随温度升高呈现出先上升后下降的趋势,40 ℃时活性最高,30-50 ℃之间都有较好的酶活性。由菌浓度可以看出,在不同的温度下菌体繁殖速度不同,这直接影响了蛋白酶活力的高低,在40 ℃时该菌具有最大菌浓度,其蛋白酶活力也达到了最高。
|
| 图 3 温度对蛋白酶活性的影响 Figure 3 Effect of temperature on protease activity |
|
|
由图 4可知,该蛋白酶活力随pH升高呈现出先上升后下降的趋势,pH在8.0时达到最大值,在碱性范围内都有比较好的活性。酶活性与菌体数量成正比关系,在pH为8.0时,菌落数也达到了最大,随着pH的变大,菌落数开始锐减。

|
| 图 4 pH值对蛋白酶活性的影响 Figure 4 Effect of pH on protease activity |
|
|
由图 5可知,随着发酵时间的延长,酶活随之增大,在48 h可达到最大;在48 h之后,酶活开始下降;96 h后,酶活开始稳定,不再变化。菌体生长曲线可以看出,在48 h左右达到了生长对数期,此时拥有最大酶活力;72 h后开始到达稳定期与衰弱期,酶活力也随之开始下降,最后达到了稳定期,可能是因为细菌生长达到稳定期密度开始变大,培养基内营养物质逐渐消耗,酶活达到了稳定。

|
| 图 5 发酵时间对蛋白酶活性的影响 Figure 5 Effect of fermentation time on protease activity |
|
|
由图 6可知,在250 mL的锥形瓶中,以25 mL的装液量其酶活性最高,100 mL以及150 mL装液体积下酶活力明显降低。在不同的装液量中,由于溶氧量的不同,导致了菌体浓度的不同,可见随着供氧量的增加,菌体浓度变大,酶活性也增强。
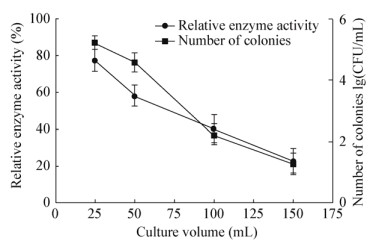
|
| 图 6 装液体积对蛋白酶活性的影响 Figure 6 Effects of culture volume on protease activity |
|
|
运用Design-Expert V8.0.5.0分析软件,在单因素试验基础上,利用响应面确定TG116的最佳产酶条件,试验结果如表 2所示。
| 序号 No. |
温度 Temperature (℃) (A) |
pH (B) |
时间 Time (h) (C) |
蛋白酶酶活 Protease activity (U/mL) |
| 1 | 45 | 7.0 | 48 | 148.08 |
| 2 | 40 | 7.0 | 72 | 120.84 |
| 3 | 40 | 7.0 | 24 | 44.91 |
| 4 | 35 | 7.0 | 48 | 64.63 |
| 5 | 35 | 8.0 | 72 | 96.36 |
| 6 | 40 | 8.0 | 48 | 252.22 |
| 7 | 40 | 8.0 | 48 | 264.29 |
| 8 | 40 | 8.0 | 48 | 259.55 |
| 9 | 35 | 8.0 | 24 | 24.63 |
| 10 | 40 | 8.0 | 48 | 254.90 |
| 11 | 40 | 8.0 | 48 | 260.60 |
| 12 | 45 | 8.0 | 24 | 67.97 |
| 13 | 45 | 8.0 | 72 | 144.93 |
| 14 | 40 | 9.0 | 24 | 59.65 |
| 15 | 45 | 9.0 | 48 | 122.94 |
| 16 | 40 | 9.0 | 72 | 135.37 |
| 17 | 35 | 9.0 | 48 | 87.57 |
对表 2中的试验数据进行回归分析,得二次回归模型编码方程为:
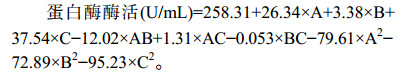
|
通过回归模型分析响应面的参数。由表 3可以看出:模型极显著(P<0.000 1),失拟项P=0.148 5,说明模型失拟不显著,回归显著,不需要引入更高次数的项。其中A、C、A2、B2、C2对TG116产酶影响较大,达到极显著(P<0.000 1);其次,AB达到显著(P<0.05)。
| 方差来源 Source |
平方和 Sum of squares |
自由度 df |
均方和 Mean square |
F值 F value |
P值 P value |
| Model | 114 800.00 | 9 | 12 758.00 | 291.20 | <0.000 1 significant |
| A | 5 550.89 | 1 | 5 550.89 | 126.70 | <0.000 1 |
| B | 91.60 | 1 | 91.60 | 2.09 | 0.191 4 |
| C | 11 275.51 | 1 | 11 275.51 | 257.37 | <0.000 1 |
| AB | 577.92 | 1 | 577.92 | 13.19 | 0.008 4 |
| AC | 6.84 | 1 | 6.84 | 0.16 | 0.704 6 |
| BC | 0.011 | 1 | 0.011 | 25 160.00 | 0.987 8 |
| A2 | 26 687.55 | 1 | 26 687.55 | 609.15 | <0.000 1 |
| B2 | 22 372.41 | 1 | 22 372.41 | 510.65 | <0.000 1 |
| C2 | 38 180.93 | 1 | 38 180.93 | 871.49 | <0.000 1 |
| Residual | 306.68 | 7 | 43.81 | ||
| Lack of fit | 215.41 | 3 | 71.80 | 3.15 | 0.148 5 not significant |
| Pure error | 91.27 | 4 | 22.82 | ||
| Cor total | 1.151E+005 | 16 |
从表 4可以看出,模型的R2=0.997 3,校正系数0.993 9,预测系数0.968 8,预测值与校正值较为接近,说明该模型拟合度较好,可以用来分析和预测TG116的最佳产酶条件。
| 标准偏差 Std. Dev |
平均值 Mean |
变异系数 C.V. % |
预测平方和 PRESS |
系数 R2 |
校正R2 Adj R2 |
预测R2 Pred R2 |
信噪比 Adeq precision |
| 6.62 | 141.73 | 4.67 | 3 589.15 | 0.997 3 | 0.993 9 | 0.968 8 | 46.767 |
根据TG116最佳产酶条件的回归方程计算所得的结果,得到不同因素之间的相应曲面图。
由图 7温度和pH对TG116蛋白酶活力交互影响的响应面图 7A可以看出,随着发酵温度逐渐提高,酶活力先增大后减小,在温度为40 ℃时达到最大值,随着pH的增大,酶活力出现先增大后减小的趋势,在pH为8.0时达到最大值;由温度和时间对TG116蛋白酶活力交互影响的响应面图 7B可以看出,随着温度的提高,酶活力先增大后减小,随着发酵时间的延长酶活力先增大后减小,在48 h时达到最大值;由pH和时间对TG116蛋白酶活力交互影响的响应面图 7C可以看出,随着pH的增大和发酵时间的延长,酶活力均呈现出先增大后减小的趋势。
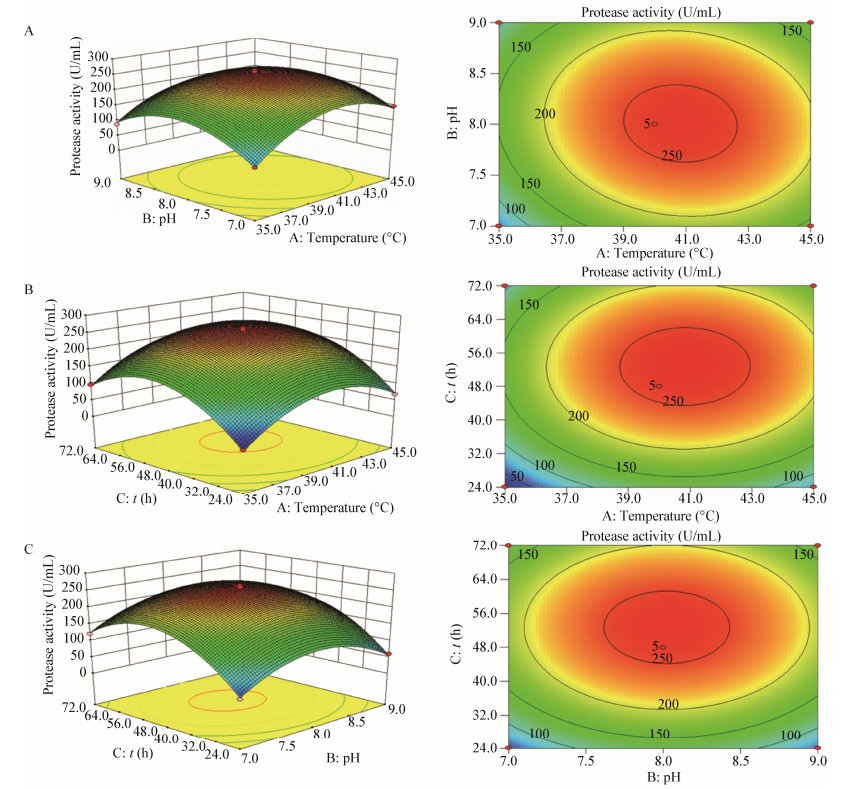
|
| 图 7 因素交互作用对蛋白酶活力影响的响应曲线和等高线 Figure 7 Response surface plot and contour plot showing effects of protease activity 注:A:温度与pH对蛋白酶活力交互影响的三维响应曲面图与等高线图;B:温度与时间对蛋白酶活力交互影响的三维响应曲面图与等高线图;C:pH与时间对蛋白酶活力交互影响的三维响应曲面图与等高线图. Note: A: The three-dimensional response surface and contour plots of the interaction of temperature and pH on protease activity; B: The three-dimensional response surface map and contour map of the interaction between temperature and time on protease activity; C: The three-dimensional response surface and contour plots of the interaction of pH and time on protease activity. |
|
|
在Design expert 10软件的预测下,所得理论最佳发酵条件为:温度40.83 ℃,pH 8.01,发酵时间53.74 h,此时模型预测的最大酶活力为264.24 U/mL。
为了检验模型预测的准确性,综合考虑实际操作的可能性,最终将最佳发酵模型修改为:温度40.8 ℃、pH 8.0、发酵时间55 h,进行产蛋白酶的发酵试验,得到的实际酶活为254.07 U/mL。实际值比预测值误差为±3.85%,可见该模型较好地预测了试验结果。
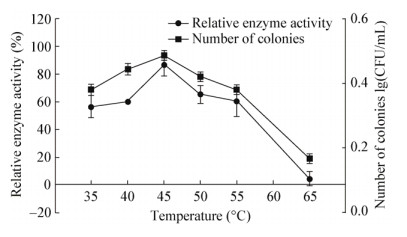
2.4 酶学性质研究 2.4.1 蛋白酶最佳作用温度及pH由图 8A可知,该蛋白酶在30-60 ℃均有蛋白降解活性,最适作用温度为50 ℃;图 8A可知,在pH 7.0-9.0时具有较高的蛋白酶活力,最适pH 8.5,为碱性蛋白酶。

|
| 图 8 温度(A)和pH (B)对蛋白酶活力的影响 Figure 8 Effects of temperatures (A) and pH (B) values on protease activity |
|
|
由图 9A可知,该蛋白酶在40 ℃时具有良好的稳定性,水浴3 h后还可保留80%以上的活性,50 ℃水浴2 h后保留60%以上的活性,60 ℃时该蛋白酶失活;图 9B可知,在pH>7.0时,该蛋白酶具有较好的稳定性,活性基本保持不变,但在偏酸的环境下该蛋白酶迅速失活,说明该蛋白酶为一种碱性蛋白酶。
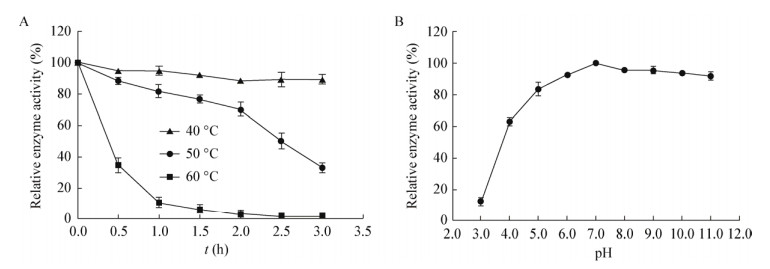
|
| 图 9 温度和pH对蛋白酶稳定性的影响 Figure 9 Effects of temperatures and pH values on protease stability |
|
|
一些金属离子对蛋白酶酶活力有激活作用,但部分也会对蛋白酶酶活力产生抑制作用。由图 10A可知,金属离子Mn2+、Zn2+对蛋白酶酶活力均具有一定的激活作用,其它金属离子Mg2+、Ca2+、Na+、Co2+、K+等具有一定的抑制作用。图 10B可知,变性剂具有强烈的蛋白酶活力抑制作用,且浓度越大抑制性越强,其中EDTA的抑制性最强。
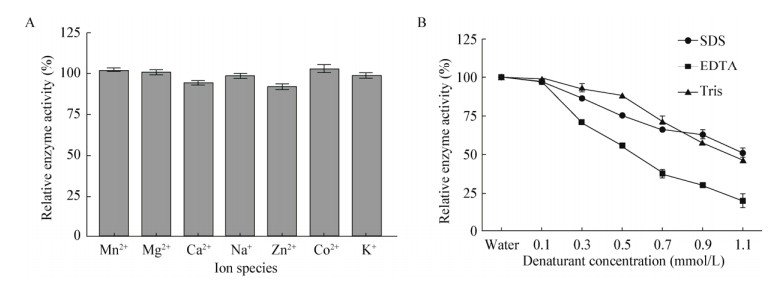
|
| 图 10 金属离子(A)与变性剂(B)对蛋白酶稳定性的影响 Figure 10 Effects of metal ions (A) and denaturant (B) on protease activity |
|
|
本研究对生防菌株TG116产蛋白酶的性质进行了探究,结果表明,该地衣芽孢杆菌最适产酶条件温度为:40.83 ℃,pH 8.01,发酵时间53.74 h,增加通气量可以显著提高酶活力。酶学性质结果表明,最适反应条件为:温度50 ℃和pH 8.5,在50 ℃水浴2 h后活性仍大于60%,具有良好的温度稳定性;在pH 5.0-11.0之间都具有一定的酶活力,特别是在碱性环境条件下,具有良好的pH耐受性;金属离子Mn2+、Zn2+对酶活力具有刺激作用,可以增强蛋白酶活性,而金属离子Mg2+、Ca2+、Na+、Co2+、K+具有一定的抑制作用,变性剂具有强烈的抑制作用。
有文献研究表明,从B. proteolyticus CFR3001[18]中分离鉴定出一种碱性丝氨酸蛋白酶,它可以通过裂解病原菌的细胞达到抑菌的作用,细胞产蛋白酶最佳条件为:37 ℃、pH 9.0、96 h;从B. cereus和B. subtilis[19]中均分离纯化得到了部分蛋白酶,并对其产酶条件与酶学性质进行了研究,结果表明该蛋白酶在60 ℃、pH 9.1时具有最高的活性,Mn2+可以明显增强蛋白酶活性,EDTA具有强烈的抑制作用,推测该蛋白酶可能为金属蛋白酶;从嗜热Bacillus菌株HS08[20]中分离纯化得到了带有丝氨酸的蛋白酶,其产酶条件与酶学性质已研究明确;从B. subtilis PE-11[21]中分离和纯化得到了热稳定的丝氨酸碱性蛋白酶,其酶学性质已得到表征。与已报道的一些碱性蛋白酶[20-21]相比,该酶最适作用pH较低,因此不易在存储过程中发生变性,不易在使用过程中产生药害,也不会对包装材料产生腐蚀现象,而更适合于农药制剂的生产。
蛋白酶是工业酶中用得最多的一类酶,约占酶总量的65%[22]。蛋白酶具有广泛的应用,特别是在食品、洗涤剂、织物、皮革、制药和化学工业中。例如,蛋白酶被广泛应用于增加肉的嫩度。商业蛋白酶主要由各种细菌产生,据报道,在洗涤剂工业中使用的总微生物酶约35%是来自细菌的蛋白酶[23]。蛋白酶通常根据其最适反应pH分为酸性蛋白酶、中性蛋白酶和碱性蛋白酶。研究者对酸性或碱性蛋白酶的性质和功能的研究进行了广泛的研究,特别是从芽孢杆菌产生碱性蛋白酶用于洗涤剂工业[24]。通常,用于洗涤剂应用的碱性蛋白酶应在高于40-50 ℃的温度和9.0-12.0的pH范围内有活性[25]。
本研究表明,从地衣芽孢杆菌中分离并部分纯化得到了一种碱性蛋白酶,它具有良好的温度、pH稳定性。本文研究结果表明TG116具有良好适应性,能有效裂解病原菌细胞壁,从而保证其生防作用。
| [1] |
Chen ML, Yu H, Gao H, et al. Talking about the research progress of Bacillus subtilis[J]. Modern Agriculture, 2014(2): 1-2. (in Chinese) 陈明丽, 于涵, 高虹, 等. 浅谈枯草芽孢杆菌的研究进展[J]. 现代化农业, 2014(2): 1-2. DOI:10.3969/j.issn.1001-0254.2014.02.001 |
| [2] |
Qiao JQ, Liu YZ, Zhang RS, et al. Optimization of fermentation process of Bacillus subtilis T-500 for production of lipopeptide antibiotics in flask[J]. Journal of Nanjing Agricultural University, 2018, 41(3): 447-455. (in Chinese) 乔俊卿, 刘邮洲, 张荣胜, 等. 枯草芽胞杆菌T-500产脂肽类抗生素的摇瓶发酵工艺优化[J]. 南京农业大学学报, 2018, 41(3): 447-455. |
| [3] |
Asaka O, Shoda M. Biocontrol of Rhizoctonia solani damping-off of tomato with Bacillus subtilis RB14[J]. Applied and Environmental Microbiology, 1996, 62(11): 4081-4085. |
| [4] |
Chen ZY. Study on the mechanism of antagonistic bacteria B-916 against rice sheath blight[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 1998 (in Chinese) 陈志谊.拮抗细菌B-916防治水稻纹枯病作用机制的研究[D].南京: 南京农业大学博士学位论文, 1998 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y281815 |
| [5] |
Xin YC. Control effects of Bacillus subtilis BL03 strain on Alternaria alternata and Colltotrichum gossypii in field[J]. Chinese Journal of Biological Control, 2000, 16(1): 47. (in Chinese) 辛玉成. 枯草芽孢杆菌BL03对苹果霉心病和棉苗病害田间防治效果[J]. 中国生物防治学报, 2000, 16(1): 47. |
| [6] |
Elad Y, Chet I. Possible role of competition for nutrients in biocontrol of Pythium damping-off by bacteria[J]. Phytopathology, 1987, 77(2): 190-195. DOI:10.1094/Phyto-77-190 |
| [7] |
Ran JJ, Xu JH, Hu XD, et al. Identification of a Bacillus strain producing lipopeptide and cloning of genes related to lipopeptide[J]. Food Science, 2016, 37(17): 127-132. (in Chinese) 冉军舰, 徐剑宏, 胡晓丹, 等. 1株产脂肽类抗生素芽孢杆菌的鉴定及脂肽类抗生素相关基因克隆[J]. 食品科学, 2016, 37(17): 127-132. DOI:10.7506/spkx1002-6630-201617021 |
| [8] |
Liu PL, Cheng DY, Miao LH. Isolation of a chitinase-producing strain Brevibacillus laterosporus and its enzymatic properties[J]. Biotechnology Bulletin, 2016, 32(6): 174-180. (in Chinese) 刘蒲临, 程德勇, 缪礼鸿. 产几丁质酶侧孢短芽孢杆菌的筛选及其酶学性质研究[J]. 生物技术通报, 2016, 32(6): 174-180. |
| [9] |
Liu Y, Li Y, Yin JY, et al. Study on isolation, identification and enzyme-reaction conditions of Bacillus amyloliquefaciens producing cellulase[J]. Acta Ecologiae Animalis Domastici, 2017, 38(4): 58-62. (in Chinese) 刘宇, 李阳, 尹珺伊, 等. 一株产纤维素酶的解淀粉芽孢杆菌的分离鉴定及其酶促反应适宜条件初步研究[J]. 家畜生态学报, 2017, 38(4): 58-62. DOI:10.3969/j.issn.1673-1182.2017.04.011 |
| [10] |
Li HK, Li YR, Li Y, et al. Optimization of fermentation conditions for the production of neutral protease by Bacillus subtilis[J]. Food and Fermentation Industries, 2016, 42(5): 102-107. (in Chinese) 李洪康, 李由然, 李赢, 等. 枯草芽孢杆菌产中性蛋白酶发酵条件优化[J]. 食品与发酵工业, 2016, 42(5): 102-107. |
| [11] |
Yu J, Zhang RY, Tan ZQ, et al. Studies on antifungal activity and purification of antifungal substance from Bacillus subtilis B25 strain[J]. Genomics and Applied Biology, 2016, 35(3): 629-634. (in Chinese) 于杰, 张荣意, 谭志琼, 等. 枯草芽孢杆菌B25抗真菌作用及抗菌蛋白的分离纯化[J]. 基因组学与应用生物学, 2016, 35(3): 629-634. |
| [12] |
Bowman SM, Free SJ. The structure and synthesis of the fungal cell wall[J]. Bioessays, 2006, 28(8): 799-808. DOI:10.1002/bies.20441 |
| [13] |
Yang HT, Guo Y, Li JS, et al. Glucanses produced by Trichoderma spp. and control of plant pathogens[J]. Shandong Science, 2003, 16(4): 1-7. (in Chinese) 杨合同, 郭勇, 李纪顺, 等. 木霉菌产生的葡聚糖酶和植物病害防治[J]. 山东科学, 2003, 16(4): 1-7. DOI:10.3969/j.issn.1002-4026.2003.04.009 |
| [14] |
Ling LJ, Lei L, Feng L, et al. Isolation and identification of endophytic bacterium TG116 from Typhonium giganteum and its antimicrobial characteristics[J]. Journal of Northwest Normal University (Natural Science), 2014, 50(5): 91-97. (in Chinese) 令利军, 雷蕾, 冯蕾, 等. 独角莲内生细菌TG116的分离鉴定及抑菌特性研究[J]. 西北师范大学学报:自然科学版, 2014, 50(5): 91-97. |
| [15] |
Li HS, Xie WT, Xu CH. Identification of a strain of Bacillus amyloliquefaciens and study on its enzymatic properties[A]//Symposium on Ecological Environment and Sustainable Development of Animal Husbandry and the 2012 Annual Meeting of the Chinese Society of Animal Husbandry and Veterinary Medicine and the National Symposium on Young Scientists and Technicians of Animal Husbandry and Veterinary Medicine[C]. Beijing: Chinese Association of Animal Science and Veterinary Medicine, 2012 (in Chinese) 李红胜, 谢为天, 徐春厚.一株解淀粉芽孢杆菌的鉴定及其蛋白酶酶学性质研究[A]//生态环境与畜牧业可持续发展学术研讨会暨中国畜牧兽医学会2012年学术年会和第七届全国畜牧兽医青年科技工作者学术研讨会会议论文集——T06饲料卫生与安全专题[C].北京: 中国畜牧兽医学会, 2012 |
| [16] |
Peng SP, Lin XG, Wang YM. Fermentation conditions and some properities of a thermostable protease from moderate thermophilic strain BY25[J]. Soils, 2010, 42(3): 410-414. (in Chinese) 彭素萍, 林先贵, 王一明. 一株产高温蛋白酶耐热菌BY25的产酶条件与酶学性质研究[J]. 土壤, 2010, 42(3): 410-414. |
| [17] |
Li JJ, Liu HJ, Ye JL, et al. Research on the properties of protease from Bacillus strain BLYS-1[J]. Journal of Henan University of Technology (Natural Science Edition), 2011, 32(2): 63-67. (in Chinese) 李金鞠, 刘海军, 叶晶龙, 等. 一株芽孢杆菌BLYS-1蛋白酶性质的研究[J]. 河南工业大学学报:自然科学版, 2011, 32(2): 63-67. |
| [18] |
Bhaskar N, Sudeepa ES, Rashmi HN, et al. Partial purification and characterization of protease of Bacillus proteolyticus CFR3001 isolated from fish processing waste and its antibacterial activities[J]. Bioresource Technology, 2007, 98(14): 2758-2764. DOI:10.1016/j.biortech.2006.09.033 |
| [19] |
Gerze A, Omay D, Guvenilir Y. Partial purification and characterization of protease enzyme from Bacillus subtilis megatherium[J]. Applied Biochemistry and Biotechnology, 2005, 121(1/3): 335-345. |
| [20] |
Huang GR, Ying TJ, Huo P, et al. Purification and characterization of a protease from Thermophilic bacillus strain HS08[J]. African Journal of Biotechnology, 2006, 5(24): 2433-2438. |
| [21] |
Adinarayana K, Ellaiah P, Prasad DS. Purification and partial characterization of thermostable serine alkaline protease from a newly isolated Bacillus subtilis PE-11[J]. AAPS PharmSciTech, 2003, 4(4): 440-448. DOI:10.1208/pt040456 |
| [22] |
Rao MB, Tanksale AM, Ghatge MS, et al. Molecular and biotechnological aspects of microbial proteases[J]. Microbiology and Molecular Biology Reviews, 1998, 62(3): 597-635. |
| [23] |
Ferrero MA, Castro GR, Abate CM, et al. Thermostable alkaline proteases of Bacillus licheniformis MIR 29: isolation, production and characterization[J]. Applied Microbiology and Biotechnology, 1996, 45(3): 327-332. DOI:10.1007/s002530050691 |
| [24] |
Fu ZB, Hamid SBA, Razak CNA, et al. Secretory expression in Escherichia coli and single-step purification of a heat-stable alkaline protease[J]. Protein Expression and Purification, 2003, 28(1): 63-68. DOI:10.1016/S1046-5928(02)00637-X |
| [25] |
Haddar A, Agrebi R, Bougatef A, et al. Two detergent stable alkaline serine-proteases from Bacillus mojavensis A21: purification, characterization and potential application as a laundry detergent additive[J]. Bioresource Technology, 2009, 100(13): 3366-3373. DOI:10.1016/j.biortech.2009.01.061 |
 2019, Vol. 46
2019, Vol. 46