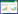扩展功能
文章信息
- 刘丽辉, 彭桂香, 黄淑芬, 王祖城, 庭友卫, 谭志远
- LIU Li-Hui, PENG Gui-Xiang, HUANG Shu-Fen, WANG Zu-Cheng, TING You-Wei, TAN Zhi-Yuan
- 落地生根内生固氮菌多样性和促生特性
- Diversity and growth promotion of endophytic diazotrophic bacteria isolated from Bryophyllum pinnatum
- 微生物学通报, 2019, 46(10): 2538-2547
- Microbiology China, 2019, 46(10): 2538-2547
- DOI: 10.13344/j.microbiol.china.180807
-
文章历史
- 收稿日期: 2018-10-17
- 接受日期: 2019-01-24
- 网络首发日期: 2019-02-19
2. 华南农业大学资源环境学院 广东 广州 510642
2. College of Natural Resources and Environment, South China Agricultural University, Guangzhou, Guangdong 510642, China
植物内生固氮菌是指定殖在健康植物体内,与宿主植物进行联合固氮的一类原核微生物,是植物微生态系统的天然组分[1]。由于长期的共同进化,植物内生菌与宿主植物建立了良好的互利共生关系,内生菌相比根际、叶际附生微生物使植物宿主更为受益[2]。内生固氮菌定殖于植物体内,生活在植物细胞内、细胞间隙、木质部导管等部位并进行固氮作用[3-4],不仅可满足自身生长和固氮所需的物质和能源,固定的氮可直接供给植物吸收,还能分泌生长素、铁载体、ACC脱氨酶和溶磷解钾,从而促进作物生长,提高作物抗性,是一类潜力巨大、尚待开发的微生物资源。
草本植物的茎秆木质部不发达,其木质化细胞少营养丰富,利于内生菌生长,是植物内生菌宿主的丰富来源。国内外对禾本科等植物内生菌已有很多报道[5-7],但是对多肉植物内生菌的研究较少。落地生根(Bryophyllum pinnatum)为景天科多年生肉质草本植物,是一种中药材,全株均可入药,具有解毒消肿活血止痛的作用,对落地生根提取物的抑菌活性成分和抗氧化研究较多,而内生菌的研究鲜有报道。
随着绿色生态农业建设的发展,长期单一施用化肥带来的对土壤和环境负面影响问题也越来越受到关注,植物内生固氮菌的研究与生物肥料和菌剂的开发利用备受重视。因此,了解植物内生菌的种群结构,充分挖掘内生菌的生物学功能,应用于生态农业,对可持续发展具有重要意义。本研究从多肉草本植物落地生根中分离纯化出26株内生固氮菌,隶属于4个属的5个菌种,具有丰富的遗传多样性和多种促生功能。扩充微生物资源库的同时,挖掘了潜在的优良促生菌。为内生菌促进植物生长和生物防治的深入研究提供理论依据及应用研究基础,具有实际价值和意义。
1 材料与方法 1.1 材料和培养基落地生根(Bryophyllum pinnatum)采自华南农业大学校园内野生草丛。选用无氮培养基DN进行内生固氮菌的分离纯化[8]。
DN培养基配方(g/L):蔗糖10.0,苹果酸5.0,NaCl 0.1,K2HPO4·H2O 0.1,KH2PO4·H2O 0.4,MgSO4·7H2O 0.2,CaCl2·H2O 0.02,FeCl3 0.01,Na2MoO4·H2O 0.002,pH 7.0。固体培养基加入20.0 g/L琼脂,半固体加入2.0 g/L琼脂。
King培养基配方(1 L):蛋白胨20.0 g,K2HPO4 1.725 g,丙三醇15.0 mL,MgSO4·7H2O 1.5 g,色氨酸0.1 g,pH 7.2。比色液配方(50 mL):0.5 mol/L FeCl3 1.0 mL,浓硫酸30.0 mL。
MSA-CAS培养基配方:向分开灭菌的1 L MSA基础培养基中分别加入50 mL磷酸缓冲液和50 mL CAS染液混匀。MSA基础培养基配方(g/L):葡萄糖4.0,蛋白胨5.0,KCl 0.5,MgSO4·7H2O 0.5,pH 7.0。磷酸缓冲液配方(100 g/mL):NaH2PO4·2H2O 0.590 5,Na2HPO4·12H2O 2.427,NH4Cl 0.250,KH2PO4·H2O 0.075,NaCl 0.125。CAS染液配方(100 g/mL):铬天青0.065 3,FeCl3 0.002 7,十六烷基三甲基溴化铵0.145 6。
PKO培养基配方(g/L):葡萄糖10.0,(NH4)2SO4 0.5,NaCl 0.3,KCl 0.3,MgSO4·7H2O 0.1,MnSO4·H2O 0.03,FeSO4 0.03,Ca3(PO4)2 5.0,酵母粉0.5,琼脂20.0,pH 7.0。
钾长石培养基配方(g/L):葡萄糖10.0,钾长石2.5,Na2HPO4 0.2,MgSO4·7H2O 0.2,NaCl 0.2,CaCO3 5.0,CaSO4·7H2O 0.1,琼脂20.0,pH 7.0。
1.2 主要试剂和仪器Taq酶、DNA Marker、蛋白Marker,康润生物科技有限公司;3-吲哚乙酸,合肥博美生物公司;α-丁酮酸,天津市科密欧化学试剂有限公司。超净工作台,苏州净化设备有限公司;培养箱,上海一恒科技有限公司;气相色谱仪,北京北分天普仪器技术有限公司;PCR仪、凝胶成像系统,Bio-Rad公司;水平电泳槽、小型双垂直电泳槽,北京六一仪器厂;高速离心机,Thermo公司;核酸蛋白检测仪,EPP公司;可见分光光度计,上海美普达仪器有限公司;
1.3 菌株的分离纯化将宿主植物的茎和叶分别剪成4 cm左右的小段,依次用75%酒精和0.1%升汞浸泡5 min和3 min,浸泡中用镊子搅拌。表面消毒后,无菌蒸馏水清洗7次,每次5 min。取最后一次洗涤蒸馏水涂于LB固体培养基作为对照,以确定宿主植物表面消毒是否彻底[9]。把经过表面消毒的根、茎、叶小段两端各去掉1 cm,分别用无菌剪刀剪碎或者用无菌研钵捣碎,将植物组织碎块穿刺接种于半固体DN培养基中,28 ℃培养3 d后用乙炔还原法测定固氮酶活性,采用平板稀释涂布法和平板划线法对具有固氮酶活性的菌株进行分离,直到获得纯化菌株。
1.4 固氮活性测定采用乙炔还原法进行固氮酶活性测定。在10 mm×100 mm试管中装入5 mL半固体无氮培养基,接种后反口胶塞密封。培养12 h后向小试管内注射1/10体积10%乙炔气体(使其终浓度为1%),同样条件下再次培养24 h,从小试管内用1 mL一次性无菌注射器抽取0.5 mL气相样品注入SP-2100气相色谱仪的样品注入口,测定样品乙烯的峰面积。标准乙烯的浓度是508 μL/L。气相色谱的工作条件设置为:柱温70 ℃,进样口120 ℃,检测器温度180 ℃。气体流量分别为:氮气30 mL/L,氢气30 mL/L,干燥空气60 mL/L。按下式计算固氮酶活性[10],单位:μmol C2H4/(mL·h)。

|
nifH固氮基因扩增:正向引物Zehrf (5′-TGYGAY CCNAARGCNGA-3′)和反向引物Zehrr (5′-NDGC CATCATYTCNCC-3′)。D:A、G或T;N:A、C、G或T;Y:C或T;R:A或G[11]。PCR反应体系(25 μL):10×PCR buffer 2.5 μL,10 mmol/L dNTPs 0.5 μL,5 U/μL Taq酶0.5 μL,50 μmol/L Zehrf 0.5 μL,50 μmol/L Zehrr 0.5 μL,模板DNA (40 ng/μL) 0.5 μL,双蒸水20.0 μL。PCR反应条件:97 ℃ 3 min;97 ℃ 60 s,55 ℃ 50 s,72 ℃ 35 s,32个循环;72 ℃ 5 min。
1.5 菌株的聚类分析 1.5.1 SDS-PAGE全细胞蛋白电泳聚类菌株全细胞可溶性蛋白提取参照谭志远等[12]方法。采用DYCZ-24D双垂直电泳槽,聚丙烯酰胺凝胶(下层10%分离胶,上层5%浓缩胶)进行电泳,配方及具体操作参照参考文献[8]。
1.5.2 IS-PCR插入序列指纹图谱聚类采用Insertion sequence-based PCR (IS-PCR)指纹图谱方法[13]。参照毕江涛等[14]方法,采用溶菌酶破壁提取细菌总DNA。选用单引物J3 (5′-GCTC AGGTCAGGTGGCCTGG-3′)进行PCR扩增,PCR反应体系(25 μL):10×PCR buffer 2.5 μL,10 mmol/L dNTPs 0.5 μL,5 U/μL Taq酶0.5 μL,50 μmol/L J3 1.0 μL,模板DNA (40 ng/μL) 0.5 μL,双蒸水20.0 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 50 s,56 ℃ 50 s,72 ℃ 1 min,35个循环;72 ℃ 5 min。采用双垂直电泳槽,6%非变性聚丙烯酰胺凝胶进行电泳。电泳图谱聚类分析参照原红娟等[15]方法。
1.6 16S rRNA基因系统发育分析16S rRNA基因扩增:正向引物25f [5'-AACT (G/T)AAGAGTTTGATCCTGGCTC-3']和反向引物1492r [5'-TACGG(C/T)TACCTTGTTACGACTT-3'][8]。PCR反应体系(25 μL):10×PCR buffer 2.5 μL,10 mmol/L dNTPs 0.5 μL,5 U/μL Taq酶0.5 μL,50 μmol/L 25f 0.5 μL,50 μmol/L 1492r 0.5 μL,模板DNA (40 ng/μL) 0.5 μL,双蒸水20.0 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 50 s,56 ℃ 50 s,72 ℃ 1 min,32个循环;72 ℃ 5 min。扩增16S rRNA基因片段约为1 500 bp,将PCR产物交北京睿博兴科生物技术有限公司测序。
16S rRNA基因序列拼接采用软件SeqMan完成。将测序结果在GenBank和EzBioCloud数据库中进行序列比对,寻找16S rRNA基因序列相似性最高的参比菌株,获得参比菌株的16S rRNA基因序列。通过MEGA 7.0软件采用邻接(Neighbor- Joining)法构建系统发育树。
1.7 菌株生理生化鉴定采用10个常规理化指标检测:甲基红试验、乙酰甲基甲醇(V-P)试验、明胶液化、过氧化氢酶、吲哚试验、淀粉水解、硝酸盐还原、产氨试验、脲酶、纤维素酶。试验所用方法和试剂配方见《微生物学实验教程》[16]。
1.8 菌株促生特性分泌生长素能力测定采用SalKowski比色法。将供试菌株等量接种到装有King液体培养基试管中,28 ℃、120 r/min培养2 d。将菌株培养液在5 000 r/min离心3 min,取上清液1 mL加比色液1 mL在黑暗中静置30 min,在530 nm波长下测定吸光度,标准曲线采用3-IAA (3-吲哚乙酸)标准品制作。
产铁载体检测:将菌株接种至MSA-CAS液体培养基中,28 ℃、120 r/min振荡培养2 d。液体培养基从蓝色变为红色、橙黄色或紫色为阳性。
溶磷试验:将菌株接种至PKO培养基平板上,28 ℃培养3 d,菌落周围形成透明圈为阳性。
解钾试验:将菌株接种至钾长石培养基平板上,28 ℃培养3 d,菌落周围形成透明圈为阳性。
ACC脱氨酶活性测定[17]采用2, 4-二硝基苯肼比色法,ACC脱氨酶活性计算公式:ACC脱氨酶
从落地生根的茎叶中共分离内生固氮菌26株,其中茎中分离到12株,叶中分离到14株。各菌株的分离来源和固氮酶活性详见表 1,这些菌株的固氮酶活性范围为3.25-45.97 μmol C2H4/(mL·h),不同菌株的固氮酶活性差异大,筛选到一些固氮酶活性高的菌株。各类群代表菌株均能扩增出360 bp的nifH固氮基因,在DNA分子水平上验证了它们的固氮能力。L091的固氮酶活性最高,达到45.97 μmol C2H4/(mL·h)。
| 组别 Group | 菌株编号 Strain No. | 分离部位 Origin | 固氮酶活性 Nitrogenase activity (μmol C2H4/(mL·h)) |
| Ⅰ | L061 | 茎 Stem | 8.59 |
| L062 | 茎 Stem | 7.96 | |
| L063 | 茎 Stem | 7.63 | |
| L064 | 叶 Leaf | 7.99 | |
| L065 | 叶 Leaf | 8.30 | |
| L066 | 叶 Leaf | 7.84 | |
| Ⅱ | L091 | 叶 Leaf | 45.97 |
| L092 | 叶 Leaf | 44.07 | |
| L093 | 叶 Leaf | 44.91 | |
| L094 | 茎 Stem | 42.04 | |
| Ⅲ | L201 | 茎 Stem | 5.63 |
| L202 | 茎 Stem | 5.34 | |
| L203 | 茎 Stem | 5.11 | |
| L204 | 叶 Leaf | 5.22 | |
| L205 | 叶 Leaf | 4.76 | |
| L206 | 叶 Leaf | 5.30 | |
| Ⅳ | L461 | 叶 Leaf | 28.81 |
| L462 | 叶 Leaf | 28.77 | |
| L463 | 叶 Leaf | 28.59 | |
| L464 | 叶 Leaf | 28.57 | |
| L465 | 叶 Leaf | 28.36 | |
| L466 | 茎 Stem | 27.92 | |
| L467 | 茎 Stem | 28.29 | |
| Ⅴ | L504 | 茎 Stem | 3.51 |
| L505 | 茎 Stem | 3.25 | |
| L506 | 茎 Stem | 3.39 |
将26株内生固氮菌进行SDS-PAGE全细胞蛋白电泳初步聚类分析,以便于菌株分类。图 1为每一类群同一群里的菌株的SDS-PAGE全细胞蛋白电泳图谱。从图 1可以看到,同一类群的菌株,其蛋白电泳带型基本一致,而不同类群的菌株蛋白电泳带型图各不相同。SDS-PAGE全细胞蛋白电泳带形图将26株菌聚为5个类群,分别为类群Ⅰ (L061、L062、L063、L064、L065、L066),类群Ⅱ (L091、L092、L093、L094),类群Ⅲ (L201、L202、L203、L204、L205、L206),类群Ⅳ (L461、L462、L463、L464、L465、L466、L467),类群Ⅴ (L504、L505、L506)。
|
| 图 1 5个类群的SDS-PAGE全细胞蛋白电泳图 Figure 1 SDS-PAGE whole-cell protein patterns of 5 kinds of group |
|
|
通过IS-PCR指纹图谱分析,可以区分种类不同的细菌菌种,根据指纹图谱得到聚类树状图(图 2),在大于90%的相似性水平上,可把该树状图分为5个类群(共26株),聚类结果与SDS-PAGE全细胞蛋白电泳一致。

|
| 图 2 IS-PCR指纹图谱聚类树状图 Figure 2 Dendrogram of IS-PCR fingerprinting patterns |
|
|
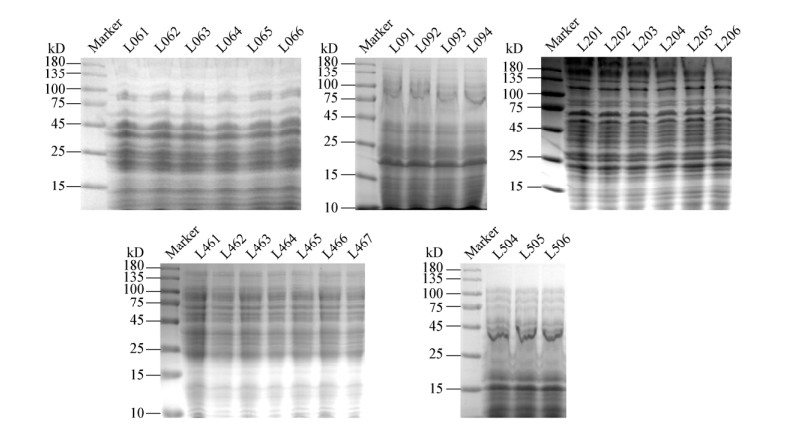
根据SDS-PAGE全细胞蛋白电泳聚类、IS-PCR指纹图谱聚类结果,每个类群选取一株代表菌株进行16S rRNA基因序列测定和分析,在GenBank和EzBioCloud数据库中比对序列,获得相似性最高菌株。EzBioCloud数据库中的比对结果如表 2所示,16S rRNA基因系统发育树如图 3所示。类群Ⅰ与类芽孢杆菌(Paenibacillus stellifer DSM14472T)相似性为99.65%;类群Ⅱ与巴西固氮螺菌(Azospirillum brasilense ATCC49958T)相似性为99.47%;类群Ⅲ与类芽孢杆菌(Paenibacillus albidus Q4-3T)相似性最高,为97.44%;类群Ⅳ与拜氏固氮菌(Azotobacter beijerinckii ATCC19360T)相似性最高,为97.82%;类群Ⅴ为克雷伯氏菌亚种(Klebsiella quasipneumoniae subsp. quasipneumoniae 01A030T),相似性为99.78%。依据国际细菌分类委员会的定义,类群Ⅲ和类群Ⅳ的16S rRNA基因序列与已知种的相似性在97%,可能为新种[18]。
| 类群 Group | 代表菌株 Representive strain | 相似性最高的已知种 Similarity with known species | 相似性 Similarity (%) |
| Ⅰ | L061 | Paenibacillus stellifer DSM 14472T | 99.65 |
| Ⅱ | L091 | Azospirillum brasilense ATCC 49958T | 99.47 |
| Ⅲ | L201 | Paenibacillus albidus Q4-3T | 97.44 |
| Ⅳ | L461 | Azotobacter beijerinckii ATCC 19360T | 97.82 |
| Ⅴ | L504 | Klebsiella quasipneumoniae subsp. quasipneumoniae 01A030T | 99.78 |
|
| 图 3 代表菌株的16S rRNA基因系统发育树 Figure 3 Phylogenetic dendrogram of 16S rRNA gene sequences for all representive strains 注:括号内为菌株的16S rRNA基因序列在GenBank中的登录号;使用邻接法构建树,节点处给出(> 50%)的数字是Bootstrap值;Bar:1%为核苷酸替换进化距离. Note: The GenBank accession numbers are given in parentheses; Constructed using the Neighbor-Joining method, numbers (> 50%) at nodes are bootstrap values; Bar: 1% nucleotide substitutions. |
|
|
各个类群的代表菌株生理生化试验结果详见表 3,L061、L091和L504与其相似性最高的已知菌种生理生化特性一致[19-21],L201和L461与其相似性最高的已知菌种生理生化特性存在一定差异[22-23]。
| 代表 菌株 | 甲基红 试验 | V.P 试验 | 明胶 液化 | 过氧化 氢酶 | 吲哚 试验 | 淀粉 水解 | 硝酸盐 还原 | 产氨 试验 | 脲酶 | 纤维 素酶 |
| Representive strain | Methyl red | V.P reactions | Gelatin liquefaction | Catalase | Indole production | Starch hydrolysis | Nitrate reduction | Ammonia production | Urease | Cellulase |
| L061 | + | + | - | + | - | + | - | + | - | - |
| L091 | - | + | - | + | + | + | + | + | + | + |
| L201 | + | + | - | + | - | + | - | - | - | - |
| L461 | + | + | - | + | - | - | + | + | - | - |
| L504 | - | + | - | + | - | - | + | + | + | - |
| Note: +: Positive; -: Negative. | ||||||||||
对各类群代表菌株分泌生长素和产铁载体的能力以及溶磷和解钾效果进行测定(表 4)。各类群代表菌株都有分泌生长素能力,且L091和L461分泌生长素能力最强,并能产生铁载体。L061同时具有溶磷解钾能力,L504是高效解钾菌,它们的解钾效果如图 4所示。L504还具有分泌ACC脱氨酶能力,ACC脱氨酶活性为2.86±0.36 μmol/(mg·h)。说明本研究从落叶生根中分离的内生固氮菌,是性状优良的促生菌,在以后的农业生产中具有潜在的应用价值。
| 菌株编号 Strain No. | 生长素 IAA (mg/L) | 产铁载体 Siderophore production | 溶磷 Phosphorus dissolving | 解钾 Potassium dissolving |
| L061 | 6.98±0.01 | - | + | + |
| L091 | 13.19±3.68 | + | - | - |
| L201 | 1.06±0.32 | - | - | + |
| L461 | 16.77±1.34 | + | - | - |
| L504 | 11.52±2.74 | + | - | + |
| Note: +: Positive; -: Negative. | ||||

|
| 图 4 菌株L061与L504解钾效果图 Figure 4 The results of dissolving potassium for strains L061 and L504 Note: A: L061; B: L054. |
|
|
目前国内外关于禾本科植物及作物的内生固氮菌已有较多报道,多肉植物落地生根的内生菌研究鲜有报到。本文从宿主植物落地生根中分离获得26株内生固氮菌,利用SDS-PAGE全细胞蛋白电泳和IS-PCR插入序列指纹图谱,对内生菌进行聚类及其遗传多样性分析,将26株菌聚为5个类群。通过16S rRNA基因系统发育分析和生理生化指标测定,对内生菌各类群代表菌株进行初步鉴定,表明所分离的内生固氮菌属于类芽孢杆菌属(Paenibacillus)、固氮螺菌属(Azospirillum)、固氮菌属(Azotobacter)和克雷伯氏菌属(Klebsiella)等不同菌种,反映了多肉植物落地生根中内生固氮菌资源多样性高。固氮螺菌属和固氮菌属能在植物体内定殖,并广泛地应用于生物肥料[24-25]。类芽孢杆菌属在野生稻[7, 26]和水稻[27]中的分离被报道。克雷伯氏菌属曾多次从野生稻、水稻、甘蔗、玉米等植物中获得[28-30]。说明这些属和种在植物体内生长数量多,是内生固氮菌中的优势菌群。
落地生根采集自野外干旱贫瘠的土地,且生长状况良好,植株高大叶片为深绿色有光泽,相比周围的短小杂草,表现出强大的生命力。野生植物在土壤贫瘠环境下生长旺盛,其生态竞争力与内生菌的功能多样性息息相关。野生植物的优良性状与内生菌功能有着千丝万缕的联系,丰富的内生菌群落为野生植株的生长和自然选择提供有利的竞争力。内生菌能够系统地分布于植物组织内,并占据有利的生态位,有充足的碳源,受到植物组织的保护的同时,相比根际、叶际等外部环境微生物更容易发挥生物学功能[28]。本试验内生菌具有固氮、分泌生长素、产铁载体、产ACC脱氨酶、溶磷和解钾等促生功能,固氮螺菌L091和固氮菌L461的固氮酶活性高,分泌生长素能力强。固氮螺菌和固氮菌的固氮能力强,常作为菌肥的应用菌种。王继雯等[31]报道的巴西固氮螺菌R5的固氮酶活性为8.2 nmol C2H2/(mg protein·min),本研究的巴西固氮螺菌L091具有更高的固氮酶活性为45.97 μmol C2H4/(mL·h)。克雷伯氏菌L504解钾能力强,解钾圈明显。郜晨等[32]也研究报道过该菌具有解钾能力,说明它可分泌酸性物质,并向周围的培养基扩散,从而形成透明圈。郜晨等[32]获得的克雷伯氏菌N32的固氮酶活性为180.40 nmol C2H4/(mL·h),而本研究的克雷伯氏菌L504固氮酶活性更高,为3.51 μmol C2H4/(mL·h)。L061是类芽孢杆菌,首次发现于包装纸板中,作为新种报道[19],固氮酶活性为168 nmol C2H2/(mg protein·h)。该菌近年来研究较少,本文研究发现该菌具有固氮酶活性[8.59 μmol C2H4/(mL·h)],分泌生长素能力,以及明显的溶磷解钾效果,该菌株在农业生产中具有一定的应用前景。L201和L461是新种资源[33]。
4 结论从野生宿主植物中分离获得的内生菌具有丰富的遗传和功能多样性,并且存在新的微生物资源,有待开发利用。本试验从多肉植物落地生根中分离纯化出26株内生固氮菌,聚为5个类群,具有遗传多样性。各类群的代表菌株经鉴定,L061和L201为类芽孢杆菌属,L091为固氮螺菌属,L461为固氮菌属,L504为克雷伯氏菌属。L201和L461是微生物新种,且各类群代表菌株具有固氮、分泌生长素、产铁载体、产ACC脱氨酶、溶磷和解钾等促生特性,为微生物肥料生产和应用提供了菌种资源和理论基础。
| [1] |
Golparyan F, Azizi A, Soltani J. Endophytes of Lippia citriodora (Syn. Aloysia triphylla) enhance its growth and antioxidant activity[J]. European Journal of Plant Pathology, 2018, 152(3): 759-768. |
| [2] |
Wang ZW, Ji YL, Chen YG. Studies and biological significances of plant endophytes[J]. Microbiology China, 2015, 42(2): 349-363. (in Chinese) 王志伟, 纪燕玲, 陈永敢. 植物内生菌研究及其科学意义[J]. 微生物学通报, 2015, 42(2): 349-363. |
| [3] |
An QL, Li JD. Endophytic diazotrophs[J]. Plant Physiology Communications, 1999, 35(4): 265-272. (in Chinese) 安千里, 李久蒂. 植物内生固氮菌[J]. 植物生理学通讯, 1999, 35(4): 265-272. |
| [4] |
Sprent JI, James EK. N2-fixation by endophytic bacteria: questions of entry and operation[A]//Fendrik I, Del Gallo M, Vanderleyden J, et al. Azospirillum Ⅵ and Related Microorganisms: Genetics-Physiology-Ecology[M]. Berlin, Heidelberg: Springer, 1995: 15-30
|
| [5] |
Peng GX. Diversity of endophtic diazothrophs isolated from wild rice and description of two novel species[D]. Guangzhou: Doctoral Dissertation of South China Agricultural University, 2010 (in Chinese) 彭桂香.野生稻内生固氮菌筛选及固氮新种的确定[D].广州: 华南农业大学博士学位论文, 2010 http://d.wanfangdata.com.cn/Thesis/Y1765807 |
| [6] |
Luo F, Wang Y, Zeng QG, et al. Diversity and plant growth promoting activities of the cultivable rhizobacteria of Dongxiang wild rice (Oryza rufipogon)[J]. Biodiversity Science, 2011, 19(4): 476-484. (in Chinese) 罗菲, 汪涯, 曾庆桂, 等. 东乡野生稻根际可培养细菌多样性及其植物促生活性分析[J]. 生物多样性, 2011, 19(4): 476-484. |
| [7] |
Yang J, Qin YX, Wang XT, et al. Diversity and growth promotion of endophytic bacteria isolated from Oryza officinalis in Guangxi[J]. Chinese Journal of Ecology, 2015, 34(11): 3094-3100. (in Chinese) 阳洁, 秦莹溪, 王晓甜, 等. 广西药用野生稻内生细菌多样性及促生作用[J]. 生态学杂志, 2015, 34(11): 3094-3100. |
| [8] |
Hu WZ, Tan ZW, Wang Y, et al. Isolation, identification and phylogenetic analysis of endophytic diazotrophs in Tengxian Medical-use Oryza officinalis[J]. Biotechnology Bulletin, 2016, 32(6): 111-119. (in Chinese) 胡文哲, 谭泽文, 王勇, 等. 藤县药用野生稻内生固氮菌分离鉴定及系统发育分析[J]. 生物技术通报, 2016, 32(6): 111-119. |
| [9] |
Tan ZY, Peng GX, Xu PZ, et al. Diversity and high nitrogenase activity of endophytic diazotrophs isolated from Oryza rufipogon Griff[J]. Chinese Science Bulletin, 2009, 54(16): 2839-2848. 谭志远, 彭桂香, 徐培智, 等. 普通野生稻(Oryza rufipogon)内生固氮菌多样性及高固氮酶活性[J]. 科学通报, 2009, 54(13): 1885-1893. |
| [10] |
Yan QH. Identification of novel diazothrophic bacteria isolated from three plants[D]. Guangzhou: Doctoral Dissertation of South China Agricultural University, 2007 (in Chinese) 袁清华.三种宿主植物固氮菌新类群分离鉴定[D].广州: 华南农业大学博士学位论文, 2007 http://d.g.wanfangdata.com.cn/Thesis_Y1174078.aspx |
| [11] |
Zehr JP, McReynolds LA. Use of degenerate oligonucleotides for amplification of the nifH gene from the marine cyanobacterium Trichodesmium thiebautii[J]. Applied and Environmental Microbiology, 1989, 55(10): 2522-2526. |
| [12] |
Tan ZY, Fu QM, Peng GX, et al. Identification and characterization of endophytic diazotrophs isolated from Cymbopogon caesius and Miscanthus floridulus[J]. Chinese Journal of Applied and Environmental Biology, 2013, 19(4): 643-649. (in Chinese) 谭志远, 傅琴梅, 彭桂香, 等. 青香茅和五节芒内生固氮菌的分离与生理生化鉴定[J]. 应用与环境生物学报, 2013, 19(4): 643-649. |
| [13] |
Wang CL, Zhang Q, Zhou YL, et al. Genetic diversity of pathogen Xanthomonas oryzae pv. oryzae from southern regions of Yangtze River in China[J]. Chinese Journal of Rice Science, 2001, 15(2): 131-136. (in Chinese) 王春连, 章琦, 周永力, 等. 我国长江以南地区水稻白叶枯病原菌遗传多样性分析[J]. 中国水稻科学, 2001, 15(2): 131-136. DOI:10.3321/j.issn:1001-7216.2001.02.010 |
| [14] |
Bi JT, He DH, Xie RM, et al. PCR-RFLP analysis of nitrogenase gene nifH of rhizobia from Ammopiptanthus mongolicus[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2009, 18(3): 315-321. (in Chinese) 毕江涛, 贺达汉, 谢瑞梅, 等. 沙冬青根瘤菌固氮酶基因nifH PCR-RFLP分析[J]. 西北农业学报, 2009, 18(3): 315-321. DOI:10.3969/j.issn.1004-1389.2009.03.070 |
| [15] |
Yuan HJ, Yan H, Yang F, et al. Molecular characterization and phylogenetic analysis of endophytic nitrogen-fixing bacteria in Oryza australiensis[J]. Chinese Journal of Applied and Environmental Biology, 2014, 20(4): 571-577. (in Chinese) 原红娟, 严慧, 杨芳, 等. 澳洲野生稻(Oryza australiensis)内生固氮菌的分子鉴定及发育分析[J]. 应用与环境生物学报, 2014, 20(4): 571-577. |
| [16] |
Zhao B, He SJ. Microbiology Experiment Course[M]. Beijing: Higher Education Press, 2013. (in Chinese) 赵斌, 何绍江. 微生物学实验教程[M]. 北京: 高等教育出版社, 2013. |
| [17] |
Penrose DM, Glick BR. Methods for isolating and characterizing ACC deaminase-containing plant growth-promoting rhizobacteria[J]. Physiologia Plantarum, 2003, 118(1): 10-15. |
| [18] |
Cho JC, Giovannoni SJ. Parvularcula bermudensis gen. nov., sp. nov., a marine bacterium that forms a deep branch in the α-Proteobacteria[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(4): 1031-1036. DOI:10.1099/ijs.0.02566-0 |
| [19] |
Suominen I, Spröer C, Kämpfer P, et al. Paenibacillus stellifer sp. nov., a cyclodextrin-producing species isolated from paperboard[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(5): 1369-1374. DOI:10.1099/ijs.0.02277-0 |
| [20] |
Peng GX, Wang HR, Zhang GX, et al. Azospirillum melinis sp. nov., a group of diazotrophs isolated from tropical molasses grass[J]. International Journal of Systematic and Evolutionary Microbiology, 2006, 56(6): 1263-1271. DOI:10.1099/ijs.0.64025-0 |
| [21] |
Brisse S, Passet V, Grimont PAD. Description of Klebsiella quasipneumoniae sp. nov., isolated from human infections, with two subspecies, Klebsiella quasipneumoniae subsp. quasipneumoniae subsp. nov. and Klebsiella quasipneumoniae subsp. similipneumoniae subsp. nov., and demonstration that Klebsiella singaporensis is a junior heterotypic synonym of Klebsiella variicola[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(9): 3146-3152. |
| [22] |
Zhuang JL, Xin D, Zhang YQ, et al. Paenibacillus albidus sp. nov., isolated from grassland soil.[J]. International Journal of Systematic and Evolutionary Microbiology, 2017, 67(11): 4685-4691. DOI:10.1099/ijsem.0.002356 |
| [23] |
Wang XH, Jiang H, Diao Z, et al. Isolation of nitrogen-fixing organisms and its use in the composting[J]. Journal of Northeast Agricultural University, 2012, 43(11): 77-80. (in Chinese) 王晓辉, 姜虎, 刁婥, 等. 固氮菌的筛选及其对菜场垃圾堆肥化的影响[J]. 东北农业大学学报, 2012, 43(11): 77-80. DOI:10.3969/j.issn.1005-9369.2012.11.018 |
| [24] |
Malinich EA, Bauer CE. The plant growth promoting bacterium Azospirillum brasilense is vertically transmitted in Phaseolus vulgaris (common bean)[J]. Symbiosis, 2018, 76(2): 97-108. DOI:10.1007/s13199-018-0539-2 |
| [25] |
Rai A, Kumar S, Bauddh K, et al. Improvement in growth and alkaloid content of Rauwolfia serpentina on application of organic matrix entrapped biofertilizers (Azotobacter chroococcum, Azospirillum brasilense and Pseudomonas putida)[J]. Journal of Plant Nutrition, 2017, 40(16): 2237-2247. DOI:10.1080/01904167.2016.1222419 |
| [26] |
Banik A, Mukhopadhaya SK, Dangar TK. Characterization of N2-fixing plant growth promoting endophytic and epiphytic bacterial community of Indian cultivated and wild rice (Oryza spp.) genotypes[J]. Planta, 2016, 243(3): 799-812. DOI:10.1007/s00425-015-2444-8 |
| [27] |
Yuan M, Tan SJ, Sun JG. Isolation and biological properties of endophytic diazotrophs from rice and their influences on rice seedling Cd accumulation[J]. Scientia Agricultura Sinica, 2016, 49(19): 3754-3768. (in Chinese) 袁梅, 谭适娟, 孙建光. 水稻内生固氮菌分离鉴定、生物特性及其对稻苗镉吸收的影响[J]. 中国农业科学, 2016, 49(19): 3754-3768. DOI:10.3864/j.issn.0578-1752.2016.19.008 |
| [28] |
Palus JA, Borneman J, Ludden PW, et al. A diazotrophic bacterial endophyte isolated from stems of Zea mays L. and Zea luxurians Iltis and Doebley[J]. Plant and Soil, 1996, 186(1): 135-142. DOI:10.1007/BF00035067 |
| [29] |
Boddey RM, Urquiaga S, Alves BJR, et al. Endophytic nitrogen fixation in sugarcane: present knowledge and future applications[J]. Plant and Soil, 2003, 252(1): 139-149. DOI:10.1023/A:1024152126541 |
| [30] |
Yin K, Yang J, Gu WJ, et al. Isolation and characterization of plant growth promotion of efficient endophytic diazotrophs from Oryza officinalis wall in Cenxi[J]. Microbiology China, 2015, 42(8): 1482-1491. (in Chinese) 尹坤, 阳洁, 顾文杰, 等. 岑溪药用野生稻高效内生固氮菌分离及促生特性[J]. 微生物学通报, 2015, 42(8): 1482-1491. |
| [31] |
Wang JW, Xie BE, Zhou FZ, et al. Isolation and identification of Azospirillum brasilense excreting high concentration of IAA and ammonium[J]. Biotechnology, 2009, 19(6): 14-17. (in Chinese) 王继雯, 谢宝恩, 周伏忠, 等. 高产吲哚乙酸及高泌氨巴西固氨螺菌的筛选与鉴定[J]. 生物技术, 2009, 19(6): 14-17. |
| [32] |
Gao C, Huang SF, Hu L, et al. Diversity and plant growth promotion of endophytic bacteria isolated from Oryza nivara[J]. Chinese Journal of Applied and Environmental Biology, 2018, 24(1): 33-38. (in Chinese) 郜晨, 黄淑芬, 胡莉, 等. 尼瓦拉野生稻内生菌多样性和促生作用[J]. 应用与环境生物学报, 2018, 24(1): 33-38. |
| [33] |
Liu LH, Yuan T, Yang F, et al. Paenibacillus bryophyllum sp. nov., a nitrogen-fixing species isolated from Bryophyllum pinnatum[J]. Antonie van Leeuwenhoek, 2018, 111(12): 2267-2273. DOI:10.1007/s10482-018-1117-6 |
 2019, Vol. 46
2019, Vol. 46