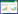扩展功能
文章信息
- 侯颖, 王维宇, 裴韬, 牛明福, 尤晓颜, 林靖坤, 张雪龚
- HOU Ying, WANG Wei-Yu, PEI Tao, NIU Ming-Fu, YOU Xiao-Yan, LIN Jing-Kun, ZHANG Xue-Gong
- 炔草酯降解菌Sphingopyxis sp. WP68的分离鉴定与降解特性
- Isolation, identification and characterization of clodinafop-propargyl degrading Sphingopyxis sp. WP68
- 微生物学通报, 2019, 46(10): 2529-2537
- Microbiology China, 2019, 46(10): 2529-2537
- DOI: 10.13344/j.microbiol.china.180919
-
文章历史
- 收稿日期: 2018-11-16
- 接受日期: 2019-02-03
- 网络首发日期: 2019-03-21
炔草酯,化学名(R)-2-[4-(5-氯-3-氟-2-吡啶氧基)苯氧基]丙酸炔丙酯,是一种主要用于小麦田的芳氧苯氧丙酸类除草剂(Aryloxyphenoxypropanoate,AOPP),对抗异丙隆的
已有研究表明,炔草酯可能引起小鼠肝癌、乳腺癌,可与小牛胸腺DNA结合等[3-7],美国癌症评估审查委员会则指出炔草酯可能会对人类产生致癌作用[8];日本在2006年修改了水产品和动物监视检查计划,在农药残留项目中添加了炔草酯,将其作为第22个需检查药物[9]。微生物在农药降解过程中具有重要作用,利用微生物降解对环境中残留的农药进行生物修复被认为是一种可持续发展、环境友好的理想方式。目前研究人员已分离到多个能够降解精噁唑禾草灵、精喹禾灵和氰氟草酯等芳氧苯氧丙酸类除草剂的高效菌株,并对其降解特性和分子机理进行了详细的研究[10-17]。相对而言,关于炔草酯微生物降解的研究较少,仅Singh报道了Pseudomonas sp. B2对炔草酯的降解,该菌株在9 h内可将浓度为80 mg/L的炔草酯降解87.14%,但120 mg/L的炔草酯就会对其降解能力产生抑制;该菌株降解炔草酯的产物主要有炔草酸和4-(4-氯-2-氟-苯氧基)苯酚[18]。
本研究从河南省某农药厂活性污泥中筛选出一株炔草酯高效降解菌株WP68,并对其分类学地位和炔草酯降解特性进行了研究,以期为研究炔草酯微生物降解的分子机理和利用微生物解决炔草酯的环境污染问题提供优良菌株和理论基础。
1 材料与方法 1.1 样品用于降解菌分离筛选的样品采自河南省郑州市某生产炔草酯的农药厂污水处理系统的活性污泥。
1.2 培养基LB培养基(g/L):胰蛋白胨10.0,酵母粉5.0,NaCl 10.0,固体培养基加入2%的琼脂粉,pH自然,0.11 MPa灭菌20 min。
基础盐培养基(g/L):NH4NO3 1.0,NaCl 1.0,K2HPO4 1.5,KH2PO4 0.5,MgSO4·7H2O 0.1,pH 7.0,固体培养基加入2%琼脂粉,0.11 MPa灭菌20 min。
富集培养基:在基础盐培养基中添加一定浓度炔草酯作为唯一碳源,并添加20.0 mg/L酵母汁作为生长因子。
1.3 主要试剂和仪器炔草酯原药(纯度98%)、精喹禾灵原药(纯度95%)、氰氟草酯原药(纯度97%),湖北康宝泰精细化工有限公司;精噁唑禾草灵(纯度96%),苏州迈睿丰生物科技有限公司。
恒温摇床,金坛市鸿科仪器厂;pH计,上海雷磁仪器厂;PCR仪,Biometra公司;凝胶成像系统,Bio-Rad公司;显微镜,Olympus公司;高效液相色谱,Agilent公司;液质联用仪,Waters公司。
1.4 炔草酯含量测定及降解产物鉴定样品前处理:取5 mL含炔草酯的培养基加入稀盐酸使其酸化至pH 2.0,加入等体积二氯甲烷,振荡萃取1 min,静置分层;移去上层水相,加入无水硫酸钠吸去残留水相。移取1 mL有机相样品液使二氯甲烷彻底挥发。加入1 mL色谱纯甲醇溶解炔草酯,用0.22 μm滤膜过滤后进行高效液相色谱分析和质谱分析。
高效液相色谱(HPLC)检测:采用250 mm×4.6 mm C18反相色谱柱;流动相为100%甲醇,流速为1 mL/min,上样量为10 μL,柱温为30 ℃。DAD检测器,检测波长为225 nm。
炔草酯降解产物的鉴定采用UPLC-MS。色谱系统:色谱柱Acquity BEH C18 (2.1 mm×50 mm,1.7 pm);柱温30 ℃;进样量5 µL;流动相:乙腈:0.1%甲酸(体积比70:30);流速0.2 mL/min,运行3 min。质谱系统:离子源ESI(+),毛细管电压3.0 kV,离子源温度110 ℃,脱溶剂气温度400 ℃,锥孔反吹气流量50 L/h,脱溶剂气流量550 L/h,检测方式为子离子扫描模式,碰撞电压20,m/z扫描范围为10–400。
1.5 炔草酯降解菌的富集与分离在含50 mg/L炔草酯的100 mL富集培养基中加入10 g活性污泥,于30 ℃、180 r/min培养7 d。富集培养液按1.4所述方法测定有降解效果后,吸取10 mL富集液转移至新鲜富集培养基中,并提高炔草酯浓度至100 mg/L,连续富集。待富集液降解效果稳定后,采用稀释平板法,将稀释后的富集液涂布于含200 mg/L炔草酯的LB固体培养基上,30 ℃培养48 h后,凡是菌落周围有透明圈的菌株即为要分离的炔草酯降解菌。对分离到的菌落形态不同的炔草酯降解菌进行划线纯化后,挑取其单菌落接种于含100 mg/L炔草酯的基础盐培养基中,30 ℃、180 r/min培养24 h后取样测定培养液中炔草酯的残留量,选取降解效果最好的菌株作为进一步研究对象。
1.6 炔草酯降解菌株的鉴定参照《常见细菌系统鉴定手册》[19]对菌株WP68进行菌落、菌体形态观察和生理生化试验。
通过高盐法提取降解菌株的基因组DNA后,采用细菌16S rRNA基因通用引物27f和1492r对降解菌株的16S rRNA基因序列进行PCR扩增。PCR反应体系:10×Taq DNA聚合酶反应缓冲液5 μL,dNTP mix (2.5 mmol/L) 4 μL,引物(25 μmol/L)各2 μL,Mg2+ (25 mmol/L) 4 μL,基因组DNA(约50 ng/L) 1 μL,Taq DNA聚合酶(5 U/μL) 0.5 μL,加灭菌双蒸水至50 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1.5 min,30个循环;72 ℃ 10 min。PCR产物经琼脂糖凝胶电泳检测后送往南京金斯瑞生物科技有限公司进行测序。将测定的菌株16S rRNA基因序列在NCBI数据库中进行在线比对分析,并在RDP数据库中下载与降解菌株16S rRNA基因序列同源的序列,采用MEGA 7.0软件构建降解菌株系统发育树。
1.7 炔草酯的降解特性研究将降解菌株经液体LB培养基活化培养后,5 000 r/min离心5 min收集菌体,用灭菌的基础盐培养基洗涤一次后,再用基础盐培养基重悬菌体制成OD600为1.0的种子液。将种子液按5%接种量接种到含200 mg/L炔草酯的基础盐培养基中,于37 ℃、180 r/min摇床培养,每隔2 h取样一次,利用HPLC测定培养液中炔草酯的含量。同时采用稀释平板法测定培养液中降解菌株的细胞数量,确定降解菌株对炔草酯的降解能力及利用炔草酯的生长情况。另外,在不同温度(20、25、30、37、42 ℃)、不同初始pH (6.0、7.0、8.0、9.0、10.0)、不同炔草酯浓度(50、100、200、300 mg/L)、不同接种量(0%、1%、3%、5%和7%)条件下测定降解菌株对炔草酯的降解特性。最后,利用分别含200 mg/L精喹禾灵、氰氟草酯和精噁唑禾草灵的固体LB培养基研究菌株对其它AOPP除草剂的降解性。
2 结果与分析 2.1 炔草酯降解菌的分离与鉴定利用含有200 mg/L炔草酯的LB固体培养基,从炔草酯降解富集液中分离筛选到一株炔草酯降解菌,将其命名为菌株WP68。菌株WP68在含有炔草酯的LB培养基上,其菌落周围能形成明显的透明圈(图 1A),说明该菌株具有很好的炔草酯降解能力,因此将该菌株作为进一步研究的对象。
|
| 图 1 菌株WP68的菌落形态与显微照片 Figure 1 Colony morphology and micrograph of strain WP68 注:A:菌株WP68在含炔草酯LB培养基上形成的菌落形态;B:菌株WP68显微照片(×1 000). Note: A: Colony morphology of strain WP68 on the LB culture containing CP; B: Micrograph of strain WP68 (×1 000). |
|
|
菌株WP68在固体LB培养基上形成黄色圆形小菌落,菌落湿润、粘稠,易挑起,边缘整齐,质地均匀,表面凸起,不透明(图 1A)。通过光学显微镜观察,菌株WP68的菌体呈长杆状,大小均匀,无芽孢(图 1B)。生理生化试验结果表明,菌株WP68的接触酶试验阳性、甲基红(M.R)试验阴性、V-P试验阴性、淀粉水解试验阴性、硝酸盐还原试验阳性、亚硝酸还原试验阴性、明胶液化试验阴性、脂酶(Tween-80)试验阳性。
利用细菌16S rRNA基因通用引物27f和1492r对菌株WP68的16S rRNA基因进行PCR扩增和测序后,将其基因序列提交GenBank,获得登录号为MH973202。通过BLAST比对,表明菌株WP68的16S rRNA基因与Sphingopyxis terrae NBRC 15098 strain 203-1的16S rRNA基因(登录号:CP013342.1)相似度最高,达到100%。利用RDP数据库的Sequence Match分析和MEGA 7.0构建菌株WP68的系统发育树如图 2所示,菌株WP68与鞘氨醇盒菌属模式菌株Sphingopyxis terrae IFO15098 (登录号D13727)位于同一分支,说明二者亲缘关系最近。综合菌株WP68的形态特征、生理生化特性,表明该菌株与鞘氨醇盒菌属(Sphingopyxis)分类特征相符,因此将该菌株初步鉴定为鞘氨醇盒菌(Sphingopyxis sp.)。

|
| 图 2 菌株WP68系统发育树 Figure 2 Phylogenetic tree of strain WP68 based on 16S rRNA gene sequences 注:括号内为菌株的16S rRNA基因序列在GenBank中的登录号;分支结点处数字为Bootstrap值;标尺的数据为进化距离. Note: Numbers in parentheses represent the accession numbers in the GenBank for the 16S rRNA gene sequences of the strain; Numbers on the branches refer to bootstrap values; Bar (0.005) represents sequence divergence. |
|
|
在温度和pH分别为37 ℃和7.0条件下,将菌株WP68种子液接种于含炔草酯的基础盐培养基中培养,利用HPLC测定炔草酯及其降解产物含量变化。通过定时取样发现,随着炔草酯含量的降低,HPLC图谱中出现了一个新的吸收峰,且其含量随着炔草酯含量的降低而升高。图 3A为培养6 h后培养基中炔草酯及其降解产物的HPLC图谱,其中炔草酯的保留时间为2.85 min;保留时间为2.287 min的吸收峰为炔草酯降解产物。收集该产物进行UPLC-MS鉴定,发现其m/z=312,并且该物质可产生m/z=91、119、238和266的碎片离子(图 3C),结合炔草酯的UPLC-MS图谱和碎片离子情况(图 3B),推测该代谢产物为炔草酸。进一步研究表明,菌株WP68不能降解炔草酸,即菌株WP68是通过断裂炔草酯分子中丙酸和丙炔之间的酯键使其降解的,这与菌株WP68脂酶试验为阳性相吻合。

|
| 图 3 炔草酯及其降解产物的高效液相色谱和质谱 Figure 3 High performance liquid chromatography and mass spectrometry of CP and metabolite 注:A:炔草酯及其降解产物的高效液相色谱;B:炔草酯的质谱;C:降解产物的质谱. Note: A: High performance liquid chromatography of CP and metabolite; B: Mass spectrometry of CP; C: Mass spectrometry of metabolite. |
|
|
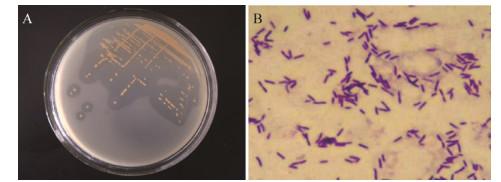
菌株WP68对炔草酯的降解曲线如图 4所示。菌株WP68对炔草酯的降解能力很强,8 h内即将200 mg/L的炔草酯降解95%以上;此后炔草酯降解速度开始放缓,10 h后其对炔草酯的降解率达到98.26%。菌株WP68对炔草酯的降解动力学方程为y=305.700 7e-0.421 1x (r=0.974 5,P < 0.05)。利用平板菌落计数法测定炔草酯降解前后培养基中菌株WP68的活菌数分别为2.32×107 CFU/mL和2.41×107 CFU/mL,表明菌株WP68可以在该培养基中进行微弱生长,这主要是由于基础盐培养基中能够被菌株WP68利用的营养物质太少,特别是碳源浓度太低所致。
|
| 图 4 菌株WP68对炔草酯的降解图 Figure 4 Degradation of CP by strain WP68 |
|
|
温度是影响微生物生长及其发挥对污染物降解作用等酶促反应的重要因素。温度对菌株WP68降解炔草酯的影响如图 5所示,温度为37 ℃时,菌株WP68在10 h对200 mg/L炔草酯的降解率最大,达到了99.79%;温度为42 ℃时,其对炔草酯的降解率也可达到97.56%。当温度低于37 ℃时,炔草酯的降解率随着温度的降低而下降,如30、25、20 ℃时,菌株WP68对炔草酯的降解率分别为65.11%、40.72%、12.31%。分析认为,温度不仅影响微生物细胞膜的通透性和降解酶的催化活性,还会影响底物的溶解性,进而影响底物的降解率。本研究的底物炔草酯为酯类物质,当温度较高时,其溶解度增大,更利于微生物的吸收和降解,因此其在37 ℃和42 ℃时的降解率明显高于30 ℃。但温度过高对酶的催化活性又会产生一定的抑制作用,所以本研究确定菌株WP68降解炔草酯的最适温度为37 ℃。

|
| 图 5 温度对菌株WP68降解炔草酯的影响 Figure 5 Effect of temperature on degradation of CP by strain WP68 |
|
|
pH是影响微生物生长和发挥其降解作用的又一重要环境因素,其对菌株WP68降解炔草酯的影响如图 6所示。在pH值为6.0-10.0的范围内,菌株WP68在10 h内对炔草酯的降解率均可达到95%以上,说明pH值对菌株WP68降解炔草酯的影响不大,其能在广泛的pH值条件下降解炔草酯。但在pH值为8.0时,炔草酯降解率最高,达到99.56%,遂认为WP68降解炔草酯的最适pH为8.0。pH同温度一样,不仅影响微生物细胞膜的通透性和降解酶的催化活性,更会影响底物的溶解性,甚至是电离性,特别是酯类物质在过酸或过碱条件下往往会发生水解。本研究也测定了未接种菌株WP68情况下,炔草酯在pH值为6.0-10.0范围内的降解率,发现其在此pH范围内均未发生降解。

|
| 图 6 pH对菌株WP68降解炔草酯的影响 Figure 6 Effect of pH on degradation of CP by strain WP68 |
|
|
如图 7所示,菌株WP68接种量为7%时,其在4 h内对200 mg/L炔草酯的降解率即可达到88%,8 h时降解率达到99%;接种量为5%时,其4 h和8 h时降解率分别为82%和96%;说明当接种量较大时,菌株WP68在较短时间内即可实现对炔草酯的高效降解。当菌株WP68接种量为1%时,200 mg/L的炔草酯在4 h和8 h的降解率仅为19%和53%,但到10 h时仍能达到77%,说明接种量小时,尽管炔草酯初始降解速度较慢,但是在一段时间后仍能达到较高的降解率。这些结果表明,炔草酯的降解效率与菌株WP68的接种量成明显的正相关。

|
| 图 7 接种量对菌株WP68降解炔草酯的影响 Figure 7 Effect of inoculum size on degradation of CP by strain WP68 |
|
|
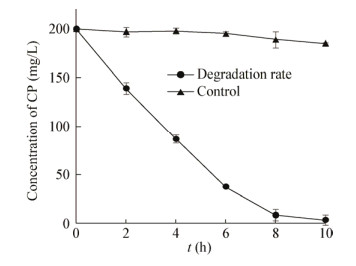
微生物对污染物的降解能力往往受到底物浓度的影响,特别是当污染物浓度较高时不仅会抑制微生物的生长,还会对微生物分泌的降解酶产生底物抑制作用,进而影响微生物的降解能力。底物浓度对菌株WP68降解炔草酯的影响如图 8所示,当炔草酯浓度分别为50、100、200和300 mg/L时,其8 h的降解率分别为99%、98%、96%和72%,即随着底物浓度的增高,菌株WP68对炔草酯的降解率逐渐降低,但通过进一步分析发现炔草酯降解的总量却在不断增加。这表明底物浓度对菌株WP68降解炔草酯的能力影响不大,300 mg/L的炔草酯对菌株WP68的降解能力也没有抑制作用。该结果进一步证明菌株WP68能十分高效地降解炔草酯。
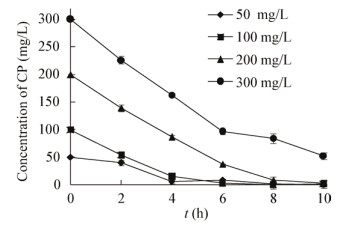
|
| 图 8 底物浓度对菌株WP68降解炔草酯的影响 Figure 8 Effect of substrate concentration on degradation of CP by strain WP68 |
|
|
菌株WP68对其他AOPP类除草剂的降解情况如图 9所示,在含有精喹禾灵和氰氟草酯的培养基上,菌株WP68的菌落周围有明显的透明圈(图 9A和9B),说明精喹禾灵和氰氟草酯能被菌株WP68降解;在含有精噁唑禾草灵的培养基上,菌株WP68菌落周围则没有出现水解圈(图 9C),说明菌株WP68不能降解精噁唑禾草灵,但是能在含有精噁唑禾草灵的培养基上生长。在已报道的芳氧苯氧丙酸类除草剂降解菌株中,大多数菌株均能降解多种该类除草剂[10-15]。
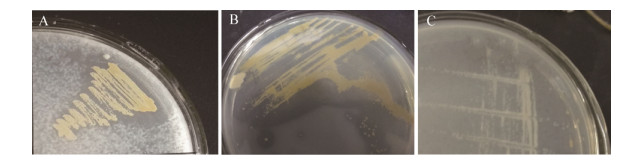
|
| 图 9 菌株WP68对其他芳氧苯氧丙酸类除草剂的降解情况 Figure 9 Degradation of other aryloxy phenoxy propionate herbicides by strain WP68 注:A:精喹禾灵;B:氰氟草酯;C:精噁唑禾草灵. Note: A: Quizalofop-p-ethyl; B: Cyhalofop-butyl; C: Fenoxaprop-p-ethyl. |
|
|
本研究从农药厂活性污泥中分离筛选到一株炔草酯降解菌WP68,通过生理生化试验和16S rRNA基因分析将其鉴定为鞘氨醇盒菌属(Sphingopyxis)。鞘氨醇盒菌属广泛存在于土壤和水体中,其抗逆性强、生长速度较快,这些特性使其成为修复环境污染的理想微生物。目前,关于利用鞘氨醇盒菌属细菌进行有机污染物降解的报道已有很多,如鞘氨醇盒菌对毒死蜱、聚乙二醇、微囊藻毒素、1, 2, 3-三氯丙烷等的降解[20-25],而本研究是首次报道鞘氨醇盒菌对炔草酯的降解。
菌株WP68 (OD600=1.0)在10 h内可将浓度为200 mg/L的炔草酯降解98%以上。相对于Singh报道的Pseudomonas sp. B2 (OD600=0.5)能在9 h内使初始浓度分别为80 mg/L和120 mg/L的炔草酯降解率达到87.14%和55%[18],菌株WP68是一株能高效降解炔草酯的优秀菌株,具有一定的研究价值与应用前景,特别是应用于高浓度炔草酯生产废水的生物处理。
菌株WP68降解炔草酯的产物为炔草酸,即菌株WP68降解炔草酯的机制是其分泌酯酶使炔草酯分子中丙酸和丙炔之间的酯键断裂。他人的研究结果也得到了相似的结论,在关于微生物降解芳氧苯氧丙酸类除草剂的已有报道中,大多数菌株均是通过分泌酯酶使该类除草剂酯键断裂形成相应的酸[10-15]。通过对炔草酯化学结构进行分析,发现酯键是其结构中最容易催化裂解的化学键,而其结构中的C-O-C以及苯环和吡啶环的结构则更稳定,不容易被降解,所以此类除草剂的完全降解往往需要多种微生物的共同作用[16-17]。因此,要想彻底解决炔草酯的污染问题,尚需进一步分离筛选能够使炔草酯C-O-C断裂以及苯环和吡啶环裂解的菌株。
除了炔草酯,菌株WP68还能降解精喹禾灵和氰氟草酯,但不能降解精噁唑禾草灵。分析认为虽然AOPP类除草剂结构中都含有一个酯键,但品种不同,酯键的稳定性也不同,因此可降解性也不同,这主要是受到酯键两端分子结构的影响。如Nie等[11]和Liu等[13]均认为形成AOPP酯键的醇的脂肪链的长短对其降解性影响较大,而芳香环的结构对其降解性影响较小。但本研究结果表明,形成炔草酯和氰氟草酯酯键的分别为丙炔和丁醇,能被菌株WP68很好地降解;形成精噁唑禾草灵和精喹禾灵酯键的均为乙醇,其可降解性却不同,因此认为酯键两侧的结构对其可降解性都有影响。对于AOPP类除草剂的微生物降解性,无论从除草剂分子结构还是从微生物及其酶学方面都尚需进一步研究。
| [1] |
Guan WB, Ma YQ, Zhang HY. Dissipation of clodinafop-propargyl and its metabolite in wheat field ecosystem[J]. Bulletin of Environmental Contamination and Toxicology, 2013, 90(6): 750-755. DOI:10.1007/s00128-013-0997-4 |
| [2] |
Zhang J, Chen QC, Guan LP, et al. Effects of sulformeturon methyl and clodinafop-propargyl on respiration intensity and nitrogen transformations of soil microorganisms[J]. Chinese Journal of Pesticide Science, 2017, 19(2): 203-210. (in Chinese) 张晶, 陈秋初, 关丽萍, 等. 甲嘧磺隆和炔草酯对土壤微生物呼吸强度和氮转化的影响[J]. 农药学学报, 2017, 19(2): 203-210. |
| [3] |
Li XB. Photo degradation of clodinafop-propargyl in water[D]. Hefei: Master's Thesis of Anhui Agricultural University, 2012 (in Chinese) 李夏冰.炔草酯在水中的光化学降解研究[D].合肥: 安徽农业大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10364-1013163008.htm |
| [4] |
Cai XM, He HM, Ding YH, et al. Environmental fates including soil surface photolysis, anaerobic soil degradation, and water-sediment degradation of clodinafop-propargyl[J]. Agrochemicals, 2011, 50(9): 677-679. (in Chinese) 蔡晓明, 何红梅, 丁亚慧, 等. 炔草酯土表光解、土壤厌氧降解和水-沉积物系统降解特性[J]. 农药, 2011, 50(9): 677-679. DOI:10.3969/j.issn.1006-0413.2011.09.017 |
| [5] |
Kashanian S, Askari S, Ahmadi F, et al. In vitro study of DNA interaction with clodinafop-propargyl herbicide[J]. DNA and Cell Biology, 2008, 27(10): 581-586. DOI:10.1089/dna.2008.0740 |
| [6] |
United States Environmental Protection Agency. Name of chemical: clodinafop-propargyl reason for issuance: conditional registration date issued: June 6, 2000[R]. Washington, DC: Environmental Protection Agency, 2000: 2-8
|
| [7] |
EFSA. Conclusion regarding the peer review of the pesticide risk assessment of the active substance cadusafos[R]. EFSA Scientific Report. EFSA, 2006, 34: 7-78
|
| [8] |
Chemicals Evaluated for Carcinogenic Potentia[C/OL]. Science Information Management Branch Health Effects Division Office of Pesticide Programs U. S. E. P. A., 2004: 10
|
| [9] |
Department of Food Safety. Development of imported foods monitoring and guidance plan for FY 2006[R]. Notice No. 0324002. Department of Food Safety. Department of Food Safety, 2006
|
| [10] |
Hou Y, Tao J, Shen WJ, et al. Isolation of the fenoxaprop-ethyl (FE)-degrading bacterium Rhodococcus sp. T1, and cloning of FE hydrolase gene feh[J]. FEMS Microbiology Letters, 2011, 323(2): 196-203. DOI:10.1111/j.1574-6968.2011.02376.x |
| [11] |
Nie ZJ, Hang BJ, Cai S, et al. Degradation of Cyhalofop-butyl (CyB) by Pseudomonas azotoformans strain QDZ-1 and cloning of a novel gene encoding CyB-hydrolyzing esterase[J]. Journal of Agricultural and Food Chemistry, 2011, 59(11): 6040-6046. DOI:10.1021/jf200397t |
| [12] |
Dong WL, Jiang S, Shi KW, et al. Biodegradation of fenoxaprop-P-ethyl (FE) by Acinetobacter sp. strain DL-2 and cloning of FE hydrolase gene afeH[J]. Bioresource Technology, 2015, 186: 114-121. DOI:10.1016/j.biortech.2015.03.039 |
| [13] |
Liu HM, Lou X, Ge ZJ, et al. Isolation of an aryloxyphenoxy propanoate (AOPP) herbicide-degrading strain Rhodococcus ruber JPL-2 and the cloning of a novel carboxylesterase gene (feh)[J]. Brazilian Journal of Microbiology, 2015, 46(2): 425-432. DOI:10.1590/S1517-838246220140208 |
| [14] |
Zhang H, Li MY, Dai C, et al. Characterization of EstQE, a new member of esterase family Ⅷ from the quizalofop-P-ethyl-degrading bacterium Ochrobactrum sp. QE-9[J]. Journal of Molecular Catalysis B: Enzymatic, 2016, 133: 167-175. DOI:10.1016/j.molcatb.2016.08.014 |
| [15] |
Zhang H, Li MY, Li J, et al. A key esterase required for the mineralization of quizalofop-p-ethyl by a natural consortium of Rhodococcus sp. JT-3 and Brevundimonas sp. JT-9[J]. Journal of Hazardous Materials, 2017, 327: 1-10. DOI:10.1016/j.jhazmat.2016.12.038 |
| [16] |
Dong WL, Hou Y, Xi XD, et al. Biodegradation of fenoxaprop-ethyl by an enriched consortium and its proposed metabolic pathway[J]. International Biodeterioration & Biodegradation, 2015, 97: 159-167. |
| [17] |
Dong WL, Liu K, Wang F, et al. The metabolic pathway of metamifop degradation by consortium ME-1 and its bacterial community structure[J]. Biodegradation, 2017, 28(2/3): 181-194. |
| [18] |
Singh B. Degradation of clodinafop propargyl by Pseudomonas sp. strain B2[J]. Bulletin of Environmental Contamination and Toxicology, 2013, 91(6): 730-733. DOI:10.1007/s00128-013-1124-2 |
| [19] |
Dong XZ, Cai MY. Manual of Systematic Identification on Common Bacteria[M]. Beijing: Science Press, 2001. (in Chinese) 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. |
| [20] |
Li RX, Hua RM, Tang XY, et al. Isolation, identification and chlorpyrifos degradation characteristic of new chlorpyrifos degrading strain Sphingopyxis terrae R17[J]. Acta Laser Biology Sinica, 2011, 20(2): 261-268. (in Chinese) 李瑞雪, 花日茂, 唐欣昀, 等. 一株毒死蜱降解新菌株Sphingopyxis terrae R17的分离鉴定及降解特性[J]. 激光生物学报, 2011, 20(2): 261-268. DOI:10.3969/j.issn.1007-7146.2011.02.022 |
| [21] |
Oelschlägel M, Rückert C, Kalinowski J, et al. Sphingopyxis fribergensis sp. nov., a soil bacterium with the ability to degrade styrene and phenylacetic acid[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(9): 3008-3015. DOI:10.1099/ijs.0.000371 |
| [22] |
Wang BX, Chu KH. Cometabolic biodegradation of 1, 2, 3-trichloropropane by propane-oxidizing bacteria[J]. Chemosphere, 2017, 168: 1494-1497. DOI:10.1016/j.chemosphere.2016.12.007 |
| [23] |
Zhang J, Lu QQ, Ding Q, et al. A novel and native microcystin-degrading bacterium of Sphingopyxis sp. isolated from lake Taihu[J]. International Journal of Environmental Research and Public Health, 2017, 14(10): 1187. DOI:10.3390/ijerph14101187 |
| [24] |
Jangkorn S, Charoenpanich J, Sriwiriyarat T. Comparative study of Enterobacter aerogenes and mixed-culture bacteria for acrylamide biodegradation in sequencing batch reactor wastewater-treatment systems[J]. Journal of Environmental Engineering, 2018, 144(3): 04017112. DOI:10.1061/(ASCE)EE.1943-7870.0001335 |
| [25] |
Chaudhary DK, Kim J. Sphingopyxis nepalensis sp. nov., isolated from oil-contaminated soil[J]. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(1): 364-370. DOI:10.1099/ijsem.0.002514 |
 2019, Vol. 46
2019, Vol. 46