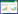扩展功能
文章信息
- 杨金水, 孔祥雪, 李金玉, 袁红莉
- YANG Jin-Shui, KONG Xiang-Xue, LI Jin-Yu, YUAN Hong-Li
- 产油微藻Auxenochlorella protothecoides UTEX 2341对镉胁迫的生理响应及抗性机理
- Physiological response and resistance mechanism of oleaginous microalgae Auxenochlorella protothecoides UTEX 2341 under cadmium treatment
- 微生物学通报, 2019, 46(10): 2504-2511
- Microbiology China, 2019, 46(10): 2504-2511
- DOI: 10.13344/j.microbiol.china.180984
-
文章历史
- 收稿日期: 2018-12-03
- 接受日期: 2019-02-13
- 网络首发日期: 2019-02-28
重金属镉(Cd)是生物毒性最强的重金属元素之一,据调查,黄浦江干流表层沉积物中镉浓度超过背景值的2倍[1-2]。2014年《全国土壤污染状况调查公报》显示,Cd污染物点位超标率达到7.0%,呈现从西北到东南、从东北到西南方向逐渐升高的态势。因此,对镉污染废水的治理成为环保领域的研究重点[3]。
微藻由于其生长速率快,分布范围广,被广泛作为处理重金属Cd污染废水的生物吸附材料之一[4]。不同微藻抵抗重金属毒性的机制不同,有些微藻主要通过细胞壁的胞外吸附作用而降低环境中重金属的含量以及重金属对细胞的毒性作用[5],但有些微藻主要通过胞内的酶学抗氧化防御系统和非酶抗氧化剂的联合作用降低重金属的细胞毒性[6-7]。本课题组的前期工作表明,产油微藻Auxenochlorella protothecoides UTEX 2341对Cd具有很好的去除能力[8]。在此基础上,本文进一步详细分析了高浓度Cd胁迫下微藻的生长、产油、光合色素合成、抗氧化酶酶活性和抗氧化剂含量的变化,以期初步阐明微藻UTEX 2341抗高浓度Cd的机理,从而为水体重金属的微藻吸附技术耦合微藻生物柴油生产技术的产业化发展奠定一定的理论和实验基础。
1 材料与方法 1.1 材料 1.1.1 藻株及培养基Auxenochlorella protothecoides UTEX 2341,实验室保存[8]。藻种保存培养基GM (g/L):甘油1.00,酸水解酪蛋白1.385,酵母抽提物0.10,KH2PO4 0.74,Na2HPO4·12H2O 0.207,CaCl2·2H2O 0.013,FeNaEDTA 0.01,MgSO4·7H2O 0.025,微量元素母液1 mL,微量元素母液成分参照Xing等[9]配制。发酵培养基(IM)成分参照Xing等[9]配制。
1.1.2 主要试剂和仪器培养基成分及油脂提取相关试剂等均为国产分析纯试剂;3CdSO4∙8H2O,国药集团化学试剂有限公司。
UV-1800紫外分光光度计,岛津公司;LGJ-12冷冻干燥机,北京松源华兴科技发展有限公司;超声波细胞破碎仪,宁波新芝生物科技股份有限公司。
1.2 试验方法 1.2.1 重金属Cd的耐受性分析添加适量Cd2+母液至IM培养基,使Cd2+终浓度为0、0.2、0.4、0.6、1.0、1.5、2.0、3.0和5.0 mmol/L。25 ℃暗培养,转速145 r/min。培养结束后,8 000 r/min离心5 min收集藻体,无菌水洗涤2次,冷冻干燥获得干藻体,称重获得藻细胞干重。油脂提取方法采用盐酸/氯仿/甲醇法[10]。
1.2.2 色素含量的测定测定方法参照孔祥雪[4]。色素含量最终转换为单位细胞湿重所占的色素量,单位为mg/g FW。
1.2.3 蛋白含量的测定采用5×Bradford protein assay reagent测定。
1.2.4 Cd胁迫下微藻的亚显微镜观察样品超薄切片制备,利用JEM-1230透射电镜观察[11]。
1.2.5 超氧化物阴离子含量的测定超氧化物阴离子含量的测定采用α-萘胺显色法[7],以O2∙-的含量来代表ROS的产生。
1.2.6 微藻胞内粗酶液的制备及抗氧化酶活测定(1) 微藻胞内酶粗酶液的制备。常温8 000 r/min离心5 min收集藻体,磷酸缓冲液洗涤藻体2次,称量藻体湿重,加入冷的酶提取液(g/L):聚乙烯吡咯烷酮10.0,EDTA-Na2∙2H2O 0.074 4,MgCl2∙6H2O 2.033,用50 mmol/L pH 7.0的磷酸缓冲液定容至1 L,超声破碎仪破碎(工作时间:间歇时间=2 s:2 s;总时间15 min;功率200 W)。超声后对混合液中残余的藻细胞计数,计算破碎率,后将混合液进行离心。上清即为粗酶液。
(2) 超氧化物歧化酶(Superoxide dismutase,SOD)和过氧化氢酶(Catalase,CAT)的活性测定。SOD采用氮蓝四唑(Nitroblue tetrazolium,NBT)光还原法测定[12]。CAT的测定方法同文献[13]。
(3) 微藻中谷胱甘肽(Glutathione,GSH)含量的测定。谷胱甘肽采用谷胱甘肽测试盒进行测定。
1.2.7 微藻油脂脂肪酸成分分析利用HP 6890气相色谱仪进行分析,样品制备同文献[9]。
1.2.8 数据与分析用SPSS 17.0软件进行显著性分析(P < 0.05),所有实验均重复3次。
2 结果与分析 2.1 Auxenochlorella protothecoides UTEX 2341耐受Cd能力分析测定了Cd浓度为0、0.2、0.4、0.6、1.0、1.5、2.0、3.0和5.0 mmol/L时微藻Auxenochlorella protothecoides UTEX 2341生物量和油脂含量的变化(图 1)。培养7 d后,5 mmol/L Cd胁迫下微藻生物量和油脂产量显著降低,2 mmol/L Cd胁迫下藻生物量为7.90 g/L,与对照相比减少了9.2%,但油脂含量为20.27%,比对照增加了95%,油脂产量最高为1.60 g/L。由此可见,Auxenochlorella protothecoides UTEX 2341具有耐受高浓度Cd胁迫的能力,并且油脂产量比对照增加1.77倍。为了细致分析高Cd浓度胁迫时UTEX 2341的生理响应及抗性机制,选择了高镉浓度2 mmol/L胁迫24、96和120 h进行了后续实验研究。
|
| 图 1 Auxenochlorella protothecoides UTEX 2341在不同浓度Cd胁迫下的生物量、油脂含量和油脂产率 Figure 1 Biomass, lipid content and lipid yield of Auxenochlorella protothecoides UTEX 2341 under different cadmium treatment |
|
|
培养5 d后,藻液颜色与对照相比轻微变黄,叶绿素(a+b)含量测定结果(图 2A)表明,120 h时的叶绿素(a+b)含量为0.71 mg/g FW,与对照相比减少了11%,5 d细胞生长已经进入稳定期,叶绿素含量变化与藻培养液颜色相符。在此基础上,继续测定了胁迫不同时间点的微藻油脂产量,油脂产量随胁迫时间的增加逐渐增加,120 h时产量1.14 g/L,与对照相比增加了62.86% (图 2B)。

|
| 图 2 Auxenochlorella protothecoides UTEX 2341在2 mmol/L Cd胁迫下叶绿素含量(A)、油脂产量(B)和蛋白含量(C)变化 Figure 2 Chlorophyll content (A), lipid yield (B) and protein content (C) of Auxenochlorella protothecoides UTEX 2341 under 2 mmol/L cadmium treatment 注:柱形图上端a、b、c表示各处理间结果差异显著性(P≤0.05).下同. Note: The a, b and c above the histogram are present the difference significant between all the treatment. The same below. |
|
|
重金属胁迫可诱导相关胁迫蛋白的产生,从而使重金属的毒性降低。因此测定了Auxenochlorella protothecoides UTEX 2341的可溶性蛋白的变化(图 2C),其含量随Cd胁迫的时间延长呈现先增加后减少的趋势,但是均显著低于对照组(P≤0.05)。文献[14]报道,重金属毒性能够抑制蛋白活性或者是损坏蛋白的结构。另外,Chlorella vulgaris在重金属Cd2+和Cu2+的胁迫下其蛋白水平分别下降了13%和17%[15]。该结果再次证实Cd胁迫确实抑制胞内可溶性蛋白的产生,且加速了蛋白质的降解。
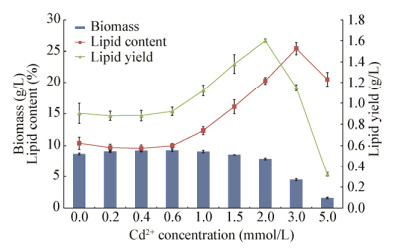
2.3 Cd胁迫下微藻的亚显微结构观察如图 3所示,Cd胁迫藻细胞的叶绿体中出现高电子密度颗粒,推测其可能是微藻吸收的Cd聚集体;并观察到胁迫藻细胞的细胞器结构不易分辨,胞质发生空泡化,油脂滴增加,此结果与图 2B的油脂产量变化一致。
|
| 图 3 微藻正常细胞(A)、吸附重金属细胞(B-D)在透射电镜下的形态 Figure 3 Morphology of normal cells (A), adsorbed cells (B-D) with heavy metal under the transmission electron microscope 注:A:96 h;B:24 h;C:96 h;D:120 h. L:油脂滴;S:淀粉;箭头:高电子密度颗粒. Note: A: 96 h; B: 24 h; C: 96 h; D: 120 h. L: lipid drops; S: Starch; Arrows: High electron density particles. |
|
|
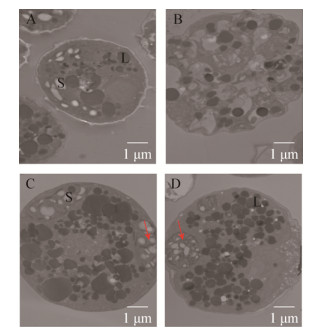
ROS在细胞中的产生和清除在正常情况下处于动态平衡的状态,但在逆境胁迫条件下这个动态平衡被打破,从而导致自由基的过量积累。ROS包括超氧化物阴离子自由基(O2∙-)、过氧化氢(H2O2)、羟自由基(∙OH)等。本研究以O2∙-的含量来代表ROS的产生。如图 4A所示,2 mmol/L Cd胁迫时胞内ROS水平均高于对照,96 h和120 h分别是对照的1.75倍和1.82倍,表明高Cd能够刺激胞内ROS的产生,但是随着培养时间的延长,ROS并没有持续增加,推测胞内存在抑制ROS产生的机制,从而抵抗高Cd产生的氧化毒性。
|
| 图 4 微藻ROS (A)、SOD (B)和CAT (C)的变化 Figure 4 ROS content (A), SOD activities (B) and CAT activities (C) of Auxenochlorella protothecoides UTEX 2341 under 2 mmol/L cadmium treatment |
|
|
抗氧化酶活的高低是植物响应逆境胁迫的重要指标。对抗氧化酶SOD和CAT活性测定发现,与对照相比,SOD和CAT酶活显著低于对照水平,说明在高浓度Cd胁迫下,胞内抗氧化酶抵抗Cd毒性的作用不大(图 4B、4C)。
2.5 Cd胁迫下微藻非酶抗氧化剂含量的变化藻类的抗氧化系统由抗氧化酶和非酶抗氧化剂组成。非酶抗氧化剂主要包括还原性谷胱甘肽(GSH)、类胡萝卜素(CAR),维生素C、维生素E、脯氨酸等。对类胡萝卜素的测定发现,2 mmol/L Cd胁迫96 h和120 h时,CAR的含量分别为0.18 mg/g FW和0.16 mg/g FW,比对照分别增加了37.6%和42.2% (图 5A)。

|
| 图 5 培养过程微藻类胡萝卜素(A)和GSH (B)的变化 Figure 5 The variation of carotenoid (A) and GSH content (B) under culture |
|
|
GSH的测定结果发现Cd胁迫使GSH含量显著增加(P≤0.05),胁迫96 h和120 h时GSH的含量分别为3.99 mg/g FW和4.60 mg/g FW,分别是对照的3.9倍和4.5倍(图 5B)。由此可见,微藻Auxenochlorella protothecoides UTEX 2341可能主要通过产生类胡萝卜素和GSH等非酶抗氧化剂,从而抵抗Cd对细胞造成的氧化毒性。
2.6 Cd胁迫对微藻脂肪酸成分的影响微藻用作生物柴油原料,其脂肪酸组成会影响生物柴油性能。文献报道C18:1单不饱和脂肪酸甲脂比其它多不饱和脂肪酸更适合生物柴油的生产,含有较多C18:1的生物柴油能更好地平衡燃料的点火性、燃烧热、粘度和润滑性等特点。2 mmol/L Cd胁迫下油酸(C18:1)含量高于对照(表 1),且脂肪酸成分中C16-C18的含量达96%-98%,符合生物柴油的生产标准。
| 成分 Composition | 名称 Name | 对照 Control | 96 h-2 mmol/L | 120 h-2 mmol/L | 168 h-2 mmol/L |
| C14:0 | 豆蔻酸 Myristic | 0.90 | 0.80 | 0.74 | 0.59 |
| C16:0 | 软脂酸 Palmitic | 11.20 | 9.51 | 8.32 | 7.70 |
| C16:1 | 棕榈油酸 Palmitoleic | 1.87 | 1.56 | 2.10 | 2.00 |
| C18:0 | 硬脂酸 Stearic | 1.64 | 1.72 | 1.03 | 0.79 |
| C18:1n9c | 油酸 Olieic | 41.26 | 46.59 | 42.74 | 46.83 |
| C18:2n6c | 亚麻油酸 Linoleic | 34.79 | 33.72 | 38.72 | 36.78 |
| C18:3n3 | γ-亚麻油酸 γ-Linoleic | 2.36 | 3.49 | 4.01 | 3.52 |
| C24:0 | 0.33 | 1.00 | 1.06 | 0.84 | |
| 饱和脂肪酸 Satiate | 19.35 | 14.38 | 12.12 | 10.58 | |
| 不饱和脂肪酸 Unsatiate | 80.65 | 85.62 | 87.88 | 89.42 |
将微藻应用于重金属污染水体处理,同时结合微藻生物柴油生产,不仅可以提升污水处理的经济效益,而且可以降低微藻生物柴油的生产成本,促进微藻生物柴油的产业化发展,因此解析微藻对重金属Cd的抗性机理非常重要。已有研究结果表明Auxenochlorella protothecoides UTEX 2341能够耐受高浓度Cd胁迫,其耐受浓度是四尾栅藻(耐受浓度为1 mg/L)的225倍,扁藻Tetraselmis gracilis (耐受浓度为1.8 mg/L)的125倍,Tetraselmis suecica (耐受浓度为7.9 mg/L)的28倍[16];杜氏盐藻Dunaliella salina (耐受浓度为48.9 mg/L)的4.6倍[17];细菌Arthrobacter C2 (耐受浓度为50 mg/L)的6倍[18];曲霉Aspergillus aculeatus (干细胞的最大耐受浓度200 mg/L)的1.5倍[19];但小于假丝酵母Candida sp. PS33的最高耐受浓度(1 236.51 mg/L)[20]。Cd能够影响微藻的光合作用,进而影响其生长,Cheng等研究发现Cd含量为7 mg/L时小球藻的生长受到抑制,此时叶绿素的含量下降93.37%[6]。Nowicka等研究表明Chlamydomonas reinhardtii在11.24 mg/L Cd胁迫下,叶绿素合成降低50%,当Cd浓度达到22.48 mg/L时,叶绿素完全降解[21]。Auxenochlorella protothecoides UTEX 2341在2 mmol/L (相当于224.82 mg/L) Cd浓度胁迫下叶绿素的抑制程度远低于以上报道,其光合作用仅受到了较小程度的破坏,这与图 1藻的生物量结果相符,也进一步证明了Auxenochlorella protothecoides UTEX 2341具有较强的Cd耐受能力。另外,ROS是细胞氧化损伤的一个重要指标,Cd处理能够引起微藻胞内ROS的积累,从而对细胞造成氧化损伤。尹文珂等研究发现,四尾栅藻在7 mg/L Cd胁迫下胞内ROS含量与对照相比增加了约8倍[22];Cheng等报道,7 mg/L Cd胁迫小球藻时,其ROS含量与对照相比增加了14.59倍[6]。Auxenochlorella protothecoides UTEX 2341在2 mmol/L Cd胁迫下ROS含量与对照相比最大增加了1.82倍,远低于以上报道。由此进一步证明Auxenochlorella protothecoides UTEX 2341具有高浓度Cd耐受水平,同时也表征微藻胞内存在有效的抵抗Cd胁迫的机制,从而使微藻细胞免受重金属毒性影响。Cheng等报道随着Cd浓度的增加,Chlorella vulgaris中SOD、CAT的活性先增加后降低,当Cd浓度为0.5 mg/L时SOD和CAT的活性达到最大,超过0.5 mg/L时,SOD和CAT的活性开始下降[6]。Arthrobacter C2中SOD、CAT的活性变化趋势与Chlorella vulgaris一致[18],而在Bacillus sp. P1中,SOD活性变化趋势与Chlorella vulgaris相似,但CAT活性在0-300 mg/L的Cd浓度范围内持续增加[23]。2 mmol/L Cd胁迫下,UTEX 2341中SOD和CAT酶活的结果与预期相悖,可能是因为使用的2 mmol/L Cd浓度过高,体内抗氧化酶SOD和CAT活性受到抑制。但是非酶抗氧化剂类胡萝卜素和GSH含量在Cd胁迫下显著增加,表明Auxenochlorella protothecoides UTEX 2341在2 mmol/L Cd浓度胁迫下,非酶抗氧化剂是缓解Cd胁迫下活性氧毒性的主要贡献者。除此以外,2 mmol/L Cd胁迫条件下微藻油脂产量显著高于对照水平,油脂组分也符合生物柴油的生产标准。该研究对微藻抗镉机制进行了初步分析,后续还需要更多实验深入系统分析微藻抗镉以及Cd胁迫下的产油机制,从而为镉污染的处理以及微藻生物柴油的工业化应用奠定良好的理论和实验基础。
| [1] |
Liang MN, Zhang T, Wang DQ, et al. Research advances of cadmium removal from wastewater by biomass adsorbent[J]. Journal of Guilin University of Technology, 2017, 37(4): 676-681. (in Chinese) 梁美娜, 张涛, 王敦球, 等. 生物质吸附剂去除废水中镉的研究进展[J]. 桂林理工大学学报, 2017, 37(4): 676-681. DOI:10.3969/j.issn.1674-9057.2017.04.020 |
| [2] |
Kong XX, Li BZ, Yang JS. Research progress in microalgae resistance to cadmium stress[J]. Microbiology China, 2017, 44(8): 1980-1987. (in Chinese) 孔祥雪, 李宝珍, 杨金水. 微藻去除重金属镉的抗性机理研究进展[J]. 微生物学通报, 2017, 44(8): 1980-1987. |
| [3] |
Yuan JR, Guo FR, Zou DS, et al. Research progress on the influence of cadmium on soil microorganism and bioremediation technology[J]. Hunan Agricultural Sciences, 2018(3): 114-117, 122. (in Chinese) 袁金蕊, 郭富睿, 邹冬生, 等. 镉对土壤微生物的影响及微生物修复镉污染研究进展[J]. 湖南农业科学, 2018(3): 114-117, 122. |
| [4] |
Kong XX. Mechanism of oil microalgae Auxenochlorella protothecoides UTEX 2341 resistance to cadmium stress[D]. Beijing: Master's Thesis of China Agricultural University, 2017 (in Chinese) 孔祥雪.产油微藻Auxenochlorella protothecoides UTEX 2341抗镉机理的初步研究[D].北京: 中国农业大学硕士学位论文, 2017 |
| [5] |
Belghith T, Athmouni K, Bellassoued K, et al. Physiological and biochemical response of Dunaliella salina to cadmium pollution[J]. Journal of Applied Phycology, 2016, 28(2): 991-999. DOI:10.1007/s10811-015-0630-5 |
| [6] |
Cheng JF, Qiu HC, Chang ZY, et al. The effect of cadmium on the growth and antioxidant response for freshwater algae Chlorella vulgaris[J]. SpringerPlus, 2016, 5: 1290. DOI:10.1186/s40064-016-2963-1 |
| [7] |
Figueira E, Freitas R, Guasch H, et al. Efficiency of cadmium chelation by phytochelatins in Nitzschia palea (Kützing) W. Smith[J]. Ecotoxicology, 2014, 23(2): 285-292. DOI:10.1007/s10646-013-1172-8 |
| [8] |
Yang JS, Cao J, Xing GL, et al. Lipid production combined with biosorption and bioaccumulation of cadmium, copper, manganese and zinc by oleaginous microalgae Chlorella minutissima UTEX2341[J]. Bioresource Technology, 2015, 175: 537-544. DOI:10.1016/j.biortech.2014.10.124 |
| [9] |
Xing GL, Yuan HL, Yang JS, et al. Integrated analyses of transcriptome, proteome and fatty acid profilings of the oleaginous microalga Auxenochlorella protothecoides UTEX 2341 reveal differential reprogramming of fatty acid metabolism in response to low and high temperatures[J]. Algal Research, 2018, 33: 16-27. DOI:10.1016/j.algal.2018.04.028 |
| [10] |
Li ZS, Yuan HL, Yang JS, et al. Optimization of the biomass production of oil algae Chlorella minutissima UTEX2341[J]. Bioresource Technology, 2011, 102(19): 9128-9134. DOI:10.1016/j.biortech.2011.07.004 |
| [11] |
Cao J. Oil Microalgae's response to environmental factors and fed-batch culture[D]. Beijing: Master's Thesis of China Agricultural University, 2014 (in Chinese) 曹静.产油微藻对环境因子的应答及补料培养[D].中国: 中国农业大学硕士学位论文, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10019-1014223591.htm |
| [12] |
Jia YH, Han YY, Liu J, et al. Physiological adaptations to cadmium stresses and cadmium accumulation in lettuce[J]. Journal of Agro⁃Environment Science, 2018, 37(8): 1610-1618. (in Chinese) 贾月慧, 韩莹琰, 刘杰, 等. 生菜对镉胁迫的生理响应及体内镉的累积分布[J]. 农业环境科学学报, 2018, 37(8): 1610-1618. |
| [13] |
Babu MY, Palanikumar L, Nagarani N, et al. Cadmium and copper toxicity in three marine macroalgae: evaluation of the biochemical responses and DNA damage[J]. Environmental Science and Pollution Research, 2014, 21(16): 9604-9616. DOI:10.1007/s11356-014-2999-0 |
| [14] |
Garcia JS, Souza GHMF, Eberlin MN, et al. Evaluation of metal-ion stress in sunflower (Helianthus annuus L.) leaves through proteomic changes[J]. Metallomics, 2009, 1(1): 107-113. DOI:10.1039/B816146A |
| [15] |
de Abreu FCP, da Costa PNM, Brondi AM, et al. Effects of cadmium and copper biosorption on Chlorella vulgaris[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 93(4): 405-409. DOI:10.1007/s00128-014-1363-x |
| [16] |
Pérez-Rama M, Alonso JA, López C, et al. Cadmium removal by living cells of the marine microalga Tetraselmis suecica[J]. Bioresource Technology, 2002, 84(3): 265-270. DOI:10.1016/S0960-8524(02)00045-7 |
| [17] |
Folgar S, Torres E, Pérez-Rama M, et al. Dunaliella salina as marine microalga highly tolerant to but a poor remover of cadmium[J]. Journal of Hazardous Materials, 2009, 165(1/3): 486-493. |
| [18] |
Li X, Wang J, Tan ZL, et al. Cd resistant characterization of mutant strain irradiated by carbon-ion beam[J]. Journal of Hazardous Materials, 2018, 353: 1-8. DOI:10.1016/j.jhazmat.2018.03.036 |
| [19] |
Xie Y, Li XN, Huang XB, et al. Characterization of the Cd-resistant fungus Aspergillus aculeatus and its potential for increasing the antioxidant activity and photosynthetic efficiency of rice[J]. Ecotoxicology and Environmental Safety, 2019, 171: 373-381. DOI:10.1016/j.ecoenv.2018.11.123 |
| [20] |
Ilyas S, Rehman A, Ilyas Q. Heavy metals induced oxidative stress in multi-metal tolerant yeast, Candida sp. PS33 and its capability to uptake heavy metals from wastewater[J]. Pakistan Journal of Zoology, 2017, 49(3): 769-775. DOI:10.17582/journal.pjz/2017.49.3.769.775 |
| [21] |
Nowicka B, Pluciński B, Kuczyńska P, et al. Physiological characterization of Chlamydomonas reinhardtii acclimated to chronic stress induced by Ag, Cd, Cr, Cu and Hg ions[J]. Ecotoxicology and Environmental Safety, 2016, 130: 133-145. DOI:10.1016/j.ecoenv.2016.04.010 |
| [22] |
Yin WK, Cheng JF, Shang WL, et al. Effect of cadmium on Scenedesmus quadricauda[J]. Journal of Agro-Environment Science, 2015, 34(4): 633-638. (in Chinese) 尹文珂, 程金凤, 尚婉露, 等. 四尾栅藻对重金属镉胁迫的响应[J]. 农业环境科学学报, 2015, 34(4): 633-638. |
| [23] |
Liu SH, Zeng ZT, Niu QY, et al. Influence of immobilization on phenanthrene degradation by Bacillus sp. P1 in the presence of Cd(Ⅱ)[J]. Science of the Total Environment, 2019, 655: 1279-1287. DOI:10.1016/j.scitotenv.2018.11.272 |
 2019, Vol. 46
2019, Vol. 46