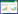扩展功能
文章信息
- 张梦君, 邱晨浩, 柴立伟, 黄木柯, 赵嫣然, 黄艺
- ZHANG Meng-Jun, QIU Chen-Hao, CHAI Li-Wei, HUANG Mu-Ke, ZHAO Yan-Ran, HUANG Yi
- 高效降解纤维素低温真菌的筛选、鉴定及发酵优化
- Screening, identification and fermentation optimization of cold-adapted fungi with high efficiency of cellulose degradation
- 微生物学通报, 2019, 46(10): 2494-2503
- Microbiology China, 2019, 46(10): 2494-2503
- DOI: 10.13344/j.microbiol.china.180910
-
文章历史
- 收稿日期: 2018-11-14
- 接受日期: 2019-04-26
- 网络首发日期: 2019-05-15
纤维素是由葡萄糖以β-1, 4-糖苷键连接而组成的大分子多糖,为植物细胞壁的重要组成成分,约占植物干重的35%-50%,是自然界中含量最为丰富的碳水化合物[1]。同时,纤维素也是一类十分重要的可再生资源,可作为能源、食品和化工产业的原料,如生产乙醇、乳酸和单细胞蛋白等[2-4]。然而,由于纤维素含有大量的高能氢键,不易被降解,利用率低,绝大多数的纤维素资源被废弃或直接焚烧,造成了极严重的资源浪费和环境污染问题[5]。因此,纤维素资源的有效开发与利用已经成为当前能源与环境研究的热点之一。
利用自然界中的微生物对纤维素进行生物转化,具有降解效率高、能耗低、安全、无污染等特点[6],可有效克服物理和化学处理法的弊端,越来越受到人们的重视。许多微生物已经被研究证明能够有效地降解纤维素,主要包括细菌中的芽孢杆菌、假单胞菌、纤维菌,真菌中的木霉、黑曲霉、青霉、酵母,以及部分放线菌等[7-13]。微生物通过合成纤维素酶来降解纤维素,纤维素酶主要由内切β-葡聚糖酶(Endocellulase)、外切β-葡聚糖酶(Exocellulase)和β-葡萄糖苷酶(β-glucosidase)组成,三者共同完成纤维素的水解过程[14-15]。
然而,当前纤维素的微生物转化主要集中在常温或高温条件下,涉及低温菌株及其产酶能力的研究则相对较少。在工业生产方面,产纤维素酶低温菌株的开发与利用,不但可以保证在低温条件下酶的高效反应,提高纤维素资源的利用效率,而且在实际的生产工艺中可以通过较低的热处理使酶失活,缩短工艺流程,降低产业能耗。同时在农业及环境保护方面,由于低温微生物经过长期的进化,可以在高山、深海、极地等低温自然环境中进行有效繁殖与活动,对于关键的生物地球化学循环发挥着重要的作用[16],可以应用于低温地区农业生态系统土壤肥力的调节以及自然生态系统的修复与强化。因此,低温降解纤维素菌株的研究具有重要的理论意义和应用前景。
本研究从西藏那曲地区海拔4 500 m的金露梅根际土壤中分离出一株可以高效降解纤维素的低温真菌,对其进行形态学观察、ITS rDNA序列分子鉴定,并通过响应面法进一步优化其产酶条件,以期为利用产纤维素酶低温真菌的产业化应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 供试土壤2017年8月,采集西藏那曲地区海拔4 500 m的金露梅根际土壤,装入采样袋,4 ℃保存于实验室。
1.1.2 培养基PDA培养基(g/L):马铃薯200.0,葡萄糖20.0,琼脂20.0,pH自然,1×105 Pa灭菌30 min。
羧甲基纤维素钠培养基(g/L):CMC-Na 15.0,NaCl 5.0,KH2PO4 1.0,MgSO4 0.2,蛋白胨10.0,酵母粉5.0,琼脂20.0,pH 7.2,1×105 Pa灭菌30 min。
产酶基础培养基(g/L):CMC-Na 15.0,酵母粉5.0,KH2PO4 2.0,pH 7.0,1×105 Pa灭菌30 min。
1.1.3 主要试剂和仪器Ezup柱式真菌基因组DNA抽提试剂盒、DNA marker、DNA聚合酶等购自生工生物工程(上海)股份有限公司;其余均为国产分析纯。光学显微镜购自上海光学仪器厂;PCR仪购自Applied Biosystems公司;酶标仪购自BioTek Instruments公司。
1.2 低温真菌的分离称取土样10 g置于90 mL的无菌水中,涡旋振荡至悬浮均匀。悬浮液分别稀释成10-2、10-3、10-4系列浓度梯度,然后分别吸取100 μL悬浮液涂布至PDA平板上,每个浓度重复3次。将平板置于15 ℃培养7 d,然后挑选形态各异的菌落进行纯化培养,对菌株编号并进行4 ℃下生长测试。
1.3 纤维素降解菌的筛选 1.3.1 初筛利用刚果红染色法对分离纯化的菌株进行初筛。分别将直径5 mm的菌块接种至羧甲基纤维素钠平板上,15 ℃培养3 d后,用1 mg/mL的刚果红染液染色1 h,弃去染液,加入1 mol/L的NaCl溶液脱色1 h。观察菌株菌落附近有无水解圈,若有则表示该菌株具有降解纤维素的能力,并记录菌落和水解圈的大小。
1.3.2 复筛将初筛得到的菌株接种到产酶基础培养基中,15 ℃、150 r/min恒温振荡培养7 d,发酵液于10 000×g离心10 min,上清液即为粗酶液,然后按照赵钰[17]所述方法,分别测定各菌株的内切β-葡聚糖酶、外切β-葡聚糖酶和β-葡萄糖苷酶活力,综合选择纤维素降解能力最强的菌株作为候选菌株进行后续研究。
1.4 候选菌株的鉴定 1.4.1 形态学观察将直径为5 mm的供试菌株菌块接种至Ø=9 cm的PDA平板上,15 ℃下培养5 d,观察菌落生长状况及其形态特征;用无菌镊子夹取适量培养好的青霉于载玻片上的棉蓝染液中央,拨动菌丝使其均匀散开,盖上盖玻片置于显微镜下,观察分生孢子及孢子头类型,分生孢子梗、小梗等的特点。
1.4.2 分子生物学鉴定采用Ezup柱式真菌基因组DNA抽提试剂盒提取供试菌株DNA;利用真菌通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)扩增菌株的ITS rDNA序列。PCR反应体系(25 μL):10×PCR buffer (含Mg2+) 2.5 μL,DNA模板0.5 μL,dNTPs (2.5 mmol/L) 1 μL,引物(20 μmol/L)各0.5 μL,Taq DNA聚合酶0.2 μL,ddH2O 19.8 μL。反应条件:94 ℃ 4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,30个循环;72 ℃ 10 min,4 ℃保存。扩增产物由生工生物工程(上海)股份有限公司测序,将测定的序列在GenBank中进行BLAST相似性比对(Available at: http://blast.ncbi.nlm.nih.gov/Blast.cgi),最后用MEGA 7.0的Neighbor-Joining法构建系统发育树,确定该菌株的系统发育学地位。
1.5 产酶条件优化 1.5.1 优化结果评价内切β-葡聚糖酶也称CMC酶,可随机识别β-1, 4-糖苷键,主要分解长链的大分子纤维素,其酶活力一般也较高于其他纤维素酶,是纤维素酶的重要组成成分之一。因此,本研究选择以内切β-葡聚糖酶酶活力作为产酶条件优化的评估指标,每个处理重复3次。
1.5.2 单因素优化培养基组分的优化:分别取2%的CMC-Na、可溶性淀粉、稻草粉、玉米芯粉和麸皮作为初始发酵培养基的碳源,接种量为2%,将种子液接入装有50 mL相应培养基的250 mL摇瓶中,15 ℃、150 r/min培养5 d,选择最佳碳源,并依次加入0.5%、1.0%、2.0%、3.0%、4.0%的碳源进行发酵培养,其余条件不变,选择最适碳源浓度;选择最佳碳源及浓度,其余条件不变,分别取1%的胰蛋白胨、酵母粉、牛肉膏、NH4NO3和(NH4)2SO4作为初始发酵培养基的氮源,选择最佳氮源,并依次加入0.25%、0.5%、1.0%、1.5%、2.0%的氮源进行发酵培养,选择最适氮源浓度;选择最佳碳源、氮源及其浓度,其余条件不变,分别取0.5%的NaCl、CaCl2、KH2PO4、FeSO4和MgSO4作为初始发酵培养基的无机盐,选择最佳无机盐,并依次加入0.1%、0.25%、0.5%、0.75%、1.0%的无机盐进行发酵培养,选择最适无机盐浓度。
培养条件的优化:根据选择的最佳培养基组分,其余培养条件不变,依次对培养时间、pH值及摇床转速进行优化。培养时间分别选择3、4、5、6、7 d;pH值分别选择5.0、6.0、7.0、8.0和9.0;摇床转速分别选择110、130、150、170、190 r/min。
1.5.3 响应面优化根据单因素实验结果,选择3个对酶活影响较显著的因素进行响应面实验设计中的Box-Benhnken实验设计,每个因素取3个水平,利用Design Expert 8.0软件进行响应面及方差分析,并对数据进行二次回归拟合,得到多元回归方程,在一定水平范围内求取最佳值,对产酶条件进行优化。最后对上述实验得出的结果进行验证实验,检测模型及结果的准确性。
2 结果与分析 2.1 降解纤维素低温真菌的分离及筛选 2.1.1 菌株的分离及初筛从西藏那曲地区海拔4 500 m的金露梅根际土壤中共分离到27株可在15 ℃下生长的真菌,其中12株在4 ℃下仍可生长。利用刚果红染色法对12株低温真菌进行降解纤维素能力的定性分析,共筛选到3株具有降解纤维素能力的低温真菌(图 1),其菌落直径及水解圈大小如表 1所示,菌株的水解圈与菌落直径比分别为1.51、1.74和2.49。因此,选择初筛得到的3株低温真菌进行产酶能力的复筛。
|
| 图 1 嗜冷真菌刚果红染色的水解效果 Figure 1 Hydrolytic effect of psychrophilic fungi with Congo red staining 注:A:NLC-1菌株;B:NLS-2菌株;C:NLP-4菌株. Note: A: NLC-1 strain; B: NLS-2 strain; C: NLP-4 strain. |
|
|
| 指标 Indices | NLC-1 | NLS-2 | NJP-4 |
| 水解圈直径 D Hydrolysis circle diameter (mm) | 11.3 | 17.4 | 12.1 |
| 菌落直径 d Colony diameter (mm) | 6.5 | 7.0 | 8.0 |
| 直径比 D/d Diameter radio | 1.74 | 2.49 | 1.51 |
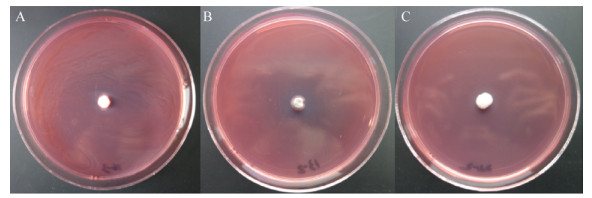
利用DNS法对初筛得到的3株降解纤维素低温真菌菌株进行产酶能力的复筛,结果(图 2)显示,在相同的培养条件下,菌株NLS-2的产纤维素酶能力最强,其内切β-葡聚糖酶活力、外切β-葡聚糖酶活力和β-葡萄糖苷酶活力分别为43.7、34.2和23.5 U/mL,均高于NLC-1和NLP-4菌株。因此选择NLS-2菌株进行后续的研究分析。
|
| 图 2 嗜冷真菌的纤维素酶活力 Figure 2 Cellulase activity of psychrophilic fungi 注:A:内切β-葡聚糖酶;B:外切β-葡聚糖酶;C:β-葡萄糖苷酶. Note: A: Endo-1, 4-β-D-glucanase; B: Exo-1, 4-β-D-glucanase; C: β-Glucosidase. |
|
|
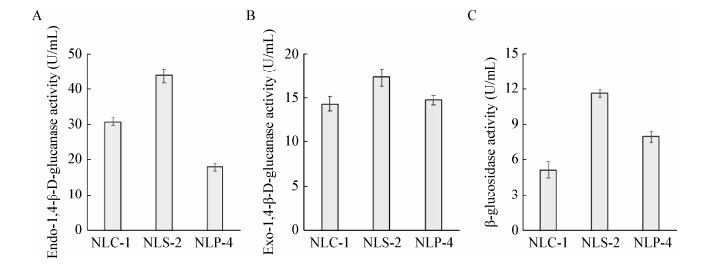
菌株NLS-2在PDA平板上15 ℃培养,初始菌落为白色,然后逐渐变为灰绿,3 d后菌落为灰色隆起,边缘齐整,直径达49 cm (图 3A);菌落表面呈粉末状并伴随菌丝绒毛,出现透明分泌液(图 3B);在显微镜镜下,菌株的分生孢子结构如图 3C所示,分生孢子梗发生于基质,壁光滑,顶端不膨大,(38-39) μm×(3.1-3.3) μm;多次分枝,呈扫帚状,梗基每轮2-3个,(31-32) μm×(2.9-3.0) μm;小梗每轮5-8个,呈圆柱状,(25-26) μm×(2.6-3.0) μm;分子孢子呈典型的圆形,光滑,直径2.6 μm-2.9 μm,呈分散状或串联的孢子链。根据菌落培养和分生孢子结构特征,参照《真菌鉴定手册》[18]和《中国真菌志》[19]进行比对分析,可初步确定菌株NLS-2为青霉属。
|
| 图 3 菌株NLS-2的形态学特征 Figure 3 Morphological characteristics of strain NLS-2 注:A:NLS-2菌落;B:NLS-2菌落特征;C:分生孢子;标尺:10 μm. Note: A: Colony of strain NLS-2; B: Colony texture of strain NLS-2; C: Conidiophores of strain NLS-2; Scale bar: 10 μm. |
|
|
经DNA提取、PCR扩增和测序获得ITS rDNA片段的长度为559 bp,在GenBank上进行BLAST比对,得出该菌株与相关青霉属菌株序列相似性达到99%。利用MEGA 7.0的Neighbor-Joining法构建系统发育树,如图 4所示,结果表明菌株NLS-2与一株青霉属菌株(MF588882)的亲缘关系更近,提交序列后获得的登录号为MK156784。结合形态学特征与分子系统学分析确定菌株NLS-2为青霉属(Penicillium sp.)的成员。

|
| 图 4 基于ITS基因序列相似性构建的菌株NLS-2的系统发育树 Figure 4 Phylogenetic tree of strain NLS-2 and its related strains based on ITS gene sequences 注:参与比对序列的GenBank登录号列于括号中,分支处标注有自展值,标尺所示长度为0.000 5核苷酸置换率. Note: GenBank accession numbers of aligned sequences are shown in the brackets. The bootstrap values are shown at the node. Bar 0.000 5 means the nucleotide substitution rate of 0.000 5. |
|
|
最优碳源及含量的选择:选取5种不同的碳源分别对NLS-2菌株进行发酵培养,各碳源测得的内切β-葡聚糖酶活力如图 5A所示,以稻草粉为唯一碳源时,酶活力达到50.6 U/mL,明显高于其他碳源种类,因此选择稻草粉作为最适碳源。在此基础上,对碳源的含量进行产酶条件优化,如图 5D所示,当稻草粉含量为3%时,菌株NLS-2产内切β-葡聚糖酶能力最强,酶活力达到53.3 U/mL,因此选择3%作为稻草粉的最优含量。

|
| 图 5 菌株NLS-2发酵条件的单因素优化 Figure 5 Single factor optimization of fermentation conditions of strain NLS-2 注:A:碳源种类选择;B:氮源种类选择;C:无机盐种类选择;D:碳源浓度选择;E:氮源浓度选择;F:无机盐浓度选择;G:发酵时间选择;H:pH值选择;I:摇床转速选择. Note: A: Carbon source selection; B: Nitrogen source selection; C: Mineral nutrition selection; D: Carbon source concentration selection; E: Nitrogen source concentration selection; F: Mineral nutrition concentration selection; G: Fermentation time selection; H: pH selection; I: Shaker speed selection. |
|
|
最优氮源及含量的选择:选取5种不同的氮源进行酶活测试,如图 5B所示,以酵母粉为唯一氮源时,酶活力达到55.7 U/mL,明显高于其他氮源种类,因此选择酵母粉作为最适氮源。在此基础上,对氮源的含量进行产酶条件优化,如图 5E所示,当稻草粉含量为0.5%时,酶活力最高,可达到57.8 U/mL,因此选择0.5%作为酵母粉的最优含量。
最优无机盐及含量的选择:选取5种不同的无机盐进行酶活测试,如图 5C所示,以KH2PO4为无机盐时,酶活力达到56.1 U/mL,明显高于其他无机盐种类,因此选择KH2PO4作为最适无机盐。在此基础上,对其含量进行产酶条件优化,如图 5F所示,含量为0.5%时酶活力最高,可达到57.9 U/mL,因此选择0.5%作为KH2PO4的最优含量。
最优培养条件的选择:分别对产酶的发酵时间、pH值和摇床转速进单因素优化,结果如图 5G–I所示,当发酵时间为6 d时酶活力最高,为65.7 U/mL;当pH值为6.0时酶活力最高,为67.3 U/mL;当摇床转速为170 r/min时酶活力最高,为69.1 U/mL。因此,选择最优发酵时间为6 d,最优pH值为6.0,最优摇床转速为170 r/min。
2.3.2 响应面优化结果为了进一步优化菌株NLS-2的产酶条件,根据单因素实验结果,选取稻草粉含量、发酵时间和pH值作为影响因素,以内切β-葡聚糖酶活力作为响应值进行Box-Behnken实验,实验因素与水平如表 2所示,实验设计与结果如表 3所示。
| 因素 Factors | 水平 Level | ||
| -1 | 0 | 1 | |
| Straw powder X1 (%) | 2.5 | 3.0 | 3.5 |
| Fermentation time X2 (d) | 5.0 | 6.0 | 7.0 |
| pH X3 | 5.5 | 6.0 | 6.5 |
| 编号 No. | 因素 Factors | 酶活 Enzyme activity (U/mL) | ||
| X1 | X2 | X3 | ||
| 1 | -1 | -1 | 0 | 46.25 |
| 2 | -1 | 1 | 0 | 72.75 |
| 3 | 1 | -1 | 0 | 48.00 |
| 4 | 1 | 1 | 0 | 53.75 |
| 5 | 0 | -1 | -1 | 46.25 |
| 6 | 0 | -1 | 1 | 49.50 |
| 7 | 0 | 1 | -1 | 52.25 |
| 8 | 0 | 1 | 1 | 72.00 |
| 9 | -1 | 0 | -1 | 46.25 |
| 10 | 1 | 0 | -1 | 49.25 |
| 11 | -1 | 0 | 1 | 69.00 |
| 12 | 1 | 0 | 1 | 54.00 |
| 13 | 0 | 0 | 0 | 66.25 |
| 14 | 0 | 0 | 0 | 67.00 |
| 15 | 0 | 0 | 0 | 67.50 |
二次回归方程拟合与方差分析:利用Design Expert 8.0软件对实验数据进行二次回归方程拟合,应用响应面的回归过程来分析数据,然后构建二次回归模型,进一步获得最优响应因子水平的回归分析。二次回归拟合方程为:Y=66.92-3.66X1+7.59X2+6.31X3-5.19X1X2-4.50X1X3+4.13X2X3-6.05X12-5.68X22-6.24X32,其中Y为预测值,X1、X2和X3分别为稻草粉含量、发酵时间和pH的编码水平;回归模型方差分析如表 4所示,P (Pr > F) < 0.01,模型效应极显著,其校正决定系数R2=0.994 3,RAdj2=0.984 1,表明该模型与实际试验拟合程度较好,实验误差较小,方程拟合良好。一次项X1、X2、X3,交互项X1X2、X1X3、X2X3和二次项X12、X22、X32都达到极显著水平(P < 0.01),表明各项对菌株NLS-2的产酶能力都有极显著的影响。
| 来源 Source | 自由度 df | 平方和 Sum of squares | 均方 Mean square | F值 F value | P值 P value |
| Model | 9 | 1 488.81 | 165.42 | 97.01 | < 0.000 1** |
| X1 | 1 | 106.95 | 106.95 | 62.72 | 0.000 5** |
| X2 | 1 | 461.32 | 461.32 | 270.54 | < 0.000 1** |
| X3 | 1 | 318.78 | 318.78 | 186.95 | < 0.000 1** |
| X1X2 | 1 | 107.64 | 107.64 | 63.12 | 0.000 5** |
| X1X3 | 1 | 81.00 | 81.00 | 47.50 | 0.001 0** |
| X2X3 | 1 | 68.06 | 68.06 | 39.91 | 0.001 5** |
| X12 | 1 | 135.24 | 135.24 | 79.31 | 0.000 3** |
| X22 | 1 | 119.00 | 119.00 | 69.79 | 0.000 4** |
| X32 | 1 | 143.75 | 143.75 | 84.30 | 0.000 3** |
| Residual | 5 | 8.53 | 1.71 | ||
| Lack of fit | 3 | 7.73 | 2.58 | 6.51 | 0.136 0 |
| Pure error | 2 | 0.79 | 0.40 | ||
| Cor total | 14 | 1 497.33 | |||
| R2=0.994 3, RAdj2=0.984 1, RPred2=0.916 2; C.V.%=2.28 | |||||
| 注:**:极显著(P < 0.01);*:显著(P < 0.05). Note: **: Extremely significant (P < 0.01); *: Significant (P < 0.05). | |||||
X1、X2、X3三因素交互作用的响应面如图 6所示,图 6A–C分别表示发酵时间、稻草粉含量和pH为最优值,以及其他两因素的交互作用与酶活力关系的三维坐标图。通过稻草粉含量、pH值和发酵时间的响应面轮廓岭脊分析可知三者的优化值分别为2.5%、6.5和7 d。综合单因素实验结果,确定最优结果为:稻草粉2.5%,酵母粉0.5%,KH2PO4 0.5%,发酵时间7 d,pH 6.5,摇床转速170 r/min,预测菌株发酵液纤维素酶活力可达72.07 U/mL。为了验证试验结果的可靠性,依据上述条件参数进行了3组平行试验,纤维素酶活力均值为71.15 U/mL,与预测值基本一致,说明该模型能够较好地预测菌株产纤维素酶情况。

|
| 图 6 两因素交互影响纤维素酶活力的响应面图 Figure 6 Response surface of cellulase activity of two factors interaction 注:A:稻草粉与pH交互影响纤维素酶活力;B:发酵时间与pH交互影响纤维素酶活力;C:稻草粉与发酵时间交互影响纤维素酶活力. Note: A: The interaction between straw powder and pH affects cellulase activity; B: The interaction between fermentation time and pH affects cellulase activity; C: The interaction between straw powder and fermentation time affects cellulase activity. |
|
|
在生物圈中,有80%以上的地方常年平均温度低于5 ℃,寒冷的环境使得大量的纤维素资源未能得到及时有效的利用[20]。产纤维素酶低温微生物能在低温环境下存活并合成进行高品质催化作用的酶,在生物地球化学循环过程中发挥着关键作用,且低温纤维素酶的应用也可以极大地节约生物质能源转化过程中的工艺成本和能耗[21]。迄今为止,国内外对于低温产纤维素酶微生物的研究主要集中在极地、深海、冰川等环境中蕴藏的低温菌,而对于土壤中耐低温解纤维素菌株的研究相对较少。目前已经报道的产纤维素酶低温微生物主要包括细菌中假单胞菌属、芽孢杆菌属、节杆菌属,真菌中的木霉属、青霉属、根霉属,以及放线菌门的多种菌属[22-25]。
本研究从西藏那曲地区海拔4 500 m的金露梅根际土壤中共计分离出27株可在15 ℃正常生长的真菌,经过4 ℃生长测试及刚果红显色反应,发现3株具有纤维素降解潜力的低温真菌。为了确定低温真菌的产纤维素酶潜力,在15 ℃的低温环境下对3株菌株进行了产酶的液体培养,酶活的定量分析结果表明,菌株NLS-2产纤维素酶能力最强,其内切β-葡聚糖酶、外切β-葡聚糖酶和β-葡萄糖苷酶活力分别为43.7、34.2和23.5 U/mL,说明该菌株在低温产纤维素酶方面具有较好的应用前景。综合形态学特征及ITS基因序列的系统发育分析结果,将NLS-2菌株确定为青霉菌属(Penicillium sp.)。
青霉菌(Penicillium spp.)是自然界中分布极广的一类真菌,因其具有产青霉素的能力而广为人知。近年来,青霉菌也被认为是纤维素酶的重要来源,可以生成复杂纤维素酶体系的所有组分,且相比于木霉可表达更高水平的β-葡聚糖酶,被认为是最具纤维素酶生产潜力的微生物类群[26]。国内外已有许多研究报道青霉菌属的多个种都能够有效地降解纤维素。Dutta等分离出一株P. citrinum,以麸皮为底物,其内切β-葡聚糖酶和滤纸酶活力分别为1.89 IU/mL和1.72 IU/mL[27]。Liu等分离出一株P. decumbens,以米糠为底物,发现其产滤纸酶活力可达5.76 IU/g[28]。Scholl等研究表明,菌株P. echinulatum SIM29在以添加了50%麦麸的象草为产酶底物时,可以高效表达纤维素酶,其滤纸酶、内切β-葡聚糖酶和β-葡萄糖苷酶活力分别为32.93、205.83和148.96 IU/g[29]。
纤维素降解菌发挥纤维素生物转化作用的物质基础是复杂的纤维素酶体系,其产量的高低直接影响菌株的降解效果,而微生物代谢产物的种类和含量与其培养条件密切相关。本研究采用单因素实验和响应面优化法对发酵条件进行优化,确定了菌株NLS-2的发酵条件为稻草粉2.5%,酵母粉0.5%,KH2PO4 0.5%,发酵时间7 d,pH 6.5,摇床转速170 r/min,其纤维素酶活力可达72.07 U/mL,为其扩大培养及产业化应用提供了理论依据。
综上所述,纤维素降解真菌NLS-2被鉴定为青霉菌属,具有高效低温产纤维素酶能力。通过发酵条件优化,显著地提高了NLS-2菌株的纤维素酶活力。后续的工作将在此优化的基础上,进一步研究其产酶的分子调控机理;同时也会对其进行产酶的固态发酵和混菌发酵,扩展菌株的应用方式。
| [1] |
Klemm D, Heublein B, Fink HP, et al. Cellulose: fascinating biopolymer and sustainable raw material[J]. Angewandte Chemie International Edition, 2005, 44(22): 3358-3393. DOI:10.1002/anie.200460587 |
| [2] |
Saini R, Saini JK, Adsul M, et al. Enhanced cellulase production by Penicillium oxalicum for bio-ethanol application[J]. Bioresource Technology, 2015, 188: 240-246. DOI:10.1016/j.biortech.2015.01.048 |
| [3] |
EI-Hawary FI, Mostafa YS, Laszlo E. Cellulase production and conversion of rice straw to lactic acid by simultaneous saccharification and fermentation[J]. Acta Alimentaria, 2001, 30(3): 281-295. DOI:10.1556/AAlim.30.2001.3.5 |
| [4] |
Liu BN, Li Y, Song JZ, et al. Production of single-cell protein with two-step fermentation for treatment of potato starch processing waste[J]. Cellulose, 2014, 21(5): 3637-3645. DOI:10.1007/s10570-014-0400-6 |
| [5] |
Liu DY, Wang MM, Ma L, et al. Isolation of the efficient lignocelluloses degrading microbes and decomposition of cellulose[J]. Journal of Nanjing Agricultural University, 2014, 37(6): 49-58. (in Chinese) 刘东阳, 王蒙蒙, 马磊, 等. 高效纤维素分解菌的分离筛选及其分解纤维素研究[J]. 南京农业大学学报, 2014, 37(6): 49-58. |
| [6] |
Guo HW, Chang J, Yin QQ, et al. Effect of the combined physical and chemical treatments with microbial fermentation on corn straw degradation[J]. Bioresource Technology, 2013, 148: 361-365. DOI:10.1016/j.biortech.2013.09.001 |
| [7] |
Han CL, Lay JJ, Shieh WK. Cellulosic fermentation using Bacillus thermoamylovorans-enabled digested sludge[J]. Journal of Environmental Engineering, 2015, 141(22): 06015007. |
| [8] |
Menénde E, Ramírez-Bahena MH, Fabryová A, et al. Pseudomonas coleopterorum sp. nov., a cellulose-producing bacterium isolated from the bark beetle Hylesinus fraxini[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65(9): 2852-2858. DOI:10.1099/ijs.0.000344 |
| [9] |
Poulsen HV, Willink FW, Ingvorsen K. Aerobic and anaerobic cellulase production by Cellulomonas uda[J]. Archives of Microbiology, 2016, 198(8): 725-735. DOI:10.1007/s00203-016-1230-8 |
| [10] |
Wen ZY, Liao W, Chen SL. Production of cellulase by Trichoderma reesei from dairy manure[J]. Bioresource Technology, 2005, 96(4): 491-499. DOI:10.1016/j.biortech.2004.05.021 |
| [11] |
Gusakov AV, Sinitsyn AP. Cellulases from Penicillium species for producing fuels from biomass[J]. Biofuels, 2012, 3(4): 463-477. DOI:10.4155/bfs.12.41 |
| [12] |
Kang SW, Park YS, Lee JS, et al. Production of cellulases and hemicellulases by Aspergillus niger KK2 from lignocellulosic biomass[J]. Bioresource Technology, 2004, 91(2): 153-156. DOI:10.1016/S0960-8524(03)00172-X |
| [13] |
El-Sersy NA, Abd-Elnaby H, Abou-Elela GM, et al. Optimization, economization and characterization of cellulase produced by marine Streptomyces ruber[J]. African Journal of Biotechnology, 2010, 9(38): 6355-6364. |
| [14] |
Singh A, Adsul M, Vaishnav N, et al. Improved cellulase production by Penicillium janthinellum mutant[J]. Indian Journal of Experimental Biology, 2017, 55: 436-440. |
| [15] |
Brás JLA, Cartmell A, Carvalho ALM, et al. Structural insights into a unique cellulase fold and mechanism of cellulose hydrolysis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(13): 5237-5242. DOI:10.1073/pnas.1015006108 |
| [16] |
Mu CL, Wu XS, Li SN, et al. Screening and identification of a cold-adapted cellulose-producing strains and characterization of cellulase[J]. Microbiology China, 2013, 40(7): 1193-1201. (in Chinese) 穆春雷, 武晓森, 李术娜, 等. 低温产纤维素酶菌株的筛选、鉴定及纤维素酶学性质[J]. 微生物学通报, 2013, 40(7): 1193-1201. |
| [17] |
Zhao Y. Screening and enzymology properties of cellulase-producing strains[D]. Shenyang: Master's Thesis of Shenyang Agricultural University, 2017 (in Chinese) 赵钰.产纤维素酶菌株的筛选及酶学性质研究[D].沈阳: 沈阳农业大学硕士学位论文, 2017 http://d.wanfangdata.com.cn/Thesis_Y1885188.aspx |
| [18] |
Wei JC. Fungal Identification Manual[M]. Shanghai: Shanghai Scientific and Technical Publishers, 1979. (in Chinese) 魏景超. 真菌鉴定手册[M]. 上海: 上海科学技术出版社, 1979. |
| [19] |
Shen YH, Ye DH. Flora Fungorum Sinicorum[M]. Beijing: Science Press, 2006. (in Chinese) 沈亚恒, 叶东海. 中国真菌志[M]. 北京: 科学出版社, 2006. |
| [20] |
Fan ZY. Isolation and degradation characterization of cellulose-degrading microorganisms under low temperature[D]. Hohhot: Master's Thesis of Inner Mongolia Agricultural University, 2012 (in Chinese) 樊兆阳.低温降解纤维素的微生物的分离及其降解特性分析[D].呼和浩特: 内蒙古农业大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10129-1013153698.htm |
| [21] |
Li J. Research on screening and characteristics of three frigostabile cellulose degrading strains[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2018 (in Chinese) 李健.三株耐低温纤维素降解菌的筛选及性能研究[D].哈尔滨: 东北农业大学硕士学位论文, 2018 |
| [22] |
Zhang SH, Liu XH, Liang F, et al. Screening of cryophilic cellulose-degradable bacterium and its zymological properties[J]. Journal of Microbiology, 2008, 28(4): 65-69. (in Chinese) 张淑红, 刘秀花, 梁峰, 等. 低温纤维素降解菌的筛选及其酶学性质初步研究[J]. 微生物杂志, 2008, 28(4): 65-69. |
| [23] |
Kong YL, Jia H, Wang SR, et al. Isolation, identification and characterization of a cold-adapted cellulose-degrading strain from eastern Qilian mountains[J]. Industrial Microbiology, 2014, 44(1): 60-66. (in Chinese) 孔雅丽, 贾辉, 王生荣, 等. 一株东祁连山耐低温纤维素降解菌株的分离、鉴定及产酶特性[J]. 工业微生物, 2014, 44(1): 60-66. DOI:10.3969/j.issn.1001-6678.2014.01.012 |
| [24] |
Yao LT, Ding YQ, Liu Y, et al. Screening and identification of bacteria decomposing maize straw under low temperature and their effect test[J]. Shandong Agricultural Sciences, 2008, 40(3): 85-87. (in Chinese) 姚良同, 丁延芹, 刘尧, 等. 玉米秸秆低温快速腐熟菌的筛选、鉴定及效果试验[J]. 山东农业科学, 2008, 40(3): 85-87. DOI:10.3969/j.issn.1001-4942.2008.03.025 |
| [25] |
Kang ZJ, Yuan N, Wang YY, et al. Characteristics of fungus community structure and cold-adapted cellulose-degrading strains in Zoige Plateau Wetland[J]. Chinese Journal of Soil Science, 2017, 48(4): 830-836. (in Chinese) 亢宗静, 袁楠, 王蓥燕, 等. 若尔盖高原湿地的真菌群落结构及低温纤维素降解真菌特征[J]. 土壤通报, 2017, 48(4): 830-836. |
| [26] |
Vaishnav N, Singh A, Adsul M, et al. Penicillium: The next emerging champion for cellulase production[J]. Bioresource Technology Reports, 2018, 2: 131-140. DOI:10.1016/j.biteb.2018.04.003 |
| [27] |
Dutta T, Sahoo R, Sengupta R, et al. Novel cellulases from an extremophilic filamentous fungi Penicillium citrinum: production and characterization[J]. Journal of Industrial Microbiology & Biotechnology, 2008, 35(4): 275-282. |
| [28] |
Liu YT, Luo ZY, Long CN, et al. Cellulase production in a new mutant strain of Penicillium decumbens ML-017 by solid state fermentation with rice bran[J]. New Biotechnology, 2011, 28(6): 733-737. DOI:10.1016/j.nbt.2010.12.003 |
| [29] |
Scholl AL, Menegol D, Pitarelo AP, et al. Elephant grass pretreated by steam explosion for inducing secretion of cellulases and xylanases by Penicillium echinulatum S1M29 solid-state cultivation[J]. Industrial Crops and Products, 2015, 77: 97-107. DOI:10.1016/j.indcrop.2015.08.051 |
 2019, Vol. 46
2019, Vol. 46