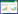扩展功能
文章信息
- 秦亚玲, 梁宗林, 宋阳, 王保军, 刘双江, 姜成英
- QIN Ya-Ling, LIANG Zong-Lin, SONG Yang, WANG Bao-Jun, LIU Shuang-Jiang, JIANG Cheng-Ying
- 高通量测序分析云南腾冲热海热泉微生物多样性
- Amplicon-based high-throughput sequencing reveals the microbial diversity in Rehai hot springs, Tengchong, Yunnan Province
- 微生物学通报, 2019, 46(10): 2482-2493
- Microbiology China, 2019, 46(10): 2482-2493
- DOI: 10.13344/j.microbiol.china.190284
-
文章历史
- 收稿日期: 2019-04-04
- 接受日期: 2019-04-24
- 网络首发日期: 2019-05-29
2. 中国科学院生态环境研究中心环境生物技术重点实验室 北京 100085;
3. 中国科学院大学 北京 100049;
4. 中国科学院环境微生物技术联合实验室 北京 100101
2. Key Laboratory of Environmental Biotechnology, Research Center for Eco-environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China;
4. IMCAS-RCEESCAS Joint-Lab of Microbial Technology for Environmental Sciences, Chinese Academy of Sciences, Beijing 100101, China
热泉(Hot spring)是全球广泛分布的一种极端环境,多分布于地壳运动活跃的板块交界处,分为陆地热泉和海底热泉。陆地热泉与早期的地球环境比较接近,其温度、pH、矿物质成分、水化学类型等自然条件呈现多态化、极端化,因此孕育着丰富且独特的极端微生物资源[1-2]。深入了解该环境中微生物多样性,探究微生物群落、微生物类群与代谢特征、极端环境微生物适应机理,不仅拓展对现有基因多样性、物种多样性、生态系统多样性的认识,而且对重构生命之树、探索早期生命起源、揭示生命与环境的协同进化机制都具有独特的贡献和意义。目前,无论是传统的纯培养方法还是基于16S rRNA基因、宏基因组、单细胞基因组测序等新一代高通量技术方法的研究结果均显示,全球范围内的地热热泉中蕴含着高丰度的未培养微生物类群[3-7],并探测到参与碳、氮、硫元素循环的重要功能基因甚至是代谢新途径[8-14]。
云南-西藏地热带是世界上最活跃的地热带之一,分布着成千上万的陆地热泉。云南省探明的温泉共有862处,腾冲热海风景区是中国最大、研究最深入的地热区[15]。近些年来,通过纯培养、分子生物学及16S rRNA基因扩增子测序等技术手段对热泉中硫化叶菌科[16]、泉古菌门[17-18]、类病毒颗粒[19]以及真菌[20-21]等的微生物多样性进行了研究[22],分析了热泉菌藻席、泉底沉积物中的微生物多样性和群落结构差异[23-24],或是通过特定的功能基因来探究功能微生物多样性[25]。酸性热泉一般pH较低,富含硫和还原型无机硫化合物,SO42-浓度高[26],独特的酸热环境中蕴藏着丰富的潜在铁、硫代谢相关的功能微生物和未知极端微生物[27]。现有的研究对酸性热泉中厚壁菌门[28]、变形菌门[29]多样性,以及铁、硫代谢功能微生物新类群及其分子代谢机制、酸性极端环境适应机制等[30-33]都有了一定程度的认识,但目前酸性热泉中还存在较大比例的未知类群,尤其是潜在的古菌,对于其中的功能微生物新类群如嗜酸热古菌的代谢机制的认识还存在较多空白。
本研究通过16S rRNA基因扩增子高通量测序技术分析腾冲热海风景区内3处热泉中微生物物种多样性及群落结构差异,旨在探索酸性热泉与其它类型热泉中的微生物组成差异以及潜在的铁、硫氧化微生物,发掘更多极端微生物新类群及功能微生物资源等,为未来极端微生物在生物冶金、煤炭生物脱硫过程中的应用以及酸性热泉中的微生物群落结构差异、生物地球化学元素循环的探究提供微生物资源和理论基础。
1 材料与方法 1.1 样品采集及环境因子测定2018年1月于云南省腾冲热海风景区采集鼓鸣泉(GMQ) (24°57′3.85″N,98°26′10.35″E)、黄瓜箐(HGQ) (24°56′28.68″N,98°26′20.49″E)和蛤蟆嘴(HMZ) (24°57′0.07″N,98°26′18.48″E)等3处热泉水样,共15个样品。利用便携手持式多参数计测定温度和pH值。用无菌采样器采取约500 mL水样于无菌广口瓶,置于干冰冰桶保存,运送至实验室进行处理。各样品用溶剂过滤器真空抽滤通过聚醚砜滤膜[34],收集微生物到无菌滤膜,用于基因组提取。采用离子色谱、ICP-OES及水质分析仪等进行阴、阳离子及元素等的测定。
1.2 主要试剂和仪器DNA提取试剂盒,QIAGEN公司;琼脂糖凝胶回收试剂盒,Omega公司;热启动HiFi高保真酶,Roche-KAPA公司。便携手持式多参数计,WTW公司;聚醚砜滤膜(Φ47 0.22 μm),PALL公司。离子色谱仪,Dionex公司;ICP-OES, PerkinElmer公司;全自动水质分析仪,Thermo Scientific公司;液相色谱,安捷伦公司;涡旋混匀仪,Scientific Incorporation公司。
1.3 样品基因组提取采用土壤DNA提取试剂盒提取样品DNA,用已灭菌的手术剪刀和镊子将收集了菌体的滤膜剪碎[35],放入PowerBead管中,后续按照试剂盒操作说明进行。利用Tris盐酸缓冲液(pH 8.0)洗脱DNA并置于-20 ℃条件下冻存,送至北京博奥汇玖生物科技有限公司完成16S rRNA基因扩增子测序。
1.4 16S rRNA基因扩增子测序对DNA样品中16S rRNA基因的V4-V5区进行扩增子测序的引物为515F (5′-GTGY CAGCMGCCGCGGTAA-3′)和926R (5′-CCGYCA ATTYMTTTRAGTTT-3′)。PCR反应体系(25 μL):2×KAPA热启动HiFi高保真酶12.5 μL,上、下游引物终浓度0.3 μmol/L,DNA模板约10 ng。PCR反应条件:95 ℃ 3 min;98 ℃ 20 s,55 ℃ 15 s,72 ℃ 15 s,25个循环;72 ℃ 1 min。PCR扩增产物经2%琼脂糖凝胶电泳后回收约440 bp (含双端分子标记)的产物条带,Qubit测定浓度并连接接头完成文库构建。检测文库片段范围和浓度后,选择Illumina HiSeq平台对文库进行测序。
1.5 测序数据分析高通量测序的原始数据(Raw data)为各样本双端序列文件,去除引物和引物中含有超过一个碱基错误的序列,采用QIIME对双端序列拼接、质控、加入样本标签、合并序列,采用Usearch V11对序列去冗余后得到62 785条序列,根据UPARSE算法对相似度≥97%的序列进行聚类形成OTU[36]并去除嵌合体,最终得到141个OTU并生成OTU表。利用RDP classifier分类器比对Silva 132 16S rRNA基因数据库,按照0.5置信度对所有OTU代表序列进行物种注释。采用QIIME对OTU表抽平后计算各分组样本的ACE、Chao1、Observed_otus、Shannon、Simpson、Simpson_e、Goods coverage等α多样性指数。采用CSS标准化方法对原始OTU表进行标准化后计算Binary_jaccard和Bray_curtis等距离矩阵用于分析样品β多样性。测序数据分析主要按照QIIME的16S rRNA基因扩增子测序分析流程进行,同时借助Usearch V11进行部分数据处理,其它数据统计及作图使用OriginLab和R。
2 结果与分析 2.1 热泉理化参数特征及16S rRNA基因序列多样性腾冲热海地热区多为硅酸盐矿物,3处热泉中硅酸盐含量普遍较高。热泉间温度范围广,pH跨度大。GMQ为碱性超高温热泉,pH 9.5,96 ℃,主要含有Na (696.68±28.16 mg/L)、Cl- (639.72± 3.68 mg/L)、K (97.65±4.05 mg/L)、NO3- (53.03± 0.64 mg/L)等;HGQ为酸性高温热泉,pH 2.5,65 ℃,主要含有SO42- (631.37±56.08 mg/L)、Cl- (80.68±0.22 mg/L)、NO3- (55.73±1.92 mg/L)、Ca (67.34±3.58 mg/L),一些金属元素含量偏高,如Al (35.74±6.32 mg/L)、Mg (14.39±2.30 mg/L)、Fe (12.41±1.29 mg/L)和Mn (1.05±0.17 mg/L)等;HMZ为中性超高温热泉,pH 7.5,86 ℃,主要含有Na (461.57±11.91 mg/L)、Cl- (389.96±1.69 mg/L)、K (66.58±2.38 mg/L)、NO3- (55.99±1.29 mg/L)等。采样信息及理化参数等见表 1。
| 样品 Sample | Temperature (℃) | pH | Ion, element concentrations (mg/L) | |||||||||||||||||
| F- | Cl- | SO42- | NH4+ | NO3- | SiO32- | Al | As | B | Ca | Fe | K | Li | Mg | Mn | Na | P | Sr | |||
| HMZ1 | 86 | 7.5 | 12.14 | 387.43 | 27.06 | 0.14 | 54.05 | 209.80 | 0.17 | 0.33 | 6.78 | 1.30 | 0.05 | 68.00 | 4.40 | 0.06 | 0.00 | 466.30 | 0.07 | 0.04 |
| HMZ2 | 11.11 | 390.06 | 27.16 | 0.14 | 57.23 | 220.00 | 0.16 | 0.33 | 7.03 | 1.35 | 0.05 | 68.72 | 4.42 | 0.10 | 0.00 | 474.70 | 0.07 | 0.05 | ||
| HMZ3 | 11.05 | 392.39 | 23.46 | 0.14 | 56.70 | 190.70 | 0.13 | 0.29 | 6.00 | 1.12 | 0.04 | 63.01 | 4.14 | 0.06 | 0.00 | 443.70 | 0.07 | 0.04 | ||
| GMQ1 | 96 | 9.5 | 18.27 | 636.07 | 32.66 | 1.21 | 52.35 | 319.00 | 0.10 | 0.92 | 10.01 | 0.75 | 0.91 | 86.24 | 6.13 | 0.06 | 0.05 | 612.70 | 0.38 | 0.08 |
| GMQ2 | 19.28 | 634.30 | 35.33 | 1.22 | 52.90 | 352.20 | 0.10 | 0.99 | 11.11 | 0.90 | 1.00 | 96.89 | 6.94 | 0.08 | 0.05 | 708.00 | 0.42 | 0.10 | ||
| GMQ3 | 18.46 | 638.63 | 35.95 | 1.22 | 52.19 | 357.60 | 0.10 | 0.99 | 11.32 | 0.92 | 1.00 | 99.26 | 6.92 | 0.05 | 0.05 | 696.20 | 0.42 | 0.10 | ||
| GMQ4 | 19.34 | 645.63 | 38.33 | 1.12 | 53.39 | 373.60 | 0.10 | 1.06 | 11.75 | 0.98 | 1.05 | 102.30 | 7.27 | 0.08 | 0.06 | 732.00 | 0.46 | 0.10 | ||
| GMQ5 | 18.02 | 644.84 | 36.24 | 1.13 | 54.57 | 355.50 | 0.09 | 0.98 | 11.29 | 0.95 | 0.98 | 101.70 | 7.12 | 0.06 | 0.05 | 714.70 | 0.43 | 0.10 | ||
| GMQ6 | 17.16 | 638.82 | 37.25 | 1.11 | 52.75 | 366.40 | 0.09 | 1.01 | 11.63 | 0.94 | 1.02 | 99.49 | 7.17 | 0.08 | 0.06 | 716.50 | 0.44 | 0.10 | ||
| HGQ1 | 65 | 2.5 | 6.11 | 80.48 | 665.80 | 0.37 | 49.97 | 218.20 | 42.14 | 0.01 | 0.13 | 71.55 | 11.65 | 22.33 | 0.02 | 15.80 | 1.18 | 15.15 | 0.00 | 0.13 |
| HGQ2 | 4.31 | 80.84 | 643.30 | 0.29 | 56.40 | 212.70 | 35.05 | 0.00 | 0.15 | 66.82 | 13.60 | 21.31 | 0.02 | 14.06 | 1.07 | 14.42 | 0.00 | 0.12 | ||
| HGQ3 | 7.54 | 80.65 | 683.40 | 0.39 | 56.71 | 212.80 | 41.60 | 0.01 | 0.18 | 69.89 | 13.62 | 22.42 | 0.02 | 16.69 | 1.22 | 15.35 | 0.00 | 0.13 | ||
| HGQ4 | 5.31 | 81.16 | 701.20 | 0.39 | 57.08 | 216.30 | 42.43 | 0.01 | 0.18 | 71.30 | 13.89 | 22.64 | 0.02 | 16.68 | 1.26 | 15.72 | 0.00 | 0.13 | ||
| HGQ5 | 3.77 | 80.71 | 550.00 | 0.23 | 57.42 | 204.10 | 26.53 | 0.02 | 0.57 | 61.64 | 10.88 | 18.09 | 0.01 | 10.62 | 0.81 | 13.25 | 0.00 | 0.11 | ||
| HGQ6 | 5.40 | 80.24 | 544.50 | 0.23 | 56.79 | 214.10 | 26.70 | 0.02 | 0.56 | 62.82 | 10.82 | 18.43 | 0.01 | 10.68 | 0.80 | 13.62 | 0.01 | 0.12 | ||
| 注:Mo、Pb、Co、Cd、Cr、Ni、V、Se、Zn、Cu、Ba等均低于检测限. Note: Mo, Pb, Co, Cd, Cr, Ni, V, Se, Zn, Cu, Ba, below detection. | ||||||||||||||||||||
3处热泉15个样品共获得606 064条16S rRNA基因序列,质控后为578 061条序列(表 2)。片段中位长度N50为372-377 bp,以97%相似度聚类形成共141个OTU,其中GMQ获得226 690条有效序列,聚类为79个OTU;HGQ获得234 416条有效序列,聚类为61个OTU;HMZ获得116 955条有效序列,聚类为58个OTU,对OTU代表序列注释后进行后续分析。文库覆盖率为99.96%-99.98%。
| 样品 Sample | 有效序列数 Sequences | OTUs | N50 | ACE | 覆盖率 Coverage (%) |
| GMQ1 | 39 748 | 55 | 376 | 60.8 | 99.97 |
| GMQ2 | 38 956 | 50 | 374 | 63.6 | 99.97 |
| GMQ3 | 40 129 | 51 | 374 | 53.5 | 99.98 |
| GMQ4 | 39 024 | 54 | 374 | 57.2 | 99.97 |
| GMQ5 | 40 153 | 54 | 374 | 55.6 | 99.97 |
| GMQ6 | 28 680 | 58 | 374 | 61.7 | 99.98 |
| HGQ1 | 39 821 | 45 | 377 | 48.3 | 99.98 |
| HGQ2 | 38 933 | 34 | 372 | 46.9 | 99.97 |
| HGQ3 | 39 465 | 43 | 377 | 45.2 | 99.98 |
| HGQ4 | 38 350 | 41 | 377 | 42.7 | 99.98 |
| HGQ5 | 37 613 | 45 | 372 | 46.4 | 99.98 |
| HGQ6 | 40 234 | 43 | 377 | 49.4 | 99.97 |
| HMZ1 | 39 377 | 50 | 372 | 48.7 | 99.97 |
| HMZ2 | 39 018 | 46 | 372 | 48.2 | 99.97 |
| HMZ3 | 38 560 | 43 | 372 | 54.5 | 99.96 |
3处热泉样品中共注释到19个门(图 1A)。碱性热泉GMQ中主要有泉古菌门(Crenarchaeota,45%)、厚壁菌门(Firmicutes,33%)、产水菌门(Aquificae,12.7%)、变形菌门(Proteobacteria,3.5%)、奇异球菌-栖热菌门(Deinococcus- Thermus,4.3%),未分类类群仅占0.28%。酸性热泉HGQ中主要有厚壁菌门(Firmicutes,39.42%)、泉古菌门(Crenarchaeota,17.8%)、变形菌门(Proteobacteria,10%)、放线菌门(Actinobacteria,1.5%)等,未分类类群高达30.7%。中性热泉HMZ中主要有厚壁菌门(Firmicutes,85.7%)、泉古菌门(Crenarchaeota,6.7%)、产水菌门(Aquificae,7%)等,未分类类群占比极低,仅占0.002%。从门水平分析,GMQ微生物多样性最高,HGQ次之,HMZ微生物多样性最低,GMQ和HMZ的物种组成比较相似。
|
| 图 1 热泉样品中门(A)和属(B)水平的物种组成 Figure 1 Distribution of microbes at phylum- (A) and genus-levels (B) in hot spring samples |
|
|
3处热泉样品中共注释到66个属(图 1B)。GMQ共注释到37个属,丰度大于3%的属为芽孢杆菌属(Bacillus,25.9%)、热棒菌属(Pyrobaculum,23.1%)、氢杆菌属(Hydrogenobacter,12.7%)、火球形菌属(Ignisphaera,10.2%)、栖热菌属(Thermus,4.3%)、嗜碱菌属(Alkaliphilus,4.1%)及喜温菌属(Caldimicrobium,3.2%)等,非培养类群及未分类类群为7.6%和0.33%。HGQ共注释到20个属,丰度大于3%的属为酸杆菌属(Acidibacillus,35.6%)、酸硫杆菌属(Acidithiobacillus,5.6%)、喜酸菌属(Acidicaldus,4.3%)、硫化芽孢杆菌属(Sulfobacillus,3.6%)、硫化叶菌属(Sulfolobus,3.2%);此外还存在具有铁氧化活性的生金球菌属(Metallosphaera,2.7%)等,非培养类群及未分类类群占比均较高,为12.4%和30.7%。HMZ共注释到32个属,丰度大于3%的属包括芽孢杆菌属(Bacillus,85.4%)、热棒菌属(Pyrobaculum,6%)、氢杆菌属(Hydrogenobacter,5.8%)等,非培养类群及未分类类群为0.33%和0.002%。从属水平分析,GMQ和HMZ的物种组成比较相近,非培养、未分类类群占比均较低,被注释程度更高,而HGQ中含有较高比例的非培养、未分类类群,未被认知程度更高。
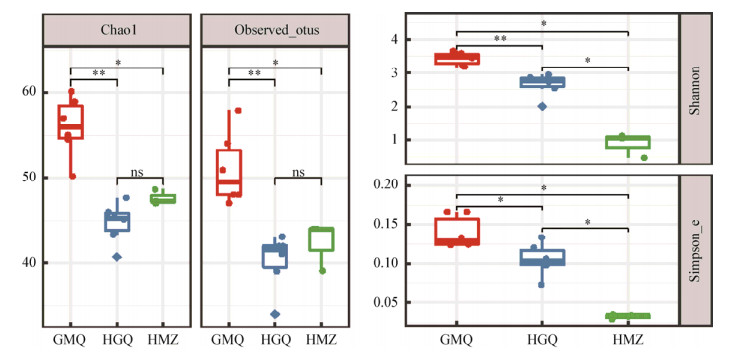
2.3 腾冲热海热泉微生物群落结构相似度分析 2.3.1 微生物组成α多样性分析3处热泉各样品的α多样性情况见图 2,箱线图中每个点代表不同样品。根据Chao1、Observed_otus等指数可以看出,3处热泉中的微生物丰富度均较低。统计结果显示,碱性热泉GMQ中微生物丰富度高于其它两处热泉(均P < 0.05),酸性热泉HGQ和中性热泉HMZ中微生物丰富度差异不显著(P > 0.05),但从箱体高低可大致认为HMZ中微生物丰富度略高于HGQ。结合Shannon多样性指数和Simpson_e均匀度指数共同分析,3处热泉间微生物的多样性具有显著差异。GMQ中微生物多样性最高,HMZ中虽然微生物丰富度较高,但是多样性却显著低于其它两处热泉。以上分析结果表明,在热泉这种极端环境中,微生物丰富度普遍较低,酸性热泉表现更为明显。碱性热泉GMQ中微生物多样性最高,酸性热泉HGQ次之,中性热泉HMZ中微生物多样性最低,主要表现为均匀度低,原因可能是少数物种在群落中具有较高的丰度,这与属水平的物种组成分析结果一致,HMZ中芽孢杆菌属(Bacillus)占比高达85.4%。
|
| 图 2 不同样品间微生物组成α多样性分析 Figure 2 α-diversity index analysis of different sample groups 注:秩和检验. ns:P > 0.05;*:P≤0.05;**:P≤0.01. Note: Wilcoxon test. ns: P > 0.05; *: P≤0.05; **: P≤0.01. |
|
|
图 3为3处热泉微生物群落结构的主坐标分析(Principal coordinate analysis,PCoA)分析结果。Bray_curtis、Binary_jaccard的分析结果均显示,3处热泉间的微生物群落结构差异显著(均P < 0.05),尤其是HGQ和GMQ间差异极为显著(均P < 0.01),各热泉中组内各样品差异较小。两种分析结果相近,表明3处热泉间群落结构差异受到各物种丰度差异的影响较小。

|
| 图 3 不同样品间微生物群落组成差异PCoA分析 Figure 3 PCoA analysis of community dissimilarities among different sample groups |
|
|
根据OTU丰度进行聚类,将高丰度、低丰度的物种模块聚集,通过颜色变化与相似程度来直观反映不同样品在属水平上群落结构的差异性和相似性,热图(图 4)能够较为直接的反映3处热泉各样品间微生物群落中物种组成相似性、差异性、物种聚类关系等情况。GMQ和HMZ在物种组成上较为相似,都含有一些超嗜热类群如热棒菌属(Pyrobaculum)、氢杆菌属(Hydrogenobacter)、栖热菌属(Thermus)、恐硫球菌属(Sulfophobococcus)、火球形菌属(Ignisphaera)、类芽孢杆菌属(Paenibacillus)、耐热球形菌属(Thermosphaera)等。GMQ中独特含有一些较低丰度的属如嗜碱菌属(Alkaliphilus)、热袍菌属(Thermotoga)、厌氧芽孢杆菌属(Anaerobacillus)、嗜氨菌属(Ammoniphilus),HMZ中独特含有一些较低丰度的属如毒弧菌属(Venenivibrio)、热丝菌属(Thermofilum)等,其非培养类群和未分类类群在3处热泉中占比最低。HGQ与其它2处热泉差异明显,主要含有一些嗜酸、硫代谢相关的属包括酸杆菌属(Acidibacillus)、酸硫杆菌属(Acidithiobacillus)、喜酸菌属(Acidicaldus)、硫化芽孢杆菌属(Sulfobacillus)、硫化叶菌属(Sulfolobus)、生金球菌属(Metallosphaera)、酸微菌属(Acidimicrobium)、脂环酸芽孢杆菌属(Alicyclobacillus)等,其中非培养类群及未分类类群在3处热泉中最高。

|
| 图 4 不同样品间微生物群落结构属水平热图分析 Figure 4 Microbial community structure (genus-level heatmap) of different sample groups |
|
|
3处热泉中主要以厚壁菌门和泉古菌门为主,尤其多样性较低的HMZ中厚壁菌门丰度高达87%。2处超高温热泉GMQ和HMZ物种组成较为相近,除含有较高丰度的产水菌门,低丰度的变形菌门(Proteobacteria)、奇异球菌-栖热菌门(Deinococcus-Thermus)和广古菌门(Euryarchaeota),还含有中性及碱性热泉生物席中常见的光合菌Cyanobacteria和绿弯菌门(Chloroflexi)等[37],未分类类群仅占0.002%和0.28%;而酸性热泉HGQ中,变形菌门(Proteobacteria)、放线菌门(Actinobacteria)丰度相对较高,但是未分类类群占比高达30.7%,全部为未分类古菌类群。
极端环境中关于厚壁菌门的研究并不充分,已有研究在HMZ中发现了种、属甚至更高分类水平的厚壁菌门新类群[28]。本研究3处热泉中厚壁菌门丰度均较高,但由于环境条件不同,厚壁菌门群落差异明显。对腾冲热泉表层沉积物、菌藻席中泉古菌的研究发现,中高温(59-77 ℃)条件下泉古菌门多样性最高[17]。本研究发现,在水体中,2处超高温热泉GMQ、HMZ的已分类泉古菌门多样性明显高于高温热泉HGQ,同时HGQ为极端酸性环境,其中未分类古菌类群占比可观,这也提供了更多对于该环境中古菌研究的参考和认知空间。与已有研究[6]类似,在超高温中性及偏碱性的2处热泉中都存在产水菌门的氢杆菌属(Hydrogenobacter),本研究在酸性高温热泉HGQ中也发现了极低丰度的该属,这可能帮助我们拓宽对于该属生存条件的已有认知。有研究在GMQ和HMZ的沉积物中发现并分离获得了放线菌门的小单孢菌属(Micromonospora)、链霉菌属(Streptomyces)、疣孢菌属(Verrucosispora)和马杜拉放线菌属(Actinomadura)等[38],但是本研究在这2处热泉的水样中却没有注释到相应的属,或许这也可以证明热泉水体中微生物是自主进化,不是来自于周边土壤[39]。HGQ中也没有注释到前期可培养研究中酸性热泉分离到的放线菌门的微球菌属(Micrococcus)、链霉菌属(Streptomyces)等[38],但是注释到低丰度的该门酸微菌属(Acidimicrobium),这为未来发掘极端环境中放线菌门物种资源、抗生素及生物活性分子等提供重要目标。
3.2 功能微生物组成多样性我国腾冲热泉中砷氧化微生物的探究表明,虽然腾冲热泉中砷含量低于西藏热泉,也低于美国黄石国家公园热泉等,但确实存在砷氧化微生物。随着热泉温度升高,虽然砷氧化微生物丰度降低,但多样性随之升高,主要集中于奇异球菌-栖热菌门(Deinococcus-Thermus)、α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)和绿弯菌门(Choloroflexi)中[40]。本研究中超高温热泉GMQ,砷含量(0.99±0.03 mg/L)相对较高,其中含有的变形菌门(Proteobacteria,3.5%)、奇异球菌-栖热菌门(Deinococcus-Thermus,4.3%)、绿弯菌门(Chloroflexi,0.02%)等低丰度微生物均有可能对该环境中砷氧化微生物的探究提供重要参考。
有关热泉沉积物、菌藻席或泉华等的相关研究发现,在热泉复杂的自然条件下(66-96 ℃,pH 4.3-9.0)均有氨氧化、碳固定新途径相关基因的存在及表达,部分碳固定相关基因和脱硫球菌目(Desulfurococcales)存在一定的关联性,并且推测氨氧化古菌可能通过有氧氨氧化及CO2固定新途径获取能量进行生长[11, 41]。本研究中注释到较高丰度的该目成员,碱性热泉GMQ中含有火球形菌属(Ignisphaera)、恐硫球菌属(Sulfophobococcus),中性热泉HMZ中含有恐硫球菌属(Sulfophobococcus)、火球形菌属(Ignisphaera)和耐热球形菌属(Thermosphaera)。关于热泉水体与沉积物、菌藻席、泉华中的该目成员是否存在前述碳固定新途径,热泉中的极端微生物是否蕴含着更多特殊代谢能力尚未见报道。
酸性热泉中分离到的铁、硫代谢相关极端微生物,尤其是古菌等由于其嗜酸嗜热的特性,在生物湿法冶金、煤炭生物脱硫等方面均具有常规环境微生物无法比拟的优势[42-43]。酸性热泉HGQ中注释到的优势属酸杆菌属(Acidibacillus)、酸硫杆菌属(Acidithiobacillus)、喜酸菌属(Acidicaldus)、硫化芽孢杆菌属(Sulfobacillus)、硫化叶菌属(Sulfolobus)以及生金球菌属(Metallosphaera)等均具有铁、硫代谢相关能力,该环境中SO42-、Mn2+、Fe2+、Mg2+等含量均较高,水体中富含含硫化合物,所以我们推测该环境中硫氧化微生物氧化还原型硫化合物生成硫酸盐的过程致使pH降低造成酸性环境。从属水平来看,HGQ中非培养类群及未分类类群占比高达12.4%和30.7%,几乎全部为古菌,它们是否与该环境中上述微生物类群相似,具有铁、硫代谢功能尚属未知,本研究对于未来发掘铁、硫代谢功能极端环境微生物资源提供了数据基础。
本研究表明,酸性热泉HGQ中蕴含着丰富的微生物资源及潜在的硫氧化微生物资源,因此我们通过传统的纯培养方法对该环境水体样品进行了微生物多样性的进一步探究。目前获得了厚壁菌门、变形菌门、放线菌门和泉古菌门中已分类类群7个属的菌种,包括脂环酸芽孢杆菌属(Alicyclobacillus)、硫化芽孢杆菌属(Sulfobacillus)、酸硫杆菌属(Acidithiobacillus)、酸土单孢菌属(Aciditerrimonas)、链霉菌属(Streptomyces)、生金球菌属(Metallosphaera)、硫化叶菌属(Sulfolobus)等属内成员,此外还分离得到3个潜在新种、6个潜在新属等未分类新类群,与相关菌群的相似性在85.5%-98.6%,关于新类群的生理生化特性及硫氧化功能探究将在后续研究中进行。
4 结论本研究利用高通量测序技术探究云南腾冲热海3处热泉微生物多样性及其群落结构组成差异,研究发现,腾冲热海热泉水体中蕴含丰富的微生物资源,热泉间微生物物种随环境条件不同组成差异明显,其中酸性热泉中存在多种具有潜在铁、硫代谢功能的菌种,非培养类群、未分类类群丰度很高,尤其是蕴藏着可观的古菌资源。本研究为微生物菌种资源的培养获得及功能认识提供了数据基础。
| [1] |
Hedlund BP, Murugapiran SK, Alba TW, et al. Uncultivated thermophiles: current status and spotlight on 'Aigarchaeota'[J]. Current Opinion in Microbiology, 2015, 25: 136-145. DOI:10.1016/j.mib.2015.06.008 |
| [2] |
Segerer AH, Burggraf S, Fiala G, et al. Life in hot springs and hydrothermal vents[J]. Origins of Life and Evolution of the Biosphere, 1993, 23(1): 77-90. |
| [3] |
Sakai HD, Kurosawa N. Saccharolobus caldissimus gen. nov., sp. nov., a facultatively anaerobic iron-reducing hyperthermophilic archaeon isolated from an acidic terrestrial hot spring, and reclassification of Sulfolobus solfataricus as Saccharolobus solfataricus comb. nov. and Sulfolobus shibatae as Saccharolobus shibatae comb. nov.[J]. International Journal of Systematic and Evolutionary Microbiology, 2018, 68(4): 1271-1278. DOI:10.1099/ijsem.0.002665 |
| [4] |
Sharp CE, Brady AL, Sharp GH, et al. Humboldt's spa: microbial diversity is controlled by temperature in geothermal environments[J]. The ISME Journal, 2014, 8(6): 1166-1174. DOI:10.1038/ismej.2013.237 |
| [5] |
de León KB, Gerlach R, Peyton BM, et al. Archaeal and bacterial communities in three alkaline hot springs in Heart Lake Geyser Basin, Yellowstone National Park[J]. Frontiers in Microbiology, 2013, 4: 330. |
| [6] |
Hou WG, Wang S, Dong HL, et al. A comprehensive census of microbial diversity in hot springs of Tengchong, Yunnan Province China using 16S rRNA gene pyrosequencing[J]. PLoS One, 2013, 8(1): e53350. DOI:10.1371/journal.pone.0053350 |
| [7] |
Eloe-Fadrosh EA, Paez-Espino D, Jarett J, et al. Global metagenomic survey reveals a new bacterial candidate phylum in geothermal springs[J]. Nature Communications, 2016, 7: 10476. DOI:10.1038/ncomms10476 |
| [8] |
Li HZ, Yang QH, Li J, et al. The impact of temperature on microbial diversity and AOA activity in the Tengchong Geothermal Field, China[J]. Scientific Reports, 2015, 5: 17056. DOI:10.1038/srep17056 |
| [9] |
Whitaker RJ, Grogan DW, Taylor JW. Geographic barriers isolate endemic populations of hyperthermophilic archaea[J]. Science, 2003, 301(5635): 976-978. DOI:10.1126/science.1086909 |
| [10] |
Zhang CL, Ye Q, Huang ZY, et al. Global occurrence of archaeal amoA genes in terrestrial hot springs[J]. Applied and Environmental Microbiology, 2008, 74(20): 6417-6426. DOI:10.1128/AEM.00843-08 |
| [11] |
Song ZQ, Wang L, Wang FP, et al. Abundance and diversity of archaeal accA gene in hot springs in Yunnan Province, China[J]. Extremophiles, 2013, 17(5): 871-879. DOI:10.1007/s00792-013-0570-4 |
| [12] |
Hua ZS, Qu YN, Zhu QY, et al. Genomic inference of the metabolism and evolution of the archaeal phylum Aigarchaeota[J]. Nature Communications, 2018, 9(1): 2832. DOI:10.1038/s41467-018-05284-4 |
| [13] |
Mall A, Sobotta J, Huber C, et al. Reversibility of citrate synthase allows autotrophic growth of a thermophilic bacterium[J]. Science, 2018, 359(6375): 563-567. DOI:10.1126/science.aao2410 |
| [14] |
Nunoura T, Chikaraishi Y, Izaki R, et al. A primordial and reversible TCA cycle in a facultatively chemolithoautotrophic thermophile[J]. Science, 2018, 359(6375): 559-563. DOI:10.1126/science.aao3407 |
| [15] |
Hedlund BP, Cole JK, Williams AJ, et al. A review of the microbiology of the Rehai geothermal field in Tengchong, Yunnan Province, China[J]. Geoscience Frontiers, 2012, 3(3): 273-288. DOI:10.1016/j.gsf.2011.12.006 |
| [16] |
Han J, Chen B, Dai X, et al. Diversity of thermoacidophilic Sulfolobus in hot springs in Tengchong of Yunnan, China[J]. Chinese Journal of Applied and Environmental Biology, 2010, 16(5): 692-696. (in Chinese) 韩剑, 陈波, 戴欣, 等. 云南腾冲热泉极端嗜酸热硫化叶菌多样性研究[J]. 应用与环境生物学报, 2010, 16(5): 692-696. |
| [17] |
Song ZQ, Chen JQ, Jiang HC, et al. Diversity of crenarchaeota in terrestrial hot springs in Tengchong, China[J]. Extremophiles, 2010, 14(3): 287-296. DOI:10.1007/s00792-010-0307-6 |
| [18] |
Song ZQ, Chen JQ, Zhi XY, et al. Crenarchaeal diversity and phylogenetic analysis of two hot springs in Tengchong[J]. Microbiology China, 2008, 35(3): 372-377. (in Chinese) 宋兆齐, 陈经全, 职晓阳, 等. 腾冲两热泉泉古菌多样性及系统发育的初步分析[J]. 微生物学通报, 2008, 35(3): 372-377. DOI:10.3969/j.issn.0253-2654.2008.03.011 |
| [19] |
Dang YF, Chen B, Zhang Q, et al. Diversity of virus-like particles from high-temperature acidic hot springs in Tengchong Rehai, China[J]. Chinese Journal of Applied and Environmental Biology, 2012, 18(2): 256-261. (in Chinese) 党亚锋, 陈波, 张琦, 等. 腾冲热海高温酸性热泉类病毒颗粒多样性[J]. 应用与环境生物学报, 2012, 18(2): 256-261. |
| [20] |
Liu KH, Ding XW, Salam N, et al. Unexpected fungal communities in the Rehai thermal springs of Tengchong influenced by abiotic factors[J]. Extremophiles, 2018, 22(3): 525-535. DOI:10.1007/s00792-018-1014-y |
| [21] |
Liu KH, Ding XW, Zhang B, et al. High-throughput sequencing to reveal fungal diversity in hot springs of Rehai at Tengchong in Yunnan[J]. Acta Microbiologica Sinica, 2017, 57(9): 1314-1322. (in Chinese) 刘开辉, 丁小维, 张波, 等. 高通量测序分析云南腾冲热海热泉真菌多样性[J]. 微生物学报, 2017, 57(9): 1314-1322. |
| [22] |
Wang T, Chai LH, Cui XL, et al. Analytical study on five 16S rDNA clones that come from hot spring in Tengchong with a culture-independent approach[J]. Journal of Yunnan University (Natural Sciences Edition), 2003, 25(1): 73-76. (in Chinese) 王涛, 柴丽红, 崔晓龙, 等. 从腾冲热海免培养获得的5个16S rDNA克隆分析[J]. 云南大学学报:自然科学版, 2003, 25(1): 73-76. |
| [23] |
Li QY, Cui XL, Zhang DH, et al. Studies on the bacterial diversities of the hot springs at Tengchong Rehai in Yunnan Province China[J]. Microbiology China, 2004, 31(5): 49-54. (in Chinese) 李沁元, 崔晓龙, 张东华, 等. 云南腾冲热海三热泉细菌多样性的研究[J]. 微生物学通报, 2004, 31(5): 49-54. DOI:10.3969/j.issn.0253-2654.2004.05.011 |
| [24] |
Li QY, Cui XL, Zhang DH, et al. Bacterial diversities of microbial mats in two hot springs in Tengchong Rehai of Yunnan[J]. Acta Microbiologica Sinica, 2004, 44(4): 431-435. (in Chinese) 李沁元, 崔晓龙, 张东华, 等. 云南腾冲热海两热泉菌藻席细菌多样性的研究[J]. 微生物学报, 2004, 44(4): 431-435. DOI:10.3321/j.issn:0001-6209.2004.04.005 |
| [25] |
Feng C, Yang J, Jiang HC. Diversity and distribution of nitrogen-fixing bacteria in two geothermal channels in Tengchong geothermal zone, Yunnan Province[J]. Earth Science, 2018, 43(S1): 10-18. (in Chinese) 冯灿, 杨渐, 蒋宏忱. 云南腾冲两条热泉溪流的固氮细菌群落多样性[J]. 地球科学, 2018, 43(S1): 10-18. |
| [26] |
Brock TD. Bimodal distribution of pH values of thermal springs of the world[J]. Geological Society of America Bulletin, 1971, 82(5): 1393-1394. DOI:10.1130/0016-7606(1971)82[1393:BDOPVO]2.0.CO;2 |
| [27] |
Jay ZJ, Beam JP, Dlakić M, et al. Marsarchaeota are an aerobic archaeal lineage abundant in geothermal iron oxide microbial mats[J]. Nature Microbiology, 2018, 3(6): 732-740. DOI:10.1038/s41564-018-0163-1 |
| [28] |
Song ZQ, Wang L, Liu XH, et al. Diversities of Firmicutes in four hot springs in Yunnan and Tibet[J]. Biotechnology, 2015, 25(5): 481-486. (in Chinese) 宋兆齐, 王莉, 刘秀花, 等. 云南和西藏四处热泉中的厚壁菌门多样性[J]. 生物技术, 2015, 25(5): 481-486. |
| [29] |
Song ZQ, Wang L, Liu XH, et al. The diversities of Proteobacteria in four acidic hot springs in Yunnan[J]. Journal of Henan Agricultural University, 2016, 50(3): 376-382. (in Chinese) 宋兆齐, 王莉, 刘秀花, 等. 云南4处酸性热泉中的变形菌门细菌多样性[J]. 河南农业大学学报, 2016, 50(3): 376-382. |
| [30] |
Jiang CY, Liu LJ, Guo X, et al. Resolution of carbon metabolism and sulfur-oxidation pathways of Metallosphaera cuprina Ar-4 via comparative proteomics[J]. Journal of Proteomics, 2014, 109: 276-289. DOI:10.1016/j.jprot.2014.07.004 |
| [31] |
Liu LJ, You XY, Zheng HJ, et al. Complete genome sequence of Metallosphaera cuprina, a metal sulfide-oxidizing archaeon from a hot spring[J]. Journal of Bacteriology, 2011, 193(13): 3387-3388. DOI:10.1128/JB.05038-11 |
| [32] |
Peng TJ, Liu LJ, Liu C, et al. Metallosphaera tengchongensis sp. nov., an acidothermophilic archaeon isolated from a hot spring[J]. International Journal of Systematic and Evolutionary Microbiology, 2015, 65: 537-542. DOI:10.1099/ijs.0.070870-0 |
| [33] |
You XY, Zhang QM, Zheng HJ, et al. Adaptation of Acidianus hospitalis W1 to oligotrophic and acidic hot spring environments[J]. Acta Microbiologica Sinica, 2014, 54(10): 1193-1203. (in Chinese) 尤晓颜, 张巧明, 郑华军, 等. 好客嗜酸两面菌W1寡营养酸性热泉环境的适应机制[J]. 微生物学报, 2014, 54(10): 1193-1203. |
| [34] |
Fuhrman JA, Comeau DE, Hagstr m , et al. Extraction from natural planktonic microorganisms of DNA suitable for molecular biological studies[J]. Applied and Environmental Microbiology, 1988, 54(6): 1426-1429. |
| [35] |
Hobbie JE, Daley RJ, Jasper S. Use of nuclepore filters for counting bacteria by fluorescence microscopy[J]. Applied and Environmental Microbiology, 1977, 33(5): 1225-1228. |
| [36] |
Edgar RC. UPARSE: highly accurate OTU sequences from microbial amplicon reads[J]. Nature Methods, 2013, 10(10): 996-998. DOI:10.1038/nmeth.2604 |
| [37] |
Liu ZF, Klatt CG, Wood JM, et al. Metatranscriptomic analyses of chlorophototrophs of a hot-spring microbial mat[J]. The ISME Journal, 2011, 5(8): 1279-1290. DOI:10.1038/ismej.2011.37 |
| [38] |
Liu L, Salam N, Jiao JY, et al. Diversity of culturable thermophilic Actinobacteria in hot springs in Tengchong, China and studies of their biosynthetic gene profiles[J]. Microbial Ecology, 2016, 72(1): 150-162. DOI:10.1007/s00248-016-0756-2 |
| [39] |
Boyd ES, Hamilton TL, Wang JX, et al. The role of tetraether lipid composition in the adaptation of thermophilic archaea to acidity[J]. Frontiers in Microbiology, 2013, 4: 62. |
| [40] |
Wu G, Jiang HC, Dong HL, et al. Distribution of arsenite-oxidizing bacteria and its correlation with temperature in hot springs of the Tibetan-Yunnan Geothermal Zone in Western China[J]. Geomicrobiology Journal, 2015, 32(6): 482-493. DOI:10.1080/01490451.2014.938206 |
| [41] |
Jiang HC, Huang QY, Dong HL, et al. RNA-based investigation of ammonia-oxidizing archaea in hot springs of Yunnan Province, China[J]. Applied and Environmental Microbiology, 2010, 76(13): 4538-4541. DOI:10.1128/AEM.00143-10 |
| [42] |
Liu LJ, You XY, Guo X, et al. Metallosphaera cuprina sp. nov., an acidothermophilic, metal-mobilizing archaeon[J]. International Journal of Systematic and Evolutionary Microbiology, 2011, 61: 2395-2400. DOI:10.1099/ijs.0.026591-0 |
| [43] |
Zhu W, Xia JL, Yang Y, et al. Sulfur oxidation activities of pure and mixed thermophiles and sulfur speciation in bioleaching of chalcopyrite[J]. Bioresource Technology, 2011, 102(4): 3877-3882. DOI:10.1016/j.biortech.2010.11.090 |
 2019, Vol. 46
2019, Vol. 46