扩展功能
文章信息
- 陈慧, 曹曦, 王鑫彤, 张菲, 王乐, 郭雷
- CHEN Hui, CAO Xi, WANG Xin-Tong, ZHANG Fei, WANG Le, GUO Lei
- 具有抗哈维氏弧菌活性共生真菌HLZ-3菌株的筛选、鉴定及其培养条件
- Screening, identification and culture conditions of symbiotic fungus HLZ-3 with antibacterial activity against Vibrio harveyi
- 微生物学通报, 2019, 46(10): 2475-2481
- Microbiology China, 2019, 46(10): 2475-2481
- DOI: 10.13344/j.microbiol.china.180818
-
文章历史
- 收稿日期: 2018-10-19
- 接受日期: 2018-12-12
- 网络首发日期: 2018-12-29
2. 江苏省海洋资源开发研究院 江苏 连云港 222005
2. Marine Resources Development Institute of Jiangsu, Lianyungang, Jiangsu 222005, China
共生(Symbiosis)一词最早是于19世纪由德国的一名外科医生Anton de Bary提出,意为两种不同生物之间密切的相互联系[1],这种联系对生物多样性的产生和维持具有重要作用。共生微生物因其与宿主之间在长期的共同进化中建立了稳定的互惠共生关系,往往拥有特殊的代谢途径,有可能产生对其自身及宿主具有重要作用的次生代谢产物[2]。
哈维氏弧菌(Vibrio harveyi),又称哈氏弧菌,是海水养殖中常见的致病菌之一[3]。鱼、虾、贝等海水经济养殖动物感染该菌后会引起体表充血、皮肤溃疡、尾鳍烂蚀等,死亡率很高,往往给养殖业造成巨大的经济损失。该菌对虾的危害十分严重,曾引起印度尼西亚、澳大利亚、泰国、印度、台湾及菲律宾的对虾育苗场斑节对虾幼体的大量死亡[4-5]。目前,海水养殖业中主要利用抗生素来防治哈维氏弧菌等病原菌,但抗生素的长期应用或滥用导致了耐药菌株的产生,使抗生素的疗效愈发不理想,并且变异病原菌往往会引起更为严重的疾病。此外,抗生素在水产品中的残留也直接威胁着人类的健康与安全[6-7]。因此,除通过调整养殖结构和养殖模式、选择优良水产动物幼苗和重视防病模式等综合防治措施外,开发新的水产用抗菌剂或抗生素的替代品迫在眉睫。
目前抗生素替代品的开发主要有以下方面:精油、植物提取物、噬菌体、益生菌和微生物次生代谢产物等[8-12]。本研究从海水养殖动物中分离共生微生物(真菌和细菌),利用水产病原哈维氏弧菌为目标菌株,测定真菌和细菌的发酵液抗哈维氏弧菌的活性,以期筛选得到具有较好抗哈维氏弧菌的活性菌株,鉴定活性菌株的种类并确定其合成抗菌活性物质的培养条件,为进一步分离纯化其抗菌活性成分提供依据。
1 材料与方法 1.1 材料 1.1.1 样品海蚌、白虾、刀鱼、花蛤、花蚬、海蛎子、牡蛎、虾婆、扇贝等9种海水养殖动物,购自连云港当地海鲜市场。
1.1.2 指示菌株哈维氏弧菌(Vibrio harveyi CGMCC 1.8690),购自中国普通微生物菌株保藏管理中心,由本实验室保存。
1.1.3 培养基真菌分离培养基为沙氏固体培养基(SDA,g/L):葡萄糖40.0,蛋白胨10.0,琼脂15.0;细菌分离培养基为2216E培养基(g/L):蛋白胨5.0,酵母膏1.0,琼脂15.0;均用陈海水配制。种子液培养基为沙氏液体培养基;菌种鉴定培养基为沙氏固体培养基;指示菌株培养基为牛肉膏蛋白胨培养基(g/L):蛋白胨10.0,牛肉膏3.0,琼脂15.0,用陈海水配制。
1.1.4 主要试剂和仪器葡萄糖、蛋白胨、酵母膏、琼脂、甲醇、乙酸乙酯,国药集团化学制剂有限公司。Shim-Pack CLC-ODS柱(6.0 mm×150 mm),岛津公司;电子分析天平,北京赛多利斯仪器系统有限公司;电热恒温鼓风干燥箱,上海一恒科技有限公司;全自动立式压力蒸汽灭菌锅,上海博讯实业有限公司;旋转蒸发仪,上海青浦沪西仪器厂;全温恒温摇床,上海彦承实业有限公司;高效液相色谱仪,赛默飞世尔(中国)有限公司。
1.2 微生物的分离采取稀释涂布平板法分离微生物。用无菌水将9种鱼虾贝类样品的表面冲洗干净,再用无菌剪刀将其剪碎。将剪碎的样品1 g用无菌水稀释10倍后分别涂布于沙氏固体和2216E培养基平板上,置于32 ℃恒温培养箱中培养。每天观察菌落生长情况,挑取各样品形态各异的菌落进行稀释涂布平板法纯化,纯化的菌株接种于相应的斜面培养基,4 ℃保存备用。
1.3 抗菌活性微生物菌株的筛选将上述4 ℃保存的真菌菌株接种于沙氏液体培养基,28 ℃、160 r/min摇床培养7 d;细菌菌株接种于2216E液体培养基,于37 ℃、160 r/min摇床培养2 d。分别取5 mL发酵液59 kHz超声破碎2 min,10 000 r/min离心10 min,上清液作为待测样品。以哈维氏弧菌为指示菌株,利用牛津杯法对上述所得待测液进行抗菌活性测定,筛选具有抗哈维氏弧菌活性的菌株。
1.4 抗菌活性的测定将冷却至50 ℃左右的沙氏固体培养基和2216E培养基15 mL分别倒入90 mm直径的培养皿中,置于室温30 min凝固后,加入100 μL的(1-2)×106个/mL哈维氏弧菌悬液涂布均匀。放入牛津杯(外径约8.0 mm),用移液器分别加入待测样品200 μL,每个样品分别做2个平行,32 ℃培养24 h后,用电子卡尺测定抑菌圈的直径,以抑菌圈直径的平均值作为待测样品的抗菌活性(mm)[13],以0.1 mg/mL的硫酸链霉素作为阳性对照。
1.5 菌株HLZ-3的鉴定 1.5.1 形态特征[14]将纯化的HLZ-3菌株接种于沙氏固体培养基平板上,28 ℃培养3-7 d,观察并描述菌落的培养特征;挑取少许健壮的菌体置于干净载玻片上的石炭酸棉兰液滴中染色,用显微镜观察其分生孢子囊特征;将菌种在SDA固体培养基上进行划线培养,并将盖玻片以45°的角度插入培养基中,在28 ℃的条件下培养7 d,然后获得带有菌丝体的玻璃盖玻片,用日立H-7650扫描电子显微镜下观察其分生孢子特征。
1.5.2 ITS序列分析[15]将HLZ-3菌株接种于沙氏固体培养基平板上,28 ℃培养7 d后,送交北京三博远志生物科技有限公司进行ITS序列分析。将测得的ITS序列提交到GenBank中,依次采用BLAST软件搜索相似序列、ClustalX (V1.83)软件对高同源序列进行多序列联配分析、MEGA 4.0软件中的Neighbor-Joining (N-J)法构建系统发育树,自展次数设置为1 000次。
1.6 菌株HLZ-3产抗菌活性物质的培养条件 1.6.1 种子液制备将HLZ-3菌株接种于沙氏斜面培养基,28 ℃培养3-4 d,挑取活化的菌株接种于装有100 mL沙氏液体培养基的250 mL锥形瓶中,28 ℃、160 r/min摇床培养24 h后作为种子液备用。
1.6.2 发酵培养基筛选按1% (体积比)的比例将制备的种子液分别加入到灭菌后的寡营养培养基[SWS (g/L):淀粉10.0,蛋白胨1.0]、沙氏液体培养基[SD (g/L):葡萄糖40.0,蛋白胨10.0]、改良沙氏液体培养基[MSD (g/L):葡萄糖30.0,蛋白胨10.0,CaCl2 0.5,MgSO4·7H2O 0.5]、真菌5号培养基[(g/L):葡萄糖10.0,麦芽糖20.0,味精10.0,酵母浸膏3.0,K2HPO4 0.5,MgSO4·7H2O 0.3]、大米培养基(50 g大米加入100 mL陈海水,浸泡5-6 h后,将水倒掉,再加入100 mL陈海水)中,大米培养基在28 ℃静置培养2周,其他4种培养基在28 ℃、160 r/min摇床培养7 d。以上培养基均用陈海水配制。发酵产物用等量乙酸乙酯萃取3次,合并3次乙酸乙酯萃取液,减压浓缩蒸发和冷冻干燥得活性浸膏。将各浸膏以甲醇溶解至10 mg/mL,利用1.4方法测定其对哈维氏弧菌的抑菌活性,平行3次,活性大小以抑菌圈直径的平均值(mm)表示。菌株次生代谢产物的多样性利用高效液相色谱(HPLC)进行分析。
1.6.3 HPLC分析[16]通过HPLC指纹图谱考察菌株次生代谢产物的化学多样性。柱系统:Shim-Pack CLC-ODS柱,样品浓度为10 mg/mL(甲醇为溶剂),进样量为20 μL,检测波长254 nm。洗脱方式:甲醇/水混合溶剂梯度洗脱,在0-20 min内甲醇浓度从10%变化到100%。
1.6.4 培养基盐度的筛选在确定发酵培养基的基础上,按1% (体积比)的比例将制备的种子液分别加入到用蒸馏水配制的含有0-5%NaCl的培养基中,并用陈海水作为对照,按1.6.2中的方法对菌株HLZ-3进行培养,并对其发酵产物的活性浸膏进行抑菌活性检测。
2 结果 2.1 微生物的分离及筛选 2.1.1 微生物分离从海蚌、白虾、刀鱼、花蛤、花蚬、海蛎子、牡蛎、虾婆、扇贝等9种鱼虾贝类样品中共分离得到52株微生物,其中真菌30株、细菌22株。
2.1.2 抗菌活性菌株筛选筛选时选择0.1 mg/mL的硫酸链霉素作为阳性对照,该浓度下硫酸链霉素对哈维氏弧菌的抑菌圈直径为19.80±0.99 mm,将抑菌圈直径大于或等于20.0 mm的菌株视为活性菌株。22株细菌对哈维氏弧菌抑菌圈的直径均小于10.0 mm,鉴于牛津杯的外径约为8.0 mm,可将这些样品视为基本没活性。具有抗哈维氏弧菌活性的真菌菌株见表 1,由表 1可知HB-1、HB-2、DY-1、HG-3、HG-4等11株菌株的抑菌圈大于20.0 mm,活性较大,因此将这11株真菌菌株进行复筛。
| 样品来源 Source of sample | 菌株编号 Number of strain | 抑菌圈 Inhibition zone (X, n=2, mm) |
| 海蚌 Mussels | HB-1 | 23.65 |
| HB-2 | 20.35 | |
| 白虾 White shrimp | BX-1 | 19.76 |
| BX-2 | 19.19 | |
| 刀鱼 Coiliaspp | DY-1 | 22.19 |
| 花蛤 Clam | HG-3 | 25.16 |
| HG-4 | 22.02 | |
| HG-5 | 21.12 | |
| HG-6 | 22.93 | |
| 花蚬 Cyrenodonax formosanus | HX-2 | 20.64 |
| HX-3 | 19.35 | |
| 海蛎子 Oyster | HLZ-2 | 19.03 |
| HLZ-3 | 22.14 | |
| 牡蛎 Shellfish | ML-1 | 18.35 |
| ML-3 | 23.11 | |
| 虾婆 Mantis shrimp | XP-1 | 20.69 |
| XP-2 | 18.99 | |
| 扇贝 Scallop | SB-3 | 19.47 |
复筛后,上述11株真菌菌株对哈维氏弧菌的抑菌效果见表 2,由表 2可知,抑菌圈直径稳定在20.0 mm以上的菌株有2株,分别为来自海蛎子的HLZ-3和牡蛎的ML-3菌株。本研究首先对海蛎子共生真菌HLZ-3菌株进行了鉴定,并筛选其合成抗菌活性物质的培养条件(ML-3菌株有待进一步研究)。
| 样品来源 Source of sample | 菌株编号 Number of strain | 抑菌圈 Inhibition zone (X±SD, n=3, mm) |
| 海蚌 Mussels | HB-1 | 16.07±0.53 |
| HB-2 | 15.33±1.26 | |
| 刀鱼 Coiliaspp | DY | 14.50±0.72 |
| 花蛤 Clam | HG-3 | 16.73±0.59 |
| HG-4 | 16.12±0.71 | |
| HG-5 | 16.96±0.12 | |
| HG-6 | 16.64±0.09 | |
| 花蚬 Cyrenodonax formosanus | HX-2 | 16.73±0.75 |
| 海蛎子 Oyster | HLZ-3 | 22.94±3.28 |
| 牡蛎 Shellfish | ML-3 | 20.08±3.69 |
| 虾婆 Mantis shrimp | XP-1 | 14.36±0.75 |
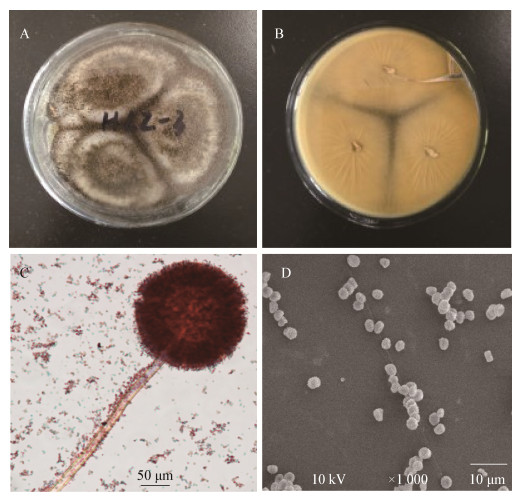
菌株HLZ-3在沙氏琼脂培养基上28 ℃培养7 d后,直径可达65 mm-70 mm,质地呈丝绒状;菌丝初生时为白色,逐渐变为棕黑色,菌落反面黄褐色(图 1A、1B);在光学及扫描电子显微镜下,分生孢子头呈球形,顶囊膨大,顶囊上具有放射状密的两轮小柄,分生孢子呈球形,直径约4 μm,表面不光滑(图 1C、1D)。参考相关文献[17],可初步鉴定菌株HLZ-3为曲霉属黑色组曲霉。
|
| 图 1 菌株HLZ-3的形态特征 Figure 1 Morphological characters of strain HLZ-3 注:A:菌落特征(正面);B:菌落特征(背面);C:分生孢子梗;D:分生孢子. Note: A: Colony (Front); B: Colony (Back); C: Conidiphore; D: Conidia. |
|
|
菌株HLZ-3的ITS序列全长595 bp (GenBank中的序列号为MH982281),经BLASTn分析,该序列与曲霉属真菌的ITS序列具有很高的相似性,其中与菌株Aspergillus tubingensis FEC 98和A. tubingensis F33-01 (序列号分别为KM386437.1和KX664374.1)的ITS序列相似性为99%,在以N-J法构建的系统发育树上聚为同一簇群(图 2)。结合形态学特征,将HLZ-3菌株鉴定为塔宾曲霉Aspergillus tubingensis。

|
| 图 2 菌株HLZ-3基于ITS序列的系统发育分析 Figure 2 Polymeric analysis of strain HLZ-3 based on ITS sequence 注:括号中的序号代表菌株的GenBank登录号;分支点上的数字代表计算1 000次聚类到一起的几率;刻度0.1表示序列偏差值. Note: The sequence number in the bracket means the GenBank accession number of the strain; The number at the node means the percentage of occurrence in 1 000 bootstrap trees; The scale bar represents 0.1 substitutions per nucleotide position. |
|
|
塔宾曲霉HLZ-3菌株分别在寡营养培养基、沙氏培养基、改良沙氏培养基、真菌5号培养基和大米培养基上培养后,发酵产物的乙酸乙酯提取物对哈维氏弧菌的抑菌活性见表 3,可以看出大米培养基的培养效果最好。HPLC指纹图谱显示大米培养基的培养产物具有系列吸收峰(图 3),化学多样性丰富,分离出活性化合物的可能性较大,因此选择大米培养基为菌株HLZ-3合成抗哈维氏弧菌活性次生代谢产物的培养基。
| 培养基 Medium type | 抑菌圈 Inhibition zone (X±SD, n=3, mm) |
| 寡营养培养基 Oligotrophic medium | 16.99±0.53 |
| 沙氏培养基 Sabouraud medium | 13.60±0.33 |
| 改良沙氏培养基 Modified sabouraud medium | 16.53±0.76 |
| 真菌5号培养基 Fungal No.5 medium | 12.11±0.78 |
| 大米培养基 Rice medium | 19.59±0.32 |

|
| 图 3 菌株HLZ-3大米培养基发酵产物乙酸乙酯提取物的HPLC指纹图 Figure 3 HPLC finger-print map of ethyl acetate extracts of strain HLZ-3 in rice medium |
|
|
盐度筛选的实验结果见表 4,当培养基盐度为4% NaCl时,菌株HLZ-3发酵产物乙酸乙酯提取物的抗菌活性物质最为明显,HPLC指纹图谱显示其化学多样性没有改变,所以将陈海水用4% NaCl的水溶液取代。因此确定最适合HLZ-3菌株产生抗菌活性物质的培养条件为:4% NaCl的大米培养基,28 ℃静置培养2周。
| NaCl浓度 Salinity of NaCl (%) | 抑菌圈 Inhibition zone (X±SD, n=3, mm) |
| 0 | 15.54±1.01 |
| 1 | 14.18±1.03 |
| 2 | 13.65±1.49 |
| 3 | 13.18±1.94 |
| 4 | 22.53±5.46 |
| 5 | 13.64±0.58 |
| Control | 13.22±1.99 |
塔宾曲霉是一种黑曲霉属真菌,已有文献报道显示塔宾曲霉能够产生萘并吡喃酮类化合物如Aurasperone A-E、环五肽、吲哚二萜等次生代谢产物[18-21],这些化合物呈现一定的抗烟草花叶病毒及细胞毒等生物活性,提示该菌具有合成抗菌活性次生代谢产物的能力。本研究室曾从塔宾曲霉LWG-42菌株的发酵产物中以活性追踪的分离方法得到2个具有DPPH自由基清除活性的化合物Aurasperone A和Aurasperone B[22]。本研究通过筛选,从海水养殖动物海蛎子共生微生物中筛选得到一株具有抗水产病原哈维氏弧菌活性的真菌HLZ-3菌株,基于该菌株的形态学特征和ITS序列分析,将其鉴定为塔宾曲霉(A.tubingensi),并确定了菌株HLZ-3合成抗哈维氏弧菌活性次生代谢产物的培养条件,为进一步分离纯化塔宾曲霉HLZ-3菌株所产抗菌活性次生代谢产物奠定了一定的基础。
| [1] |
Lu H, Zou WX, Meng JC, et al. New bioactive metabolites produced by Colletotrichum sp., an endophytic fungus in Artemisia annua[J]. Plant Science, 2000, 151(1): 67-73. DOI:10.1016/S0168-9452(99)00199-5 |
| [2] |
Ge HM, Tan RX. Symbionts, an important source of new bioactive natural products[J]. Progress in Chemistry, 2009, 21(1): 30-46. (in Chinese) 戈惠明, 谭仁祥. 共生菌-新活性天然产物的重要来源[J]. 化学进展, 2009, 21(1): 30-46. |
| [3] |
Morya VK, Choi W, Kim EK. Isolation and characterization of Pseudoalteromonas sp. from fermented Korean food, as an antagonist to Vibrio harveyi[J]. Applied Microbiology and Biotechnology, 2014, 98(3): 1389-1395. DOI:10.1007/s00253-013-4937-3 |
| [4] |
Thompson J, Gregory S, Plummer S, et al. An in vitro and in vivo assessment of the potential of Vibrio spp. as probiotics for the Pacific white shrimp, Litopenaeus vannamei[J]. Journal of Applied Microbiology, 2010, 109(4): 1177-1187. DOI:10.1111/j.1365-2672.2010.04743.x |
| [5] |
Guo L, Guo JC, Xu FQ. Optimized extraction process and identification of antibacterial substances from Rhubarb against aquatic pathogenic Vibrio harveyi[J]. 3 Biotech, 2017, 7(6): 377. DOI:10.1007/s13205-017-1012-2 |
| [6] |
Cao HP, He S, Wei RP, et al. Bacillus amyloliquefaciens G1: a potential antagonistic bacterium against eel-pathogenic Aeromonas hydrophila[J]. Evidence-based Complementary and Alternative Medicine, 2011, 2011: 824104. |
| [7] |
Harikrishnan R, Balasundaram C, Heo MS. Effect of probiotics enriched diet on Paralichthys olivaceus infected with lymphocystis disease virus (LCDV)[J]. Fish & Shellfish Immunology, 2010, 29(5): 868-874. |
| [8] |
Kesarcodi-Watson A, Kaspar H, Lategan MJ, et al. Probiotics in aquaculture: the need, principles and mechanisms of action and screening processes[J]. Aquaculture, 2008, 274(1): 1-14. DOI:10.1016/j.aquaculture.2007.11.019 |
| [9] |
Randrianarivelo R, Danthu P, Benoit C, et al. Novel alternative to antibiotics in shrimp hatchery: effects of the essential oil of Cinnamosma fragrans on survival and bacterial concentration of Penaeus monodon larvae[J]. Journal of Applied Microbiology, 2010, 109(2): 642-650. |
| [10] |
Turker H, Yıldırım AB. Screening for antibacterial activity of some Turkish plants against fish pathogens: a possible alternative in the treatment of bacterial infections[J]. Biotechnology & Biotechnological Equipment, 2015, 29(2): 281-288. |
| [11] |
Xu HM, Rong YJ, Zhao MX, et al. Antibacterial activity of the lipopetides produced by Bacillus amyloliquefaciens M1 against multidrug-resistant Vibrio spp. isolated from diseased marine animals[J]. Applied Microbiology and Biotechnology, 2014, 98(1): 127-136. DOI:10.1007/s00253-013-5291-1 |
| [12] |
Guo L, Wang C, Zhu WC, et al. Bioassay-guided fractionation and identification of active substances from the fungus Aspergillus tubingensis against Vibrio anguillarum[J]. Biotechnology & Biotechnological Equipment, 2016, 30(3): 602-606. |
| [13] |
Guo L, Wang C. Optimized production and isolation of antibacterial agent from marine Aspergillus flavipes against Vibrio harveyi[J]. 3 Biotech, 2017, 7(6): 383. DOI:10.1007/s13205-017-1015-z |
| [14] |
Ye BP, Jia YY, Xu TT, et al. Aspergillus sp. strain F7 from the rhizospheric soil of Rhizophora stylosa and its biological activity evaluation[J]. Mycosystema, 2010, 29(2): 241-248. (in Chinese) 叶波平, 贾阳阳, 许婷婷, 等. 来自红海榄根际土壤的曲霉属真菌F7菌株及其生物活性分析[J]. 菌物学报, 2010, 29(2): 241-248. |
| [15] |
Guo L, Zhu WC, Liu WW, et al. Identification and fermentation optimization of marine fungus HN4-13 with antibacterial activity[J]. Microbiology China, 2013, 40(6): 951-958. (in Chinese) 郭雷, 朱文成, 刘玮炜, 等. 抗菌活性海洋真菌HN4-13的鉴定及其发酵优化[J]. 微生物学通报, 2013, 40(6): 951-958. |
| [16] |
Zhou YL, Wang Y, Liu PP, et al. Effects of environmental stress on secondary metabolites of Aspergillus ochraceus LCJ11-102 associated with the coral Dichotella gemmacea[J]. Acta Microbiologica Sinica, 2010, 50(8): 1023-1029. (in Chinese) 周雅琳, 王乂, 刘培培, 等. 环境胁迫对珊瑚共附生真菌Aspergillus ochraceus LCJ11-102次生代谢产物的影响[J]. 微生物学报, 2010, 50(8): 1023-1029. |
| [17] |
Qi ZT. Flora Fungorum Sinicorum (Volume 5): Aspergillus and Related Sexual Types[M]. Beijing: Science Press, 1997: 92-93. (in Chinese) 齐祖同. 中国真菌志(第五卷):曲霉属及其相关有性型[M]. 北京: 科学出版社, 1997: 92-93. |
| [18] |
Huang HB, Feng XJ, Liu L, et al. Three dimeric naphtho-γ-pyrones from the mangrove endophytic fungus Aspergillus tubingensis isolated from Pongamia pinnata[J]. Planta Medica, 2010, 76(16): 1888-1891. DOI:10.1055/s-0030-1249955 |
| [19] |
Zhan JX, Gunaherath GMKB, Wijeratne EMK, et al. Asperpyrone D and other metabolites of the plant-associated fungal strain Aspergillus tubingensis[J]. Phytochemistry, 2007, 68(3): 368-372. DOI:10.1016/j.phytochem.2006.09.038 |
| [20] |
Tan QW, Gao FL, Wang FR, et al. Anti-TMV activity of malformin A1, a cyclic penta-peptide produced by an endophytic fungus Aspergillus tubingensis FJBJ11[J]. International Journal of Molecular Sciences, 2015, 16(3): 5750-5761. |
| [21] |
Siriwardane AMDA, Kumar NS, Jayasinghe L, et al. Chemical investigation of metabolites produced by an endophytic Aspergillus sp. isolated from Limonia acidissima[J]. Natural Product Research, 2015, 29(14): 1384-1387. DOI:10.1080/14786419.2015.1025230 |
| [22] |
Guo L, Wang C, Guo JC, et al. Identification of marine-derived Aspergillus tubingensis LWG-42 and isolation of its antioxidant active compounds[J]. Journal of Microbiology, 2017, 37(6): 30-35. (in Chinese) 郭雷, 王聪, 郭家才, 等. 海洋来源塔宾曲霉LWG-42菌株的鉴定及其抗氧化活性化合物的分离[J]. 微生物学杂志, 2017, 37(6): 30-35. DOI:10.3969/j.issn.1005-7021.2017.06.005 |
 2019, Vol. 46
2019, Vol. 46