扩展功能
文章信息
- 姚琳, 逄凤娇, 张奇, 庞倩倩, 李风铃, 江艳华, 王联珠, 翟毓秀
- YAO Lin, PANG Feng-Jiao, ZHANG Qi, PANG Qian-Qian, LI Feng-Ling, JIANG Yan-Hua, WANG Lian-Zhu, ZHAI Yu-Xiu
- 基于Qβ噬菌体的甲肝病毒装甲RNA标准参考样品的研制
- Armored RNA reference material of hepatitis A virus based on Qβ bacteriophage
- 微生物学通报, 2019, 46(1): 209-216
- Microbiology China, 2019, 46(1): 209-216
- DOI: 10.13344/j.microbiol.china.180146
-
文章历史
- 收稿日期: 2018-02-26
- 接受日期: 2018-05-09
- 网络首发日期: 2018-06-05
2. 山东华宇工学院 山东 德州 253000
2. Shandong Huayu Institute of Technology, Dezhou, Shandong 253000, China
甲肝病毒(Hepatitis A virus,HAV)为单股正链RNA病毒,属于小RNA病毒科,主要以人类等灵长类动物为宿主,约70%的成年人感染后会发生急性肝炎,严重者可致死[1-2]。受污染的贝类等食品是HAV传播的重要媒介之一[3]。虽然HAV是严格的细胞内寄生物,在食品中不能繁殖,但是其携带的病毒会引起感染甚至疫情[4]。1988年上海暴发了甲肝大流行,共有30多万人发病,这是由HAV引发食品安全与公共卫生安全的典型事件。近年来,在意大利[5-6]、韩国[7]、瑞典[8]、西班牙[9]等国家也暴发了多起由污染食品引发的甲肝疫情。实时荧光RT-PCR方法因其特异、灵敏、快速等优势目前已成为食品中HAV主要的检测方法,而在检测过程中添加核酸类标准参考样品,对于提高食品等复杂基质样本检测结果的可靠性和准确性具有重要意义[10]。现有标准参考样品主要包括弱毒病毒株、cRNA、质粒DNA等,但存在一定生物安全隐患,而且易降解,不能真实评价RNA提取、反转录过程等缺陷。由特定的RNA序列和MS2噬菌体衣壳蛋白包装成的装甲RNA无生物安全隐患,耐RNase降解,稳定性良好,是一种理想的RNA标准参考样品[11-12]。有研究表明,与MS2噬菌体相比,Qβ噬菌体的衣壳蛋白更稳定,更适合标准参考样品的研制和保存[13]。因此,本研究基于Qβ噬菌体装甲RNA制备平台[14],将HAV检测靶标RNA包装在Qβ噬菌体衣壳蛋白内,研发了内含甲肝病毒RNA检测靶标的装甲RNA,并进行初步定值、均匀性与稳定性研究,为甲肝病毒的RNA检测提供了良好的标准参考样品。
1 材料与方法 1.1 质粒和菌株大肠杆菌BL21(DE3)感受态细胞为天根生化科技(北京)有限公司产品;pET-28a(+)为本实验室保存;用于体外转录cRNA的重组质粒pGEM-HAV由本实验室制备并保存,其包含GB/T 22287-2008 《贝类中甲型肝炎病毒检测方法普通RT- PCR方法和实时荧光RT-PCR方法》[15]规定的实时荧光RT-PCR法检测靶标cDNA序列。
1.2 主要试剂和仪器RNA提取试剂TRIzol,Invitrigen公司;One Step PrimeScriptTM RT-PCR Kit、限制性内切酶,宝生物工程(大连)有限公司;T7 RiboMAXTM Express Large Scale RNA Production System体外转录试剂盒,Promega公司;琼脂糖凝胶DNA回收试剂盒,天根生化科技(北京)有限公司;丙烯酰胺葡聚糖凝胶,北京天恩泽生物技术有限公司;无水乙醇、异丙醇、氯仿等试剂均为分析纯。
电泳仪,北京六一生物科技有限公司产品;实时荧光PCR仪,Roche公司;微量蛋白核酸测定仪,Implen公司;透射电镜,日本电子公司。
1.3 引物和探针参照GB/T 22287-2008,由生工生物工程(上海)股份有限公司(以下简称上海生工)合成HAV检测所需的引物、探针。正向引物HAV1:5′-TTTCCGGAGCCCCTCTTG-3′,反向引物HAV2:5′-AAAGGGAAATTTAGCCTATAGCC-3′;探针:5′-FAM-ACTTGATACCTCACCCGCCGTTT GCCTTAMARA-3′。
1.4 重组质粒pET-QGBHAV的构建与鉴定参考本实验室前期建立的方法[14],由上海生工合成包含Qβ噬菌体成熟酶编码基因、衣壳蛋白编码基因、包装位点、HAV检测靶标cDNA序列的核酸片段QGBHAV,并亚克隆到pET-28a(+)中,构建重组表达质粒,命名为pET-QGBHAV,使用限制性内切酶Not I单酶切和Not I/BamH I双酶切鉴定重组质粒,送至上海生工测序。
1.5 pET-QGBHAV的诱导表达及纯化将重组质粒pET-QGBHAV转入大肠杆菌BL21(DE3)感受态细胞,涂布至卡那霉素(终浓度为50 mg/L)的LB平板,37 ℃培养过夜后挑取单菌落,接种到5 mL含卡那霉素的LB培养基中,37 ℃振荡培养过夜,取200 µL活化后的菌液于20 mL含卡那霉素的LB培养基中,37 ℃、180 r/min振荡培养至OD600约为0.6,加入终浓度0.8 mmol/L的IPTG诱导表达12 h,4 ℃、11 000 r/min离心10 min收集菌体,用SDS-PAGE分析目的蛋白表达情况。
按上述方法诱导200 mL菌液,4 ℃、11 000 r/min离心10 min收集菌体,超声波破碎,4 ℃、11 000 r/min离心20 min后收集上清,分别加入终浓度为8 U/mL的DNase I和终浓度为12 µg/mL的RNase A消化。将滤液采用氯化铯密度梯度离心,4 ℃、85 000 r/min离心5 h,用透析缓冲液透析3 h,将透析液经0.45 µm的滤膜过滤后使用丙烯葡聚糖凝胶层析柱纯化,获得含有甲肝病毒检测靶标RNA的装甲RNA,命名为AR-HAV。2%磷钨酸负染,用透射电镜观察。
1.6 AR-HAV中残留质粒的检测用实时荧光PCR方法检测纯化后的AR-HAV中是否含有残留质粒pET-QGBHAV的污染。PCR反应体系:2×Premix ExTaq (probe qPCR) 10.0µL,引物HAV1/HAV2 (10 µmoL/L)各0.4 µL,探针(10 µmoL/L) 0.8 µL,AR-HAV 2.0 µL,RNase-Free H2O 6.4 µL。PCR反应条件:95 ℃ 10 s;95 ℃ 5 s,60 ℃ 20 s,40个循环。
1.7 AR-HAV的初步定值 1.7.1 cRNA标准曲线的构建将本实验室保存的pGEM-HAV重组质粒使用Nde I内切酶进行线性化处理,用凝胶回收试剂盒回收线性化pGEM-HAV,参照体外转录试剂盒说明书体外转录cRNA。
按照说明书用TRIzol法提取纯化体外转录的cRNA,利用微量蛋白核酸测定仪对cRNA进行浓度和纯度鉴定,根据公式(6.02×1023拷贝/mol)× RNA含量(ng/µL)×(10−9)/(RNA片段长度×340)=(拷贝/µL)计算cRNA的拷贝数。将cRNA进行10倍系列稀释后,参照One Step PrimeScriptTM RT-PCR Kit说明书及优化后的反应体系与条件进行实时荧光RT-PCR检测,反应体系:2×One step RT-PCR buffer Ⅲ 10 µL,TaKaRa ExTaq HS (5 U/µL)0.4µL,PrimeScript RT Enzyme Mix Ⅱ 0.4 µL,引物HAV1/HAV2 (10 µmoL/L)各1.8 µL,探针(10 µmoL/L) 0.5 µL,cRNA 2.0 µL,RNase-Free H2O 3.1 µL。反应条件:42 ℃ 5 min;95 ℃ 10 s;95 ℃ 5 s,60 ℃ 20 s,40个循环。根据测得的Ct值与各稀释度拷贝数的对数绘制cRNA标准曲线,建立标准回归方程。
1.7.2 AR-HAV的初步定值及不确定度分析随机选取15管AR-HAV,按1.7.1方法用Trizol试剂提取RNA后采用实时荧光RT-PCR方法测定Ct值,代入建立的标准曲线计算AR-HAV拷贝浓度。参照JJF 1059-1999《测量不确定度表示指南》[16]中有关规定,采用公式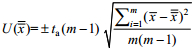
参考GB/T 15000.3-2008《标准样品工作导则》[17],按1.7.1方法进行检测,单因素方差分析样本均匀性。
1.9 AR-HAV的稳定性分析参考GB/T 15000.3-2008《标准样品工作导则》[17]的要求,将分装后的AR-HAV分别置于37、25、4、−20、−80 ℃保存不同时间,按照先密后疏的原则定期抽取3管AR-HAV样品,按1.7.1方法进行实时荧光RT-PCR检测,每管重复3次,单因素方差和线性回归方法统计样本的稳定性程度。
2 结果与分析 2.1 pET-QGBHAV重组质粒鉴定酶切鉴定重组质粒(图 1)并测序,结果表明重组质粒构建成功,命名为pET-QGBHAV。

|
| 图 1 pET-QGBHAV的酶切鉴定图 Figure 1 Enzyme digestion of pET-QGBHAV Note: M: DL15000 DNA marker; 1: Not I/BamH I; 2: Not I. |
|
|
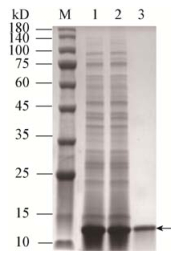
pET-QGBHAV在大肠杆菌BL21中经IPTG诱导表达,在大约14.1 kD处出现一条明显的蛋白条带,如图 2所示,与预期结果一致。超声破碎后的上清液经过超离、透析、滤膜过滤、丙烯葡聚糖凝胶层析柱纯化后得到AR-HAV,其SDS-PAGE分析结果表明未见其他杂条带,纯化效果良好,如图 3所示。

|
| 图 2 pET-QGBHAV表达产物的SDS-PAGE分析 Figure 2 SDS-PAGE analysis of pET-QGBHAV express products 注:M:蛋白质分子量;1:未诱导的pET-28a(+)空载体;2:诱导后的pET-28a(+)空载体;3:诱导前重组菌;4−6:诱导后重组菌. Note: M: Protein ladder; 1: pET-28a(+) without induction; 2: Induced pET-28a(+); 3: Express products the recombinant bacteria without induction; 4−6: Express products from the induced recombinant bacteria. |
|
|
|
| 图 3 AR-HAV纯化后SDS-PAGE分析 Figure 3 SDS-PAGE analysis of AR-HAV after purification 注:M:蛋白质分子量;1−2:诱导表达菌液;3:层析纯化AR-HAV. Note: M: Protein ladder; 1−2: Induced recombinant bacteria; 3: Purified AR-HAV. |
|
|
电镜观察纯化后的AR-HAV,可看到大量结构完整、大小均一的病毒样颗粒,直径约25 nm,与预期大小一致,结果如图 4所示。

|
| 图 4 AR-HAV的电镜观察 Figure 4 Transmission electron microscopy of AR-HAV |
|
|
以AR-HAV为模板进行实时荧光PCR检测。结果显示AR-HAV与阴性对照的Ct值接近,无明显扩增,说明制备的AR-HAV中无质粒DNA的残留,结果如图 5所示。

|
| 图 5 AR-HAV中残留质粒实时荧光PCR检测结果 Figure 5 Real-time fluorescence PCR of residue plasmid in AR-HAV 注:1:阳性对照(pET-QGBHAV);2:阴性对照;3:AR-HAV. Note: 1: Positive control (pET-QGBHAV); 2: Negative control; 3: AR-HAV. |
|
|
将制备的cRNA进行10倍梯度稀释,采用实时荧光RT-PCR法根据稀释梯度和Ct值绘制出标准曲线:y=−3.347 1x+40.682,R2=0.999。随机选取15管AR-HAV,采用实时荧光RT-PCR方法测定Ct值,根据建立的标准曲线计算得知AR-HAV拷贝数为2.57×107 copies/µL。应用A类不确定度评定方法进行评定,所得AR-HAV的不确定度为0.12×107,因此本次制备的AR-HAV定值结果为(2.57±0.12)×107 copies/µL。
2.6 AR-HAV的均匀性实验均匀性检验结果显示:F=Msamong/Mswithin= 1.23 < F0.05(9, 20),临界值F0.05(9, 20)=2.39由F表查得,因此可认为组内和组间无明显差异,样品是均匀的(表 1)。
| 变差源 Source of variation |
平方和 Sum of squares |
自由度 Degrees of freedom |
均方 Mean square |
F | F0.05(9, 20) |
| 组间Between groups | 2.54×1015 | 9 | 2.82×1014 | 1.23 | 2.39 |
| 组内Within groups | 4.59×1015 | 20 | 2.30×1014 | ||
| 总和Total | 7.14×1015 | 29 |
分别在37、25、4、−20、−80 ℃条件下进行AR-HAV稳定性检测,结果表明:AR-HAV在37 ℃可稳定保存9 d,25 ℃可稳定保存25 d,4 ℃可稳定保存40 d,−20 ℃可稳定保存180 d,−80 ℃可稳定保存至少360 d,证明研究制备的AR-HAV稳定性良好(表 2)。
| 温度 Temperature (℃) |
拟合方程 Linear approximation equation |
斜率b1 Slope b1 |
斜率的不确定度s(b1) Uncertainty associated with the slope s(b1) |
自由度n-2 Degrees of freedom n-2 |
t0.95, (n-2) | |b1|−t0.95, (n-2)×s(b1) | 趋势分析 Trend analysis |
| 37 | Y=(−9.65×106)X+1.16×108 | −9.65×106 | 2.85×106 | 2 | 4.30 | −2.60×106 < 0 | No obvious trend observed |
| 25 | Y=(−5.42×105)X+1.55×107 | −5.42×105 | 2.47×105 | 5 | 2.57 | −9.35×104 < 0 | |
| 4 | Y=(−1.40×105)X+1.62×107 | −1.40×105 | 9.97×104 | 4 | 2.78 | −1.37×105 < 0 | |
| −20 | Y=(−5.30×104)X+1.55×107 | −5.30×104 | 4.58×104 | 4 | 2.78 | −7.44×104 < 0 | |
| −80 | Y=(3.65×104)X+1.49×107 | −3.65×104 | 4.08×104 | 3 | 3.18 | −1.66×105 < 0 |
据统计,全球每年约有150万人感染HAV,然而由于部分无症状表现,以及流行病学统计、公开数据的局限性,这个数字要远远低于实际发病数[18-19],严重威胁着人类健康。实时荧光RT-PCR是检测HAV的重要手段,而标准参考样品是确保检测结果准确性的重要因素。有研究使用HAV弱毒株作为检测阳性质控品[20-21],存在一定生物安全隐患,并且无法进行量值测定,不适宜用于核酸的定量分析;有研究用质粒DNA作为RNA病毒检测的阳性质控品,然而质粒无法对RNA提取及逆转录过程进行有效评价[22];也有研究将含有特定RNA病毒的阳性血清冻干处理后作为阳性质控品[23],该方法模拟了病毒在血清中的原始状态,但不同个体血清基质的差异对检测存在不同程度的干扰,既不利于实验室标准化批量制备,也不适用于食品中HAV的检测。
某些病毒如噬菌体的病毒样颗粒可以耐受RNase的作用,目标RNA序列包装到这些病毒样颗粒内就可以使其免受环境中RNase的降解,大大提高RNA的稳定性,这也是装甲RNA技术的理论基础。噬菌体的宿主范围小,无生物安全风险,容易培养和保存,而且能很好地模拟病毒粒子的结构[24-26],因此噬菌体成为装甲RNA最主要的技术研发工具。现已成功基于MS2噬菌体制备了麻疹病毒、丁型肝炎病毒、寨卡病毒等多种病毒的装甲RNA作为检测的阳性质控品[27-29]。此外,装甲RNA适合标准化批量制备,可应用于质检、临床、疾控等多个领域。
通过原核表达系统制备装甲RNA时极有可能残留质粒DNA,将严重影响其作为RNA阳性质控品的可信性。本研究通过DNase I消化和丙烯葡聚糖凝胶纯化来消除残留质粒DNA。本实验室前期通过普通PCR检测残留质粒DNA[14],而本研究基于标准中的引物HAV1、HAV2和探针采用灵敏度更高的实时荧光PCR方法检测残留质粒,结果仍未见扩增,说明制备的AR-HAV中无残留质粒。在GB/T 22287-2008的实时荧光RT-PCR法中,规定了3条HAV引物(HAV1、HAV2、HAV3),其中两条反义引物HAV2和HAV3均位于HAV 5′UTR的保守区域,二者均具有良好的特异性与代表性,其扩增产物只存在一个碱基的差异。本研究选取了HAV1/HAV2对应的扩增片段作为装甲RNA的包装序列,通用性好,也避免了同时包装两条高度相似片段引发的样品在定值、均匀性等方面的不确定性。
本研究充分考虑了标准参考样品在保存、运输过程中可能出现的多种温度条件,设置25、4、−20、−80 ℃ 4个稳定性测试温度,同时设置37℃作为稳定性的高温挑战实验。结果表明AR-HAV在4 ℃条件下能保存40 d,−20 ℃条件下能保存180 d,−80 ℃条件下能够至少保存360 d,在相应时间内未观察到不稳定性,表明本研究制备的AR-HAV标准参考样品拷贝数高、稳定性好,可在HAV的定量检测、仪器设备与新检测方法灵敏度评价等方面开展应用。前期本实验室初步证实了Qβ噬菌体制备的装甲RNA的稳定性优于MS2[14],本研究基于Qβ噬菌体制备的AR-HAV在−20 ℃条件下能稳定保存180 d,也进一步证实了该结论。虽然AR-HAV在37 ℃条件下的第9天后和25 ℃条件下的第25天后表现出不稳定性,但其拷贝数的数量级均没有变化(数据未发表),依然可作为普通阳性质控品用于HAV定性检测分析。目前大部分基于装甲RNA技术的研究多集中在阳性质控品的层面,本研究按照国家标准的要求进一步评价了AR-HAV的均匀性与稳定性,后续研究中将联合多个实验室进行联合定值,以期申请国家有证标准样品(Certified reference material,CRM),为甲肝病毒标准化检测提供安全、稳定的标准样品奠定基础。
| [1] |
Fang BH, Yue ZQ, Sun T, et al. Risk assessment and genotyping of hepatitis a virus in fruit and vegetable products[J]. Chinese Journal of Virology, 2016, 32(4): 484-489. (in Chinese) 房保海, 岳志芹, 孙涛, 等. 果蔬产品中甲型肝炎病毒风险评估和基因分型研究[J]. 病毒学报, 2016, 32(4): 484-489. |
| [2] |
Lanini S, Minosse C, Vairo F, et al. A large ongoing outbreak of hepatitis a predominantly affecting young males in Lazio, Italy; August 2016 - March 2017[J]. PLoS One, 2017, 12(11): e0185428. DOI:10.1371/journal.pone.0185428 |
| [3] |
Provost K, Dancho BA, Ozbay G, et al. Hemocytes are sites of enteric virus persistence within oysters[J]. Applied and Environmental Microbiology, 2011, 77(23): 8360-8369. DOI:10.1128/AEM.06887-11 |
| [4] |
Wu QP, Kou XX, Zhang JM. Foodborne viruses and its detection methods[J]. Microbiology China, 2004, 31(3): 101-105. (in Chinese) 吴清平, 寇晓霞, 张菊梅. 食源性病毒及其检测方法[J]. 微生物学通报, 2004, 31(3): 101-105. DOI:10.3969/j.issn.0253-2654.2004.03.022 |
| [5] |
Lopalco PL, Malfait P, Menniti-Ippolito F, et al. Determinants of acquiring hepatitis a virus disease in a large Italian region in endemic and epidemic periods[J]. Journal of Viral Hepatitis, 2005, 12(3): 315-321. DOI:10.1111/jvh.2005.12.issue-3 |
| [6] |
Pontrelli G, Boccia D, Di Renzi M, et al. Epidemiological and virological characterization of a large community-wide outbreak of hepatitis a in southern Italy[J]. Epidemiology & Infection, 2008, 136(8): 1027-1034. |
| [7] |
Yoon EL, Sinn DH, Lee HW, et al. Current status and strategies for the control of viral hepatitis a in Korea[J]. Clinical and Molecular Hepatology, 2017, 23(3): 196-204. DOI:10.3350/cmh.2017.0034 |
| [8] |
Pintó RM, Costafreda MI, Bosch A. Risk assessment in shellfish-borne outbreaks of hepatitis A[J]. Applied and Environmental Microbiology, 2009, 75(23): 7350-7355. DOI:10.1128/AEM.01177-09 |
| [9] |
Polo D, Varela MF, Romalde JL. Detection and quantification of hepatitis a virus and norovirus in Spanish authorized shellfish harvesting areas[J]. International Journal of Food Microbiology, 2015, 193: 43-50. DOI:10.1016/j.ijfoodmicro.2014.10.007 |
| [10] |
Li JM. The role of nucleic acid reference materials in detection of HBV DNA and HCV RNA[J]. Chinese Journal of Laboratory Medicine, 2007, 30(8): 850-852. (in Chinese) 李金明. 标准物质在乙型和丙型肝炎病毒核酸检测标准化中的重要性[J]. 中华检验医学杂志, 2007, 30(8): 850-852. DOI:10.3760/j.issn:1009-9158.2007.08.002 |
| [11] |
Li JM. Research progress on control products and standards for RNA virus amplification[J]. Chinese Journal of Laboratory Medicine, 2004, 27(12): 873-874. (in Chinese) 李金明. RNA病毒扩增检测的质控品和标准品研究进展[J]. 中华检验医学杂志, 2004, 27(12): 873-874. DOI:10.3760/j:issn:1009-9158.2004.12.023 |
| [12] |
Zhang K, Wei YX, Li JM. RNA phage virus-like particle packaging mechanism and its application research progress[J]. Journal of Microbes and Infection, 2008, 3(2): 111-114, 123. (in Chinese) 张括, 魏玉香, 李金明. RNA噬菌体病毒样颗粒包装机制及其应用研究进展[J]. 微生物与感染, 2008, 3(2): 111-114, 123. DOI:10.3969/j.issn.1673-6184.2008.02.014 |
| [13] |
Cielens I, Ose V, Petrovskis I, et al. Mutilation of RNA phage Qβ virus-like particles: from icosahedrons to rods[J]. FEBS Letters, 2000, 482(3): 261-264. DOI:10.1016/S0014-5793(00)02061-5 |
| [14] |
Zhang Q, Yao L, Jiang YH, et al. Development of armored RNA reference material of norovirus based on Qbeta bacteriophage[J]. China Biotechnology, 2018, 38(1): 42-50. (in Chinese) 张奇, 姚琳, 江艳华, 等. 基于Qbeta噬菌体装甲RNA技术的诺如病毒RNA标准参考样品的研制[J]. 中国生物工程杂志, 2018, 38(1): 42-50. |
| [15] |
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 22287-2008 Detection of hepatitis a virus in shellfish by contentional RT-PCR and real-time fluorescence RT-PCR[S]. Beijing: China Standard Press, 2008 (in Chinese) 中华人民共和国国家质量监督检验检疫总局. GB/T 22287-2008贝类中甲型肝炎病毒检测方法普通RT-PCR方法和实时荧光RT-PCR方法[S].北京: 中国标准出版社, 2008 |
| [16] |
The State Bureau of Quality and Technical Supervision. JJF 1059-1999 Evaluation and expression of uncertaintv in measurement[S]. Beijing: China Measurement Press, 2004 (in Chinese) 国家质量技术监督局. JJF 1059-1999测量不确定度平定与表示[S].北京: 中国计量出版社, 2004 |
| [17] |
Standardization Administration of China. GB/T 15000.3-2008 Directives for the work of reference materials- Reference materials-General and statistical principles for certification[S]. Beijing: China Standard Press, 2008 (in Chinese) 国家标准化管理委员会. GB/T 15000.3-2008标准样品工作导则(3)标准样品定值的一般原则和统计方法[S].北京: 中国标准出版社, 2008 |
| [18] |
W HO. WHO position paper on hepatitis a vaccines[J]. Weekly Epidemiological Record, 2012, 28/29(87): 261. |
| [19] |
Lemon SM, Ott JJ, van Damme P, et al. Type a viral hepatitis: a summary and update on the molecular virology, epidemiology, pathogenesis and prevention[J]. Journal of Hepatology, 2018, 68(1): 167-184. DOI:10.1016/j.jhep.2017.08.034 |
| [20] |
Mo XM, Gao DW. SYBR GreenⅠreal-time polymerase chain reaction for the detection of HAV in strawberry[J]. Food Science, 2010, 31(14): 153-157. (in Chinese) 莫雪梅, 高东微. 运用SYBR Green Ⅰ荧光实时RT-PCR法检测草莓中甲肝病毒[J]. 食品科学, 2010, 31(14): 153-157. |
| [21] |
Hu Y, Arsov I. A rapid single-tube protocol for HAV detection by nested real-time PCR[J]. Food and Environmental Virology, 2014, 6(3): 189-195. DOI:10.1007/s12560-014-9152-6 |
| [22] |
Wang DY, Fang ZD, Xie CX, et al. Standard construction for detection of rotavirus using the real-time fluorescence quantitative PCR[J]. Journal of Logistical Engineering University, 2013, 29(4): 66-73. (in Chinese) 王大勇, 方振东, 谢朝新, 等. 轮状病毒荧光定量PCR标准品的构建[J]. 后勤工程学院学报, 2013, 29(4): 66-73. DOI:10.3969/j.issn.1672-7843.2013.04.012 |
| [23] |
Saldanha J, Heath A, Lelie N, et al. A World Health Organization International Standard for hepatitis a virus RNA nucleic acid amplification technology assays[J]. Vox Sanguinis, 2005, 89(1): 52-58. DOI:10.1111/vox.2005.89.issue-1 |
| [24] |
Janner A. Form, symmetry and packing of biomacromolecules. Ⅳ. Filled capsids of cowpea, tobacco, MS2 and pariacoto RNA viruses[J]. Acta Crystallographica Section A: Foundations and Advances, 2011, 67(Pt6): 517-520. |
| [25] |
Pan Y, Zhang Y, Jia TT, et al. Development of a microRNA delivery system based on bacteriophage MS2 virus-like particles[J]. FEBS Journal, 2012, 279(7): 1198-1208. DOI:10.1111/j.1742-4658.2012.08512.x |
| [26] |
ElSawy KM, Caves LSD, Twarock R. The impact of viral RNA on the association rates of capsid protein assembly: bacteriophage MS2 as a case study[J]. Journal of Molecular Biology, 2010, 400(4): 935-947. DOI:10.1016/j.jmb.2010.05.037 |
| [27] |
Zhang D, Sun Y, Jia TT, et al. External quality assessment for the detection of measles virus by reverse transcription-PCR using armored RNA[J]. PLoS One, 2015, 10(8): e0134681. DOI:10.1371/journal.pone.0134681 |
| [28] |
Karataylı E, Altunoğlu YÇ, Karataylı SC, et al. A one step real time PCR method for the quantification of hepatitis delta virus RNA using an external armored RNA standard and intrinsic internal control[J]. Journal of Clinical Virology, 2014, 60(1): 11-15. DOI:10.1016/j.jcv.2014.01.021 |
| [29] |
Lin GG, Zhang K, Zhang D, et al. Fast preparation of a long chimeric armored RNA as controls for external quality assessment for molecular detection of Zika virus[J]. Clinica Chimica Acta, 2017, 466: 138-144. DOI:10.1016/j.cca.2017.01.023 |
 2019, Vol. 46
2019, Vol. 46




