扩展功能
文章信息
- 钱柚粉, 邓通初, 陈乐天, 张列宇, 许玫英
- QIAN You-Fen, DENG Tong-Chu, CHEN Le-Tian, ZHANG Lie-Yu, XU Mei-Ying
- 水体沉积物中微生物厌氧呼吸耦合多环芳烃降解的研究进展
- Progress in microbial anaerobic respiration coupling degradation of polycyclic aromatic hydrocarbons in aquatic sediment
- 微生物学通报, 2019, 46(1): 162-171
- Microbiology China, 2019, 46(1): 162-171
- DOI: 10.13344/j.microbiol.china.180302
-
文章历史
- 收稿日期: 2018-04-13
- 接受日期: 2018-08-06
- 网络首发日期: 2018-09-11
2. 广东省微生物研究所广东省菌种保藏与应用重点实验室 广东 广州 510070;
3. 中国环境科学研究院 北京 100012;
4. 省部共建华南应用微生物国家重点实验室 广东 广州 510070
2. Guangdong Provincial Key Laboratory of Microbial Culture Collection and Application, Guangdong Institute of Microbiology, Guangzhou, Guangdong 510070, China;
3. Chinese Research Academy of Environmental Sciences, Beijing 100012, China;
4. State Key Laboratory of Applied Microbiology Southern China, Guangzhou, Guangdong 510070, China
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是水体沉积物中主要的持久性有机污染物之一,它的来源相当广泛,主要来源于煤和石油的燃烧以及工业废水和废气的排放等[1]。PAHs本身的强疏水性、高脂溶性和难降解性等特点使其容易吸附在颗粒物上,因而在水体沉积物中大量累积,造成严重污染[2]。PAHs具有致畸、致癌、致突变的“三致”效应[3-4],可通过生态系统中食物链的级联放大效应危害人体健康[5]。因此,美国环境保护署和中国生态环境部均将PAHs列为重点监控的典型有机污染物,欧洲化学管理局(European Chemicals Agency,ECHA)制定的ECHA法规也对进入欧盟市场的PAHs进行了限制[6]。水体沉积物中PAHs的污染水平可划分为4个等级:低污染(0−100 ng/g)、中度污染(100−1 000 ng/g)、高度污染(1 000−5 000 ng/g)、重度污染(> 5 000 ng/g)[7]。国内已开展的水体沉积物PAHs污染调查研究表明,松花江城市段水体沉积物的PAHs含量为55 172.4 ng/g,属于重度污染水平;京杭大运河(苏北段)水体底泥的PAHs平均含量为5 984 ng/L,处于重度污染水平;位于珠江三角洲经济特区的水体沉积物中PAHs处于高度污染状况[8];国内的其他河流,如黄浦江、长江口近岸、黄河兰州段等水体沉积物均处于中高度污染水平[1, 9]。国外的调查研究结果也发现,工业发达地区水体沉积物中PAHs的含量较高,如美国的Mill河[10]和Susquehanna河[11]、英国的Tyne河[12]和Inner Clyde河[13]等水体沉积物中PAHs均处于重度污染水平;而对于工业不发达地区,如韩国的Hyeongsn河[14]、智利的Biobío河等水体沉积物则处于低污染水平。由此可见,水体沉积物的PAHs污染现状相当严峻,迫切需要加强治理。
由于PAHs的有氧降解效率高,好氧降解功能微生物也相对容易纯化培养,早期的研究大部分都集中在PAHs的好氧降解[15-16]。但由于氧气在水体沉积物中的传质很差、溶解度很低,即使持续不断地向水底曝气,水体沉积物环境仍然呈现缺氧或厌氧状态,难以实现PAHs污染的有氧治理[17]。此外,曝气还会导致沉积物重悬浮,增加了底部沉积物中蓄积的污染物向上覆水体重新释放的风险[18]。随着研究的深入,越来越多的研究[19-22]发现,微生物在厌氧条件下能利用硝酸盐、Fe(Ⅲ)以及硫酸盐为电子受体进行呼吸并耦合PAHs降解。此外,微生物对PAHs胁迫的适应机制及其协同降解能力是影响水体沉积物中PAHs生物修复效果的另一个重要因素。
因此,本文对水体沉积物中微生物厌氧呼吸耦合PAHs降解的相关研究进展进行综述,并分析目前有关纯菌和菌群降解PAHs的代谢网络研究进展及存在的问题,进一步展望未来的研究方向,以期为进一步加速水体沉积物中PAHs的微生物降解转化提供科学的理论指导。
1 微生物厌氧呼吸耦合PAHs降解的研究概况微生物厌氧降解PAHs实质上是微生物在厌氧条件下以PAHs作为电子供体进行呼吸产能维持代谢活性并实现细胞增殖的过程。在这个过程中,微生物所利用的电子受体主要包括硝酸盐、Fe(Ⅲ)、硫酸盐等(表 1)。研究表明,厌氧条件下,这些电子受体促进PAHs降解由强到弱的顺序依次是:硫酸盐 > 硝酸盐 > Fe(Ⅲ)[43-44]。但无论是以哪种电子受体进行厌氧呼吸,微生物降解PAHs的机理都是使每个芳香环在相应酶的催化作用下逐级断裂成链状化合物,最终进入三羧酸(Tricarboxylic acid cycle,TCA)循环而被代谢利用。
| 电子受体 Electron acceptors |
多环芳烃 PAHs |
微生物菌种/群 Strains |
沉积物类型 Sediment types |
参考文献 References |
| Nitrate | Naphthalene Fluoranthene | Microbial community | Estuary sediment | [22] |
| Naphthalene Phenanthrene | Microbial consortium | Marine sediment | [23-24] | |
| Naphthalene 2-Methylnaphthalene Anthracene | Microbial community | Marine sediment | [25] | |
| Pyrene | Paracoccus denitrificans strain M-1 | Contaminated sediment | [26] | |
| Aromatic-compound | Microbial community | River sediment | [27-28] | |
| Phenanthrene | Bacterial consortium | River sediment | [29] | |
| PAHs | Microbial community | Estuary sediment | [30] | |
| Fe(Ⅲ) | Phenanthrene Pyrene | Bacterial consortium | Contaminated sediment | [31] |
| Fluorine Phenanthrene Fluoranthene Pyrene | Microbial community | Mangrove sediment | [32] | |
| Aromatic-compound | Microbial community | Contaminated sediment | [33] | |
| Sulfate | Naphthalene Phenanthrene | Microbial community | Harbor sediment | [34] |
| Naphthalene 2-Methylnaphthalene | Deltaproteobacteria NaphS3 Deltaproteobacteria NaphS6 | Marine sediment | [35] | |
| Naphthalene 2-Methylnaphthalene | Microbial community | Contaminated sediment | [36] | |
| Naphthalene Phenanthrene Fluorene Fluoranthene | Microbial community | Harbor sediment | [37-38] | |
| Naphthalene | Desulfobacterium str. N47 | River sediment | [39] | |
| Naphthalene 2-Methylnaphthalene | Deltaproteobacterial culture N47 | Contaminated sediment | [40-41] | |
| Phenanthrene | Indigenous microorganisms | River sediment | [42] |
在水体沉积物体系中,利用硝酸盐呼吸耦合PAHs降解已取得了一定的进展。反硝化作用耦合PAHs的厌氧降解是目前了解相对较多的一种机制。Rockne等[24]利用流化床反应器(Fluidized bed reactor,FBR)首次揭示了存在反硝化作用的沉积物中可以长期维持生物降解PAHs的能力。Abercron等[25]利用分子生物学手段(功能基因和16S rRNA基因扩增)研究对比加入PAHs以及硝酸盐前后沉积物中微生物群落结构的变化,并发现在反硝化作用条件下,Acidobacteria和Bacilli的相对丰度显著增加,而Bacteroidetes和Actinobacteria的相对丰度出现了不同程度的降低,原因可能是这两类菌对PAHs的毒害作用较敏感。
反硝化作用过程具体讲就是在缺氧或厌氧的水体沉积物中,微生物以PAHs为碳源和电子供体、以硝酸盐作为电子受体进行反硝化作用,最终的代谢产物主要是二氧化碳(CO2)、一氧化氮(NO)、氧化亚氮(N2O)以及分子氮(N2)[23]。在该过程中,硝酸盐不仅能作为PAHs降解菌的电子受体,还能为微生物的生长繁殖提供氮源。目前,关于反硝化作用耦合PAHs的微生物降解机理研究较清楚的是萘降解机理[15, 45]:

|
(1) |

|
(2) |
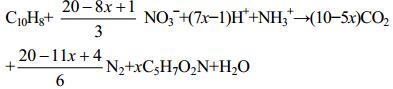
|
(3) |
Dou等[45]研究发现,在该过程中大约有7.5%−11.7%的萘转化成微生物自身机体所需物质,即方程(3)中x的近似值;并且由方程(1)−(3)可知,降解1 mol萘需要消耗约7 mol硝酸盐,萘最终经过微生物的矿化作用,生成CO2和C5H7O2N,而C5H7O2N则作为可生物利用的有机物质被微生物代谢再利用。
最近有研究报道[46]指出,在沉积物环境中分离的厌氧甲烷氧化菌(Candidatus Methylomrabilis oxyfera)[47]和其它烷烃类的厌氧氧化菌(Gammaproteobacterium HdN1)携带的nod基因可以产生相应的一氧化氮歧化酶(NOD),催化NO产生O2和N2,促进烷烃在厌氧环境中降解。另外,Ribeiro等[22]基于16S rRNA基因扩增的PICRUSt分析发现,在以硝酸盐作为电子受体的厌氧沉积物中不仅PAHs的厌氧降解基因(nahC、banA)丰度提高了,PAHs的好氧降解基因(bssA、bbsE、bssF、hcrB)丰度也出现相应的增加。但是目前尚不清楚这些好氧基因在体系中的作用特点。我们团队[27-28, 30, 48]在开展珠江流域污染水体沉积物的原位修复研究中发现,投加硝酸盐可以明显地提高PAHs的去除率,激活以硝酸盐作为电子受体的多种功能微生物。我们最近还发现硝酸盐可以改变水体沉积物中硫杆菌和寡养单胞菌的演替规律,并且明显提高了菲的降解率[29]。
随着微生物利用硝酸盐呼吸耦合PAHs降解机理的阐明,将逐步建立和完善基于硝酸盐呼吸的水体沉积物原位修复技术,促进水体沉积物中PAHs等有机污染物的降解转化。
1.2 微生物Fe(Ⅲ)呼吸耦合PAHs降解铁元素是水体沉积物中含量最丰富的元素之一。关于缺氧或厌氧水体沉积物体系中微生物利用Fe(Ⅲ)呼吸耦合PAHs降解的研究已广泛开展,但相关研究还主要停留在分析比较加入Fe(Ⅲ)前后体系中PAHs的含量变化,进而推断Fe(Ⅲ)对PAHs降解的促进程度,关于该过程中PAHs的降解机理及其主要影响因素的了解仍然相当有限。
Yan等[31]的研究发现,在投加可溶性Fe(Ⅲ)和微生物燃料电池的淡水沉积物中,经过240 d的培养可以使菲和芘的降解率分别达到99%和94%。Lovley等[33]通过向缺氧沉积物中投加能与Fe(Ⅲ)结合的有机配体(氮三乙酸),以此提高铁元素的生物可利用性,刺激了以Fe(Ⅲ)作为电子受体的芳烃类污染物的微生物降解。Coates等[17]早期的研究认为厌氧条件下Fe(Ⅲ)促进微生物降解PAHs的机理主要包含2个方面:(1)厌氧条件下PAHs降解过程中的产氢产酸阶段需要氢化酶参与,而铁元素是产氢产酸菌合成氢化酶必不可少的元素;(2) Fe(Ⅲ)可作为一种氧化剂,将PAHs氧化成为简单的链状结构,促进了铁还原菌或其它微生物的吸收代谢。这显然忽略了微生物利用Fe(Ⅲ)为电子受体进行厌氧呼吸氧化PAHs的降解作用。
然而,以Fe(Ⅲ)作为电子受体降解PAHs时极易受到环境pH的影响。当pH偏碱性时,Fe(Ⅲ)易沉淀而难以被微生物吸收代谢[49],限制了微生物Fe(Ⅲ)呼吸耦合PAHs降解转化。Li等[32]结合PAHs的降解动力学和统计学方法分析发现,在红树林沉积物中Fe(Ⅲ)对PAHs的降解以及相应的降解菌群没有显著的影响;在同时存在硫酸盐和Fe(Ⅲ)的情况下,PAHs降解菌群更倾向于利用硫酸盐作为电子受体呼吸耦合PAHs (芴、菲、荧蒽和芘)降解。这可能是由于Fe(Ⅲ)通常以不溶性水合氧化铁(Hydrous ferric oxides, HFO)的形式存在[50],受HFO比表面积限制和结晶程度的影响,导致Fe(Ⅲ)作为电子受体的竞争力弱于硫酸盐。
1.3 微生物硫酸盐呼吸耦合PAHs降解在海洋沉积物或受污染的黑臭水体沉积物中往往存在着较为活跃的硫元素循环过程。在该体系中,微生物以硫酸盐作为电子受体呼吸耦合PAHs降解是去除PAHs的重要途径。Lei等[42]在黑臭水体沉积物中(存在较为活跃的硫元素循环系统)分别加入1 000 mg/L硝酸钠和30 mmol硫酸钠,发现沉积物中的土著微生物只能利用硫酸钠作为电子受体降解PAHs,而硝酸钠对PAHs的降解毫无影响。进一步根据化学平衡移动原理分析发现微生物还能在一定程度上将硫酸盐还原所产生的硫化物氧化为硫酸盐,从而在驱动硫循环的同时抑制水体黑臭现象的发生[51]。
随着研究方法手段的发展和应用,有关微生物以硫酸盐为电子受体厌氧呼吸耦合PAHs降解的机理逐步得到阐释,但仍然有待深入[52]。早在20世纪90年代,Coates等[37-38]就使用14C标记技术证明了圣地亚哥湾沉积物中的微生物在厌氧条件下能以硫酸盐为电子受体降解萘、菲、芴等多环芳烃,并进一步使用钼酸盐抑制硫酸盐的还原过程对这一发现进行确认。Aitken等[51]以美国新泽西州海岸采集的沉积物为接种物,研究硫酸盐呼吸耦合萘和菲的微生物降解机理;并采用稳定同位素(13C)方法标记体系中存在的碳酸氢盐,发现中间代谢产物萘甲酸和菲甲酸的羧酸基团(碳原子)是由碳酸氢盐提供的。2002年,Rothermich等[36]和Chang等[53]也先后报道了硫酸盐促进水体沉积物中PAHs降解的研究。Rothermich等[36]发现,向受石油污染的河岸沉积物中提供足量的硫酸盐,培养90 d后可以使萘和甲基萘的降解率分别达到90%和60%。Chang等[53]把经过长期污染的水体沉积物与土壤混合在一起,发现水体沉积物中的微生物能够以硫酸盐作为电子受体促进土壤中的PAHs降解,并且5种主要PAHs的降解从易到难依次为:菲 > 芘 > 蒽 > 芴 > 苊,推测硫酸盐呼吸耦合多环芳烃降解的难易程度可能与芳香环的数量有关。近几年,Kümmel等[39]将13C同位素追踪、16S rRNA基因分析以及蛋白质组学等方法相结合,预测了Desulfobacterium str. N47以硫酸盐为电子受体对萘的降解矿化机理和代谢途径(萘经羧化酶激活,产生中间代谢产物2-萘酰-CoA,并经过多步的生化反应产生CO2)。但总体而言,目前对于三环以上PAHs在硫酸盐呼吸条件下的矿化机理研究仍然较少,可能与这些有机物的结构稳定性和强疏水性,以及水体沉积物中有机硫和无机硫氧化还原过程的复杂性有关。
由此可见,有必要结合稳定同位素标记、微电极、高通量分析检测等新型的研究方法,深入研究水体沉积物中微生物以硫酸盐作为电子受体进行厌氧呼吸耦合PAHs降解矿化的机理,从而实现控制H2S释放的同时加速PAHs污染治理。
2 微生物降解PAHs的代谢网络及其互作机理研究在生物有机体内,任何一个代谢途径都不是孤立存在的,各种代谢途径和代谢物质相互作用、相互牵制而构成了代谢网络。代谢网络是决定细胞生理、生化特性的一整套代谢过程,涉及到基因转录、调控表达、翻译以及代谢等多个方面,具有复杂性、整体性、可调性、特异性、无尺度性等特点[54]。在水体沉积物这个复杂环境中,微生物彼此之间更是以互利、互损或是毫无影响的共存关系形成复杂的互作网络[55],维持着水体沉积物微生态系统的稳定性。目前,国内外很多学者已经从微生物基因组、蛋白组、代谢组以及菌群互作等多个角度研究了微生物降解PAHs的代谢网络,获得了不少新的发现。
2.1 基于微生物体内多环芳烃代谢网络的解析微生物利用硝酸盐、Fe(Ⅲ)以及硫酸盐为电子受体呼吸耦合PAHs的厌氧降解在水体沉积物中是普遍存在的。深入了解PAHs在微生物机体内的代谢途径,以及参与该代谢途径的基因组、蛋白质组和代谢组,将有助于人们优化生物降解的条件。
目前,关于基因组代谢网络的研究主要是利用构建的基因组规模代谢网络模型(Genome-scale metabolic network model,GSMM)[56-57],借助GSMM对细胞的代谢功能进行解析,帮助研究者发现不同代谢反应之间的关系和依赖性,找到新的PAHs降解代谢通路。近几年,研究者们已陆续对沉积物中分离获得的部分PAHs厌氧降解微生物的代谢网络进行了研究。2010年,Selesi等[41]首次报道了从污染的沉积物中富集培养获得的具有硫酸盐呼吸耦合PAHs降解功能的菌群Deltaproteobacterial culture N47,发现菌群N47携带的nmsABC基因可以编码2-萘甲基琥珀酸合成酶,催化2-甲基萘反应生成2-萘甲基琥珀酸,并且在nmsABC基因上游存在的nmsD基因可以编码Nms活化酶,辅助nmsABC基因的表达;另外,菌群N47还携带有bns基因簇,可以编码参与β-氧化反应的相关酶,催化2-萘甲基琥珀酸酯转化为2-萘甲酰-CoA[40]。DiDonato等[58]研究发现Deltaproteobacterial NaphS2菌株也同样携带有nms和bns基因,并且能够在厌氧条件下降解2-甲基萘。考虑到nms和bns基因普遍存在于PAHs厌氧降解基因组中,Chin等[59]通过检测nms和bns基因在沉积物中的表达情况来表征沉积物中PAHs的厌氧降解活性。
相对于核酸而言,蛋白质直接反映了微生物的代谢特点和调控机理,能更加具体地给出微生物代谢活性的相关信息。多种微生物降解转化PAHs的酶已陆续被发现,包括加氧酶、脱氢酶、醛缩酶等,这些酶有些调控代谢通路(信号蛋白、转运蛋白),有些直接参与降解转化作用。例如,Bergmann等[40]利用液相色谱-电喷雾离子化-质谱法(LC-ESI MS/MS)测定了菌株N47的蛋白质组,发现了与萘、2-甲基萘以及2-萘甲酸代谢有关的乙酰-CoA、一氧化碳脱氢酶以及2-萘酰-CoA还原酶等酶;并通过测定菌株N47生长过程中的关键酶,首次提出菌株N47具有还原性乙酰-CoA/CO脱氢酶途径和完整的TCA循环。然而,针对每种多环芳烃降解通路的特异性蛋白以及代谢途径的关键酶还有待进一步研究。
代谢组学[60]研究的是菌体内源呼吸所产生代谢物质的整体动态以及变化规律,可以理解为菌体胞外PAHs降解和胞内代谢物质利用所构成的PAHs复杂代谢网络。早期的研究[37]发现萘的厌氧降解先通过微生物的羧合作用生成2-萘酸。然而,进一步研究[34]以硫酸盐作为电子受体的还原体系中,2-萘酸不是萘厌氧分解的直接羧合产物,而是借助体系中的CO2通过乙酰-CoA途径甲基化生成2-甲基萘,2-甲基萘再被氧化成中间代谢产物萘甲酰-CoA,最后通过富马酸盐加成反应降解成简单物质(图 1)。这一代谢通路也在Safinowski等[61]的研究中得以证实。Safinowski等[61]发现使用氘萘进行微生物降解时,能够检测到两种含有氘的代谢产物,分别是2-萘甲基琥珀酸和2-萘亚甲基琥珀酸,进而推测萘可能先甲基化生成2-甲基萘,随后进入2-甲基萘的降解途径。由此可见,通过代谢组学分析PAHs的厌氧降解产物可以为基于基因水平、蛋白质水平所构建的代谢通路及网络提供更直接的证据。

|
| 图 1 硫酸盐呼吸耦合萘的两种厌氧降解途径 Figure 1 Two proposed pathway of anaerobic degradation in respiration coupled polycyclic aromatic hydrocarbons with sulfate |
|
|
硫酸盐呼吸耦合PAHs厌氧降解的生物化学反应化学计量式:
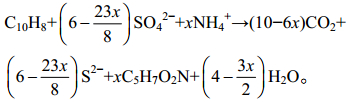
|
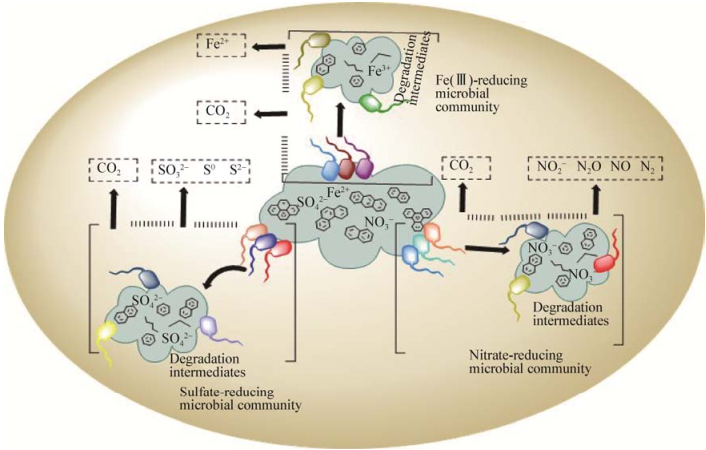
截至目前,在水体沉积物中所开展的大量实验研究[25, 62]仍主要集中在调查微生物群落对PAHs污染的响应,以及基于OTU (Operational taxonomic unit)相关菌群所呈现的丰度变化(α、β多样性)间接地表征系统的稳定性。但是,对于沉积物环境的生态系统功能而言,该系统中的微生物通过物质、能量的相互交换所形成的复杂生态网络比丰度更重要[63-64]。Brenner等[65]的研究也表明微生物之间所形成的复杂生态网络是通过代谢产物或者释放小分子信号等方式进行交流的。另外,在沉积物环境中普遍存在各种电子受体(硝酸盐、Fe(Ⅲ)、硫酸盐)呼吸耦合PAHs降解的微生物生态网络(图 2)。在这个生态网络中存在能够厌氧降解高环PAHs的微生物菌群,同时产生的中间代谢产物(低环PAHs、芳香烃断裂产生的直链烷烃)又被其它微生物菌群呼吸利用[66]。通过物质转化和能量流动逐步使菌群中的不同菌体实现功能分工,最终完成群落的总体任务,共同维持水体沉积物中微生物生态系统的循环和稳定。
|
| 图 2 水体沉积物中PAHs厌氧降解的微生物生态网络 Figure 2 Microbial ecological networks of anaerobic degradation for PAHs in aquatic sediments |
|
|
尽管近几年利用硝酸盐、铁(Ⅲ)、硫酸盐等电子受体加速厌氧水体沉积物中PAHs原位降解转化的相关研究取得了较好的进展,但是相关的厌氧呼吸耦合PAHs降解转化的机理仍有待进一步研究。重点需要解决以下几个方面的问题:
(1) 不同电子受体条件下微生物厌氧降解转化PAHs的代谢途径亟待阐明
通过投加电子受体促进PAHs降解转化的技术已广泛应用于水体沉积物污染治理中。由于水体沉积物具有较强的异质性且微生物的群落结构复杂,目前有关电子受体促进水体沉积物中PAHs降解转化的研究主要是基于处理前后多环芳烃含量的变化来判断,对于不同电子受体条件下微生物厌氧降解转化PAHs的代谢途径了解极少。然而相关代谢途径的阐明却是我们合理选择和投加电子受体、调控微生物厌氧呼吸活性,进而促进PAHs降解转化的重要理论基础。
(2) 水体沉积物中高环PAHs的强化降解脱毒菌群合成工作亟待开展
由于PAHs的疏水性通常随环数的增加而提高,因此水体沉积物中高环PAHs的污染更加突出。但是,过去有关多环芳烃的降解研究多是局限于低环的PAHs,而高环PAHs的降解机理还处于研究探索阶段,主要原因在于高环PAHs的结构相当稳定,纯菌极少能够独立完成对这类污染物进行降解转化,而是需要多种微生物组成代谢网络共同发挥作用。随着组学技术、高通量选育技术及合成生物学技术的发展,有望突破传统微生物分离选育技术的局限性,通过大量挖掘PAHs降解相关的功能基因或蛋白质,构建高环PAHs高效降解菌群,解决水体沉积物中高环PAHs大量累积的污染问题。
(3) 复合污染水体沉积物中PAHs的降解脱毒网络调控机制亟待揭示
微生物在环境中通常是组合代谢网络共同发挥作用,复合污染水体沉积物中微生物降解转化PAHs的作用方式更是如此。这些微生物之间会通过碳循环、氮循环、硫循环等过程相互关联,以此对抗复合污染胁迫,促进PAHs的脱毒降解,甚至进一步矿化为CO2和水。因此,研究阐明复合污染水体沉积物中PAHs降解脱毒代谢网络调控机制,是通过人工调控水体沉积物微环境、构建PAHs降解脱毒代谢网络、加速PAHs污染水体沉积物原位修复的重要理论指导。然而,由于水体沉积物的异质性和微生物群落的复杂性、难培养性,以及单个菌体进化过程中的变异性和难以预测性,给代谢网络的调控带来了极大的挑战。随着微宇宙技术、宏基因组学、单细胞生物学、生物信息学及计算生物学等技术手段的发展,有望通过理论预测与实验验证的紧密结合而使代谢网络研究方法得到不断的改进和优化,从而为揭示复合污染水体沉积物中PAHs降解脱毒网络调控机制提供关键的技术支撑。
| [1] |
Chen SY, Lü WG, Zhang JQ, et al. Review on isolation of naphthalene degradation bacterium in different habitats and the combined remediation[J]. Environmental Science & Technology, 2017, 40(7): 152-159. (in Chinese) 陈思尹, 吕卫光, 张娟琴, 等. 萘降解菌的分离及其联合修复作用的研究进展[J]. 环境科学与技术, 2017, 40(7): 152-159. |
| [2] |
Burgess RM, Berry WJ, Mount DR, et al. Mechanistic sediment quality guidelines based on contaminant bioavailability: equilibrium partitioning sediment benchmarks[J]. Environmental Toxicology and Chemistry, 2013, 32(1): 102-114. DOI:10.1002/etc.2025 |
| [3] |
Gómez J, Rodríguez SD, Pazos M, et al. Applicability of Coriolopsis rigida for biodegradation of polycyclic aromatic hydrocarbons[J]. Biotechnology Letters, 2006, 28(13): 1013-1017. DOI:10.1007/s10529-006-9039-1 |
| [4] |
Murray JR, Penning TM. Carcinogenic polycyclic aromatic hydrocarbons[A]//Comprehensive Toxicology[M]. Oxford: Elsevier, 2018: 87-153
|
| [5] |
Zheng ZW, Li KM, Zhu F, et al. Overviews of biodegradation of PAHs and in situ remediation of PAHs-contaminated sediment[J]. Environmental Science & Technology, 2010, 33(6): 49-53, 104. (in Chinese) 郑政伟, 李开明, 朱芳, 等. 底泥中多环芳烃的微生物降解与原位修复技术[J]. 环境科学与技术, 2010, 33(6): 49-53, 104. |
| [6] |
Keith L, Telliard W. ES & T special report: priority pollutants: I-a perspective view[J]. Environmental Science & Technology, 1979, 13(4): 416-423. |
| [7] |
Baumard P, Budzinski H, Michon Q, et al. Origin and bioavailability of PAHs in the Mediterranean Sea from mussel and sediment Records[J]. Estuarine, Coastal and Shelf Science, 1998, 47(1): 77-90. DOI:10.1006/ecss.1998.0337 |
| [8] |
Deng DY, Qiu MD, Sun GP, et al. Distribution and potential ecological risk of polycyclic aromatic hydrocarbons in the sediments from typical electronics industrial zone[J]. Environmental Science, 2012, 33(6): 1801-1807. (in Chinese) 邓代永, 邱孟德, 孙国萍, 等. 典型电器工业区河涌沉积物中多环芳烃的分布、来源和潜在生态风险[J]. 环境科学, 2012, 33(6): 1801-1807. |
| [9] |
Ou DN, Liu M, Xu SY, et al. Distribution and origin of polycyclic aromatic hydrocarbons in suspended particulate matters from the Yangtze Estuarine and nearby coastal areas[J]. Environmental Science, 2008, 29(9): 2392-2398. (in Chinese) 欧冬妮, 刘敏, 许世远, 等. 长江口近岸水体悬浮颗粒物多环芳烃分布与来源辨析[J]. 环境科学, 2008, 29(9): 2392-2398. DOI:10.3321/j.issn:0250-3301.2008.09.002 |
| [10] |
White JC, Triplett T. Polycyclic aromatic hydrocarbons (PAHs) in the sediments and fish of the Mill River, New Haven, Connecticut, USA[J]. Bulletin of Environmental Contamination and Toxicology, 2002, 68(1): 104-110. DOI:10.1007/s00128-001-0225-5 |
| [11] |
Ko FC, Baker J, Fang MD, et al. Composition and distribution of polycyclic aromatic hydrocarbons in the surface sediments from the Susquehanna River[J]. Chemosphere, 2007, 66(2): 277-285. DOI:10.1016/j.chemosphere.2006.05.033 |
| [12] |
Woodhead RJ, Law RJ, Matthiessen P. Polycyclic aromatic hydrocarbons in surface sediments around England and Wales, and their possible biological significance[J]. Marine Pollution Bulletin, 1999, 38(9): 773-790. DOI:10.1016/S0025-326X(99)00039-9 |
| [13] |
Vane CH, Harrison I, Kim AW. Assessment of polyaromatic hydrocarbons (PAHs) and polychlorinated biphenyls (PCBs) in surface sediments of the Inner Clyde Estuary, UK[J]. Marine Pollution Bulletin, 2007, 54(8): 1301-1306. DOI:10.1016/j.marpolbul.2007.04.005 |
| [14] |
Yim UH, Hong SH, Shim WJ. Distribution and characteristics of PAHs in sediments from the marine environment of Korea[J]. Chemosphere, 2007, 68(1): 85-92. DOI:10.1016/j.chemosphere.2006.12.032 |
| [15] |
Rockne KJ, Chee-Sanford JC, Sanford RA, et al. Anaerobic naphthalene degradation by microbial pure cultures under nitrate-reducing conditions[J]. Applied and Environmental Microbiology, 2000, 66(4): 1595-1601. DOI:10.1128/AEM.66.4.1595-1601.2000 |
| [16] |
Eriksson M, Sodersten E, Yu ZT, et al. Degradation of polycyclic aromatic hydrocarbons at low temperature under aerobic and nitrate-reducing conditions in enrichment cultures from Northern soils[J]. Applied and Environmental Microbiology, 2003, 69(1): 275-284. DOI:10.1128/AEM.69.1.275-284.2003 |
| [17] |
Coates JD, Anderson RT, Woodward JC, et al. Anaerobic hydrocarbon degradation in petroleum-contaminated harbor sediments under sulfate-reducing and artificially imposed iron-reducing conditions[J]. Environmental Science & Technology, 1996, 30(9): 2784-2789. |
| [18] |
Lu XY, Zhang T, Fang HHP. Bacteria-mediated PAH degradation in soil and sediment[J]. Applied Microbiology and Biotechnology, 2011, 89(5): 1357-1371. DOI:10.1007/s00253-010-3072-7 |
| [19] |
McNally DL, Mihelcic JR, Lueking DR. Biodegradation of three- and four-ring polycyclic aromatic hydrocarbons under aerobic and denitrifying conditions[J]. Environmental Science & Technology, 1998, 32(17): 2633-2639. |
| [20] |
Avrahamov N, Antler G, Yechieli Y, et al. Anaerobic oxidation of methane by sulfate in hypersaline groundwater of the Dead Sea aquifer[J]. Geobiology, 2014, 12(6): 511-528. DOI:10.1111/gbi.12095 |
| [21] |
Lovley DR, Phillips EJP. Rapid assay for microbially reducible ferric iron in aquatic sediments[J]. Applied and Environmental Microbiology, 1987, 53(7): 1536-1540. |
| [22] |
Ribeiro H, De Sousa T, Santos JP, et al. Potential of dissimilatory nitrate reduction pathways in polycyclic aromatic hydrocarbon degradation[J]. Chemosphere, 2018, 199: 54-67. DOI:10.1016/j.chemosphere.2018.01.171 |
| [23] |
Rockne KJ, Strand SE. Anaerobic biodegradation of naphthalene, phenanthrene, and biphenyl by a denitrifying enrichment culture[J]. Water Research, 2001, 35(1): 291-299. |
| [24] |
Rockne KJ, Strand SE. Biodegradation of bicyclic and polycyclic aromatic hydrocarbons in anaerobic enrichments[J]. Environmental Science & Technology, 1998, 32(24): 3962-3967. |
| [25] |
Abercron SMMV, Pacheco D, Benito-Santano P, et al. Polycyclic aromatic hydrocarbon-induced changes in bacterial community structure under anoxic nitrate reducing conditions[J]. Frontiers in Microbiology, 2016, 7: 1775. |
| [26] |
Yang XN, Ye JX, Lyu LM, et al. Anaerobic biodegradation of pyrene by Paracoccus denitrificans under various nitrate/nitrite-reducing conditions[J]. Water, Air, & Soil Pollution, 2013, 224: 1578. |
| [27] |
Xu MY, He ZL, Zhang Q, et al. Responses of Aromatic-degrading microbial communities to elevated nitrate in sediments[J]. Environmental Science & Technology, 2015, 49(20): 12422-12431. |
| [28] |
Liu J, Deng DY, Sun GP, et al. Effects of nitrate on organic removal and microbial community structure in the sediments[J]. Environmental Science, 2013, 34(7): 2847-2854. (in Chinese) 刘近, 邓代永, 孙国萍, 等. 硝酸盐对沉积物中有机物氧化减量及微生物群落结构的影响[J]. 环境科学, 2013, 34(7): 2847-2854. |
| [29] |
Yang XN, Chen ZF, Wu QH, et al. Enhanced phenanthrene degradation in river sediments using a combination of biochar and nitrate[J]. Science of the Total Environment, 2018, 619-620: 600-605. DOI:10.1016/j.scitotenv.2017.11.130 |
| [30] |
Xia CY, Xu MY, Liu J, et al. Sediment microbial fuel cell prefers to degrade organic chemicals with higher polarity[J]. Bioresource Technology, 2015, 190: 420-423. DOI:10.1016/j.biortech.2015.04.072 |
| [31] |
Yan ZS, Song N, Cai HY, et al. Enhanced degradation of phenanthrene and pyrene in freshwater sediments by combined employment of sediment microbial fuel cell and amorphous ferric hydroxide[J]. Journal of Hazardous Materials, 2012, 199-200: 217-225. DOI:10.1016/j.jhazmat.2011.10.087 |
| [32] |
Li CH, Wong YS, Tam NFY. Anaerobic biodegradation of polycyclic aromatic hydrocarbons with amendment of iron(Ⅲ) in mangrove sediment slurry[J]. Bioresource Technology, 2010, 101(21): 8083-8092. DOI:10.1016/j.biortech.2010.06.005 |
| [33] |
Lovley DR, Woodward JC, Chapelle FH. Stimulated anoxic biodegradation of aromatic hydrocarbons using Fe(Ⅲ) ligands[J]. Nature, 1994, 370(6485): 128-131. DOI:10.1038/370128a0 |
| [34] |
Zhang XM, Young LY. Carboxylation as an initial reaction in the anaerobic metabolism of naphthalene and phenanthrene by sulfidogenic consortia[J]. Applied and Environmental Microbiology, 1997, 63(12): 4759-4764. |
| [35] |
Musat F, Galushko A, Jacob J, et al. Anaerobic degradation of naphthalene and 2-methylnaphthalene by strains of marine sulfate-reducing bacteria[J]. Environmental Microbiology, 2009, 11(1): 209-219. DOI:10.1111/emi.2009.11.issue-1 |
| [36] |
Rothermich MM, Hayes LA, Lovley DR. Anaerobic, sulfate-dependent degradation of polycyclic aromatic hydrocarbons in petroleum-contaminated harbor sediment[J]. Environmental Science & Technology, 2002, 36(22): 4811-4817. |
| [37] |
Coates JD, Anderson RT, Lovley DR. Oxidation of polycyclic aromatic hydrocarbons under sulfate-reducing conditions[J]. Applied and Environmental Microbiology, 1996, 62(3): 1099-1101. |
| [38] |
Coates JD, Woodward J, Allen J, et al. Anaerobic degradation of polycyclic aromatic hydrocarbons and alkanes in petroleum-contaminated marine harbor sediments[J]. Applied and Environmental Microbiology, 1997, 63(9): 3589-3593. |
| [39] |
Kümmel S, Herbst FA, Bahr A, et al. Anaerobic naphthalene degradation by sulfate-reducing Desulfobacteraceae from various anoxic aquifers[J]. FEMS Microbiology Ecology, 2015, 91(3): fiv006. |
| [40] |
Bergmann F, Selesi D, Weinmaier T, et al. Genomic insights into the metabolic potential of the polycyclic aromatic hydrocarbon degrading sulfate-reducing Deltaproteobacterium N47[J]. Environmental Microbiology, 2011, 13(5): 1125-1137. DOI:10.1111/emi.2011.13.issue-5 |
| [41] |
Selesi D, Jehmlich N, Von Bergen M, et al. Combined genomic and proteomic approaches identify gene clusters involved in anaerobic 2-methylnaphthalene degradation in the sulfate-reducing enrichment culture N47[J]. Journal of Bacteriology, 2010, 192(1): 295-306. DOI:10.1128/JB.00874-09 |
| [42] |
Lei L, Khodadoust AP, Suidan MT, et al. Biodegradation of sediment-bound PAHs in field-contaminated sediment[J]. Water Research, 2005, 39(2-3): 349-361. DOI:10.1016/j.watres.2004.09.021 |
| [43] |
Chang BV, Chang SW, Yuan SY. Anaerobic degradation of polycyclic aromatic hydrocarbons in sludge[J]. Advances in Environmental Research, 2003, 7(3): 623-628. DOI:10.1016/S1093-0191(02)00047-3 |
| [44] |
Yuan SY, Chang BV. Anaerobic degradation of five polycyclic aromatic hydrocarbons from river sediment in Taiwan[J]. Journal of Environmental Science and Health Part B, 2007, 42(1): 63-69. DOI:10.1080/03601230601020860 |
| [45] |
Dou JF, Liu X, Ding AZ. Anaerobic degradation of naphthalene by the mixed bacteria under nitrate reducing conditions[J]. Journal of Hazardous Materials, 2009, 165(1/3): 325-331. |
| [46] |
Zhu BL, Bradford L, Huang SC, et al. Unexpected diversity and high abundance of putative nitric oxide dismutase (Nod) genes in contaminated aquifers and wastewater treatment systems[J]. Applied and Environmental Microbiology, 2017, 83(4): AEM.02750-16. |
| [47] |
Ettwig KF, Speth DR, Reimann J, et al. Bacterial oxygen production in the dark[J]. Frontiers in Microbiology, 2012, 3: 273. |
| [48] |
Xu M, Zhang Q, Xia C, et al. Elevated nitrate enriches microbial functional genes for potential bioremediation of complexly contaminated sediments[J]. The ISME Journal, 2014, 8(9): 1932-1944. DOI:10.1038/ismej.2014.42 |
| [49] |
Seeliger S, Cord-Ruwisch R, Schink B. A periplasmic and extracellular c-type cytochrome of Geobacter sulfurreducens acts as a ferric iron reductase and as an electron carrier to other acceptors or to partner bacteria[J]. Journal of Bacteriology, 1998, 180(14): 3686-3691. |
| [50] |
Cummings DE, March AW, Bostick B, et al. Evidence for microbial Fe(Ⅲ) reduction in anoxic, mining-impacted lake sediments (Lake Coeur d'Alene, Idaho)[J]. Applied and Environmental Microbiology, 2000, 66(1): 154-162. DOI:10.1128/AEM.66.1.154-162.2000 |
| [51] |
Aitken CM, Jones DM, Maguire MJ, et al. Evidence that crude oil alkane activation proceeds by different mechanisms under sulfate-reducing and methanogenic conditions[J]. Geochimica Et Cosmochimica Acta, 2013, 109: 162-174. DOI:10.1016/j.gca.2013.01.031 |
| [52] |
Gutierrez T, Singleton DR, Berry D, et al. Hydrocarbon-degrading bacteria enriched by the Deepwater Horizon oil spill identified by cultivation and DNA-SIP[J]. The ISME Journal, 2013, 7(11): 2091-2104. DOI:10.1038/ismej.2013.98 |
| [53] |
Chang BV, Shiung LC, Yuan SY. Anaerobic biodegradation of polycyclic aromatic hydrocarbon in soil[J]. Chemosphere, 2002, 48(7): 717-724. DOI:10.1016/S0045-6535(02)00151-0 |
| [54] |
Dombrowski N, Donaho JA, Gutierrez T, et al. Reconstructing metabolic pathways of hydrocarbon-degrading bacteria from the Deepwater Horizon oil spill[J]. Nature Microbiology, 2016, 1(7): 16057. DOI:10.1038/nmicrobiol.2016.57 |
| [55] |
Faust K, Raes J. Microbial interactions: from networks to models[J]. Nature Reviews Microbiology, 2012, 10(8): 538-550. DOI:10.1038/nrmicro2832 |
| [56] |
O'Brien EJ, Monk JM, Palsson BO. Using genome-scale models to predict biological capabilities[J]. Cell, 2015, 161(5): 971-987. DOI:10.1016/j.cell.2015.05.019 |
| [57] |
Zhu Y, Czauderna T, Zhao J, et al. Genome-scale metabolic modeling of responses to polymyxins in Pseudomonas aeruginosa[J]. GigaScience, 2018. DOI:10.1093/gigascience/giy021 |
| [58] |
DiDonato RJ Jr, Young ND, Butler JE, et al. Genome sequence of the Deltaproteobacterial strain NaphS2 and analysis of differential gene expression during anaerobic growth on naphthalene[J]. PLoS One, 2010, 5(11): e14072. DOI:10.1371/journal.pone.0014072 |
| [59] |
Chin KJ, Sharma ML, Russell LA, et al. Quantifying expression of a dissimilatory (bi) sulfite reductase gene in petroleum-contaminated marine harbor sediments[J]. Microbial Ecology, 2008, 55(3): 489-499. DOI:10.1007/s00248-007-9294-2 |
| [60] |
Nicholson JK, Lindon JC. Systems biology: metabonomics[J]. Nature, 2008, 455(7216): 1054-1056. DOI:10.1038/4551054a |
| [61] |
Safinowski M, Meckenstock RU. Methylation is the initial reaction in anaerobic naphthalene degradation by a sulfate-reducing enrichment culture[J]. Environmental Microbiology, 2006, 8(2): 347-352. DOI:10.1111/emi.2006.8.issue-2 |
| [62] |
Xie YW, Wang JZ, Wu Y, et al. Using in situ bacterial communities to monitor contaminants in river sediments[J]. Environmental Pollution, 2016, 212: 348-357. |
| [63] |
Jeanbille M, Gury J, Duran R, et al. Response of core microbial consortia to chronic hydrocarbon contaminations in coastal sediment habitats[J]. Frontiers in Microbiology, 2016, 7: 1637. |
| [64] |
Montoya JM, Pimm SL, Solé RV. Ecological networks and their fragility[J]. Nature, 2006, 442(7100): 259-264. DOI:10.1038/nature04927 |
| [65] |
Brenner K, You LC, Arnold FH. Engineering microbial consortia: a new frontier in synthetic biology[J]. Trends in Biotechnology, 26(9): 483-489
|
| [66] |
Daghio M, Vaiopoulou E, Patil SA, et al. Anodes stimulate anaerobic toluene degradation via sulfur cycling in marine sediments[J]. Applied and Environmental Microbiology, 2016, 82(1): 297-307. DOI:10.1128/AEM.02250-15 |
 2019, Vol. 46
2019, Vol. 46




