扩展功能
文章信息
- 杨莹, 张娇娇, 卜宁, 董彩虹
- YANG Ying, ZHANG Jiao-Jiao, BU Ning, DONG Cai-Hong
- 氮源对蛹虫草生长及类胡萝卜素产生的影响
- Effect of nitrogen sources on the growth and carotenoid production in Cordyceps militaris
- 微生物学通报, 2019, 46(1): 130-138
- Microbiology China, 2019, 46(1): 130-138
- DOI: 10.13344/j.microbiol.china.180404
-
文章历史
- 收稿日期: 2018-05-24
- 接受日期: 2018-07-04
- 网络首发日期: 2018-07-20
2. 中国科学院微生物研究所 真菌学国家重点实验室 北京 100101
2. State Key Laboratory of Mycology, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
蛹虫草[Cordyceps militaris (L.) Fr.],又名北虫草、北冬虫夏草,是一种具有营养和滋补作用的珍稀食药用真菌。蛹虫草富含虫草酸、虫草多糖、核苷类等多种活性成分,具有抗肿瘤、抗炎、抗衰老、抗氧化和提高免疫力等多种功效[1]。当前已经在东亚地区被广泛用作滋补品及药用菌,我国卫生部于2009年3月16日正式将其列为新资源食品(中华人民共和国卫生部公告2009年第3号,http://www.moh.gov.cn/publicfiles/business/htmlfiles/zwgkzt/pgg/200903/39591.htm)。蛹虫草还含有独特的活性成分虫草素和喷司他丁[2],引起了研究者广泛关注。
蛹虫草子实体呈现鲜艳的橘黄色,证实其为类胡萝卜素类[3],类胡萝卜素含量是评价其子实体品质的重要指标之一[4]。付鸣佳等[5]和张志军等[6]报道了类胡萝卜素的提取方法;已经从蛹虫草中分离出叶黄素[7]、玉米黄素[8]和北虫草黄素[9]。目前的研究集中于蛹虫草色素的提取及稳定性[10-11]。
对于蛹虫草而言,光照是其子实体发育、色素产生的必要条件[3, 12]。殷林等[11]优化了蛹虫草在谷物培养基中液体培养产类胡萝卜素的条件,但是仅限于各种谷物的配比。蛹虫草黑暗摇瓶培养2 d后蓝光静置培养数天,培养基表面菌丝产生类胡萝卜素[13],不同波长光对菌丝体生长及类胡萝卜素含量的影响研究发现,蓝光和白光有利于类胡萝卜素的合成[14]。本团队对蛹虫草类胡萝卜素的产生条件进行了系列研究,除白化菌株外,光照刺激促进蛹虫草菌丝色素的形成,而且蓝光的作用优于白光[12];蓝光光照条件下子实体类胡萝卜素含量极显著高于自然光光照[15],栽培后期热胁迫有助于类胡萝卜素的产生[16]。除此之外,对于影响类胡萝卜素产生的条件和调控鲜有报道。
氮源作为真菌生长发育不可缺少的营养因子,同时可以调节代谢产物的产生[17]。蛹虫草中已有的研究表明氮源调节其虫草酸、虫草多糖[18]、虫草蛋白[19]和虫草素[20]的产生,促进菌丝生长量的增加[21]。红曲霉的研究中证实氮源影响类胡萝卜素产生[22],无机氮源中NH4+促进红曲霉S产黄色素,NO3-促进红曲霉S产红色素[23];朱振元等[24]的研究证明蛋白胨有利于中国拟青霉色素的合成。目前为止还没有氮源对蛹虫草色素产生调控的研究。
作为一种新食品原料,蛹虫草的营养和保健功能越来越得到人们的认可,但是目前市场上子实体产品的质量参差不齐,各种有效成分差异很大。本研究通过研究不同的氮源种类及其浓度对蛹虫草类胡萝卜素产生的调控作用,为蛹虫草子实体的优质栽培提供依据。
1 材料与方法 1.1 供试菌株本实验室保存蛹虫草菌株,编号633。
1.2 主要试剂和仪器甲醇、丙酮、石油醚、2, 6-二叔丁基-4-甲基苯酚(BHT)、氯化铵、柠檬酸铵、硝酸铵、硝酸钠,国药集团化学试剂有限公司;硝酸钠、磷酸氢二钾、氯化钾、七水硫酸镁、七水硫酸亚铁、蔗糖,北京现代东方精细化学有限公司;蛋白胨和酵母提取物,安琪酵母股份有限公司;甘氨酸,上海金畔生物科技有限公司;谷氨酸,宝如亿(北京)生物技术有限公司;琼脂粉,北京鼎国昌盛生物技术有限责任公司。
生化培养箱,上海博讯实业有限公司医疗设备厂;台式高速离心机,湖南赫西仪器装备有限公司;分光光度计,尤尼柯仪器有限公司(上海);电热鼓风干燥箱,上海一恒科学仪器有限公司。
1.3 不同氮源培养基查氏培养基(g/L):硝酸钠3.0,磷酸氢二钾1.0,氯化钾0.5,七水硫酸镁0.5,七水硫酸亚铁0.01,蔗糖30.0,琼脂15.0,pH 6.0-6.5。
以查氏培养基为基础培养基,按照硝酸钠的氮含量(16.5%),计算其他氮源的添加量以保证各种氮源培养基中氮含量一致(表 1)。采用打孔器(Φ=1.0 cm)在菌种平板边缘打孔,接种于上述氮源培养基,12 h白光/12 h黑暗,光照强度735 lx,20 ℃培养20 d,观察菌落形态,十字交叉法测定菌落生长速度,血球计数板测定产孢量。
| 氮源种类 Classification |
氮源 Nitrogen source |
氮含量 Nitrogen content (%) |
添加量 Amount (g/L) |
| 氨基酸Amino acid | 甘氨酸Glycine | 18.6 | 2.6 |
| 谷氨酸Glutamic acid | 9.5 | 5.2 | |
| 无机氮源Inorganic nitrogen | 氯化铵Ammonium chloride | 26.2 | 1.9 |
| 柠檬酸铵Ammonium citrate | 17.3 | 2.9 | |
| 硝酸铵Ammonium nitrate | 35.4 | 1.4 | |
| 硝酸钠Sodium nitrate | 16.5 | 3.0 | |
| 有机氮源Organic nitrogen | 蛋白胨Peptone | 12.5 | 4.0 |
| 黄豆粉Soybean flour | 5.2 | 9.5 | |
| 酵母提取物Yeast extract | 12.7 | 3.9 | |
| 麦麸Wheat bran | 10.0 | 4.9 |
以PDA为基础培养基,配制不同浓度的蛋白胨PDA固体培养基,1×105 Pa灭菌30 min。接种,20 ℃避光培养20 d,光照3 d,观察菌落形态及其颜色变化。
液体培养基配制方法同固体培养基(不添加琼脂粉),装液量80 mL/250 mL三角瓶,1×105 Pa灭菌30 min。采用打孔器(Φ=1.0 cm)在菌种平板边缘打孔,每瓶接种6块,20 ℃避光振荡培养4 d,转至20 ℃白光(735 lx)静置培养7 d。收取菌膜,观察其形态,并测定类胡萝卜素含量。
1.5 蛹虫草子实体栽培蛹虫草子实体栽培方法参考Guo等[25],在营养液中添加不同浓度的蛋白胨,并在不同光照条件下(白光735 lx,蓝光19.3 lx)培养35 d,观察子实体颜色变化,测定子实体鲜重,计算生物转化率并测定类胡萝卜素含量。
生物转化率根据以下公式计算:

|
类胡萝卜素含量测定采用酸热法破壁,丙酮:石油醚=4:1 (体积比)混合溶剂作为提取剂[4]。0.3 g样品加入4.5 mL 1 mol/L HCl,加入0.1% BHT以防止氧化,浸提30 min,沸水煮4 min,立即冰上冷却,5 000 r/min离心10 min,弃上清,水洗2次,最后一次离心转速提到8 000 r/min (避光)。弃上清,加入4.5 mL丙酮:石油醚=4:1 (体积比)混合溶剂,提取30 min,提取2次,合并提取液。采用紫外分光光度计在445 nm处测定提取液的吸光度值,并通过下列公式计算其含量:

|
式中,A:吸光度值;V:提取试剂的体积;D:稀释倍数;0.16:消光系数;W:蛹虫草子实体干重(g)。
1.7 数据分析所有试验数据分析采用SPSS 19.0统计学软件,Excel绘制图表。计算平均值、标准差,并进行单因素方差分析,以Duncan’s新复极差法进行多重比较,确定差异显著性。
2 结果与分析 2.1 不同氮源对蛹虫草生长的影响 2.1.1 菌落形态菌株633在不添加氮源的对照培养基中长势微弱,仅有稀疏的菌丝生长;在所有供试氮源培养基中,633菌丝长势明显强于不添加氮源的对照组(图 1)。在无机氮源(硝酸钠、硝酸铵、氯化铵、柠檬酸铵)和氨基酸(甘氨酸、谷氨酸)为氮源的培养基中,气生菌丝均较厚,除了谷氨酸、氯化铵、硝酸钠、硝酸铵平板背面有微量色素产生外,其他培养基平板正面和背面均几乎不转色。4种有机氮源培养基中蛹虫草菌丝生长形态和颜色差别较大,胰蛋白胨、酵母提取物培养基中,菌丝转色明显,呈橙黄色,气生菌丝致密且生长旺盛;麦麸培养基中,菌落最大,但是菌丝贴附于培养基生长,长势微弱、生长稀疏,呈荧光黄;黄豆粉培养基中菌落大小仅次于麦麸培养基,菌丝贴附于培养基生长,呈白色,菌落背面呈现微红色,菌落有明显的节律圈(图 1)。
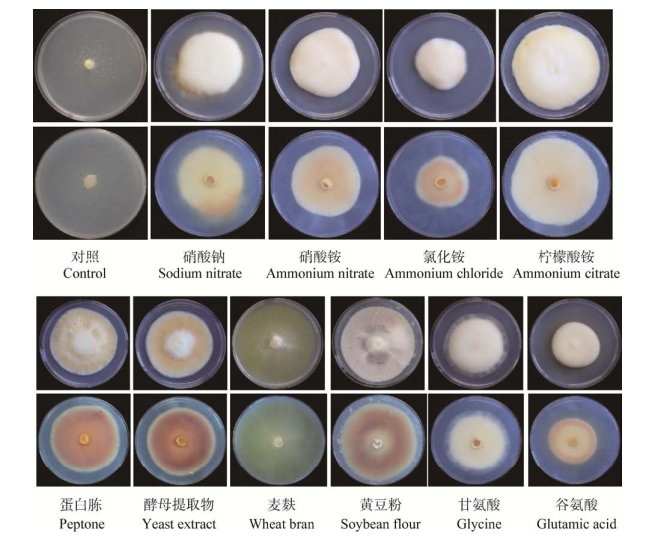
|
| 图 1 不同氮源培养基中蛹虫草菌落形态差异 Figure 1 Colony of Cordyceps militaris cultured on media with different nitrogen sources |
|
|
总体来看(表 2),蛹虫草菌株在有机氮源培养基中的生长速度高于无机氮源和氨基酸为氮源的培养基。在麦麸为氮源的培养基中生长最快,显著高于黄豆粉以外的其他氮源培养基(P < 0.01);在胰蛋白胨和酵母提取物培养基中,其菌落生长速度虽然较麦麸和黄豆粉培养基稍慢,但是菌落明显致密,气生菌丝更旺盛。在无机氮源培养基中,氯化铵培养基中生长最慢,蛹虫草在柠檬酸铵为氮源的培养基中生长较快,显著高于其他的无机氮源培养基(P < 0.01)。
| 氮源种类 Classification |
氮源 Nitrogen source |
生长速度 Growth rate (mm/d) |
产孢量 Conidia production (×106/dish) |
| 氨基酸Amino acid | 甘氨酸Glycine | 3.34±0.23D | 10.92±0.58C |
| 谷氨酸Glutamic acid | 2.48±0.05F | 7.42±0.72C | |
| 无机氮源Inorganic nitrogen | 氯化铵Ammonium chloride | 2.30±0.13F | 2.92±0.52C |
| 柠檬酸铵Ammonium citrate | 3.46±0.40CD | 8.00±3.50C | |
| 硝酸铵Ammonium nitrate | 2.95±0.13E | 5.50±2.95C | |
| 硝酸钠Sodium nitrate | 2.37±0.38F | 2.83±1.28C | |
| 有机氮源Organic nitrogen | 蛋白胨Peptone | 3.66±0.50BC | 24.67±11.56B |
| 黄豆粉Soybean flour | 3.81±0.15AB | 11.83±2.67C | |
| 酵母提取物Yeast extract | 3.32±0.38D | 71.17±10.69A | |
| 麦麸Wheat bran | 4.03±0.09A | 3.92±0.29C | |
| 注:表中数据为平均值±标准差,同列数据后的不同大写字母(Duncan’s多重比较结果)表示0.01水平上的差异显著,即极显著差异. Note: Values are the mean±SD of triple determinations and values followed by the different capital letters are extremely significantly different by Duncan’s multiple range test (P < 0.01). | |||
如表 2所示,菌株633在酵母提取物及蛋白胨为氮源的培养基中分生孢子产生最多,极显著高于其他氮源培养基(P < 0.01);在NaNO3作为氮源的培养基中分生孢子产生最少。
综合生长速度、色素产生和成本考虑,选用蛋白胨研究不同浓度氮源对蛹虫草生长和色素产生的影响。
2.2 固体培养条件下不同蛋白胨浓度对蛹虫草生长的影响菌株633分别接种在0、1%、3%的蛋白胨培养基中,相同培养条件下生长速度差别不大,但是菌落颜色差异明显(图 2)。3%蛋白胨的培养基中菌落颜色最深,正面呈橘黄色,背面颜色也最深。
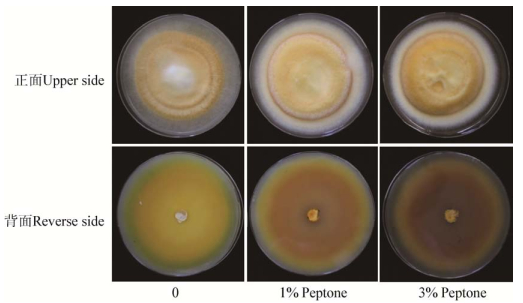
|
| 图 2 不同蛋白胨浓度培养基中蛹虫草菌落形态 Figure 2 Colony of Cordyceps militaris on the media with different peptone concentrations |
|
|
菌株633接种于不同浓度蛋白胨液体培养基中培养,形成的菌膜颜色差异明显,菌膜正面颜色随着蛋白胨浓度的增大而逐渐加深(图 3),而且菌膜背面颜色较正面更深。类胡萝卜素含量测定结果也表明3%蛋白胨浓度的培养基中形成的菌膜类胡萝卜素含量最高,达3067.80±208.07 μg/g,极显著高于其他浓度的培养基(图 4,P < 0.01),为不添加蛋白胨培养基中菌膜类胡萝卜素含量的5倍。

|
| 图 3 不同浓度蛋白胨对液体静置培养形成菌膜颜色的影响 Figure 3 Effect of peptone concentration on the color of the velum under static liquid culture |
|
|

|
| 图 4 不同蛋白胨浓度对蛹虫草菌膜类胡萝卜素含量的影响 Figure 4 Effect of peptone concentration on carotenoid production of the velum |
|
|
在蛹虫草子实体栽培培养液中添加不同浓度的蛋白胨,均表现为添加高浓度蛋白胨(5%)时子实体转化率最低,而蛋白胨浓度为1%时转化率最高。子实体颜色观察发现在各种蛋白胨浓度条件下,均表现为蓝光光照颜色深于白光光照,类胡萝卜素含量测定结果与肉眼观察结果一致(表 3)。两种光照条件下均表现为蛋白胨浓度为1%时类胡萝卜素含量高于其他蛋白胨浓度。所有处理中蓝光光照条件、蛋白胨浓度为1%时生物转化率和类胡萝卜素含量均为最高。
| 蛋白胨浓度 Peptone concentration (%) |
生物转化率 Biological efficiency (%) |
类胡萝卜素含量 Carotenoid yield (μg/g) |
|||
| 白光 White light |
蓝光 Blue light |
白光 White light |
蓝光 Blue light |
||
| 0 | 71.00±0.91ab | 70.63±4.33ab | 2 193.75±290.63b | 2 943.75±301.75b | |
| 1 | 78.00±1.22a | 78.75±1.94a | 2 809.38±386.24a | 4 093.75±518.37a | |
| 3 | 73.34±3.12ab | 69.25±1.94b | 2 225.00±349.06b | 3 275.00±564.16b | |
| 5 | 63.63±1.44b | 59.63±3.22c | 1 968.75±110.53b | 3 375.00±525.00ab | |
| 注:表中数据为平均值±标准差,同列数据后的不同小写字母(Duncan’s多重比较结果)表示0.05水平上的差异显著. Note: Values are the mean±SD of triple determinations and values followed by the different letters are significantly different by Duncan’s multiple range test (P < 0.05). | |||||
天然类胡萝卜素除了能作为食品添色外,还具有较高的营养和保健价值,几乎所有类胡萝卜素均有抗氧化、增强免疫力、防止紫外线损伤、抗心血管疾病和抗癌等功能[26]。类胡萝卜素作为食品添加剂和营养增补剂,已经得到FDA (Food and drug administration)、欧洲共同体、WHO (World health organization)等国际组织的认可,蛹虫草作为天然类胡萝卜素的来源,研究其代谢产生具有重要意义。我们通过研究氮源及其浓度对蛹虫草生长和类胡萝卜素产生影响的结果表明,氮源种类及其浓度为蛹虫草类胡萝卜素产生的重要调控因子,为富含类胡萝卜素的蛹虫草子实体栽培提供了试验依据。
见光转色为蛹虫草子实体人工栽培中菌种质量判定的重要标准,本研究表明见光转色也和培养基中的氮源种类相关。在固体培养基培养条件下,有机氮培养基中蛹虫草转色较明显,而在无机氮培养基中基本不转色或仅有微弱转色(图 1)。在蛋白胨和酵母提取物为氮源的培养基中,菌落呈现黄色,背面为红棕色,而在麦麸培养基中呈现为荧光黄色,表现出明显的颜色差别,表明不同氮源培养基中产生的色素组分可能存在差别。赵能等[27]在研究不同氮源对牛樟芝菌丝生长的影响时也发现,不同氮源培养基中牛樟芝均可以生长,但是菌落颜色差别很大,仅有酵母提取物能得到自然状态下的红色菌体。
以蛋白胨为氮源时,其不同浓度对菌丝体和子实体类胡萝卜素合成也有调控作用。在固体培养基和液体培养基静置培养情况下,随着蛋白胨浓度的增加,平板及菌膜正反面颜色均加深。类胡萝卜素含量测定结果表明,蛋白胨浓度为3%时类胡萝卜素含量极显著高于其他处理,但是子实体栽培结果发现在白光和蓝光条件下均表现为1%蛋白胨浓度时类胡萝卜素含量最高,在栽培时可以通过调节氮源浓度影响蛹虫草子实体颜色。本研究也证实在不同的氮源浓度下,蓝光光照更有利于蛹虫草子实体类胡萝卜素的产生,这与我们之前的研究结果一致[13]。
已有的研究表明真菌中类胡萝卜素合成代谢途径的关键基因受到氮源、光照等多种因素的调控[28],蛹虫草类胡萝卜素合成途径还有待解析[16],因此氮源对蛹虫草类胡萝卜素合成调控的机制还有待深入研究。
综上所述,氮源种类和浓度影响蛹虫草菌落形态及类胡萝卜素产生。蛹虫草子实体栽培中,蓝光光照和1%蛋白胨浓度为其类胡萝卜素产生的最佳条件。本研究为蛹虫草子实体的优质栽培提供理论基础。
| [1] |
Das SK, Masuda M, Sakurai A, et al. Medicinal uses of the mushroom Cordyceps militaris: current state and prospects[J]. Fitoterapia, 2010, 81(8): 961-968. DOI:10.1016/j.fitote.2010.07.010 |
| [2] |
Xia YL, Luo FF, Shang YF, et al. Fungal cordycepin biosynthesis is coupled with the production of the safeguard molecule pentostatin[J]. Cell Chemical Biology, 2017, 24(12): 1479-1489. DOI:10.1016/j.chembiol.2017.09.001 |
| [3] |
Fu MJ. Study on the carotenoid produced from Cordyceps militaris L.[J]. Journal of Food Science and Biotechnology, 2005, 24(5): 107-110. (in Chinese) 付鸣佳. 蛹虫草产类胡萝卜素的研究[J]. 食品与生物技术学报, 2005, 24(5): 107-110. DOI:10.3321/j.issn:1673-1689.2005.05.025 |
| [4] |
Yang T, Sun JD, Lian TT, et al. Process optimization for extraction of carotenoids from medicinal caterpillar fungus, Cordyceps militaris (Ascomycetes)[J]. International Journal of Medicinal Mushrooms, 2014, 16(2): 125-135. DOI:10.1615/IntJMedMushr.v16.i2 |
| [5] |
Fu MJ, Wang XJ, Huang WF. Blue light induced carotenoid accumulation in Cordyceps militaris L.[J]. Microbiology China, 2005, 32(5): 24-28. (in Chinese) 付鸣佳, 王小菁, 黄文芳. 蓝光诱导蛹虫草菌丝类胡萝卜素的积累[J]. 微生物学通报, 2005, 32(5): 24-28. DOI:10.3969/j.issn.0253-2654.2005.05.006 |
| [6] |
Zhang ZJ, Jiang XL, Mou HJ, et al. Study of extraction conditions on the carotenoid produced from Cordyceps militaris[J]. Food Science and Technology, 2007(4): 99-103. (in Chinese) 张志军, 江晓路, 牟海津, 等. 蛹虫草类胡萝卜素提取工艺的研究[J]. 食品科技, 2007(4): 99-103. DOI:10.3969/j.issn.1005-9989.2007.04.029 |
| [7] |
Yan XT, Bao HY, Bau T. Isolation and identification of one natural pigment from cultured Cordyceps militaris[J]. Mycosystema, 2010, 29(5): 777-781. (in Chinese) 闫喜涛, 包海鹰, 图力古尔. 人工培养蛹虫草中一种天然色素的分离和结构鉴定[J]. 菌物学报, 2010, 29(5): 777-781. |
| [8] |
Chen C. Chemical study of cultured Cordyceps militaris[D]. Changchun: Master's Thesis of Jilin Agricultural University, 2012 (in Chinese) 陈策.人工蛹虫草的化学成分研究[D].长春: 吉林农业大学硕士学位论文, 2012 http://cdmd.cnki.com.cn/Article/CDMD-10193-1013126602.htm |
| [9] |
Dong JZ, Wang SH, Ai XR, et al. Composition and characterization of cordyxanthins from Cordyceps militaris fruit bodies[J]. Journal of Functional Foods, 2013, 5(3): 1450-1455. DOI:10.1016/j.jff.2013.06.002 |
| [10] |
Zhang XJ, Chen XX, Tang J, et al. Study on the stability of Cordyceps militaris yellow pigment A1[J]. Science and Technology of Food Industry, 2012, 33(18): 128-130, 134. (in Chinese) 张晓君, 陈雪香, 唐健, 等. 蛹虫草黄色素A1稳定性研究[J]. 食品工业科技, 2012, 33(18): 128-130, 134. |
| [11] |
Yin L, Lin JF, Qian J, et al. Optimization of the liquid culture medium composition for high carotenoid production by Cordyceps militaris and the investigation on the improvement of carotenoid extraction[J]. Science and Technology of Food Industry, 2017, 38(18): 79-84. (in Chinese) 殷林, 林俊芳, 钱璟, 等. 高产类胡萝卜素的蛹虫草液体培养基优化及其提取工艺研究[J]. 食品工业科技, 2017, 38(18): 79-84. |
| [12] |
Yang T, Dong CH. Photo morphogenesis and photo response of the blue-light receptor gene Cmwc-1 in different strains of Cordyceps militaris[J]. FEMS Microbiology Letters, 2014, 352(2): 190-197. DOI:10.1111/fml.2014.352.issue-2 |
| [13] |
Shen JL, Jin HY, Gao Y, et al. Two-step fermentation of carotenoid by blue light induction in Cordyceps militaris L.[J]. China Biotechnology, 2013, 33(2): 83-87. (in Chinese) 沈俊良, 金华燕, 高雅, 等. 蛹虫草蓝光诱导两步法发酵产类胡萝卜素[J]. 中国生物工程杂志, 2013, 33(2): 83-87. |
| [14] |
Wu SM, Zhou LH, Shi W, et al. Influence of light intensity on the growth and development of carotene content and body of Cordyceps militaris[J]. Guangdong Agricultural Sciences, 2013, 40(7): 24-25, 45. (in Chinese) 吴铄溟, 周礼红, 史炜, 等. 光照对蛹虫草菌丝体生长发育及类胡萝卜素含量的影响[J]. 广东农业科学, 2013, 40(7): 24-25, 45. DOI:10.3969/j.issn.1004-874X.2013.07.008 |
| [15] |
Lian TT, Dong CH, Yang T, et al. Effects of blue light on the growth and bioactive compound production of Cordyceps militaris[J]. Mycosystema, 2014, 33(4): 838-846. (in Chinese) 廉添添, 董彩虹, 杨涛, 等. 蓝光光照对蛹虫草子实体生长和主要活性成分的影响[J]. 菌物学报, 2014, 33(4): 838-846. |
| [16] |
Zhang JJ, Wang F, Liu KB, et al. Heat and light stresses affect metabolite production in the fruit body of the medicinal mushroom Cordyceps militaris[J]. Applied Microbiology and Biotechnology, 2018, 102(10): 4523-4533. DOI:10.1007/s00253-018-8899-3 |
| [17] |
Tudzynski B. Nitrogen regulation of fungal secondary metabolism in fungi[J]. Frontiers in Microbiology, 2014, 5: 656. |
| [18] |
Li F, Wang Z, Bian WY, et al. Effects of five kinds nitrogen sources on the growth and quality of Cordyceps militaris[J]. Fujian Agricultural Science and Technology, 2018(1): 4-6. (in Chinese) 李菲, 王忠, 卞文印, 等. 5种氮源对蛹虫草生长及其质量的影响[J]. 福建农业科技, 2018(1): 4-6. |
| [19] |
Fang HZ, Xiao XM. Effects of different nitrogen sources on the main active components of Cordyceps militaris[J]. Journal of Jingchu University of Technology, 2016, 31(6): 5-10. (in Chinese) 方华舟, 肖习明. 不同氮源对蛹虫草主要活性成分的影响及规律研究[J]. 荆楚理工学院学报, 2016, 31(6): 5-10. DOI:10.3969/j.issn.1008-4657.2016.06.001 |
| [20] |
Jian LR, Du ST. Effect of nitrogen and inorganic salt on production of stroma, cordycepin and adenosine in Cordyceps militaris[J]. Northern Horticulture, 2016(19): 163-167. (in Chinese) 简利茹, 杜双田. 氮源和无机盐对蛹虫草子座产量及虫草素和腺苷的影响[J]. 北方园艺, 2016(19): 163-167. |
| [21] |
Gu YY, Zhang YP, Chen CJ, et al. Effects of carbon and nitrogen sources in culture medium on growth amount of Cordyceps militaris hyphae[J]. Shandong Agricultural Sciences, 2008(7): 77-79. (in Chinese) 顾寅钰, 张亚平, 陈传杰, 等. 蛹虫草培养基碳源和氮源对菌丝生长量的影响[J]. 山东农业科学, 2008(7): 77-79. DOI:10.3969/j.issn.1001-4942.2008.07.025 |
| [22] |
Zhou B, Pu YW, Zhu MJ, et al. Effects of nitrogen sources on Monascus yellow pigment production by Monascus mutant[J]. Modern Food Science and Technology, 2008, 24(2): 123-127. (in Chinese) 周波, 浦跃武, 朱明军, 等. 氮源对红曲霉突变株产黄色素的影响[J]. 现代食品科技, 2008, 24(2): 123-127. |
| [23] |
Yang CL, Yang XJ, He ZG, et al. Effects of carbon and nitrogen sources on Monascus purpureus S in its secreting pigment[J]. Fujian Journal of Agricultural Sciences, 2011, 26(5): 832-836. (in Chinese) 杨成龙, 杨晓君, 何志刚, 等. 碳氮源对红曲霉S产色素的影响[J]. 福建农业学报, 2011, 26(5): 832-836. DOI:10.3969/j.issn.1008-0384.2011.05.031 |
| [24] |
Zhu ZY, Han D, Pang W. Study on the producting conditions of pigment by Paecilomyces sinensis[J]. Food Research and Development, 2017, 38(2): 190-195. (in Chinese) 朱振元, 韩丹, 庞伟. 中国拟青霉产色素发酵条件的研究[J]. 食品研究与开发, 2017, 38(2): 190-195. DOI:10.3969/j.issn.1005-6521.2017.02.043 |
| [25] |
Guo MM, Guo SP, Yang HJ, et al. Comparison of major bioactive compounds of the caterpillar medicinal mushroom, Cordyceps militaris (Ascomycetes), fruiting bodies cultured on wheat substrate and pupae[J]. International Journal of Medicinal Mushrooms, 2016, 18(4): 327-336. DOI:10.1615/IntJMedMushrooms.v18.i4 |
| [26] |
Rodriguez-Amaya DB. Quantitative analysis, in vitro assessment of bioavailability and antioxidant activity of food carotenoids——a review[J]. Journal of Food Composition and Analysis, 2010, 23(7): 726-740. DOI:10.1016/j.jfca.2010.03.008 |
| [27] |
Zhao N, Yuan XL, Chen J, et al. Effect of different carbon and nitrogen sources on mycelia growth of Antrodia cinnamomea[J]. Journal of West China Forestry Science, 2016, 45(4): 7-12. (in Chinese) 赵能, 原晓龙, 陈剑, 等. 不同碳氮源对牛樟芝菌丝体生长的影响[J]. 西部林业科学, 2016, 45(4): 7-12. |
| [28] |
Gmoser R, Ferreira JA, Lennartsson PR, et al. Filamentous ascomycetes fungi as a source of natural pigments[J]. Fungal Biology and Biotechnology, 2017, 4: 4. DOI:10.1186/s40694-017-0033-2 |
 2019, Vol. 46
2019, Vol. 46




