扩展功能
文章信息
- 张骏达, 李素艳, 孙向阳, 张骅, 呼诺, 傅振, 郭子腾
- ZHANG Jun-Da, LI Su-Yan, SUN Xiang-Yang, ZHANG Hua, HU Nuo, FU Zhen, GUO Zi-Teng
- 基于高通量测序技术的不同年代公园绿地土壤细菌多样性
- Analysis of soil bacterial diversity in urban parks with different ages by high throughput sequencing
- 微生物学通报, 2019, 46(1): 65-74
- Microbiology China, 2019, 46(1): 65-74
- DOI: 10.13344/j.microbiol.china.180184
-
文章历史
- 收稿日期: 2018-03-12
- 接受日期: 2018-05-29
- 网络首发日期: 2018-06-25
2. 乌兰浩特第四中学 内蒙古 乌兰浩特 137400
2. No. 4 Middle School of Ulanhot, Ulanhot, Inner Mongolia 137400, China
土壤微生物是生物地球化学循环的驱动者,也是绿地土壤生态系统的重要参与者,在绿地凋落物分解、土壤肥力的形成与维持、养分循环与碳氮周转等生态过程中发挥着重要作用[1]。土壤微生物对土壤环境和养分有效性的变化非常敏感,是土壤生物活性、立地质量和生产力变化的早期响应指标[2],被认为是比土壤有机质更可信的环境变化指示因子[3]。而细菌是土壤中最丰富、分布最广泛的微生物类群,广泛参与土壤营养物质循环过程[4]。
城区公园绿地作为城市生态系统的重要组成部分,在休闲、公共健康和景观生态等方面都发挥着重要作用,可以看作是一个互相作用的动脉系统,有助于提升城区居民的生活质量[5]。同时,城市公园绿地还发挥着重要的生态功能,比如污染物降解[6]、碳氮养分循环[7]和生物化学循环[8]等。
在城市公园绿地生态系统中,公园年代是影响公园绿地土壤环境质量的重要因素。现代公园为城市居民提供生态服务功能,垃圾清除、野餐、游客活动、割草等人为影响都可以改变植被与土壤之间的关系[9],从而影响整个生态环境的复杂性,影响微生物群落多样性和结构。另一方面,古典公园建园时间可追溯至清代,土壤理化性质和微生物群落会长期受植被年龄的影响[10],土壤微生物也是植物-土壤生态系统的重要组成部分[11],所以相对于年轻的生态系统而言,年代久远的生态系统会长期对土壤养分和微生物群落产生重要影响。
目前,国内关于土壤微生物多样性方面的研究以林地、农田和草地为主,而对城市绿地土壤微生物多样性方面的研究则严重不足,特别是对不同年代公园绿地土壤微生物的对比研究更是空白领域,所以本研究通过Illumina MiSeq测序分析技术对比分析了北京市不同年代公园绿地土壤细菌群落多样性和群落结构,解决了不同公园年代对土壤细菌群落影响机理等方面的科学问题,这将为深入研究北京市公园绿地土壤生态系统提供理论基础,同时也为城市公园绿地绿化管理提供科学依据。
1 材料与方法 1.1 研究区域概况与公园选择研究区域位于北京市五环内城区,属暖温带半湿润大陆性季风气候,年平均气温为11−12 ℃,多年平均降水量超过600 mm,雨量集中在夏季。在北京五环内城区选取了8个代表性公园,其中4个现代公园分别为海淀公园(HDP)、朝阳公园(CYP)、八家郊野公园(BJP)和紫竹院公园(ZZY);4个古典公园分别为颐和园(YHY)、天坛(TTP)、景山公园(JSP)和北海公园(BHP)。具体公园相关信息见表 1。
| 公园名称 Name |
年龄 Age (a) |
面积 Area (hm2) |
行政区域 District |
类别 Type |
| 八家郊野公园Bajia Country Park (BJP) | 13 | 101 | Haidian district | Modern park |
| 海淀公园Haidian Park (HDP) | 14 | 34 | Haidian district | Modern park |
| 朝阳公园Chaoyang Park (CYP) | 30 | 320 | Chaoyang district | Modern park |
| 紫竹院公园Purple Bamboo Park (ZZY) | 49 | 14 | Haidian district | Modern park |
| 北海公园Beihai Park (BHP) | 206 | 71 | Xicheng district | Classical park |
| 颐和园Summer Palace (YHY) | 238 | 290 | Xicheng district | Classical park |
| 景山公园Jingshan Park (JSP) | 251 | 23 | Xicheng district | Classical park |
| 天坛公园Temple of Heaven Park (TTP) | 582 | 270 | Dongcheng district | Classical park |
DNA抽提试剂盒,Omega公司。PCR仪,ABI公司;电泳仪,北京市六一仪器厂;MiSeq测序仪,Illumina公司;超微量分光光度计,Thermo Fisher Scientific公司;Eppendorf高速台式冷冻离心机,Eppendorf公司。
1.3 样品采集按照公园面积的大小决定每个公园所采集的样品数量,随机确定3−5个采样点,共在北京城区8个代表性公园中确定39个采样点。所有采样点均布设在常见公园植被覆盖的绿地土壤区域,按照梅花取样法在每个样点周围分别采集5个不同的子样,去除杂草、草根、石砾等杂物,采集2 cm−30 cm的表层土壤样品,然后将子样混合均匀后组合为一个样品,作为该采样点的土壤样品。对于化学分析样品,土样装入无菌自封样品袋中并置于4 ℃电子恒温箱中,采集样品原始重量应不低于1 kg,确保样品经过风干、过20目筛后重量不少于500 g。对于微生物分析样品,土样充分混合,过2 mm筛后装入无菌自封样品袋中,储存于−80 ℃的干冰保温箱内,用于提取土壤细菌DNA。
1.4 土壤理化指标的测定依据常规土壤农化分析方法分析[12],土壤pH值用土:水=1:2.5 (质量比)浸提,电位法;土壤含水量SM采用烘干测定法;土壤有机质SOM采用重铬酸钾容量法-外加热法;土壤全氮TN采用半微量凯氏定氮法;土壤速效氮AN采用碱解扩散法;土壤速效钾AK采用乙酸铵浸提-火焰光度计法;土壤有效磷AP采用碳酸氢钠浸提-钼锑抗比色法。
1.5 土壤细菌总DNA的提取采用DNA抽提试剂盒提取土壤总DNA,参考试剂盒说明书操作,通过2%琼脂糖凝胶电泳对所提取的DNA效果进行鉴定。
1.6 土壤细菌16S rRNA基因的PCR扩增将每个土样提取出的3个DNA样品充分混合后作为PCR扩增模版,采用通用引物对338F (5′-ACTCCTACGGGAGGCAGCAC-3′)和806R (5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA基因V3−V4区进行目的片段的扩增。PCR反应体系:5×FastPfu buffer 4.0 μL,dNTPs (2.5 mmol/L) 2.0 μL,正、反向引物(5 μmol/L)各0.8 μL,FastPfu polymerase (2.5 U/μL) 0.4 μL,BSA 0.2 μL,模板DNA 10 ng,ddH2O补足20 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,25个循环;72 ℃ 10 min;10 ℃保存。扩增产物均取3 μL于2%的琼脂糖凝胶中,在凝胶成像系统中检测。参照电泳初步定量结果,使用Qubit荧光定量系统对PCR产物进行检测定量,之后按照每个样本的测序量要求,根据精确定量结果进行相应比例的混合。随后进行MiSeq文库构建,Illumina上机测序。
1.7 数据分析基于QIIME分析平台对原始FASTQ文件进行过滤、拼接、去除嵌合体。序列比对后按照97%相似性水平划分操作分类单元(Operational taxonomic unit,OTU),选取最优序列作为代表性序列,通过RDP提供的参考序列和分类系统进行分类。利用Mothur软件计算样品的α多样性指数,经过UniFrac算法利用系统进化的信息来比较样品间的物种群落差异,进行β多样性分析[13-14]。使用Canoco 4.5软件对土壤环境因子和细菌群落进行冗余分析(Redundancy analysis,RDA)。采用Excel进行数据整理和初步处理,用SPSS软件进行统计分析,Origin 8.0进行绘图,差异显著性检验采用Duncan法,相关性分析采用Pearson相关检验。
2 结果与分析 2.1 土壤理化性质对现代公园及古典公园土壤理化性质(表 2)进行分析,结果表明两类公园绿地土壤有机质含量、pH、水分含量、土壤全氮含量、土壤速效钾含量和有效磷含量虽有差别,但差异均不显著。现代公园的有机质含量范围是13.86−23.83 g/kg,而古典公园是23.59−38.96 g/kg;现代公园的土壤水分含量范围是6.90%−12.25%,而古典公园则提升至13.25%− 18.89%;现代公园的土壤速效钾含量范围是114.14−218.70 mg/kg,而古典公园则是136.98−261.32 mg/kg。所有公园的土壤pH值范围在7.02−7.70,说明北京市公园绿地土壤均呈弱碱性,除天坛公园(TTP)外,古典公园的pH值比现代公园的pH值范围更高。总体而言,古典公园的土壤有机质含量、pH值、土壤水分的平均含量明显高于现代公园。
| Park | SOM (g/kg) | TN (g/kg) | pH | SM (%) | AK (mg/kg) | AP (mg/kg) |
| BJP | 21.44ab | 1.38a | 7.12e | 10.71bc | 114.14d | 27.50a |
| HDP | 13.86c | 0.69c | 7.03f | 11.62bc | 164.74bcd | 12.94c |
| CYP | 23.83bc | 1.02abc | 7.21cd | 12.25bc | 196.29abc | 17.60bc |
| ZZY | 23.77bc | 1.12abc | 7.17de | 6.90c | 218.70ab | 17.32bc |
| BHP | 38.96a | 1.43a | 7.29bc | 14.44ab | 136.98cd | 19.85bc |
| YHY | 29.90ab | 1.21abc | 7.30b | 14.42ab | 261.32a | 17.46bc |
| JSP | 34.50ab | 1.28ab | 7.70a | 18.89a | 260.29a | 23.47ab |
| TTP | 23.59bc | 1.02abc | 7.02f | 13.25ab | 152.36bcd | 15.25c |
| 注:同列数字后不同小写字母表示差异显著(P < 0.05).
Note: Different lower case letters in the same column indicate significant difference at 0.05 level. |
||||||
通过Illumina MiSeq高通量测序并优化后,8个公园的39个土壤样品共获得1 690 365条有效序列,总碱基数为745 476 964 bp,平均长度为441 bp。39个土壤样品共产生6 354个OTU,古典公园共产生了6 260个OTU,其中北海公园产生5 374个OTU,颐和园产生5 080个OTU,景山公园产生5 314个OTU,天坛公园产生5 283个OTU;而现代公园只产生了5 781个OTU,其中,八家郊野公园产生4 306个OTU,海淀公园产生4 837个OTU,朝阳公园产生4 373个OTU,紫竹院公园产生4 154个OTU。
稀释曲线反映了样品的取样深度,可以用来评价测序量是否足以覆盖所有类群。从稀释曲线(图 1)可知,样品稀释曲线均已趋于平缓,文库的覆盖率已超过99% (表 3),说明样本的OTU覆盖度已经饱和,本次测序深度可以反映土壤细菌群落的真实情况。

|
| 图 1 相似度为97%条件下不同土壤样品的稀释曲线 Figure 1 Rarefaction curves of each soil sample at cutoff level of 3% |
|
|
| Parks | Shannon index | Simpson index | ACE index | Chao1 index | Coverage (%) |
| BJP | 7.146 8ab | 0.001 8b | 4 769abc | 4 859abc | 99.07bc |
| HDP | 7.146 3ab | 0.002 3ab | 5 259ab | 5 326ab | 99.25a |
| CYP | 7.022 5bc | 0.002 6a | 4 789bcd | 4 781bc | 99.23a |
| ZZY | 6.964 0c | 0.002 4a | 4 615d | 4 664d | 99.09a |
| BHP | 7.366 9ab | 0.001 5b | 5 626ab | 5 704ab | 99.59bc |
| YHY | 7.264 3abc | 0.001 6b | 5 426cd | 5 512cd | 99.52ab |
| JSP | 7.363 0a | 0.001 5b | 5 523a | 5 566a | 99.59c |
| TTP | 7.230 4abc | 0.001 8ab | 5 516abc | 5 573abc | 99.63a |
| 注:同列数字后不同小写字母表示差异显著(P < 0.05).
Note: Different lower case letters in the same column indicate significant difference at 0.05 level. |
|||||
细菌群落丰富度用Chao1和ACE指数表示,细菌群落多样性程度用Shannon指数和Simpson指数表示。本研究中所有公园绿地土壤细菌群落的多样性如表 3所示。依据细菌OTU数量计算出的α多样性指数,古典公园土壤细菌的ACE指数和Chao1指数均显著高于现代公园,结果表明古典公园土壤的细菌丰度显著高于现代公园。古典公园土壤Shannon和Simpson指数也同样表明古典公园土壤的细菌群落多样性程度明显高于现代公园。在所有公园中,北海公园(BHP)的土壤细菌丰度和多样性指数最高,而紫竹院公园(ZZY)的土壤细菌丰度和多样性指数最低。以上结果表明,古典公园和现代公园绿地土壤细菌群落多样性和丰度存在显著差异。
2.4 公园土壤细菌群落组成分析从门的分类水平看,公园土壤样本共检测出45个细菌门类,它们在公园土壤中均有分布,但不同年代的公园土壤所占比例不尽相同。如图 2所示,本研究中公园土壤细菌优势门类为酸杆菌门(Acidobacteria,21.19%−37.59%)、变形菌门(Proteobacteria,21.12%−29.37%)、绿弯菌门(Chloroflexi,11.89%−13.85%)、放线菌门(Actinobacteria,8.49%−16.11%),它们的平均相对丰度大于5%,占总序列的75%以上;而芽单胞菌门(Gemmatimonadetes)、硝化螺旋菌门(Nitrospirae)、拟杆菌门(Bacteroidetes)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)的平均相对丰度大于1%但低于5%。

|
| 图 2 土壤细菌群落在门水平上的组成和相对丰度 Figure 2 Composition and relative abundance of the bacteria community at the phylum level |
|
|
如图 2所示,现代公园土壤中酸杆菌门的相对丰度显著高于古典公园(P < 0.05);而古典公园土壤中变形菌门和绿弯菌门的相对丰度则显著高于现代公园(P < 0.05)。另外,在两类公园土壤中,放线菌门的相对丰度无显著性差异。由此可见,古典公园和现代公园土壤细菌群落结构优势菌种的相对丰度存在显著差异。
2.5 公园土壤细菌群落相似性分析土壤细菌群落相似性分析是用来比较一对样品在物种多样性方面存在的差异大小。ANOSIM (Analysis of similarities)分析结果表明,古典公园和现代公园土壤的OTU组成之间存在显著差异(R=0.885 4,P=0.024)。
对古典公园和现代公园的样点数据进行主坐标分析(Principal Co-ordinates analysis,PCoA),如图 3所示,第一主成分(PC1)、第二主成分(PC2)和第三主成分(PC3)的贡献率分别为37.54%、16.99%和15.47%,累计贡献率超过70%。同时,古典公园与现代公园的两组样点之间有明显分离,说明不同年代的两类公园之间微生物多样性组间差异远大于组内差异。

|
| 图 3 β多样性的主坐标分析(PCoA)图 Figure 3 Principal coordinate analysis (PCoA) scores plot of β diversity |
|
|
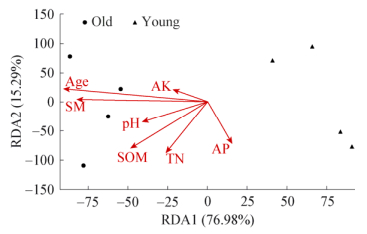
土壤可以提供细菌群落生长繁殖的微环境,而不同年代的公园绿地土壤通过改变其微环境间接影响了土壤细菌群落结构的组成。RDA二维排序图(图 4)可以直观给出研究对象与环境变量和公园年代等因子之间的关系,排序轴与箭头连线夹角表示各因子与排序轴的相关性,夹角越小表明关系越密切,而箭头连线表示各因子与研究对象相关程度的大小,连线越短,相关性越小,反之越大。与土壤细菌群落相似性分析结果一致,RDA分析同样表明古典公园和现代公园的土壤细菌结构之间存在显著差异,其中第一排序轴(76.98%)与第二排序轴(15.29%)累计解释变异量达到92.27%,说明前两轴的贡献值可以很好地解释各因子对土壤细菌群落结构的影响。古典公园天坛公园(TTP)、颐和园(YHY)、景山公园(JSP)和北海公园(BHP)的土壤细菌群落结构与公园年代、含水量、有机质、全氮、pH值以及速效钾呈正相关,与速效磷呈负相关;现代公园海淀公园(HDP)、朝阳公园(CYP)、紫竹院公园(ZZY)和八家郊野公园(BJP)的土壤细菌群落结构与速效磷呈正相关,与公园年代、有机质、含水量、全氮、pH值以及速效钾呈负相关。
|
| 图 4 土壤微生物群落结构与各影响因子的冗余分析 Figure 4 Redundancy analysis (RDA) of relationships among soil microbial community structure and impact factors |
|
|
在公园样点与各因子的冗余分析中,公园年代(R2=0.729 3)、含水量(R2=0.567 5)、速效钾(R2=0.078 0)和pH值(R2=0.246 1)与轴1相关性较大,解释率达到了78.77%;全氮(R2=0.706 3)、有机质(R2=0.733 8)和速效磷(R2=0.458 2)与轴2相关性较大;然而只有公园年代(P=0.035)、含水量(P=0.037)、有机质(P=0.04)和全氮(P=0.039)对公园土壤细菌群落组成的影响达到显著水平(P < 0.05),其它因子均未达到显著水平(P > 0.05)。这一结果表明公园年代、土壤含水量、有机质和全氮是影响公园土壤细菌群落结构的关键因子,也说明了土壤细菌在土壤碳氮养分转化中发挥着重要作用。
3 讨论与结论本研究采用高通量测序技术对北京市不同年代公园绿地土壤细菌群落进行了分析。细菌多样性的分析结果表明,不同年代公园的细菌多样性指数和丰度指数存在显著差异。古典公园绿地土壤的细菌丰度指数和多样性指数均高于现代公园,这是因为细菌适合生长在养分富足的土壤环境中,较高的土壤肥力能够刺激细菌的生长[15],古典公园绿地土壤养分含量较高,为细菌生长提供了更为丰富的养分基质,这与前人研究结果一致[16]。除此之外,古典公园绿地生态系统更为稳定,植被根系密集,根系分泌物种类多、数量大,存在较少的人为扰动,每年都有大量的凋落物转化为有效养分,向土壤输入较多的碳氮源供微生物利用[17],而现代公园植被根系尚未形成稳定的系统,并且长期受人为活动的影响,造成土壤理化性质的改变,缺少细菌生长的碳氮源,不利于土壤中细菌群落的繁殖[18]。
土壤细菌是土壤微生物的重要组成部分,土壤细菌群落结构的变化以群落组分变化为基础,不同类型生境土壤细菌群落组分的差异预示着环境改变为这些细菌提供了特异性的生存条件,从而对菌群进行选择[19]。研究表明,绝大多数土壤优势细菌种类基本相同,主要包括10个左右的细菌类群[20-21]。在门分类水平,土壤细菌以变形菌门为绝对优势菌,占细菌群落的41.61%−44.82%;酸杆菌门广泛存在于自然界的各种环境中,是土壤细菌群落的重要组成,约占土壤细菌类群的5%−46%[22]。本研究中北京市不同年代公园绿地土壤细菌群落分属于45菌门,其中酸杆菌门、变形菌门、绿弯菌门和放线菌门为北京市公园绿地土壤细菌群落的优势菌群。古典公园的变形菌门相对丰度高于现代公园,而酸杆菌门的相对丰度则低于现代公园,可能的原因是古典公园对园林废弃物再利用的有效管理方式促进古典公园绿地土壤碳氮源输入增多,这与Fierer假说观点一致,随着土壤输入的碳氮源增多,富营养型菌群(如变形菌门)丰度增加,伴随着相应的贫营养型类群(如酸杆菌门)丰度减少,空出生态位[23]。放线菌门在古典公园和现代公园中均呈现较高的相对丰度,这与放线菌门最适合生长在环境土壤pH偏碱性有关[24],本研究中,古典公园和现代公园土壤都呈现偏碱性,土壤环境适合放线菌门的生长。前人研究表明不同类型生境的土壤样品中存在着特有的高相对丰度和低相对丰度细菌门类,这与本研究结果一致[25]。
土壤细菌PCoA分析结果表明,古典公园和现代公园的土壤细菌群落结构存在显著差异,同时,ANOSIM分析结果也表明古典公园和现代公园土壤的OTU组成之间存在显著差异。现代公园园区内的公园绿地与公园游览区不分离,绿地常提供游客运动锻炼、野餐、亲子活动等服务功能,同时园区管理常常集中清扫园林废弃物。而古典公园园区内的公园绿地常与游览区有明显分离,并用护栏对绿地进行保护,从而避免了人为活动对于绿地生态系统的严重影响;同时,古典公园绿地管理方式与现代公园也不尽相同,良好的灌溉措施与有机施肥结合模式对绿地土壤养分及时进行了补充,同时也对园林废弃物进行了充分的再利用,有机物经过长年积累,土壤养分含量极高,特别是碳氮养分[26]。
本研究中,冗余分析结果显示环境因子中土壤含水量、土壤有机质和全氮含量与土壤细菌群落结构呈显著正相关,表明土壤含水量、碳和全氮可能是引起土壤细菌群落结构差异的主要因子。细菌群落对土壤含水量的变化敏感,土壤含水量不同,导致土壤细菌活性存在较大差异[27]。Schimel等研究发现,长期干燥能够导致土壤微生物呼吸和生物量降低,微生物群落结构发生变化,尤其是潮湿和干燥的时间对土壤微生物影响较大[28]。Gordon等[29]和Xiang等[30]研究发现,较高的土壤含水量可提高土壤微生物活性。土壤有机质是土壤的重要组成部分,作为微生物所需能量的主要来源,土壤有机质被认为是调控土壤微生物多样性和群落结构的关键因素[31]。土壤微生物在土壤有机质转化和养分循环中具有重要作用[32]。土壤有机质含量对于提供维持土壤各种功能所必需的能量、底物和微生物多样性至关重要[33],是影响土壤微生物群落组成的关键因素,研究表明土壤有机碳与土壤微生物功能多样性之间存在明显的相关性[34]。此外,微生物的生长活性还受氮源有效性的限制[35]。土壤中积累的土壤养分能够被土壤细菌作为能量来源直接利用,为土壤细菌对碳、氮的利用提供了有利条件[36]。古典公园的园林凋落物得到了有效的充分利用,在土壤中形成的有机质含量相对较高,从而更有利于土壤细菌生长和代谢。北京市公园绿地土壤中拥有复杂的土壤细菌群落结构,因此,认识和利用土壤细菌群落对维护绿地土壤生态系统平衡和绿地土壤管理利用具有重要的意义[37]。
许多研究表明土壤pH是影响细菌群落结构的重要因子[38],但也有研究已经证实,细菌群落相对丰度与土壤pH相关性不显著[39]。尽管pH不是引起本研究中土壤细菌群落结构差异的显著影响因子,但仍表现出与细菌群落多样性的相关规律性。本研究中古典公园pH值显著高于现代公园,同时细菌群落多样性也更为丰富,这与有些学者的研究结果一致[40],可能是较高浓度的氢离子抑制了细菌生长。本研究中导致古典公园土壤pH值高于现代公园的可能原因是古典公园建筑石料的风化导致盐基离子进入到土壤中,从而造成古典公园pH值一定程度的升高。此外,在一些研究中,由于一些细菌门类的基因序列也在中性甚至碱性的环境中被检测出来[41],所以土壤细菌群落结构与pH的关系还有待进一步研究。
除了环境因子,本研究还引入公园年代作为土壤细菌群落潜在影响因子进行冗余分析,结果表明公园年代与土壤含水量、有机质和全氮对公园绿地土壤细菌群落都可产生显著影响。同时,公园年代也是影响细菌群落结构的最重要影响因子,结果表明,与先前假设一致,公园年代确实对土壤细菌群落结构产生显著影响,导致古典公园和现代公园的细菌群落结构存在显著差异。相关研究表明,细菌除了用来指示土壤微生物群落中细菌群落的相对丰度外,还可用来表征土壤生态系统的稳定性[42]。因此,随着公园年代的增加,土壤细菌多样性呈增加趋势,在一定程度上表明北京市公园绿地土壤生态系统朝着稳定的方向发展。
本研究利用Illumina高通量测序技术对北京市不同年代的公园绿地土壤细菌多样性和群落结构进行了研究,以期更深入地理解城市公园绿地生态系统土壤细菌结构组成对公园年代的响应,同时为公园生态管理提供重要的指导作用和参考价值。
| [1] |
Luo D, Liu S, Shi ZM, et al. Soil microbial community structure in Picea asperata plantations with different ages in subalpine of western Sichuan, Southwest China[J]. Chinese Journal of Applied Ecology, 2017, 28(2): 519-527. (in Chinese) 罗达, 刘顺, 史作民, 等. 川西亚高山不同林龄云杉人工林土壤微生物群落结构[J]. 应用生态学报, 2017, 28(2): 519-527. |
| [2] |
Zhang W, Wei HL, Gao HW, et al. Advances of studies on soil microbial diversity and environmental impact factors[J]. Chinese Journal of Ecology, 2005, 24(1): 48-52. (in Chinese) 张薇, 魏海雷, 高洪文, 等. 土壤微生物多样性及其环境影响因子研究进展[J]. 生态学杂志, 2005, 24(1): 48-52. |
| [3] |
Zhang D, Zhang YX, Qu LY, et al. Effects of altitude on soil microbial community in Quercus liaotungensis forest[J]. Chinese Journal of Applied Ecology, 2012, 23(8): 2041-2048. (in Chinese) 张地, 张育新, 曲来叶, 等. 海拔对辽东栎林地土壤微生物群落的影响[J]. 应用生态学报, 2012, 23(8): 2041-2048. |
| [4] |
Chen FL, Zhang K, Zheng H, et al. Analyzing the effect of mixed decomposition of conifer and broadleaf litters on soil microbial communities by using PCR-DGGE[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(2): 145-150. (in Chinese) 陈法霖, 张凯, 郑华, 等. PCR-DGGE技术解析针叶和阔叶凋落物混合分解对土壤微生物群落结构的影响[J]. 应用与环境生物学报, 2011, 17(2): 145-150. |
| [5] |
Chiesura A. The role of urban parks for the sustainable city[J]. Landscape and Urban Planning, 2004, 68(1): 129-138. DOI:10.1016/j.landurbplan.2003.08.003 |
| [6] |
Escobedo FJ, Kroeger T, Wagner JE. Urban forests and pollution mitigation: analyzing ecosystem services and disservices[J]. Environmental Pollution, 2011, 159(8/9): 2078-2087. |
| [7] |
Cusack DF, Silver WL, Torn MS, et al. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests[J]. Ecology, 2011, 92(3): 621-632. DOI:10.1890/10-0459.1 |
| [8] |
Yang LY, Zhang LB, Li Y, et al. Water-related ecosystem services provided by urban green space: a case study in Yixing City (China)[J]. Landscape and Urban Planning, 2015, 136: 40-51. DOI:10.1016/j.landurbplan.2014.11.016 |
| [9] |
Jim CY. Soil characteristics and management in an urban park in Hong Kong[J]. Environmental Management, 1998, 22(5): 683-695. DOI:10.1007/s002679900139 |
| [10] |
Jia GM, Cao J, Wang CY, et al. Microbial biomass and nutrients in soil at the different stages of secondary forest succession in Ziwulin, northwest China[J]. Forest Ecology and Management, 2005, 217(1): 117-125. DOI:10.1016/j.foreco.2005.05.055 |
| [11] |
Zhang YY, Qu LY, Chen LD, et al. Soil microbial properties under different vegetation types in Loess hilly region[J]. Chinese Journal of Applied Ecology, 2010, 21(1): 165-173. (in Chinese) 张燕燕, 曲来叶, 陈利顶, 等. 黄土丘陵沟壑区不同植被类型土壤微生物特性[J]. 应用生态学报, 2010, 21(1): 165-173. |
| [12] |
Lu RK. Soil Argrochemistry Analysis Protocoes[M]. Beijing: China Agriculture Science Press, 2000. (in Chinese) 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. |
| [13] |
Schloss PD, Westcott SL, Ryabin T, et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
| [14] |
Kemp PF, Aller JY. Bacterial diversity in aquatic and other environments: what 16S rDNA libraries can tell us[J]. FEMS Microbiology Ecology, 2004, 47(2): 161-177. DOI:10.1016/S0168-6496(03)00257-5 |
| [15] |
Mendham DS, Sankaran KV, O'Connell AM, et al. Eucalyptus globulus harvest residue management effects on soil carbon and microbial biomass at 1 and 5 years after plantation establishment[J]. Soil Biology and Biochemistry, 2002, 34(12): 1903-1912. DOI:10.1016/S0038-0717(02)00205-5 |
| [16] |
Cao YS, Fu SL, Zou XM, et al. Soil microbial community composition under Eucalyptus plantations of different age in subtropical China[J]. European Journal of Soil Biology, 2010, 46(2): 128-135. DOI:10.1016/j.ejsobi.2009.12.006 |
| [17] |
Wang Y, Zhang ZM, Li XH, et al. Effects of land use type on the abundance of bacteria, crenarchaea, and ammonia-oxidizing archaea in black soil[J]. Chinese Journal of Ecology, 2013, 32(11): 2931-2936. (in Chinese) 王影, 张志明, 李晓慧, 等. 土地利用方式对土壤细菌, 泉古菌和氨氧化古菌丰度的影响[J]. 生态学杂志, 2013, 32(11): 2931-2936. |
| [18] |
Zhang DJ, Zhang J, Yang WQ, et al. Potential allelopathic effect of Eucalyptus grandis across a range of plantation ages[J]. Ecological Research, 2010, 25(1): 13-23. DOI:10.1007/s11284-009-0627-0 |
| [19] |
Xu F, Cai TJ, Yang X, et al. Effect of cultivation and natural restoration on soil bacterial community diversity in marshland in the Sanjiang Plain[J]. Acta Ecologica Sinica, 2016, 36(22): 7412-7421. (in Chinese) 徐飞, 蔡体久, 杨雪, 等. 三江平原沼泽湿地垦殖及自然恢复对土壤细菌群落多样性的影响[J]. 生态学报, 2016, 36(22): 7412-7421. |
| [20] |
Janssen PH. Identifying the dominant soil bacterial taxa in libraries of 16S rRNA and 16S rRNA genes[J]. Applied and Environmental Microbiology, 2006, 72(3): 1719-1728. DOI:10.1128/AEM.72.3.1719-1728.2006 |
| [21] |
Philippot L, Andersson SGE, Battin TJ, et al. The ecological coherence of high bacterial taxonomic ranks[J]. Nature Reviews Microbiology, 2010, 8(7): 523-529. DOI:10.1038/nrmicro2367 |
| [22] |
Ellis RJ, Morgan P, Weightman AJ, et al. Cultivation-dependent and -independent approaches for determining bacterial diversity in heavy-metal-contaminated soil[J]. Applied and Environmental Microbiology, 2003, 69(6): 3223-3230. DOI:10.1128/AEM.69.6.3223-3230.2003 |
| [23] |
Fierer N, Bradford MA, Jackson RB. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364. DOI:10.1890/05-1839 |
| [24] |
Zeng QC, Dong YH, An SS. Bacterial community responses to soils along a latitudinal and vegetation gradient on the Loess Plateau, China[J]. PLoS One, 2016, 11(4): e0152894. DOI:10.1371/journal.pone.0152894 |
| [25] |
Zhang W, Chen YF. Analysis of the bacterial communities in continuous cotton fields of Xinjiang Province[J]. Acta Ecologica Sinica, 2014, 34(16): 4682-4689. (in Chinese) 张伟, 陈一峰. 棉花长期连作对新疆土壤细菌群落结构的影响[J]. 生态学报, 2014, 34(16): 4682-4689. |
| [26] |
Hui N, Jumpponen A, Francini G, et al. Soil microbial communities are shaped by vegetation type and park age in cities under cold climate[J]. Environmental Microbiology, 2017, 19(3): 1281-1295. DOI:10.1111/1462-2920.13660 |
| [27] |
Wang QL, Cao GM, Wang CT. Quantitative characters of soil microbes and microbial biomass under different vegetations in alpine meadow[J]. Chinese Journal of Ecology, 2007, 26(7): 1002-1008. (in Chinese) 王启兰, 曹广民, 王长庭. 高寒草甸不同植被土壤微生物数量及微生物生物量的特征[J]. 生态学杂志, 2007, 26(7): 1002-1008. DOI:10.3321/j.issn:1000-4890.2007.07.007 |
| [28] |
Schimel JP, Gulledge JM, Clein-Curley JS, et al. Moisture effects on microbial activity and community structure in decomposing birch litter in the Alaskan taiga[J]. Soil Biology and Biochemistry, 1999, 31(6): 831-838. DOI:10.1016/S0038-0717(98)00182-5 |
| [29] |
Gordon H, Haygarth PM, Bardgett RD. Drying and rewetting effects on soil microbial community composition and nutrient leaching[J]. Soil Biology and Biochemistry, 2008, 40(2): 302-311. DOI:10.1016/j.soilbio.2007.08.008 |
| [30] |
Xiang SR, Doyle A, Holden PA, et al. Drying and rewetting effects on C and N mineralization and microbial activity in surface and subsurface California grassland soils[J]. Soil Biology and Biochemistry, 2008, 40(9): 2281-2289. DOI:10.1016/j.soilbio.2008.05.004 |
| [31] |
Griffiths BS, Ritz K, Ebblewhite N, et al. Soil microbial community structure: effects of substrate loading rates[J]. Soil Biology and Biochemistry, 1998, 31(1): 145-153. DOI:10.1016/S0038-0717(98)00117-5 |
| [32] |
Wang QK, Wang SL, Gao H, et al. Influence of land use on soil organic matter[J]. Chinese Journal of Ecology, 2005, 24(4): 360-363. (in Chinese) 王清奎, 汪思龙, 高洪, 等. 土地利用方式对土壤有机质的影响[J]. 生态学杂志, 2005, 24(4): 360-363. DOI:10.3321/j.issn:1000-4890.2005.04.002 |
| [33] |
Wu ZY, Lin WX, Chen ZF, et al. Characteristics of soil microbial community under different vegetation types in Wuyishan National Nature Reserve, East China[J]. Chinese Journal of Applied Ecology, 2013, 24(8): 2301-2309. (in Chinese) 吴则焰, 林文雄, 陈志芳, 等. 武夷山国家自然保护区不同植被类型土壤微生物群落特征[J]. 应用生态学报, 2013, 24(8): 2301-2309. |
| [34] |
Zhong WH, Cai ZC. Effect of soil management practices and environmental factors on soil microbial diversity: a review[J]. Biodiversity Science, 2004, 12(4): 456-465. (in Chinese) 钟文辉, 蔡祖聪. 土壤管理措施及环境因素对土壤微生物多样性影响研究进展[J]. 生物多样性, 2004, 12(4): 456-465. DOI:10.3321/j.issn:1005-0094.2004.04.010 |
| [35] |
Craine JM, Morrow C, Fierer N. Microbial nitrogen limitation increases decomposition[J]. Ecology, 2007, 88(8): 2105-2113. DOI:10.1890/06-1847.1 |
| [36] |
Jiang J, Song MH. Review of the roles of plants and soil microorganisms in regulating ecosystem nutrient cycling[J]. Chinese Journal of Plant Ecology, 2010, 34(8): 979-988. (in Chinese) 蒋婧, 宋明华. 植物与土壤微生物在调控生态系统养分循环中的作用[J]. 植物生态学报, 2010, 34(8): 979-988. DOI:10.3773/j.issn.1005-264x.2010.08.011 |
| [37] |
Cookson WR, Murphy DV, Roper MM. Characterizing the relationships between soil organic matter components and microbial function and composition along a tillage disturbance gradient[J]. Soil Biology and Biochemistry, 2008, 40(3): 763-777. DOI:10.1016/j.soilbio.2007.10.011 |
| [38] |
Chu HY, Fierer N, Lauber CL, et al. Soil bacterial diversity in the Arctic is not fundamentally different from that found in other biomes[J]. Environmental Microbiology, 2010, 12(11): 2998-3006. DOI:10.1111/emi.2010.12.issue-11 |
| [39] |
Liu JJ, Sui YY, Yu ZH, et al. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of northeast China[J]. Soil Biology and Biochemistry, 2015, 83: 29-39. DOI:10.1016/j.soilbio.2015.01.009 |
| [40] |
Rousk J, Brookes PC, Bååth E. Contrasting soil pH effects on fungal and bacterial growth suggest functional redundancy in carbon mineralization[J]. Applied and Environmental Microbiology, 2009, 75(6): 1589-1596. DOI:10.1128/AEM.02775-08 |
| [41] |
Xiong JB, Liu YQ, Lin XG, et al. Geographic distance and pH drive bacterial distribution in alkaline lake sediments across Tibetan Plateau[J]. Environmental Microbiology, 2012, 14(9): 2457-2466. DOI:10.1111/emi.2012.14.issue-9 |
| [42] |
Boyle SA, Yarwood RR, Bottomley PJ, et al. Bacterial and fungal contributions to soil nitrogen cycling under Douglas fir and red alder at two sites in Oregon[J]. Soil Biology and Biochemistry, 2008, 40(2): 443-451. DOI:10.1016/j.soilbio.2007.09.007 |
 2019, Vol. 46
2019, Vol. 46




