扩展功能
文章信息
- 王钰, 刘明坤, 苗小草, 王杨, 白晓慧
- WANG Yu, LIU Ming-Kun, MIAO Xiao-Cao, WANG Yang, BAI Xiao-Hui
- 城市供水系统对水中真菌数量和群落结构的影响
- Effect of urban water supply system on fungi population and community structure
- 微生物学通报, 2019, 46(1): 20-28
- Microbiology China, 2019, 46(1): 20-28
- DOI: 10.13344/j.microbiol.china.180298
-
文章历史
- 收稿日期: 2018-04-12
- 接受日期: 2018-06-11
- 网络首发日期: 2018-07-03
病原微生物是生活饮用水水质卫生要求的首要关注对象。世界卫生组织(World Health Organization WHO)《饮用水水质准则》(第4版)仅列出了细菌、病毒及原虫和蠕虫等潜在风险微生物名录,但缺乏真菌的相关信息[1-4]。已有研究表明很多条件致病真菌,如曲霉属[5] (Aspergillus spp.)、镰刀霉属[6](Fusarium spp.)等为水生真菌并能介水传播,可对人体健康造成风险。此外,饮用水中的真菌还能引发嗅味[7]、毒素污染[8]、人类过敏反应[9]等问题。目前大部分国家和地区都使用粪便污染指示菌(如大肠杆菌、大肠菌群)来指示水中病原微生物风险,但有研究表明饮用水中粪便污染指示菌与真菌之间并无直接关联[10],仅采用指示菌指标无法反映供水系统中真菌信息,供水系统中的真菌微生物风险应当引起人们关注。
目前,国内外对水环境中真菌检测并无标准方法。平板培养法是其中应用最广泛的方法,但存在耗时长、易受环境条件影响、不能覆盖非培养微生物等问题[11]。近年来,MiSeq高通量测序凭借其覆盖度深、信息量大、快速简便等优点被广泛应用于各类环境样本真菌微生物群落分析[12],如雾霾、土壤、泥炭地、淡水湖等,能够较好地解决传统方法的不足,但将其应用于饮用水水质的研究尚不多见。
本研究以黄浦江上游水源城市供水系统为研究对象,通过平板培养计数以及ITS1区高通量测序方法,分析真菌数量、群落组成在供水系统中的迁移变化及供水系统多级屏障对真菌的影响效能,为供水系统中真菌风险控制提供数据支持。
1 材料与方法 1.1 样品采集及处理2016年11月,水样采集自以黄浦江上游为水源的炭滤前置水厂(CF水厂)和炭滤后置水厂(PC水厂)供水系统,滤池中活性炭使用年限相同。CF水厂净水工艺过程依次为原水(SOU)、絮凝沉淀(CF_SED)、臭氧氧化(CF_POZ)、生物活性炭过滤(CF_CAR)、砂滤(CF_SAN)、氯胺消毒出水(CF_EFF);PC水厂净水工艺过程依次为原水(SOU)、絮凝沉淀(PC_SED)、砂滤(PC_SAN)、臭氧氧化(PC_POZ)、生物活性炭过滤(PC_CAR)、氯胺消毒出水(PC_EFF)。以及相应输配管网中2种供水模式4个末端样本,2个地面水箱水泵供水系统样本(Tap1、Tap2)和2个市政直供水系统样本(Tap3、Tap4),共计15个样本。每处采集点使用已灭菌容器共采集10−20 L水样,样品采集后立即带回实验室处理并4 ℃保存备用。
1.2 主要试剂、培养基和仪器水样基因组DNA提取试剂盒(Water DNA Kit),Omega公司;麦芽浸膏琼脂培养基(Malt Extract Agar,MEA),OXOID公司;孟加拉红琼脂培养基(Rose bengal agar,RB),青岛海博生物技术有限公司。全自动样品快速研磨仪,上海净信实业发展有限公司;PCR仪,Eppendorf公司;凝胶成像系统,上海天能科技有限公司;电泳仪,Bio-Rad公司;过滤器,PALL公司;0.45 μm孔径滤膜,MilliPore公司。
1.3 平板培养法计数将采集的水样使用已灭菌0.45 μm孔径滤膜抽滤100 mL,随后立即将滤膜置于MEA和RB培养基上(培养基已加入氯霉素和链霉素)[3],滤膜和培养基之间应尽量无气泡,各样品均重复3次。28 ℃黑暗培养7 d后进行菌落计数,各水样中菌落数表示为CFU/100 mL。MEA培养基与RB培养基均为检测真菌总数的常用培养基,2种培养基配合使用旨在尽量培养出样本中全部种类的真菌,减少误差。数据结果用SPSS 19.0.0进行统计分析。
1.4 水样总DNA提取与ITS1区高通量测序将采集水样使用已灭菌0.45 μm孔径滤膜抽滤浓缩,依照水体基因组DNA提取试剂盒操作说明提取水样总DNA。提取不同采样点水样总DNA时,水样用量为600 mL到4 L不等。每处采集点水样均提取3个重复水样总DNA,将所得DNA混合均匀后作为待测总DNA样品备用。
使用待测总DNA作为模板扩增ITS1区,扩增引物为ITS1F (5′-CTTGGTCATTTAGAGGAAG TAA-3′)和ITS2R (5′-GCTGCGTTCTTCATCGATG C-3′)[13]。PCR反应体系(20 μL):10× rTaq buffer 2 μL,2.5 mmol/L dNTPs 2 μL,5 μmol/L上、下游引物各0.8 μL,rTaq polymerase (5 U/μL) 0.2 μL,BSA 0.2 μL和DNA模板10 ng,ddH2O补足至20 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。2%琼脂糖凝胶电泳检测PCR产物。将扩增产物送至上海美吉生物医药科技有限公司,采用Illumina MiSeq测序平台进行测序。
1.5 测序数据质控与分析测序完毕后,将过滤后的双端序列拼接为一条序列,过滤掉Overlap小于10 bp且错配率大于0.2的序列,根据Barcode与引物序列,调整序列方向得到优化数据;使用USEARCH[14]对不同相似度序列进行OTU (Operational taxonomic unit)划分,以大于97%相似水平对已提取的非重复序列进行聚类(其间需去除嵌合体)后得到OTU代表序列,随后选出与代表序列相似性在97%以上的优化序列生成OTU表格;利用QIIME (V1.8.0)[15]平台在UNITE (V7.1.0)中以置信度70%得到OTU对应的物种信息进行注释分析,以及计算α多样性指数Chao1和Shannon指数[16-17];利用Fast UniFrac根据UniFrac算法计算样本间距离矩阵绘制热图(Heatmap),进行β多样性分析。
2 结果与分析 2.1 供水系统中真菌数量变化采用MEA培养基与RB培养基对供水系统中真菌数量的检测结果如图 1所示。经统计分析,采用2种培养基检测的真菌数量之间无显著差异(P > 0.05)。黄浦江原水真菌数量可达200 CFU/100 mL,经过混凝沉淀、臭氧氧化、砂滤、消毒,水中真菌都有明显的去除效果。经过生物活性炭处理后水中真菌数目又有所上升,其中,活性炭滤池前置水厂真菌数目上升至30 CFU/100 mL,活性炭滤池后置水厂真菌数目上升至28 CFU/100 mL,说明运行中的生物活性炭滤池存在微生物泄漏现象,从而导致水中真菌数量有所上升。经过水厂消毒工艺后,2个水厂出厂水中可培养真菌数目均为0 CFU/100 mL,水中可培养真菌得到完全去除,净水工艺对原水中可培养真菌可实现高效控制。
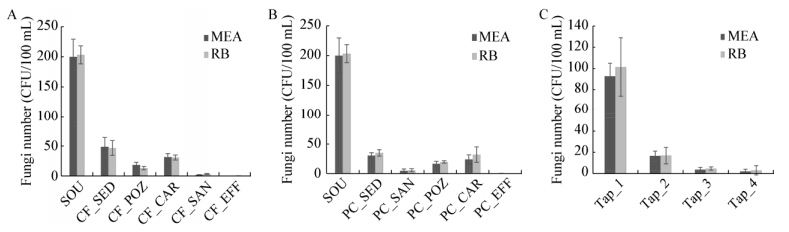
|
| 图 1 城市供水系统中真菌数量变化 Figure 1 Variation of the fungi numbers in water supply systems 注:A:CF水厂;B:PC水厂;C:用户龙头水. Note: A: CF waterworks; B: PC waterworks; C: Tap water. |
|
|
经过供水管网输配后,真菌数量又出现上升,特别是经过二次供水水箱水泵系统后,用户龙头水中真菌数量明显上升,最高可达到100 CFU/100 mL,明显超过直供水模式。因此,二次供水模式应尽量减少中间停滞环节以控制供水管网中真菌的再生风险。
2.2 供水系统中真菌群落组成变化在UNITE (V7.1.0)数据库中将聚类获得的OTU进行比对,根据分类学结果可以获得各样本在门(Phylum)和属(Genus)水平上真菌的群落结构组成。图 2A、B、C分别表示了炭滤前置水厂、炭滤后置水厂以及二次供水样品在门水平上的真菌相对丰度统计信息,图 2D、E、F分别表示了各样品在属水平上的真菌相对丰度统计信息。
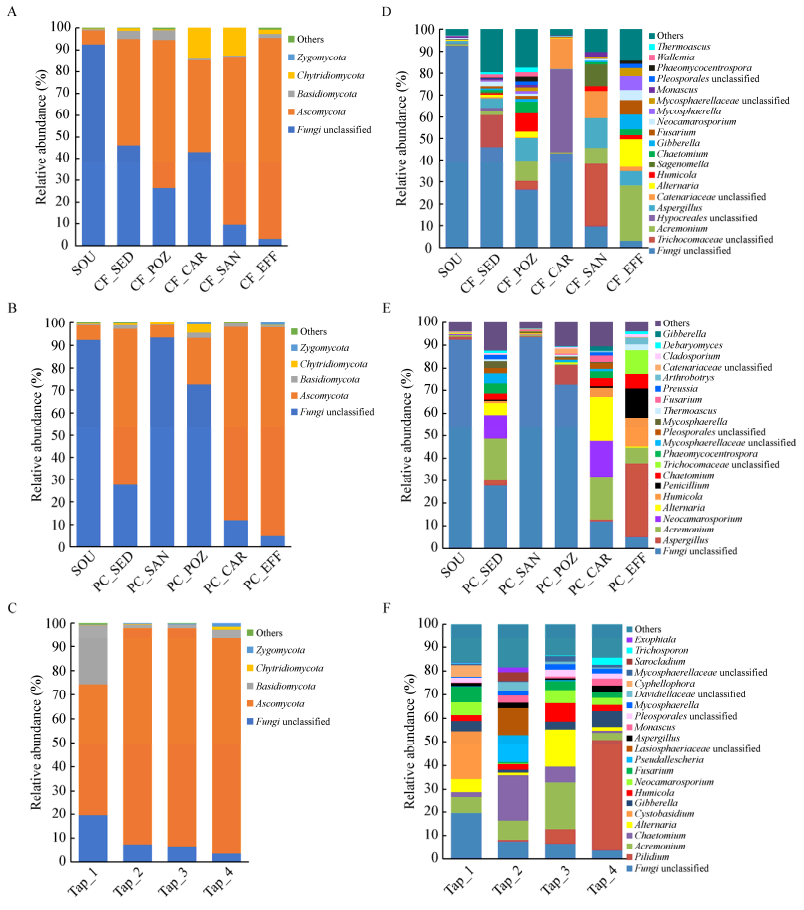
|
| 图 2 城市供水系统中真菌门水平与属水平相对丰度分析 Figure 2 The relative abundance of fungi on the phylum and genus level in water supply systems 注:A:CF水厂门水平;B:PC水厂门水平;C:用户龙头水门水平;D:CF水厂属水平;E:PC水厂属水平;F:用户龙头水属水平. Note: A: Phylum level in CF waterworks; B: Phylum level in PC waterworks; C: Phylum level in tap water; D: Genus level in CF waterworks; E: Genus level in PC waterworks; F: Genus level in tap water. |
|
|
如图 2A、B、C所示,在门水平上,黄浦江上游原水中含有大量未分类(Unclassfied)真菌(92.44%),经过净水工艺后的两水厂出厂水中,Unclassfied真菌相对丰度则分别下降至3.07%和4.93%,经过供水输配管网直接进入用户的Unclassfied真菌相对丰度(6.44%和3.52%)低于经过二次供水设施(如水箱)的用户水中的Unclassfied真菌相对丰度(19.24%和7.35%)。表明在供水系统原水中含有大量未知真菌,经过水厂净化工艺后,水中未知真菌能得到有效去除,但二次供水设施有利于水中各种真菌增殖。在整个供水系统中,随着原水中占比最大的Unclassfied真菌受净水工艺影响相对丰度大幅度下降,原水中占比较低的子囊菌门(Ascomycota)则逐渐增至最大,从原水中占比6.4%增至CF水厂出水中65.69%、PC水厂出水中55.02%、用户水中54.43%。供水系统中还存在担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、接合菌门(Zygomycota),占比均较低(0−6.03%)。
如图 2D、E、F所示,在属水平上,曲霉属(Aspergillus) (1.27%)、枝顶孢属(Acremonium) (0.78%)、红曲霉属(Monascus) (0.7%)、Neocamarosporium (0.4%)、链格孢属(Alternaria) (0.37%)、脉孢菌属(Neurospora) (0.3%)、Wallemia (0.25%)、镰刀霉属(Fusarium) (0.22%)在黄浦江原水样本中丰度较高;发菌科(Trichocomaceae) unclassified (9.53%)、Acremonium (8.8%)、肉座菌目(Hypocreales) unclassified (7.94%)、Aspergillus (7.12%)、Alternaria (3.37%)、链枝菌科(Catenariaceae) unclassified (5.9%)、毛壳霉属Chaetomium (2.06%)、腐质霉属Humicola (2.67%)和Sagenomella (2.08%)在CF水厂样本中丰度较高;Acremonium (9.1%)、Aspergillus (9.06%)、Neocamarosporium (5.37%)、Alternaria (5.17%)、Humicola (3.63%)、青霉属Penicillium (2.84%)、Chaetomium (2.56%)、Trichocomaceae unclassified (2.21%)和Phaeomycocentrospora (1.59%)在PC水厂样本中丰度较高;Pilidium (10.87%)、Acremonium (7.68%)、Chaetomium (5.92%)、Alternaria (4.75%)、Cystobasidium (4.04%)、赤霉菌属Gibberella (3.1%)、Humicola (3.07%)、Neocamarosporium (2.85%)、Fusarium (2.66%)在用户龙头水样中丰度较高。在所有样本中均存在的为支顶孢属(Acremonium)和曲霉属(Aspergillus)。
2.3 供水系统中真菌群落多样性分析α多样性指数通过对单样本进行分析,以统计学指数来反映生物群落的丰度和多样性。其中Chao1指数常用来估算物种数目,与物种丰富度成正比;Shannon指数从均匀度和丰富度2个维度共同反映物种多样性,与物种多样性成正比。由表 1可知,所有样本的覆盖率均大于99.9%,表明所有样本中真菌的物种信息已经基本被覆盖完全。供水系统中,黄浦江上游原水样本Chao1指数(391.2)最高;CF水厂和PC水厂经过生物活性炭处理后的水样Chao1指数均比前一净水工艺单元有所上升;CF水厂的砂滤后与出厂水样品Chao1指数已经降低到60.0与77.5,PC水厂出厂水Chao1指数为44.0;用户龙头水样本Chao1指数均高于两水厂出厂水样本。结果表明生物活性炭工艺能增加真菌物种丰富度,而氯化消毒能使对消毒剂敏感物种失活并去除,经过供水管网输配和二次供水设施后,水中真菌物种丰富度再度增加,特别是经过二次供水设施后,物种丰富度增加显著。
| Sample | Chao1 index | Shannon index | Coverage (%) |
| SOU | 391.2 | 3.278 746 | 99.96 |
| CF_SED | 314.142 9 | 4.336 488 | 99.97 |
| CF_POZ | 141.2 | 4.077 612 | 99.99 |
| CF_CAR | 236.5 | 1.949 183 | 99.90 |
| CF_SAN | 60.0 | 2.723 005 | 99.98 |
| CF_EFF | 77.5 | 3.295 016 | 99.99 |
| PC_SED | 164.428 6 | 3.809 336 | 99.96 |
| PC_SAN | 284.375 | 1.865 31 | 99.94 |
| PC_POZ | 210.857 1 | 3.780 981 | 99.99 |
| PC_CAR | 255.333 3 | 3.358 821 | 99.96 |
| PC_EFF | 44.0 | 2.634 728 | 100.00 |
| Tap_1 | 279.25 | 4.004 644 | 99.97 |
| Tap_2 | 111.0 | 3.509 377 | 99.99 |
| Tap_3 | 117.428 6 | 3.145 825 | 99.99 |
| Tap_4 | 87.0 | 2.614 185 | 99.98 |
Unweighted UniFrac距离算法不计入相对丰度差异,仅考虑物种类别差异,通过计算样本距离矩阵可以检测不同样本间物种种类变化。图 3为基于Unweighted UniFrac距离算法的所有样本在OTU水平上的样本距离热图,样本距离用颜色梯度表示。可以看出,图中样本距离结果完全支持α多样性指数分析结果。CF水厂砂滤后样本距离和出厂水样本非常接近,与炭滤后的距离差异显著;同样,PC水厂经过活性炭处理后样本与CF水厂炭滤后样本距离接近,与出厂水样本差距显著;二次供水样本中,市政直供水各样本距离较近,说明消毒工艺及二次供水设施对物种丰富度的显著影响。
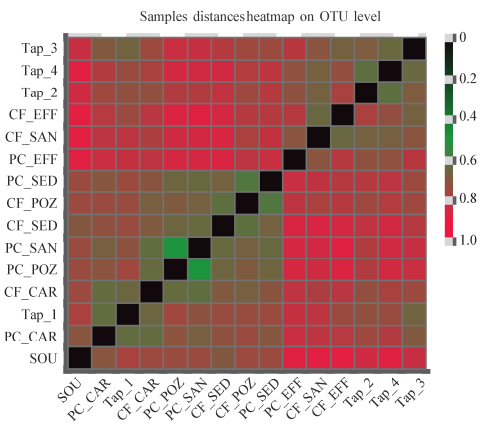
|
| 图 3 OTU水平下基于Unweighted UniFrac算法样本距离热图 Figure 3 Heatmap of the Unweighted UniFrac pairwise distance on OTU level |
|
|
表 2为所研究城市供水系统中通过高通量测序方法检测出的7种潜在致病真菌的分布。其中,青霉属真菌Penicillium lilacinum能够引发眼部感染、皮肤感染和甲癣[18];Penicillium marneffei能侵染免疫缺陷人群[19];枝孢霉属、链格孢属与支顶孢属真菌能够引发过敏、过敏性肺炎、鼻炎和哮喘[20];曲霉属真菌中的一些条件致病菌,如黄曲霉(Aspergillus flavus)、烟曲霉(Aspergillus fumigatus)、Aspergillus calidoustus、黑曲霉(Aspergillus niger)常在饮用水中被检测和分离到[2];饮用水被认为是引发曲霉侵染的可能环境来源之一。黄曲霉毒素和黄曲霉在二次供水水箱水中被检出[8],若长期摄入低剂量黄曲霉毒素,会引起慢性黄曲霉毒素中毒症并导致免疫抑制等疾病[21];假丝酵母菌属真菌在人体抵抗力下降时,能够引发皮肤、粘膜和内脏的炎症,对人类健康造成严重危害[22];在美国德克萨斯州的一个医院中,饮用水被认为是镰刀霉属真菌侵染的环境来源[6]。
| Genus | Phylum | SOU (%) | CF_EFF (%) | PC_EFF (%) | Tap water (%) |
| 青霉属Penicillium | Ascomycota | 0.03 | 0.00 | 12.82 | 0.45 |
| 枝孢霉属Cladosporium | Ascomycota | 0.10 | 0.00 | 1.25 | 0.45 |
| 曲霉属Aspergillus | Ascomycota | 1.27 | 6.53 | 32.80 | 1.79 |
| 支顶孢属Acremonium | Ascomycota | 0.78 | 25.33 | 6.96 | 9.60 |
| 假丝酵母菌属Candida | Ascomycota | 0.06 | 0.00 | 0.59 | 0.23 |
| 镰刀霉属Fusarium | Ascomycota | 0.22 | 6.66 | 0.00 | 3.32 |
| 链格孢属Alternaria | Ascomycota | 0.37 | 12.76 | 0.48 | 5.94 |
真菌在供水系统中广泛存在,但国际上对饮用水中真菌的检测与计数方法并无统一标准。应用最广泛和最普遍的仍是传统培养法,以CFUs (Colony forming units)对单位体积样本中的真菌数量进行统计,并通过分离培养、显微观察或分子手段鉴定真菌。尽管传统平板培养法操作简单、费用低廉,但仍旧存在许多问题。如在实验室条件下并非所有真菌都能够培养;培养基种类、温度等外界环境条件对真菌种类鉴定都有影响;每一个CFU可能由许多真菌结构组成,不同的结构个体聚集为一个CFU而影响计数结果准确性等[23]。Paterson等[24]也在研究中表示,由于上述种种原因使得不同报道中的饮用水中真菌检测与计数结果很难进行比较。近年来,高通量测序技术的快速发展为研究饮用水真菌提供了新思路,有助于更加深入全面地了解饮用水的真菌群落结构。本研究将城市供水系统分为原水、净水工艺、二次供水3个部分,通过培养法和免培养法(高通量测序)对整个城市供水系统中的真菌数量、群落结构和多样性进行了分析。
本研究通过高通量测序对供水系统15个样品中真菌的ITS1区进行了检测,共计检测到8门26纲67目228属的真菌。通过对群落组成分析,可知子囊菌门为供水系统中的优势菌门,但黄浦江上游原水、净水工艺和用户龙头水之间优势菌属各有不同。在所有样品中均有曲霉属与支顶孢属真菌存在,表明这2种菌属能够穿透净水工艺过程的多级屏障,现有的净水工艺无法将其有效去除。在其他研究中也从饮用水中分离得到曲霉属与支顶孢属真菌[25]。曲霉属与支顶孢属真菌的孢子为疏水性孢子,更容易集聚或与其它颗粒物结合而抵抗净水工艺中的胁迫条件[26]。此外,这两属的真菌均能够产生黑色素,从而为其在胁迫条件下提供保护[27],因此在整个供水系统中均能存活。
CF水厂和PC水厂工艺顺序不相同,但2个水厂经过生物活性炭滤池的出水真菌数目与物种多样性均比前一工艺单元有所上升,这主要是由于生物活性炭过滤工艺在运行中受到水流冲刷,附着在活性炭表面的真菌发生脱落所致。生物活性炭滤池出水中微生物数量上升这一问题并不鲜见,如Han等[28]研究表明由于活性炭上附着的生物膜,导致该工艺出水细菌总数达数万CFU/mL。多项研究表明虽然细菌是生物膜的主要组成部分,但真菌也能够嵌入生物膜中[29]。Chao1指数反映了样本物种丰富度信息,基于Unweighted UniFrac算法的样本距离则反映了物种差异信息。CF水厂砂滤池前已经进行了氯化消毒,PC水厂是在出厂水前加氯进行消毒,结果显示CF水厂砂滤池出水真菌物种数目较炭滤池出水有明显下降且与出厂水相近,物种种类与2个水厂出厂水也很相似。可以看出,氯化消毒对真菌的去除起到了关键作用,而研究显示真菌的耐氯性远高于普通细菌,甚至包括大肠杆菌[30]。若以大肠杆菌作为加氯量的指示微生物,则不能较好地反映真菌风险。
通过平板培养计数法结果可知水厂净水工艺能有效去除水中可培养真菌。两个水厂出厂水中真菌数目皆为0,但高通量测序分析结果显示这2个样本中仍有部分真菌存在。文刚等[31]对氯灭活木霉属、青霉属、枝孢属真菌机制的研究结果显示,灭活后样本中所有孢子胞内ATP的比例显著高于其中可培养孢子的比例,即有部分真菌孢子仍具有代谢活性但已经无法在培养基上生长。表明真菌也可能会进入有活性但不能培养(Viable but non-culturable,VBNC)状态,在适当条件下还能再重新培养生长;经过供水管网和二次供水环节之后,真菌数量(平板培养法计数)及真菌物种多样性(Chao1指数)均较出厂水有了明显上升,由此可以推测供水管网及二次供水设施是末端饮用水中真菌污染的重要来源。已有研究表明供水管网中生物膜是真菌重要的栖息地。Grabińska-Łoniewska等[1]研究表明生物膜上的真菌数量是水中的1 000−5 000倍,而由于管网末端余氯的衰减,不足以杀灭真菌,使得真菌更加容易定殖在管网末端,水流剪切力会使生物膜周期性脱落到水中,使真菌释放到水中并沿供水管网传播。Anaissie等[32]在研究中发现,曲霉属真菌数量在贮水池中要显著高于市政供水龙头水中。Hageskal等[2]也提出水池水箱更易滋生大量真菌。
对本研究数据和文献中报道的潜在病原微生物进行比对后发现,所研究城市供水系统中存在潜在致病真菌。Hageskal等[2]发现直接饮用受真菌污染的水对免疫功能完全的人来说并不会引起急性疾病,但依旧有可能引发表层和局部感染,对免疫功能有缺陷的人来说可能引发严重的感染。还有研究发现[6],从受茄病镰刀菌感染的病人临床样本中分离出的真菌与供水系统中的镰刀属菌基因型匹配,从病人肺部获得的烟曲霉与医院供水系统中的烟曲霉菌基因型一致,表明供水系统为引发感染的源头。瑞典和芬兰也分别报道过由水中真菌引发的人群大面积皮肤、肺部过敏现象[33-34]。因此,供水系统中真菌微生物安全问题不容忽视,需要更多研究以加深理解并发现有效控制途径。
| [1] |
Grabińska-Łoniewska A, Koniłłowicz-Kowalska T, Wardzyńska G, et al. Occurrence of fungi in water distribution system[J]. Polish Journal of Environmental Studies, 2007, 16(4): 539-547. |
| [2] |
Hageskal G, Gaustad P, Heier BT, et al. Occurrence of moulds in drinking water[J]. Journal of Applied Microbiology, 2007, 102(3): 774-780. DOI:10.1111/jam.2007.102.issue-3 |
| [3] |
Al-Gabr HM, Zheng T, Yu X. Occurrence and quantification of fungi and detection of mycotoxigenic fungi in drinking water in Xiamen City, China[J]. Science of the Total Environment, 2014, 466-467: 1103-1111. DOI:10.1016/j.scitotenv.2012.12.060 |
| [4] |
Bandh SA, Kamili AN, Ganai BA, et al. Opportunistic fungi in lake water and fungal infections in associated human population in Dal Lake, Kashmir[J]. Microbial Pathogenesis, 2016, 93: 105-110. DOI:10.1016/j.micpath.2016.01.022 |
| [5] |
Anaissie EJ, Penzak SR, Dignani MC. The hospital water supply as a source of nosocomial infections: A plea for action[J]. Archives of Internal Medicine, 2002, 162(13): 1483-1492. DOI:10.1001/archinte.162.13.1483 |
| [6] |
Anaissie EJ, Kuchar RT, Rex JH, et al. Fusariosis associated with pathogenic fusarium species colonization of a hospital water system: a new paradigm for the epidemiology of opportunistic mold infections[J]. Clinical Infectious Diseases, 2001, 33(11): 1871-1878. DOI:10.1086/cid.2001.33.issue-11 |
| [7] |
Bai XZ, Zhang T, Qu ZP, et al. Contribution of filamentous fungi to the musty odorant 2, 4, 6-trichloroanisole in water supply reservoirs and associated drinking water treatment plants[J]. Chemosphere, 2017, 182: 223-230. DOI:10.1016/j.chemosphere.2017.04.138 |
| [8] |
Paterson RRM, Kelley J, Gallagher M. Natural occurrence of aflatoxins and Aspergillus flaws (Link) in water[J]. Letters in Applied Microbiology, 1997, 25(6): 435-436. DOI:10.1111/lam.1997.25.issue-6 |
| [9] |
Vesper SJ, Haugland RA, Rogers ME, et al. Opportunistic Aspergillus pathogens measured in home and hospital tap water by quantitative PCR (QPCR)[J]. Journal of Water & Health, 2007, 5(3): 427-431. |
| [10] |
Göttlich E, van der Lubbe W, Lange B, et al. Fungal flora in groundwater-derived public drinking water[J]. International Journal of Hygiene & Environmental Health, 2002, 205(4): 269-279. |
| [11] |
Hageskal G, Lima N, Skaar I. The study of fungi in drinking water[J]. Mycological Research, 2009, 113(2): 165-172. DOI:10.1016/j.mycres.2008.10.002 |
| [12] |
Buse HY, Lu JR, Struewing IT, et al. Eukaryotic diversity in premise drinking water using 18S rDNA sequencing: implications for health risks[J]. Environmental Science & Pollution Research International, 2013, 20(9): 6351-6366. |
| [13] |
Adams RI, Miletto M, Taylor JW, et al. Dispersal in microbes: fungi in indoor air are dominated by outdoor air and show dispersal limitation at short distances[J]. The ISME Journal, 2013, 7(7): 1262-1273. DOI:10.1038/ismej.2013.28 |
| [14] |
Edgar RC. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [15] |
Caporaso JG, Kuczynski J, Stombaugh J, et al. QIIME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [16] |
Chao A. Nonparametric estimation of the number of classes in a population[J]. Scandinavian Journal of Statistics, 1984, 11(4): 265-270. |
| [17] |
Hill MO. Diversity and evenness: A unifying notation and its consequences[J]. Ecology, 1973, 54(2): 427-432. DOI:10.2307/1934352 |
| [18] |
Gottlieb T, Atkins BL. Case Report. Successful treatment of cutaneous Paecilomyces lilacinus infection with oral itraconazole in an immune competent host[J]. Mycoses, 2011, 44(11/12): 513-515. |
| [19] |
Valeyrie L, Botterel F, Minozzi C, et al. Prolonged fever revealing disseminated infection due to Penicillium marneffei in a French HIV-seropositive patient[J]. Aids, 1999, 13(6): 731-732. DOI:10.1097/00002030-199904160-00017 |
| [20] |
Ponikau JU, Sherris DA, Kern EB, et al. The diagnosis and incidence of allergic fungal sinusitis[J]. Mayo Clinic Proceedings, 1999, 74(9): 877-884. DOI:10.4065/74.9.877 |
| [21] |
Azziz-Baumgartner E, Lindblade K, Gieseker K, et al. Case-control study of an acute aflatoxicosis outbreak, Kenya, 2004[J]. Environmental Health Perspectives, 2005, 113(12): 1779-1783. DOI:10.1289/ehp.8384 |
| [22] |
De Rosa FG, Garazzino S, Pasero D, et al. Invasive candidiasis and candidemia: new guidelines[J]. Minerva Anestesiologica, 2009, 75(7/8): 453-458. |
| [23] |
Gonçalves AB, Paterson RRM, Lima N. Survey and significance of filamentous fungi from tap water[J]. International Journal of Hygiene and Environmental Health, 2006, 209(3): 257-264. DOI:10.1016/j.ijheh.2005.12.001 |
| [24] |
Paterson RRM, Hageskal G, Skaar I, et al. Occurrence, problems, analysis and removal of filamentous fungi in drinking water[A]//Fungicides. Chemistry, Environmental Impact and Health Effects[M]. New York: Nova Science Publishers Inc., 2009: 380-399
|
| [25] |
Sammon NB, Harrower KM, Fabbro LD, et al. Incidence and distribution of microfungi in a treated municipal water supply system in sub-tropical Australia[J]. International Journal of Environmental Research & Public Health, 2010, 7(4): 1597-1611. |
| [26] |
Mamane-Gravetz H, Linden KG. Relationship between physiochemical properties, aggregation and u.v. inactivation of isolated indigenous spores in water[J]. Journal of Applied Microbiology, 2005, 98(2): 351-363. DOI:10.1111/jam.2005.98.issue-2 |
| [27] |
Langfelder K, Streibel M, Jahn B, et al. Biosynthesis of fungal melanins and their importance for human pathogenic fungi[J]. Fungal Genetics & Biology, 2003, 38(2): 143-158. |
| [28] |
Han LN, Liu WJ, Chen M, et al. Comparison of NOM removal and microbial properties in up-flow/down-flow BAC filter[J]. Water Research, 2013, 47(14): 4861-4868. DOI:10.1016/j.watres.2013.05.022 |
| [29] |
Paramonova E, Krom BP, van der Mei HC, et al. Hyphal content determines the compression strength of Candida albicans biofilms[J]. Microbiology, 2009, 155(6): 1997-2003. DOI:10.1099/mic.0.021568-0 |
| [30] |
Ma X, Bibby K. Free chlorine and monochloramine inactivation kinetics of Aspergillus and Penicillium in drinking water[J]. Water Research, 2017, 120: 265-271. DOI:10.1016/j.watres.2017.04.064 |
| [31] |
Wen G, Zhu H, Huang TL, et al. Inactivation efficiency and mechanism of three dominant fungal spores in drinking groundwater by chlorine[J]. Environmental Science, 2016, 37(11): 4228-4234. (in Chinese) 文刚, 朱红, 黄廷林, 等. 氯灭活地下水源中3种优势真菌的效能与机制[J]. 环境科学, 2016, 37(11): 4228-4234. |
| [32] |
Anaissie EJ, Stratton SL, Dignani MC, et al. Pathogenic Aspergillus species recovered from a hospital water system: A 3-year prospective study[J]. Clinical Infectious Diseases, 2002, 34(6): 780-789. DOI:10.1086/338958 |
| [33] |
Aslund P. Skin irritations cause by moulds[J]. Var Föda, 1984, 36: 327-336. |
| [34] |
Muittari A, Kuusisto P, Virtanen P, et al. An epidemic of extrinsic allergic alveolitis caused by tap water[J]. Clinical & Experimental Allergy, 1980, 10(1): 77-90. |
 2019, Vol. 46
2019, Vol. 46




