扩展功能
文章信息
- 李小龙, 吴群, 徐岩
- LI Xiao-Long, WU Qun, XU Yan
- 乙醇与酸度协同作用推动芝麻香型白酒固态发酵过程的微生物群落演替
- Synergism between ethanol and acidity drives microbial community succession during roasted sesame-flavor liquor solid-state fermentation
- 微生物学通报, 2019, 46(1): 1-10
- Microbiology China, 2019, 46(1): 1-10
- DOI: 10.13344/j.microbiol.china.180242
-
文章历史
- 收稿日期: 2018-03-27
- 接受日期: 2018-05-04
- 网络首发日期: 2018-06-05
微生物群落组装及其演变对于食品发酵过程和最终产物的品质特征具有重要作用,但微生物群落如何组装以及受哪些因素控制目前并不清晰,解析食品发酵过程微生物群落组装及其驱动因素有助于解析食品微生物的酿造机制。
白酒由复杂的微生物群落发酵作用生产。目前,学者们对于白酒固态发酵过程的微生物群落演变规律开展了大量研究。Li等研究发现耐热耐旱性的Bacillales、Eurotiales和Mucorales在大曲固态发酵升温阶段会取代Lactobacillales和Saccharomycetales成为优势微生物[1]。Song等研究确定了10个细菌属和11个真菌属是酱香型白酒固态发酵过程的核心微生物群,Schizosaccharomyces到Lactobacillus的微生物结构改变会驱动风味物质从乙醇到乳酸、乙酸的转变[2];王鹏等根据风味贡献程度、相互作用关系强度和相对丰度确定了Lactobacillus、Candida、Rhizopus、Dipodascus等10个属为浓香型白酒固态发酵过程的核心微生物群[3]。Xiao等和Li等以大曲作为研究对象,揭示了生物热是中温大曲功能微生物群落形成的关键环境驱动力[4],以及高温会引起大曲微生物群落中Enterobacteriales和Eurotiales丰度的显著降低,进而改变微生物结构[5]。这些研究揭示了微生物群落的演替规律,解析了不同香型白酒的核心微生物群,探究了环境因素对群落演替的驱动作用,对于解析微生物酿造机制具有重要意义。
芝麻香型白酒是创新型白酒,具有“清蒸续𥻗、泥底砖窖、大麸结合、三高一长”的工艺特点。邢敏钰等借助高通量测序分析了芝麻香型白酒发酵过程中乳酸菌群的多样性及其演替规律,发现Weissella和Lactobacillus分别是堆积阶段和发酵阶段的优势细菌[6];高传强等解析了其发酵过程中细菌、酵母和霉菌类群的优势微生物及其潜在的风味贡献[7],但是目前对其核心微生物以及群落演替的环境驱动因素并不清楚。因此,本文以芝麻香型白酒为研究对象,研究其固态发酵过程中微生物群落演变规律及演替环境推动力,以期为解析微生物酿造机制以及提高固态发酵过程的可控性提供依据。
1 材料与方法 1.1 材料 1.1.1 酒醅样品采集芝麻香型白酒窖池上层酒醅并置于−20 ℃保存(取样深度为50 cm;取样时间为0、5、10、20、30 d (出池);每个时间点包括3个不同班组的平行样品;N=15份),用于酒醅样品宏基因组提取和检测。
1.1.2 主要试剂和仪器所有试剂均为分析纯,购自国药集团化学试剂有限公司。数显双金属温度计,上海上龙电器有限公司;细胞破碎仪,上海玉博生物科技有限公司;核酸浓度检测仪和荧光定量PCR仪,赛默飞世尔科技有限公司。
1.2 方法 1.2.1 理化因子检测采用数显双金属温度计记录发酵过程中窖池温度数据;采用干燥法(将酒醅放置在恒温烘箱,105 ℃,4 h)、滴定法(0.1 mol/L标准氢氧化钠溶液滴定并添加酚酞作为指示剂)和DNS法分别测定酒醅样品的水分、酸度和还原糖含量;采用pH计和高效液相色谱测定酒醅样品的pH值和乙醇含量。
1.2.2 酒醅宏基因组提取称取7 g酒醅样品,用0.1 mol/L的PBS缓冲溶液洗涤3次,收集酒醅中的微生物细胞,利用细胞破碎仪破碎细胞并用苯酚-氯仿提取酒醅宏基因组,并用核酸浓度检测仪检测宏基因组DNA质量,操作方法参考文献[8]。
1.2.3 高通量测序利用Illumina MiSeq技术对酒醅宏基因组进行测序,测序区域为细菌16S rRNA基因的V3−V4区域(引物338F:5′-ACTCCTACGGGAGGCAGCA G-3′;引物806R:5′-GACTACHVGGGTWTCTAA T-3′)和真菌的ITS2区域(引物ITS1:5′-GCATCGAT GAAGAACGCAGC-3′;引物ITS2:5′-TCCTCCGCT TATTGATATGC-3′)[9]。扩增子测序过程和数据处理参考文献[10]。将高通量测序的原始数据提交DDBJ (DNA Data Bank of Japan),编号为DRA006797和DRA006798。利用MOTHUR软件计算Chao1和Shannon指数揭示微生物组成的多样性和均匀性。
1.2.4 模拟原位系统发酵实验取堆积结束的酒醅(pH 4.1),用磷酸盐调节酒醅酸度至不同梯度(pH 5.0、6.0和7.0),置于恒温培养箱静置密封发酵,并按照原位系统调节温度(22.0 ℃→31.6 ℃→34.0 ℃→36.0 ℃→36.6 ℃→ 34.3 ℃)。培养5 d后提取酒醅宏基因组并用荧光定量PCR定量细菌、乳酸菌、芽孢杆菌、酵母和霉菌的生物量,引物和反应程序参考文献[11-12]。
1.2.5 数据统计分析利用SPSS计算固态发酵过程中微生物和酒醅理化因子的Spearman相关系数ρ,并用Gephi对|ρ| > 0.6且P < 0.05的数据可视化成共现网络;利用Canoco 5分析固态发酵过程中酒醅理化因子和微生物群落组成的关联性;利用R语言计算单一环境因子对微生物群落物种分布的解释率。
2 结果与分析 2.1 理化因子演替规律水分、酸度、温度、还原糖和乙醇是白酒发酵过程中的重要环境因子,解析芝麻香型白酒发酵过程中环境因素的演变规律,结果如图 1所示。固态发酵过程可划分为两个阶段:在阶段Ⅰ (0−5 d),窖池温度从22.0 ℃升高至35.0±2.0 ℃,还原糖含量从53.38±2.74 mg/g下降到36.88±8.43 mg/g,乙醇含量从32.09±6.45 mg/g升高到71.94±0.99 mg/g,酸度从0.18±0.01 mmol/g升高至0.19±0.00 mmol/g,水分含量从56.63%±0.55%升高到59.00%± 0.66%;在阶段Ⅱ (5−30 d),温度和还原糖含量分别降低至26.0±1.0 ℃和20.45±3.30 mg/g,酸度和乙醇含量分别升高至0.31±0.00 mmol/g和83.54±6.49 mg/g,水分含量介于58.40%±0.75%和59.93%±0.51%。

|
| 图 1 芝麻香型白酒固态发酵过程中酒醅理化因子变化曲线图 Figure 1 Variation curves of physicochemical properties during roasted sesame-flavor liquor SSF 注:A:化学因子(包括乙醇和还原糖);B:物理因子(包括水分、酸度和温度). Note: A: Chemical properties (ethanol and reducing sugar); B: Physical properties (moisture, acidity and temperature). |
|
|
根据发酵过程中酒醅理化因子演变规律可知,随着固态发酵过程中碳源消耗及初级代谢产物的积累,酒醅环境极端性逐渐增强。酒醅理化因子在阶段Ⅰ (0−5 d)变化剧烈,乙醇合成速率和还原糖消耗速率最大,分别为7.97 mg/(g·d)和3.30 mg/(g·d);在阶段Ⅱ (5−30 d),酸度在5−10 d变化速率最大为0.15 mmol/(g·d)。酒醅理化因子对于发酵过程微生物群落的演替具有重要作用,因此进一步解析固态发酵过程中的酒醅微生物群落。
2.2 酒醅微生物群落解析所有酒醅样本测序Reads > 20 000,Goods coverage > 99%,测序数据具有良好的准确性和可信度。基于分类操作单元(OTU)矩阵序列聚类共得到188个原核微生物OTU和279个真核微生物OTU。从α多样性、群落组成、代谢途径丰度分布解析芝麻香型白酒固态发酵过程中酒醅微生物群落的演替规律。
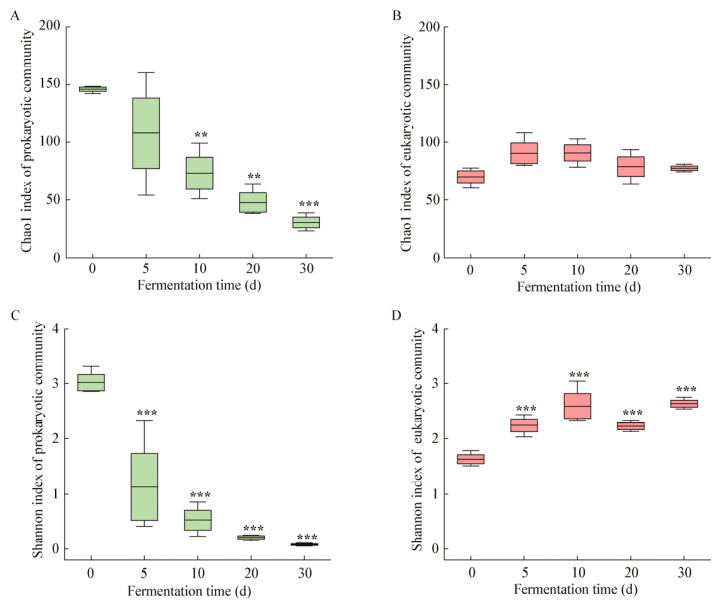
2.2.1 α多样性变化Chao1指数和Shannon指数分别表示微生物群落的物种多样性和物种分布的均匀度。如图 2所示,从0 d到30 d,原核微生物群落的Chao1指数和Shannon指数分别从145.92±3.17和3.01±0.25降低到30.88±7.64和0.08±0.03;从0 d到10 d,真核微生物群落的Chao1指数由70.10±9.06升高到90.67±12.14,Shannon指数由1.63±0.14升高到2.59±0.39;从10 d到30 d,Chao1指数下降到77.41±3.24,Shannon指数先下降后上升到2.64±0.11。这说明在固态发酵过程中原核微生物群落的多样性和均匀度不断降低;真核微生物群落的多样性先升高后降低,均匀度总体是提高的。
|
| 图 2 芝麻香型白酒固态发酵过程中酒醅微生物群落α多样性变化 Figure 2 The α-diversity of mash microbial community during roasted sesame-flavor liquor SSF 注:A:原核微生物群落Chao1指数;B:真核微生物群落Chao1指数;C:原核微生物群落Shannon指数;D:真核微生物群落Shannon指数. *:P < 0.05;**:P < 0.01;***:P < 0.001. Note: A: Chao1 index of prokaryotic community; B: Chao1 index of eukaryotic community; C: Shannon index of prokaryotic community; D: Shannon index of eukaryotic community. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
|
|
与发酵0 d相比,真核微生物群落的Chao1指数在不同发酵时间没有显著性差异(P > 0.05),说明了真核微生物群落的相对稳定性;从发酵第5天开始,真核微生物群落和原核微生物群落的Shannon指数产生极显著差异(P < 0.001);从发酵第10天开始,原核微生物群落的Chao1指数产生显著性差异(P值分别为0.008、0.001、< 0.001)。说明固态发酵过程中微生物群落组成的显著改变。
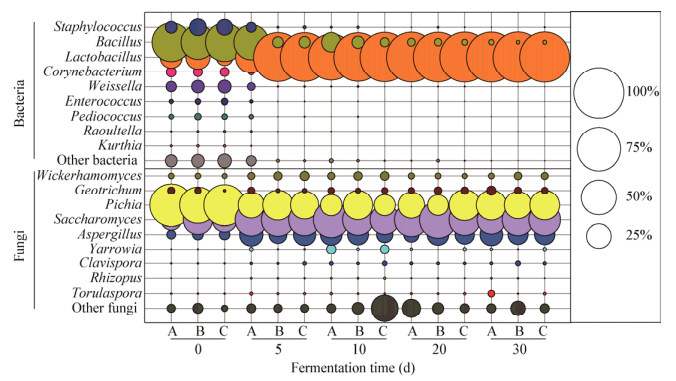
2.2.2 微生物群落结构和功能转变芝麻香型白酒固态发酵过程中微生物群落结构在属水平的分布变化见图 3。在阶段Ⅰ (0−5 d),Bacillus (54.12%±7.12%)是原核微生物群落相对丰度最高的微生物属,此外原核微生物群落组成还包括Lactobacillus (17.91%±6.32%)、Staphylococcus (8.92%±2.93%)、Corynebaccterium (3.58%±0.38%)、Weissella (5.95%±1.29%)、Enterococcus (1.21%± 0.45%)、Pediococcus (1.32%±0.40%)和其他低丰度细菌属(< 1%);Pichia (64.86%±10.30%)是真核微生物群落相对丰度最高的微生物属,此外真核微生物群落组成还包括Saccharomyces (25.26%±8.66%)、Wickerhamomyces (1.20%±0.20%)、Aspergillus (4.19%±0.71%)、Geotrichum (1.31%±0.91%)、Clavispora (1.09%±0.18%)和其他低丰度的微生物属(< 1%)。在阶段Ⅱ (5−30 d),Lactobacillus取代Bacillus的优势地位成为原核微生物群落的优势微生物,其相对丰度占原核微生物群落的90%以上,直至固态发酵结束;Saccharomyces成为真核微生物群落最优势微生物,其相对丰度约为40%,其次是Pichia和Aspergillus,而Wickerhamomyces和Geotrichum在整个固态发酵过程中的丰度相对恒定。
|
| 图 3 芝麻香型白酒固态发酵过程中微生物群落结构在属水平的分布变化 Figure 3 Distribution of microbial community at the genus level during roasted sesame-flavor liquor SSF |
|
|
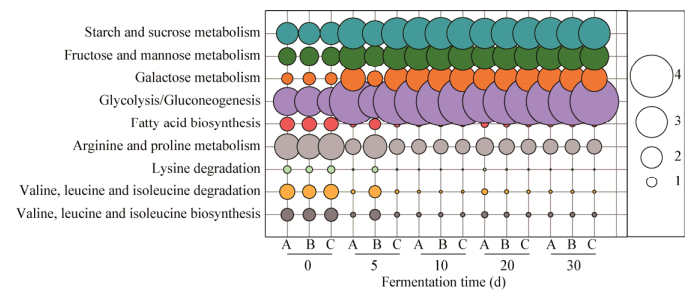
基于扩增子测序的PICRUSt表明:不同KEGG (Kyoto encyclopedia of genes and genomes)通路在芝麻香型白酒固态发酵过程中的分布相对恒定,涉及代谢、遗传信息处理和环境信号处理的通路比例分别为43.62%±1.88%、22.07%±2.88%和17.78%± 0.96%。但是,固态发酵过程中原核微生物群落结构演替导致了碳源代谢和氨基酸代谢途径丰度的显著改变。鉴于乳酸菌对糊精、D-麦芽糖、纤维二糖、D-甘露糖、D-果糖、D-半乳糖等多种糖类物质的利用较强[6],而Bacillus可以合成淀粉酶、蛋白酶、脂肪酶并催化产生各种风味物质的前体[13],Lactobacillus对Bacillus的取代也导致原核微生物群落在阶段Ⅱ (5−30 d)对碳源(淀粉、蔗糖、果糖、甘露糖和半乳糖)的分解利用加强,糖酵解途径丰度也显著提高;而氨基酸代谢途径(精氨酸和脯氨酸代谢,赖氨酸降解,缬氨酸、亮氨酸和异亮氨酸的代谢)和脂肪酸合成代谢丰度下降。芝麻香型白酒固态发酵过程中原核微生物群落代谢途径的分布变化见图 4。
|
| 图 4 芝麻香型白酒固态发酵过程中原核微生物群落代谢途径的分布变化 Figure 4 Distribution of metabolic pathways of prokaryotic microbial community during roasted sesame-flavor liquor SSF |
|
|
优势微生物的判定有助于芝麻香型白酒群落微生物组装机制的解析,也可为酒醅微生物强化提供科学依据。表 1展示了芝麻香型白酒固态发酵过程中平均相对丰度超过1%的微生物属以及丰度超过1%的样品占总样品数的频率。Lactobacillus和Saccharomyces是芝麻香型白酒固态发酵过程中相对丰度最高的原核微生物属和真核微生物属,其平均相对丰度分别为76.44%和38.38%;Pichia、Aspergillus、Wickerhamomyces、Geotrichum和Bacillus平均相对丰度分别为36.38%、14.06%、1.96%、1.68%和16.73%,并且在超过50%的样品中相对丰度 > 1%。Staphylococcus和Weissella的平均相对丰度分别为2.13%和1.39%,仅在发酵前期的部分样品中相对丰度 > 1%,所以分布频率低于50%。
| Genus | Relative abundance range (%) | Average of relative abundance (%) | Frequency (%) |
| Lactobacillus | 10.97−99.5 | 76.44 | 100.00 |
| Bacillus | 0.46−58.79 | 16.73 | 86.67 |
| Staphylococcus | 0.00−11.11 | 2.13 | 26.67 |
| Weissella | 0.01−6.92 | 1.39 | 26.67 |
| Saccharomyces | 17.18−54.30 | 38.38 | 100.00 |
| Pichia | 17.29−73.08 | 36.38 | 100.00 |
| Aspergillus | 3.38−21.92 | 14.06 | 100.00 |
| Wickerhamomyces | 0.97−3.41 | 1.96 | 93.33 |
| Geotrichum | 0.29−3.51 | 1.68 | 80.00 |
研究结合固态发酵过程中微生物属的相对丰度以及分布频率,将平均相对丰度超过1%且至少在50%的样品中丰度超过1%的微生物定义为优势微生物[14]。综上,芝麻香型白酒固态发酵过程中的优势微生物属包括Lactobacillus、Bacillus、Pichia、Saccharomyces、Aspergillus、Wickerhamomyces和Geotrichum。
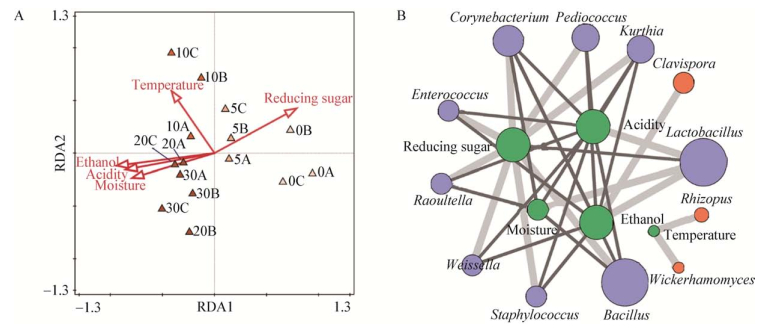
2.3 微生物群落结构和环境因素关联性分析酒醅样品理化因子会影响微生物群落物种分布,解析微生物群落演替的环境驱动力可为调整生产参数、提高固态发酵可控性提供依据。冗余分析(Redundancy anatysis,RDA)表明,酒醅理化因子对于固态发酵过程中群落物种分布的解释率为68.27%,说明酒醅理化因子是微生物群落演替的主要推动力,如图 5A所示。根据微生物与理化因子的共现网络,酒醅理化因子与微生物属存在显著相互作用。如图 5B所示,发酵过程还原糖含量和温度分别与Enterococcus、Weissella、Saccharomyces、Bacillus、Kurthia、Pediococcus、Corynebacterium和Rhizopus、Wickerhamomyces呈显著正相关;水分含量与Kurthia、Corynebacterium、Raoultella和Bacillus呈显著负相关;乙醇含量和酸度与Lactobacillus的相对丰度呈显著正相关,与除Lactobacillus外的几乎所有细菌属呈显著负相关。Lactobacillus在发酵过程中迅速合成高浓度的乳酸,并且自身可以耐受高浓度的乳酸和乙醇[15],这既抑制了不具有抗酸抗醇特性的微生物,从而保证发酵正常进行,又维持了Lactobacillus与其他微生物的相互作用,保证了发酵体系的稳定[8]。
|
| 图 5 芝麻香型白酒固态发酵过程中微生物与酒醅理化因子相关性 Figure 5 The correlation between microbes and physicochemical properties during roasted sesame-flavor liquor SSF 注:A:冗余分析;B:基于Spearman相关性构建的理化因子和微生物的共现网络,其中蓝色、红色和绿色圆圈分别代表细菌、真菌和理化因子;浅灰色、深灰色分别代表正、负相互作用. Note: A: Redundancy analysis; B: Co-occurrence network of physicochemical properties and microbes based on spearman correlation. Blue, red, and green circles represented bacteria, fungi, and physicochemical properties respectively. Line of light gray and dark gray represented positive and negative interactions respectively. |
|
|
进一步计算了单个环境因子对于固态发酵过程中微生物群落物种分布的解释率,如表 2所示。在阶段Ⅰ (0−5 d),环境因素对于发酵过程物种分布的解释率为100.00%,酸度(4.30%)是群落演替的关键环境驱动力;在阶段Ⅱ (5−30 d),环境因素对于发酵过程物种分布的解释率为44.23%,乙醇(11.07%)是群落演替的关键环境驱动力。在芝麻香型白酒固态发酵过程中,环境因素对物种分布的解释率为68.27%:乙醇(最高解释变量)、酸度和二者共同的解释率分别为13.76%、4.43%和23.17%,说明乙醇和酸度对推动白酒微生物群落演替具有协同作用;温度的解释率为8.83%,说明温度不仅是塑造中温大曲微生物群落的关键推动力[4],也是芝麻香型白酒发酵过程群落演替的重要推动力。此外,还原糖在一定程度上也会推动微生物群落的演替过程。
| Environment factors | Stage Ⅰ (0−5 d) | Stage Ⅱ (5−30 d) | SSF (0−30 d) |
| Moisture | 4.02 | < 0.01 | < 0.01 |
| Acidity | 4.30 | 7.12 | 4.43 |
| Temperature | 3.94 | 7.11 | 8.83 |
| Reducing sugar | 2.87 | 9.50 | 4.62 |
| Ethanol | 3.39 | 11.07 | 13.76 |
| Sum | 100.00 | 44.23 | 68.27 |
为了验证酸度对芝麻香型白酒固态发酵阶段Ⅰ (0−5 d)微生物群落演替的推动作用,向入池酒醅(pH 4.1)中添加磷酸盐将酒醅酸度调整至pH值为5.0、6.0和7.0,经过5 d的厌氧发酵后,通过主要微生物类群生物量(图 6)的变化比较微生物群落组成差异。

|
| 图 6 酒醅微生物类群生物量 Figure 6 Biomass of different microflora in simulated system Note: A: Control, pH 4.1; B: pH 5.0; C: pH 6.0; D: pH 7.0. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
|
|
与对照组(pH 4.1)相比,当调整酒醅酸度至pH 5.0、6.0和7.0时,霉菌生物量没有显著差异,细菌生物量增加但不具有显著性;当调整酒醅酸度至pH 5.0时,乳酸菌生物量显著提高(P=0.008);当调整酒醅酸度至pH 6.0时,酵母生物量显著降低(P=0.043),乳酸菌(P=0.002)和芽孢杆菌(P=0.035)的生物量显著提高;当调整酒醅酸度至pH 7.0时,乳酸菌(P=0.004)和芽孢杆菌(P=0.001)的生物量显著提高,酵母生物量下降但不具有显著性。
酒醅酸度的改变会导致主要微生物类群的生物量显著改变,进一步影响微生物群落结构组成;与对照组相比,降低酒醅酸度可能会导致芽孢杆菌、乳酸菌生物量提高和酵母生物量下降,以及酿造体系微生物相互作用关系的平衡,这可能是酵母生物量下降并不与酸度改变幅度呈正比的原因。由于微生物代谢特性差异很大,对于白酒风味的影响也需要进一步验证。
3 讨论与结论芝麻香型白酒固态发酵过程中的优势微生物对于其风味特征形成具有重要作用。在阶段Ⅰ (0−5 d),Bacillus和Pichia分别是丰度最高的原核微生物和真核微生物,其中Bacillus可以合成淀粉酶、蛋白酶、脂肪酶并催化产生各种风味物质的前体[13],Pichia可以合成4-乙烯基愈创木酚和4-乙烯基苯酚以及它们的前体物质[16]。在阶段Ⅱ (5−30 d),Lactobacillus和Saccharomyces成为酿造体系丰度最高的微生物,其中Lactobacillus可以合成高浓度乳酸,维持Lactobacillus与其他微生物的相互作用,同时为乳酸乙酯提供前体物质,增加白酒的醇厚感[17];Saccharomyces,尤其是Saccharomyces cerevisiae是乙醇的主要贡献微生物。此外,芝麻香型白酒固态发酵过程的优势微生物还包括Aspergillus、Wickerhamomyces和Geotrichum,其中Wickerhamomyces的某些微生物可大量合成乙酸乙酯,赋予白酒水果香气的同时抑制部分霉菌生长[18];平均相对丰度不足2%的Geotrichum具有突出的脂肪酶合成能力,还可以降解高级醇生成酯类[19-20]。
鉴于环境条件会决定微生物群落的组成[5],Song等通过探究酱香型白酒核心微生物群与环境因子的相关性,揭示了在发酵前期和后期与核心微生物群显著相关的环境因子分别为乙醇、水分和乳酸、pH[2];王鹏等通过探究浓香型白酒核心微生物群演替的环境推动力,揭示了微生物代谢导致的化学因素改变是群落演替的关键推动力[3]。但是以上研究未揭示单个环境因子对于微生物群落演替的贡献率。本研究发现,酸度和乙醇分别是阶段Ⅰ (0−5 d)和阶段Ⅱ (5−30 d)微生物群落演替的关键环境推动力。在芝麻香型白酒固态发酵过程中,乙醇和酸度对于群落物种分布的解释率分别为13.76%和4.43%,而两个环境因子的共同解释率为23.17%,它们对于推动微生物群落演替具有明显的协同作用;其他环境因子,如还原糖和温度对于物种分布的解释率分别为4.62%和8.83%,也会影响微生物群落的演替过程。
本研究借助高通量测序技术解析了芝麻香型白酒固态发酵过程中酒醅微生物群落组成及结构转变,并利用多元统计分析方法探究了环境因素对酒醅微生物群落物种分布的影响,这对于解析芝麻香型白酒核心功能菌群,以及通过调整生产参数提高固态发酵过程的可控性具有重要意义。
| [1] |
Li P, Liang HB, Lin WT, et al. Microbiota dynamics associated with environmental conditions and potential roles of cellulolytic communities in traditional Chinese cereal starter solid-state fermentation[J]. Applied and Environmental Microbiology, 2015, 81(15): 5144-5156. DOI:10.1128/AEM.01325-15 |
| [2] |
Song ZW, Du H, Zhang Y, et al. Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J]. Frontiers in Microbiology, 2017, 8: 1294. DOI:10.3389/fmicb.2017.01294 |
| [3] |
Wang P, Wu Q, Xu Y. Core microbiota in Chinese liquor fermentation and associations with environmental factors[J]. Acta Microbiologica Sinica, 2018, 58(1): 142-153. (in Chinese) 王鹏, 吴群, 徐岩. 中国白酒发酵过程中的核心微生物群及其与环境因子的关系[J]. 微生物学报, 2018, 58(1): 142-153. |
| [4] |
Xiao C, Lu ZM, Zhang XJ, et al. Bio-heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J]. Applied and Environmental Microbiology, 2017, 83(23): e01550-17. |
| [5] |
Li P, Lin WF, Liu X, et al. Environmental factors affecting microbiota dynamics during traditional solid-state fermentation of Chinese Daqu Starter[J]. Frontiers in Microbiology, 2016, 7: 1237. |
| [6] |
Xing MY, Du H, Xu Y. Diversity and succession of lactic acid bacteria during sesame-flavor liquor fermentation[J]. Microbiology China, 2018, 45(1): 19-28. (in Chinese) 邢敏钰, 杜海, 徐岩. 芝麻香型白酒发酵过程中乳酸菌多样性及其演替规律[J]. 微生物学通报, 2018, 45(1): 19-28. |
| [7] |
Gao CQ, Yang F, Zhang HS. Advances in microbial flora and flavor components of sesame flavor liquor[J]. Microbiology China, 2017, 44(4): 940-948. (in Chinese) 高传强, 阳飞, 张华山. 芝麻香型白酒微生物菌群及风味物质研究进展[J]. 微生物学通报, 2017, 44(4): 940-948. |
| [8] |
Wang XS, Du H, Xu Y. Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J]. International Journal of Food Microbiology, 2017, 244: 27-35. DOI:10.1016/j.ijfoodmicro.2016.12.018 |
| [9] |
Hong XT, Chen J, Liu L, et al. Metagenomic sequencing reveals the relationship between microbiota composition and quality of Chinese Rice Wine[J]. Scientific Reports, 2016, 6: 26621. DOI:10.1038/srep26621 |
| [10] |
Li Z, Dong L, Huang Q, et al. Bacterial communities and volatile compounds in Doubanjiang, a Chinese traditional red pepper paste[J]. Journal of Applied Microbiology, 2016, 120(6): 1585-1594. DOI:10.1111/jam.2016.120.issue-6 |
| [11] |
Zhang Y. Community structure and function of lactic acid bacteria during Maotai-flavor liquor fermentation[D]. Wuxi: Master's Thesis of Jiangnan University, 2015 (in Chinese) 张艳.酱香型白酒发酵中乳酸菌群结构及功能研究[D].无锡: 江南大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10295-1015430087.htm |
| [12] |
Wang P. Effect of Bacillus licheniformis inoculation on the microbial community and metabolism during strong flavored liquor brewing process[D]. Wuxi: Master's Thesis of Jiangnan University, 2017 (in Chinese) 王鹏.地衣芽孢杆菌强化对浓香型白酒酿造微生物群落结构和代谢的影响[D].无锡: 江南大学硕士学位论文, 2017 http://cdmd.cnki.com.cn/Article/CDMD-10295-1017272845.htm |
| [13] |
Zhang R, Wu Q, Xu Y. Aroma characteristics of Moutai-flavour liquor produced with Bacillus licheniformis by solid-state fermentation[J]. Letters in Applied Microbiology, 2013, 57(1): 11-18. DOI:10.1111/lam.12087 |
| [14] |
Wolfe BE, Button JE, Santarelli M, et al. Cheese rind communities provide tractable systems for in situ and in vitro studies of microbial diversity[J]. Cell, 2014, 158(2): 422-433. DOI:10.1016/j.cell.2014.05.041 |
| [15] |
Li XR, Ma EB, Yan LZ, et al. Bacterial and fungal diversity in the traditional Chinese liquor fermentation process[J]. International Journal of Food Microbiology, 2011, 146(1): 31-37. DOI:10.1016/j.ijfoodmicro.2011.01.030 |
| [16] |
Suezawa Y, Suzuki M. Bioconversion of ferulic acid to 4-vinylguaiacol and 4-ethylguaiacol and of 4-vinylguaiacol to 4-ethylguaiacol by halotolerant yeasts belonging to the genus Candida[J]. Bioscience, Biotechnology, and Biochemistry, 2007, 71(4): 1058-1062. DOI:10.1271/bbb.60486 |
| [17] |
Gao WJ, Fan WL, Xu Y. Characterization of the key odorants in light aroma type chinese liquor by gas chromatography-olfactometry, quantitative measurements, aroma recombination, and omission studies[J]. Journal of Agricultural and Food Chemistry, 2014, 62(25): 5796-5804. DOI:10.1021/jf501214c |
| [18] |
Oro L, Feliziani E, Ciani M, et al. Volatile organic compounds from Wickerhamomyces anomalus, Metschnikowia pulcherrima and Saccharomyces cerevisiae inhibit growth of decay causing fungi and control postharvest diseases of strawberries[J]. International Journal of Food Microbiology, 2018, 265: 18-22. DOI:10.1016/j.ijfoodmicro.2017.10.027 |
| [19] |
Maldonado RR, Aguiar-Oliveira E, Pozza EL, et al. Production of lipase from Geotrichum candidum using corn steep liquor in different bioreactors[J]. Journal of the American Oil Chemists' Society, 2014, 91(12): 1999-2009. DOI:10.1007/s11746-014-2552-9 |
| [20] |
Zhu J, Shi JL, Lu Y, et al. Application of strains of Geotrichum spp. to decrease higher alcohols and to increase esters[J]. Journal of the Institute of Brewing, 2016, 122(1): 147-155. DOI:10.1002/jib.v122.1 |
 2019, Vol. 46
2019, Vol. 46




