扩展功能
文章信息
- 潘爱红, 李江, 王蕾, 宋益民
- PAN Ai-Hong, LI Jiang, WANG Lei, SONG Yi-Min
- 南极交替单胞菌R11-5产卡拉胶酶的发酵条件优化
- Optimization of carrageenase fermentation conditions of Antarctic bacterium Alteromonas sp. R11-5
- 微生物学通报, 2018, 45(9): 2022-2034
- Microbiology China, 2018, 45(9): 2022-2034
- DOI: 10.13344/j.microbiol.china.180367
-
文章历史
- 收稿日期: 2018-05-09
- 接受日期: 2018-07-13
- 网络首发日期(www.cnki.net): 2018-07-31
2. 国家海洋局第一海洋研究所 山东 青岛 266061;
3. 青岛大学 山东 青岛 266071
2. First Institute of Oceanography, State Oceanic Administration, Qingdao, Shandong 266061, China;
3. Qingdao University, Qingdao, Shandong 266071, China
卡拉胶是一种从红藻中提取的酸性多糖,俗称鹿角菜胶或角叉菜胶,具有抗氧化[1]、抗病毒[2]、抗肿瘤[3]的生理活性,在医学领域具有广泛的应用价值,在制药工艺上常被作为悬浮剂、凝胶剂和增稠剂[4]使用。卡拉胶的降解产物是卡拉胶寡糖,相比卡拉胶,卡拉胶寡糖具有水溶性好、稳定性高、易吸收的特点,其分子链上的活性基团充分暴露,在免疫调节功能[5]、抗氧化活性[6]、抗病毒活性、抗肿瘤活性[7-8]方面优于卡拉胶。
目前,卡拉胶寡糖的制备方法主要有3种:化学法、物理法和生物酶法。化学法即通过化学试剂的作用使卡拉胶大分子中的糖苷键断裂,形成小分子的寡糖,但化学降解会使降解底物的硫酸根基团掉落,降低寡糖的生物活性[9]。物理法主要通过超声波、微波和辐射[10]途径降解卡拉胶大分子,其寡糖的组成和结构虽不会改变,但反应条件难以控制。生物酶法即通过生物中提取的活性酶降解卡拉胶,因其专一性强,降解卡拉胶产生的产物单一,反应条件温和,不会破坏卡拉胶中活性基团,能够有效保持卡拉胶的活性结构,在食品工业及医药等领域具有良好的应用前景。
现阶段研究最广泛的是从海洋微生物中制备卡拉胶酶[11]。最近的研究表明,寒冷环境存在大量冷适应的、种类繁多的多糖降解海洋细菌[12]。然而,对南极细菌多糖降解活性的研究还很少。迄今为止,只有项目组从南极菌交替假单胞菌(Pseudoalteromanas sp.) NJ21中筛选、克隆和表达了耐低温的琼胶酶Aga21[13],该酶在10 ℃时仍能保持80%以上的初始酶活。Jung等[14]报道了Gayadomonas joobiniege G7产的冷适应琼胶酶AgaJ9,该酶能够从凝固的琼脂糖中直接回收DNA,而有关南极微生物产卡拉胶酶的研究尚未见报道。
南极分布着种类繁多的大型海藻[15],目前已发现的就有117种,其中57种是南极所特有的种属[16],因此,大型海藻在南极生态系统及物质能量循环代谢中发挥着重要的作用。海藻多糖降解酶是海藻降解的关键酶,其为南极海洋生物系统提供了大量的有机碳源,发现和研究南极微生物产的海藻多糖降解酶,不仅能获得结构新颖的海藻多糖降解酶,也有助于理解南极海洋生态系统的代谢和调节机制。
微生物培养条件的优化在微生物代谢产物的研究中起着重要的作用,野生菌受自然环境条件限制,其生长和发酵产酶条件并非最优,特别是对于生长温度较低的南极微生物,为了使野生菌的产酶效率达到最高,需要对野生菌的培养条件进行优化,以满足后续的研究。本文将采用响应面法对产卡拉胶酶南极交替单胞菌R11-5的培养条件进行系统研究,以提高其产酶量,从而为该酶的异源表达、酶学性质研究以及后续的应用研究提供科学依据,同时也有助于理解南极海洋微生物的碳代谢机制。
1 材料与方法 1.1 材料 1.1.1 菌株南极交替单胞菌R11-5来源于中国第30次南极科学考察沉积物样品,考察区域位于普里兹湾。采集后筛选分离,保存于–80 ℃。
1.1.2 主要试剂和仪器蛋白胨、酵母粉,Oxoid公司;卡拉胶,HASHENG生物科技公司;氯化钙、牛肉浸膏,国药集团化学试剂有限公司;3-5二硝基水杨酸(DNS)溶液:182 g四水合酒石酸钾钠溶解于600 mL蒸馏水中,加入21 g NaOH,6.3 g DNS,5 mL苯酚,5 g亚硫酸钠,定容到1 L容量瓶,储存于棕色瓶中;碘单质、碘化钾,上海银典化工有限公司。
PCR仪、台式冷冻离心机,赛默飞世尔公司;分光光度计,上海尤尼柯公司;数显恒温水浴锅,常州丹瑞实验仪器公司;全温振荡培养箱,北京东联哈尔有限公司。
1.1.3 培养基2216E液体培养基(g/L):蛋白胨5.0,酵母粉1.0,过滤海水配制,1.21×105 Pa灭菌20 min。
卡拉胶酶筛选培养基(g/L):蛋白胨5.0,酵母粉1.0,卡拉胶20.0,过滤海水配制,1.21×105 Pa灭菌20 min。
1.2 方法 1.2.1 菌株的筛选将从沉积物样品中筛选得到的85株可培养的南极细菌接种到5 mL 2216E液体培养基中,15 ℃、150 r/min培养24 h;取2 μL菌液接种于卡拉胶酶筛选培养基上,在15 ℃恒温培养箱中静置培养48 h,观察菌落形态,用卢戈氏碘液染色法筛选出具有卡拉胶酶活性的菌株,测定卡拉胶酶活。
1.2.2 卡拉胶酶活的测定方法[17-18]将筛选得到的具有卡拉胶酶活性的菌株接种到2216E液体培养基中,15 ℃、150 r/min培养24 h,4 ℃、10 000 r/min离心10 min,取1 mL发酵上清液作为粗酶液,与1 mL 0.1%卡拉胶底物(0.1%的卡拉胶溶解于0.2 mol/L Na2HPO4-NaH2PO4缓冲液,pH 7.0)反应45 min后,用DNS法测得反应体系中还原糖的含量来表示粗酶的酶活,每组实验设3个重复。1个酶活力单位(U)定义为:在30 ℃条件下,1 min内催化产生1 μg还原糖所需的酶量。发酵上清液酶活力计算公式:
酶活计算公式:酶活力(U/mL)=ΔA×1 000×n/T。
ΔA (mg/mL):半乳糖标准曲线上用DNS法测得的吸光值对应的含糖量。n:实验时酶液被稀释的倍数。T:酶与底物的反应时间。
1.2.3 菌株的鉴定以卡拉胶酶活力最高的菌株R11-5基因组为DNA模板,用通用引物27F/1492R对菌株R11-5 16S rRNA基因进行PCR扩增。PCR反应体系(50 μL):2×Taq PCR Master Mix 25 µL,通用引物(10 μmol/L)各1 μL,基因组DNA模板(1 mg/L) 2 μL,双蒸水补足50 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,30个循环;72 ℃ 10 min,4 ℃保存。PCR产物送青岛擎科科技有限公司进行测序并拼接。将所测序列在GenBank数据库(NCBI)用BLAST分析比对。
1.3 R11-5菌株的发酵条件优化 1.3.1 单因素实验分别以接种量、培养温度、培养基pH、不同碳源、不同氮源、最适碳源浓度、最适氮源浓度、不同金属离子、最适金属离子浓度以及卡拉胶浓度作为唯一变量进行发酵实验,确定各环境因素对菌株R11-5酶活的影响,每组实验设3个重复。各因素及变量见表 1。以发酵液在波长600 nm下的吸光度代表其生物量,离心发酵上清液酶活最高时条件为单因素实验下最适产酶条件,并将该条件下酶活定义为100%。
| 因素 Factors |
因素变量 Factor variables |
| 接种量Inoculation amount (%) | 0.5, 1.0, 1.5, 2.0, 2.5, 3.0, 3.5 |
| 培养温度Temperature (℃) | 5.0, 10.0, 15.0, 20.0, 25.0 |
| pH | 5.0, 5.5, 6.0, 6.5, 7.0, 7.5, 8.0, 8.5, 9.0 |
| 碳源Carbon source | Lactose, Glucose, Maltose, Yeast powder, Amylum, Sucrose |
| 氮源Nitrogen source | NH4Cl, Peptone, Beef extract, Urea, (NH4)2SO4, NH4NO3 |
| 酵母粉浓度Yeast powder concentration (g/L) | 1.0, 2.0, 3.0, 4.0, 5.0, 6.0, 7.0, 8.0, 9.0, 10.0 |
| 牛肉膏浓度Beef extract concentration (g/L) | 5.0, 6.0, 7.0, 8.0, 9.0, 10.0, 11.0, 12.0, 13.0, 14.0, 15.0 |
| 金属离子Metal ion | Mn2+, Sr2+, Fe2+, Fe3+, Mg2+, Ca2+, Cr2+, Cu2+ |
| 卡拉胶浓度Carrageenan concentration (g/L) | 1.0, 2.0, 3.0, 4.0, 5.0 |
| Ca2+ (mmol/L) | 1.0, 3.0, 5.0, 7.0, 9.0 |
1) Plackett-Burman实验[19]。根据单因素的实验结果,对南极菌R11-5培养条件中的接种量、培养温度、初始pH、酵母粉浓度、牛肉膏浓度、卡拉胶浓度和Ca2+浓度7个因素进行考察,采用Factors=7和Runs=12的Plackett-Burman设计,选取各因素最高和最低2个水平,按表 2进行发酵实验,每组实验设3个重复。用每毫升发酵上清液中卡拉胶酶活力表示响应值R1,确定影响R11-5发酵产酶的4个主要因素,实验因素及水平见表 2。
| 因素 Factors |
代码 Encode |
水平 Levels |
|
| -1 | 1 | ||
| 接种量Inoculation amount (%) | A | 1.5 | 2.5 |
| 培养温度Temperature (℃) | B | 10.0 | 20.0 |
| pH | C | 6.0 | 7.5 |
| 酵母粉浓度Yeast powder concentration (g/L) | D | 4.0 | 8.0 |
| 牛肉膏浓度Beef extract concentration (g/L) | E | 9.0 | 13.0 |
| 卡拉胶浓度Carrageenan concentration (g/L) | F | 1.0 | 5.0 |
| Ca2+ (mmol/L) | G | 1.0 | 9.0 |
2) 响应面Box-Behnken实验[20]设计。根据Box-Benhnken实验设计确定的4个重要因素,利用Design-Expert V8.05软件设计4因素3水平的响应面实验,按照实验设计进行实验,每组实验设3个重复,考察4个显著因素之间的交互作用,获得发酵上清液酶活最高时的4因素组合。
2 结果与分析 2.1 菌种的筛选在卡拉胶筛选培养基的作用下,从85株可培养的南极细菌中筛选得到12株具有卡拉胶酶活性的菌株,通过DNS法测定这12株菌的酶活,得到酶活性最高的菌株R11-5,其卡拉胶的筛选培养基上产生明显的透明圈(图 1)。

|
| 图 1 菌株R11-5在卡拉胶培养基上产生的透明圈 Figure 1 R11-5 produce transparent circle on carragenan solid medium |
|
|
菌株R11-5 16S rRNA基因经测序拼接后长度为1 350 bp,通过在NCBI进行BLAST比对分析,发现菌株R11-5与交替单胞菌属(Alteromonas)相似度高达99%,可以初步确定该产卡拉胶酶的南极菌为交替单胞菌属(Alteromonas),命名为交替单胞菌R11-5。
2.3 单因素实验结果各种环境因素对交替单胞菌R11-5生长及产酶的影响情况如下:菌株交替单胞菌R11-5的接种量为2%时,酶产量达到最大值,但随着接种量增加,酶产量并未出现显著升高(图 2A);当培养温度为15 ℃时,菌株交替单胞菌R11-5的酶产量最高,且生物量也最大(图 2B);当培养基pH为7.0时,菌株R11-5酶产量达到最高,生物量也最大(图 2C);最佳碳源为酵母粉时,菌株R11-5酶产量最高(图 2D),而且当酵母粉浓度为6 g/L时,酶产量最高(图 2F);最佳氮源为牛肉膏时,菌株R11-5酶产量最高(图 2E),而且当牛肉膏浓度为11 g/L时,酶产量达到最大值(图 2G);金属离子对酶产量也有显著的影响,Ca2+能增加菌株R11-5的酶产量,5 mmol/L Ca2+时酶的产量最高(图 2H、I);Mn2+、Sr2+、Fe2+、Mg2+则具有抑制作用,而Fe3+、Cr2+、Cu2+几乎抑制了酶的产生(图 2H);而当培养基中添加3 g/L的卡拉胶时,酶产量最高(图 2J)。
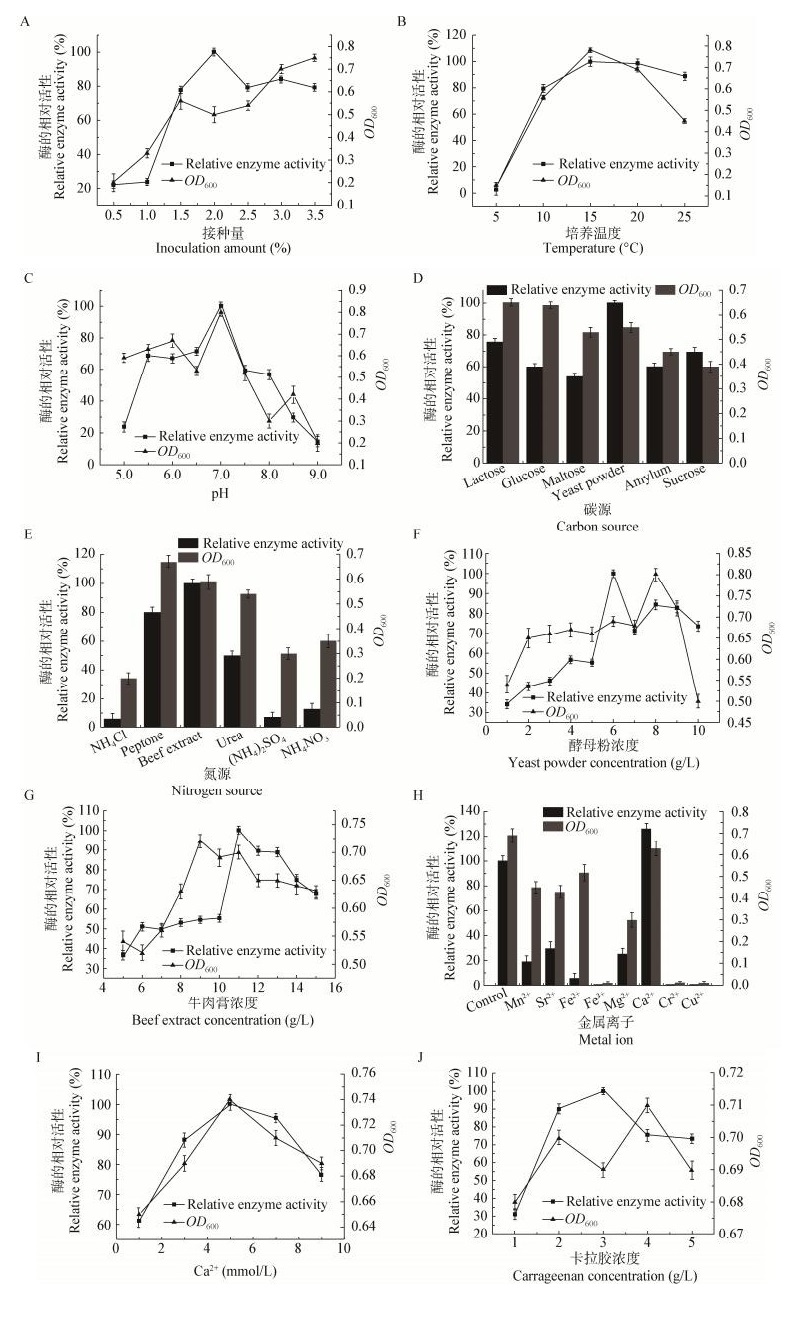
|
| 图 2 不同培养条件对交替单胞菌R11-5生长及产卡拉胶酶的影响 Figure 2 The influence of different culture conditions on Alteromonas sp. R11-5 growth and carrageenase produce |
|
|
Plackett-Burman实验结果见表 3,通过对实验结果进行F检验可以看出影响交替单胞菌R11-5酶活的4个重要因素依次是卡拉胶浓度、培养温度、牛肉膏浓度和培养基中Ca2+离子浓度,P < 0.05 (表 4),说明这4个因素对交替单胞菌R11-5产酶量影响显著。
| 试管序号 Serial No. |
A | B | C | D | E | F | G | 酶活 Enzyme activity (U/mL) |
| 1 | -1 | -1 | -1 | 1 | 1 | 1 | -1 | 35.101 |
| 2 | -1 | -1 | 1 | 1 | 1 | -1 | 1 | 52.754 |
| 3 | 1 | 1 | -1 | -1 | 1 | -1 | 1 | 61.680 |
| 4 | 1 | -1 | 1 | -1 | -1 | -1 | 1 | 57.855 |
| 5 | 1 | -1 | -1 | -1 | 1 | 1 | 1 | 55.942 |
| 6 | -1 | 1 | -1 | -1 | -1 | 1 | 1 | 67.419 |
| 7 | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 32.551 |
| 8 | -1 | 1 | 1 | -1 | 1 | -1 | -1 | 50.203 |
| 9 | -1 | -1 | -1 | -1 | -1 | -1 | -1 | 29.639 |
| 10 | -1 | 1 | 1 | 1 | -1 | 1 | 1 | 68.057 |
| 11 | 1 | 1 | -1 | 1 | -1 | -1 | -1 | 61.680 |
| 12 | 1 | 1 | 1 | -1 | 1 | 1 | -1 | 88.463 |
| 代码 Encode |
F值 F value |
P值 Pr > | f | |
重要性排列 Order of importance |
| A | 1.044 | 0.345 | 5 |
| B | 3.164 | 0.026 | 2 |
| C | 0.635 | 0.555 | 7 |
| D | -0.653 | 0.537 | 6 |
| E | 0.926 | 0.031 | 3 |
| F | 1.001 | 0.017 | 1 |
| G | 0.833 | 0.037 | 4 |
由Plackett-Burman实验筛选出了4个显著因素:Ca2+浓度、培养温度、牛肉膏浓度、卡拉胶浓度,用这4个显著因素设计Box-Behnken实验,根据得到的中心值(0水平),对称选取最高水平值(1水平)和最低水平值(–1水平) (表 5),采用Factors=4和run=29进行Box-Behnken响应面实验设计,分析显著因素之间的交互作用和交互作用最佳值,Box-Behnken实验设计及实验结果见表 6。
| 代码 Encode |
因素 Factors |
水平 Levels |
||
| -1 | 0 | 1 | ||
| B | 培养温度Temperature (℃) | 10 | 15 | 20 |
| E | 牛肉膏浓度Beef extract concentration (g/L) | 10 | 11 | 12 |
| F | 卡拉胶浓度Carrageenan concentration (g/L) | 2 | 3 | 4 |
| G | Ca2+ (mmol/L) | 1 | 5 | 9 |
| 试管序号 Serial No. |
B | E | F | G | 酶活 Enzyme activity (U/mL) |
| 1 | -1 | -1 | 0 | 0 | 22.456 |
| 2 | 1 | -1 | 0 | 0 | 45.177 |
| 3 | -1 | 1 | 0 | 0 | 53.431 |
| 4 | 1 | 1 | 0 | 0 | 39.223 |
| 5 | 0 | 0 | -1 | -1 | 62.247 |
| 6 | 0 | 0 | 1 | -1 | 64.645 |
| 7 | 0 | 0 | -1 | 1 | 67.363 |
| 8 | 0 | 0 | 1 | 1 | 66.627 |
| 9 | -1 | 0 | 0 | -1 | 55.591 |
| 10 | 1 | 0 | 0 | -1 | 35.314 |
| 11 | -1 | 0 | 0 | 1 | 39.915 |
| 12 | 1 | 0 | 0 | 1 | 58.313 |
| 13 | 0 | -1 | -1 | 0 | 54.282 |
| 14 | 0 | 1 | -1 | 0 | 58.663 |
| 15 | 0 | -1 | 1 | 0 | 50.099 |
| 16 | 0 | 1 | 1 | 0 | 63.318 |
| 17 | -1 | 0 | -1 | 0 | 41.188 |
| 18 | 1 | 0 | -1 | 0 | 63.961 |
| 19 | -1 | 0 | 1 | 0 | 54.591 |
| 20 | 1 | 0 | 1 | 0 | 42.526 |
| 21 | 0 | -1 | 0 | -1 | 31.853 |
| 22 | 0 | 1 | 0 | -1 | 70.085 |
| 23 | 0 | -1 | 0 | 1 | 63.818 |
| 24 | 0 | 1 | 0 | 1 | 54.173 |
| 25 | 0 | 0 | 0 | 0 | 89.215 |
| 26 | 0 | 0 | 0 | 0 | 88.423 |
| 27 | 0 | 0 | 0 | 0 | 87.182 |
| 28 | 0 | 0 | 0 | 0 | 87.932 |
| 29 | 0 | 0 | 0 | 0 | 88.431 |
对实验结果进行二次多元回归方差分析,得到发酵上清液酶活R1与自变量培养温度、牛肉膏浓度、卡拉胶浓度、Ca2+浓度的多元回归方程为:
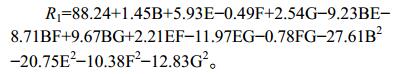
|
回归模型方差分析见表 7。从表 7中可以看出E、G、BF、BG、EF、EG、B2、E2、F2、G2的P值均小于0.01,说明其对交替单胞菌R11-5产酶影响度极显著;交互项和二次项中B、FG的P < 0.05,说明其对交替单胞菌属R11-5产酶影响显著;F、BE的P值大于0.05,对交替单胞菌R11-5产酶无显著影响,因此可以说明试验因素对响应面值的影响不是简单的线性关系,二次项和交互项对响应面有很大的影响。模型P=0.002 1 < 0.01说明线性模型回归高度显著,模拟得到的方程可信。决定系数R2=0.970 8[21]表明方程拟合较好,失拟项CV=3.84%,数值越低说明实验操作越可信,失拟项P=0.137 > 0.1,失拟项不显著,表明模型的选择正确,以上可以表明通过多元回归分析得到的方程可以很好地解释交替单胞菌R11-5产酶量与培养温度、牛肉膏浓度、卡拉胶浓度、Ca2+浓度之间的关系。
| 来源 Source |
方差总和 Sum of squares |
自由度 Degree of freedom |
平均方差 Mean squares |
F值 F value |
P值 Prob > F |
| Model | 8 917.04 | 14 | 636.93 | 125.92 | 0.002 1 |
| B | 25.06 | 1 | 25.06 | 4.95 | 0.043 |
| E | 422.55 | 1 | 422.55 | 83.54 | < 0.000 1 |
| F | 2.90 | 1 | 2.90 | 0.57 | 0.461 6 |
| G | 77.39 | 1 | 77.39 | 15.30 | 0.001 6 |
| BE | 340.94 | 1 | 340.94 | 67.40 | 0.270 6 |
| BF | 303.42 | 1 | 303.42 | 59.98 | < 0.000 1 |
| BG | 373.94 | 1 | 373.94 | 73.93 | 0.002 |
| EF | 19.53 | 1 | 19.53 | 3.86 | 0.004 9 |
| EG | 573.05 | 1 | 573.05 | 113.29 | 0.004 5 |
| FG | 2.46 | 1 | 2.46 | 0.49 | 0.031 2 |
| B2 | 4 944.73 | 1 | 4 944.73 | 977.55 | < 0.000 1 |
| E2 | 2 792.44 | 1 | 2 792.44 | 552.05 | < 0.000 1 |
| F2 | 699.15 | 1 | 699.15 | 138.22 | 0.005 9 |
| G2 | 1 067.36 | 1 | 1 067.36 | 211.01 | < 0.000 1 |
| Residual | 70.82 | 14 | 5.06 | ||
| Lack of Fit | 68.58 | 10 | 6.86 | 12.28 | 0.137 |
| Pure Error | 2.23 | 4 | 0.56 | ||
| Cor Total | 8 987.85 | 28 | |||
| 注:显著:Prob > F值小于0.05;高度显著:Prob > F值小于0.01.
Note: Significant: Prob > F value less than 0.05; Highly significant: Prob > F value less than 0.01. | |||||
根据多元回归方程绘制的培养温度、牛肉膏浓度、卡拉胶浓度、Ca2+浓度两两交互作用的响应曲面及等高线见图 3-8。从响应曲面图可以看出发酵上清液酶活R1的值在所选因素范围内最大值为等高面图的中心点。通过SAS软件分析求解多元回归方程。所构建模型的最大值及最大值条件下对应各因素的组合,对所得的回归拟合方程分别求各自变量的一阶偏导数,并令其为0,得到三元一次方程组,求解此方程组得此模型R1最大值为88.683 4 U/mL,此条件下各因素对应的值为B=15.09,E=11.13,F=2.98,G=5.19。即最佳培养条件为温度15.09 ℃,牛肉膏浓度为11.13 g/L,卡拉胶浓度为2.98 g/L,Ca2+浓度为5.19 mmol/L。为验证模型的正确性,我们进行了3组发酵实验,为提高实验的可操作性,我们将培养条件设置为温度15.0 ℃、牛肉膏浓度11.0 g/L、卡拉胶浓度3.0 g/L、Ca2+浓度5.0 mmol/L,用3组数据平均值来表示优化后发酵上清液的酶活。测得优化后发酵上清液酶活R1=86.889 U/mL,R2=86.822 U/mL,R3=87.867 U/mL,接近预测值,表明优化得到的发酵条件可信,发酵后的产酶量是未优化前的1.8倍。
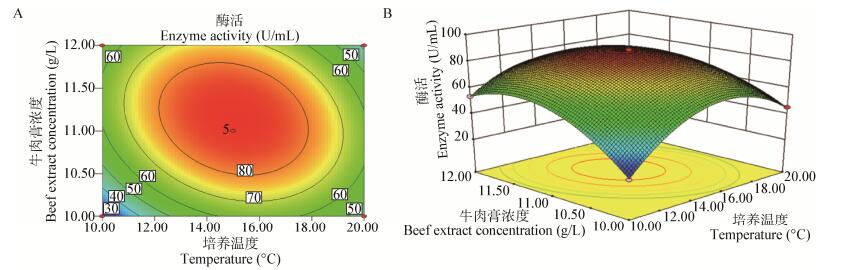
|
| 图 3 培养温度和牛肉膏浓度对交替单胞菌R11-5产酶的影响 Figure 3 Contour plot (A) and response surface (B) of temperature and beef extract concentration influence Alteromonas sp. R11-5 carrageenase production |
|
|

|
| 图 4 培养温度和卡拉胶浓度对交替单胞菌R11-5产酶的影响 Figure 4 Contour plot (A) and response surface (B) of temperature and carrageenan concentration influence Alteromonas sp. R11-5 carrageenase production |
|
|

|
| 图 5 培养温度和Ca2+浓度对交替单胞菌R11-5产酶的影响 Figure 5 Contour plot (A) and response surface (B) of temperature and Ca2+ concentration influence Alteromonas sp. R11-5 carrageenase productio |
|
|

|
| 图 6 牛肉膏浓度和卡拉胶浓度对交替单胞菌R11-5产酶的影响 Figure 6 Contour plot (A) and response surface (B) of beef extract concentration and carrageenan concentration influence Alteromonas sp. R11-5 carrageenase production |
|
|

|
| 图 7 牛肉膏浓度和Ca2+浓度对交替单胞菌R11-5产酶的影响 Figure 7 Contour plot (A) and response surface (B) of beef extract concentration and Ca2+ concentration influence Alteromonas sp. R11-5 carrageenase production |
|
|
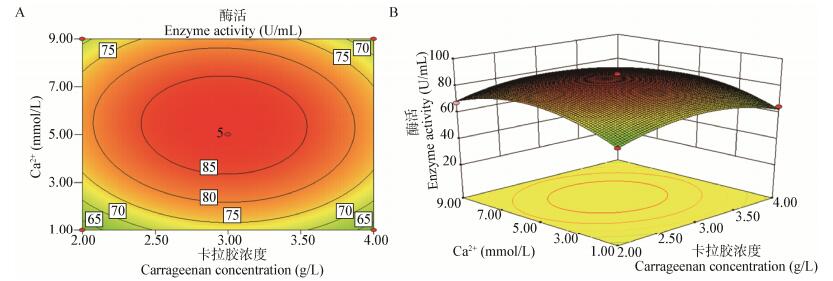
|
| 图 8 卡拉胶浓度和Ca2+浓度对交替单胞菌R11-5产酶的影响 Figure 8 Contour plot (A) and response surface (B) of carrageenan concentration and Ca2+ concentration influence Alteromonas sp. R11-5 carrageenase production |
|
|
冷适应酶是由在北极和南极地区、高寒地区、深海和冰川等永久寒冷环境中生长的生物所产生的,由于其在较低的温度下具有高活性和高催化效率,能够有效降低能耗,因而具有巨大的经济效益和应用潜力[22]。极地寒冷环境中不仅发现了大量具有潜在应用前景的蛋白酶和脂肪酶等冷适应酶,同时也存在种类繁多的多糖降解海洋细菌,因此南极微生物也成为发掘具有生物技术应用前景的海藻多糖降解酶的潜在新来源。
与传统的单次单因子法和正交实验相比,响应面法实验次数少、周期短,不仅能够评价各因素对生物过程的影响,并且还能体现各因素之间的交互作用得到最佳条件,是优化培养条件的有效方法[23]。本研究采用响应面法对南极交替单胞菌R11-5进行培养优化,从接种量、温度、pH、碳源、氮源和金属离子等因素入手,逐一作为唯一变量进行单因素实验,优化交替单胞菌R11-5的发酵条件,然后参考单因素实验的结果应用响应面分析法,借助Design-Expert软件,采用Plackett-Burman实验设计筛选出影响酶活的4个主要因素:培养温度、牛肉膏浓度、卡拉胶浓度、Ca2+浓度,在此基础上利用Box-Behnken设计及响应面分析法进行回归分析,得出南极菌交替单胞菌R11-5的最佳培养条件为温度15.09 ℃、牛
肉膏浓度11.13 g/L、卡拉胶浓度2.98 g/L、Ca2+浓度5.19 mmol/L,考虑到实验的可操作性,我们将培养条件设置为温度15.0 ℃、牛肉膏浓度11.0 g/L、卡拉胶浓度3.0 g/L、Ca2+浓度5.0 mmol/L。在此优化条件下,发酵上清液的酶活达到87.193 U/mL,与预测值高度吻合,比优化前提高了1.8倍。彭小珍等[24]采用单因素和正交试验法优化产卡拉胶酶菌株施氏假单胞菌的发酵条件,优化后最佳发酵条件为卡拉胶浓度3.0 g/L,酵母浸粉浓度1.0 g/L,NaNO3浓度3.0 g/L,乳糖浓度0.4 g/L,吐温-80浓度0.2 g/L,起始pH值6.0,温度32.0 ℃,装样量90 mL/250 mL,接种量13.0%,摇床转速160.0 r/min,产酶活力为26.5 U/mL。刘苹等[25]采用响应面法优化产卡拉胶酶菌株黄杆菌YK-5的发酵条件,优化后最佳发酵条件为温度28.17 ℃、pH 8.77、卡拉胶浓度3.71 g/L,产酶活力为215.72 U/mL。通过与上述的研究比较可见,卡拉胶酶作为一种诱导表达的水解酶,培养基中卡拉胶组分对于该酶的产量具有普遍的诱导效果,而且培养基中卡拉胶浓度一般都在3.0 g/L左右。其次,影响卡拉胶酶产量的因素是温度,培养温度对于微生物的生长和产酶量均具有重要的作用,由于本研究中的交替单胞菌R11-5分离自南极低温环境,所以其培养温度远低于施氏假单胞菌和黄杆菌YK-5。此外,pH和金属离子等也是影响菌株产酶量的主要因素。交替单胞菌R11-5的产酶虽然不是很高,但鉴于极地微生物产海藻多糖降解酶的潜在应用前景,下一步将采用基因工程手段对该酶进行克隆和异源表达并系统研究其酶学性质,通过构建稳定的工程菌株,为其开发应用提供依据。田琳等[21]对菌株Zobellia sp. ZM-2的卡拉胶酶编码基因进行了重组表达,构建了重组菌BL21-HTa-cgkZ,并采用响应面法对其进行了发酵条件优化,重组卡拉胶酶产量由原来的0.33 U/mL提高到1.362 U/mL,特别是优化后重组卡拉胶酶产量达到10.76 U/mL (表 8);张兰等[26]对菌株Pseudoalteromonas sp. QY203进行了重组表达,构建了重组菌E. coli BL21(DE3)/ pET22b-CgkX-CM,并采用响应面法对菌株进行了发酵条件优化,重组卡拉胶酶产量由原来的0.821 U/mL提高到5.836 U/mL,特别是优化后重组卡拉胶酶产量高达42.60 U/mL (表 8)。因此,通过基因工程手段实现卡拉胶酶的高效异源表达,是提高卡拉胶酶产量、实现其工业化应用的重要途径。
| 菌株名称 Strains |
野生菌优化前酶活 Enzyme activity before optimization of wild bacteria (U/mL) |
野生菌优化后酶活 Enzyme activity after optimization of wild bacteria (U/mL) |
重组菌优化前酶活 Enzyme activity before optimization of recombinant bacteria (U/mL) |
重组菌优化后酶活 Enzyme activity after optimization of recombinant bacteria (U/mL) |
参考文献 References |
| Alteromonas sp. R11-5 | 48.441 | 87.193 | - | - | This work |
| Zobellia sp. ZM-2 | 0.330 | - | 1.362 | 10.76 | [21] |
| Pseudoalteromonas sp. QY203 | 0.821 | - | 5.836 | 42.60 | [26] |
| [1] |
Rafiquzzaman SM, Ahmed R, Lee JM, et al. Improved methods for isolation of carrageenan from Hypnea musciformis and its antioxidant activity[J]. Journal of Applied Phycology, 2016, 28(2): 1265-1274. DOI:10.1007/s10811-015-0605-6 |
| [2] |
Kalitnik AA, Barabanova AOB, Nagorskaya VP, et al. Low molecular weight derivatives of different carrageenan types and their antiviral activity[J]. Journal of Applied Phycology, 2013, 25(1): 65-72. DOI:10.1007/s10811-012-9839-8 |
| [3] |
Guo D, Luan H, Sun LW, et al. Research progress on biological activities of low molecular weight carrageenan and its derivatives[J]. Journal of Anhui Agricultural Sciences, 2010, 38(5): 2581-2583, 2598. (in Chinese) 郭丹, 栾晖, 孙藜玮, 等. 低分子量卡拉胶及其衍生物的生物学活性研究进展[J]. 安徽农业科学, 2010, 38(5): 2581-2583, 2598. DOI:10.3969/j.issn.0517-6611.2010.05.139 |
| [4] |
He XJ, Lou ZX, Ma CY, et al. Application of the mixture of Carrageenan and enzyme digested Konjac gum in jelly sweets[J]. Science and Technology of Food Industry, 2013, 34(3): 284-287. (in Chinese) 贺雪姣, 娄在祥, 马朝阳, 等. 降解魔芋胶与κ-卡拉胶复配胶在凝胶软糖中的应用[J]. 食品工业科技, 2013, 34(3): 284-287. |
| [5] |
Xu L, Yao ZA, Wu HG, et al. The immune regulation of κ-carrageenan oligosaccharide and its desulfated derivatives on LPS-activated microglial cells[J]. Neurochemistry International, 2012, 61(5): 689-696. DOI:10.1016/j.neuint.2012.06.019 |
| [6] |
Yuan HM, Song JM, Zhang WW, et al. Antioxidant activity and cytoprotective effect of κ-carrageenan oligosaccharides and their different derivatives[J]. Bioorganic & Medicinal Chemistry Letters, 2006, 16(5): 1329-1334. |
| [7] |
Zhou GF, Li SF, Wang CH. Immunomodulating effects of sulfated κ-carrageenan[J]. Marine Sciences, 2010, 34(8): 56-59. (in Chinese) 周革非, 李树福, 王长海. κ-卡拉胶硫酸多糖的免疫调节活性初步研究[J]. 海洋科学, 2010, 34(8): 56-59. |
| [8] |
Ma YX, Dong SL, Mou HJ, et al. Preparation and in vitro antiviral activity of kappa-carrageenan oligosaccharides[J]. Acta Scientiarum Naturalium Universitatis Sunyatseni, 2009, 48(6): 105-108. (in Chinese) 马悦欣, 董双林, 牟海津, 等. κ-卡拉胶寡糖的酶解制备及其体外抗病毒活性[J]. 中山大学学报:自然科学版, 2009, 48(6): 105-108. |
| [9] |
Wang CY, Gu QQ, Zhou P, et al. Molecular modification of carrageenan, a polysaccharide from red seaweed Kappaphycus striatumⅠ. Acidic degradation[J]. Chinese Journal of Marine Drugs, 2003, 22(2): 24-27. (in Chinese) 王长云, 顾谦群, 周鹏, 等. 红藻多糖卡拉胶分子修饰研究Ⅰ.酸降解[J]. 中国海洋药物, 2003, 22(2): 24-27. DOI:10.3969/j.issn.1002-3461.2003.02.006 |
| [10] |
Zhu NN, Yao ZA, Wu HG, et al. Research progress on carrageenan oligosaccharides[J]. Chemistry & Bioengineering, 2009, 26(10): 9-12. (in Chinese) 朱楠楠, 姚子昂, 吴海歌, 等. 卡拉胶寡糖的研究进展[J]. 化学与生物工程, 2009, 26(10): 9-12. DOI:10.3969/j.issn.1672-5425.2009.10.003 |
| [11] |
Ghanbarzadeh M, Golmoradizadeh A, Homaei A. Carrageenans and carrageenases: versatile polysaccharides and promising marine enzymes[J]. Phytochemistry Reviews, 2018, 17(3): 535-571. DOI:10.1007/s11101-018-9548-2 |
| [12] |
Jain A, Krishnan KP. A glimpse of the diversity of complex polysaccharide-degrading culturable bacteria from Kongsfjorden, Arctic Ocean[J]. Annals of Microbiology, 2017, 67(2): 203-214. DOI:10.1007/s13213-016-1252-0 |
| [13] |
Li J, Sha YJ. Expression and enzymatic characterization of a cold-adapted β-agarase from Antarctic bacterium Pseudoalteromonas sp. NJ21[J]. Chinese Journal of Oceanology and Limnology, 2015, 33(2): 319-327. DOI:10.1007/s00343-015-4072-3 |
| [14] |
Jung S, Jeong BC, Hong SK, et al. Cloning, expression, and biochemical characterization of a novel acidic GH16 β-Agarase, AgaJ11, from Gayadomonas joobiniege G7[J]. Applied Biochemistry and Biotechnology, 2017, 181(3): 961-971. DOI:10.1007/s12010-016-2262-x |
| [15] |
Wulff A, Iken K, Quartino ML, et al. Biodiversity, biogeography and zonation of marine benthic micro- and macroalgae in the Arctic and Antarctic[J]. Botanica Marina, 2009, 52(6): 491-507. |
| [16] |
Ramírez EM. Flora marina bentónica de la región austral de sudamérica y la antártica[J]. Anales del Instituto de la Patagonia, 2010, 38(1): 57-71. |
| [17] |
Sha YJ, Yang PP, He PQ, et al. Optimization of fermentation condition for Agarase production of strain Bacillus sp. BI-3 from Indonesian hot Spring[J]. Oceanologia et Limnologia Sinica, 2013, 44(5): 1358-1364. (in Chinese) 沙玉杰, 杨平平, 何培青, 等. 印尼热泉菌Bacillus sp. BI-3产琼胶酶的发酵条件优化[J]. 海洋与湖沼, 2013, 44(5): 1358-1364. |
| [18] |
Xie MS. Research of thermostable κ-carrageenase produced by Bacillus sp. car19 from Indonesia hot spring[D]. Qingdao: Master's Thesis of The First Institute of Oceanography, SOA, 2017 (in Chinese) 谢买胜.印尼热泉菌Bacillus sp. Car19产热稳定κ-卡拉胶酶的研究[D].青岛: 国家海洋局第一海洋研究所硕士学位论文, 2017 |
| [19] |
Cao DM, Hu YH. Fermentation optimization for the production of β-cyclodextrin glvcosvltransferase by thermophilic strain HY15 using response surface methodology[J]. Journal of Northeast Forestry University, 2012, 40(1): 97-100. (in Chinese) 曹冬梅, 胡耀辉. 基于响应面法优化HY15发酵生产β-环糊精葡萄糖基转移酶的发酵条件[J]. 东北林业大学学报, 2012, 40(1): 97-100. DOI:10.3969/j.issn.1000-5382.2012.01.025 |
| [20] |
Zhang D, Min WH, Liu JS, et al. Response surface optimization of fermentation conditions for protease production by Pichia kudriavzevii yeast[J]. Food Science, 2011, 32(13): 248-253. (in Chinese) 张丹, 闵伟红, 刘景圣, 等. 响应面法优化蛋白酶菌株发酵条件[J]. 食品科学, 2011, 32(13): 248-253. |
| [21] |
Tian L, Liu ZM, Duan FY, et al. Optimization of fermentation conditions of κ-carrageenase by recombinant strain BL21-HTa-cgkZ[J]. Microbiology China, 2015, 42(10): 1945-1951. (in Chinese) 田琳, 刘哲民, 段芳媛, 等. 重组菌BL21-HTa-cgkZ产κ-卡拉胶酶的发酵条件优化[J]. 微生物学通报, 2015, 42(10): 1945-1951. |
| [22] |
Cavicchioli R, Charlton T, Ertan H, et al. Biotechnological uses of enzymes from psychrophiles[J]. Microbial Biotechnology, 2011, 4(4): 449-460. DOI:10.1111/j.1751-7915.2011.00258.x |
| [23] |
Du P, Zhu LJ, Chen SX. Fermentation medium optimization for γ-PGA production of Bacillus subtilis HD-F9 by response surface methodology[J]. Journal of Henan University (Natural Science), 2010, 40(5): 498-503. (in Chinese) 杜沛, 朱丽娟, 陈双喜. 响应面法优化Bacillus subtilis HD-F9产γ-聚谷氨酸发酵培养基[J]. 河南大学学报:自然科学版, 2010, 40(5): 498-503. |
| [24] |
Peng XZ, Ji HW, Liu HM, et al. Optimization of liquid fermentation conditions on Pseudomonas stutzeri producing carrageenase[J]. Food Research and Development, 2007, 28(10): 7-11. (in Chinese) 彭小珍, 吉宏武, 刘唤明, 等. 施氏假单胞菌Pseudomonas stutzeri产卡拉胶酶液体发酵条件优化[J]. 食品研究与开发, 2007, 28(10): 7-11. DOI:10.3969/j.issn.1005-6521.2007.10.003 |
| [25] |
Liu P, Zhang Z, Zhang CZ, et al. Optimization of fermentation conditions for carrageenase production by Flavobacterium sp. YK-5 using response surface methodology[J]. Journal of Yantai University (Natural Science and Engineering Edition), 2012, 25(3): 194-198. (in Chinese) 刘苹, 张珠, 张聪芝, 等. 响应面法优化黄杆菌YK-5产卡拉胶酶的发酵条件[J]. 烟台大学学报:自然科学与工程版, 2012, 25(3): 194-198. |
| [26] |
Zhang L, Su PA, Yang XM, et al. Recombinant expression and fermentation optimization of the catalytic module of κ-carrageenase CgkX[J]. Progress in Modern Biomedicine, 2016, 16(6): 1008-1011, 1127. (in Chinese) 张兰, 苏平安, 杨雪梅, 等. κ-卡拉胶酶CgkX催化区的重组表达菌株筛选和发酵优化[J]. 现代生物医学进展, 2016, 16(6): 1008-1011, 1127. |
 2018, Vol. 45
2018, Vol. 45




