扩展功能
文章信息
- 纪晓奇, 李青连, 鞠建华
- JI Xiao-Qi, LI Qing-Lian, JU Jian-Hua
- 融合表达氨基转移酶DsaD和异构酶DsaE合成L-别异亮氨酸
- Overexpression of the aminotransferase DsaD and isomerase DsaE as a fusion protein to synthesize L-allo-isoleucine
- 微生物学通报, 2018, 45(9): 2006-2013
- Microbiology China, 2018, 45(9): 2006-2013
- DOI: 10.13344/j.microbiol.china.180424
-
文章历史
- 收稿日期: 2018-05-30
- 接受日期: 2018-07-01
- 网络首发日期(www.cnki.net): 2018-08-15
2. 中国科学院大学 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
L-异亮氨酸(L-isoleucine,L-Ile)作为8种必需氨基酸之一,因其在人体生命活动中起到重要作用而备受关注,并且在食品和医药领域具有重要的应用前景。L-别异亮氨酸(L-allo-isoleucine,L-allo-Ile)是L-亮氨酸的一个立体同分异构体,两者的区别在于β位碳原子上的甲基构象不同:(2S, 3S)L-异亮氨酸和(2S, 3R)L-别异亮氨酸(图 1)。L-别异亮氨酸于1958年首次被发现[1],在自然界中广泛存在,除了存在于槟榔科植物海枣之外,在真菌次级代谢产物中的Aureobasidin A[2]以及放线菌次级代谢产物中球状霉素[3]、Desotamides[4]、Marformycins[5]等化合物中都发现含有L-别异亮氨酸结构单元。L-别异亮氨酸在血浆中的浓度水平还可以作为罕见的常染色体隐性遗传病——枫糖尿症(Maple syrup urine disease)检测时的重要指标[6]。Li等[7]和Liu等[8]对抗感染环肽抗生素Desotamides和Marformycins的生物合成进行研究时,分别鉴定了其生物合成基因簇。Li等深入阐明了Desotamides和Marformycins中L-别异亮氨酸结构单元的生物合成机制,他们在Desotamide和Marformycin的生物合成途径中分别鉴定了一对由磷酸吡哆醛(Pyridoxal 5′-phospahte,PLP)依赖的“氨基转移酶”和新颖异构酶(Isomerase)组成的酶对DsaD/DsaE和MfnO/MfnH;利用体外生化实验证明,L-别异亮氨酸的生物合成来源是L-异亮氨酸,纯化的DsaD/DsaE (或MfnO/MfnH)在不需要添加额外辅因子的条件下可以协作催化L-亮氨酸和L-别异亮氨酸间的可逆转化(图 1);并进一步在体外蛋白定点突变实验中证明,氨基转移酶DsaD和MfnO的催化位点分别是其第198位和第206位赖氨酸残基,异构酶DsaE和MfnH的关键催化位点分别是位于其C-端的第115位和第107位精氨酸残基[9]。

|
| 图 1 氨基转移酶DsaD和异构酶DsaE协作催化L-Ile和L-allo-Ile之间相互转化 Figure 1 Interconversion between L-Ile and L-allo-Ile catalyzed by aminotransferase DsaD and isomerase DsaE |
|
|
然而,上述研究中L-别异亮氨酸的催化生产过程比较繁琐,需要分别表达和纯化氨基转移酶DsaD (或MfnO)和异构酶DsaE (或MfnH)。因此,本研究通过理性设计,将氨基转移酶DsaD和异构酶DsaE的基因进行融合表达,经Ni-NTA亲和层析法一步纯化获得融合蛋白DsaDE,体外酶反应证明融合蛋白DsaDE能同时行使氨基转移酶和异构酶2种酶的功能,为进一步研究L-别异亮氨酸的工业化生产奠定了基础。
1 材料与方法 1.1 材料 1.1.1 菌种、质粒及引物本研究所用的菌种、质粒及引物见表 1。
| 菌株、质粒及引物 Strains, plasmids and primers |
性质 Description |
来源 Source |
| 菌株Strains | ||
| E. coli DH5α | 基因克隆宿主菌 | Stratagene |
| E. coli BL21(DE3) | 蛋白表达宿主菌 | Novagen |
| 质粒Plasmids | ||
| pGEM-T | Ampr抗性,基因克隆载体 | Invitrogen |
| pET28a(+) | Kanr抗性,蛋白表达载体 | Novagen |
| 引物Primers | 引物序列Sequences (5′→3′) | |
| F1 | AAATTTCCCATATGACCGAGAGCTCTCCCAC (Nde Ⅰ酶切位点用下划线标出) | |
| R1 | ATCTACGGTACCCACCAGTGGGGCGAAGAAG (Kpn Ⅰ酶切位点用下划线标出) | |
| F2 | ATCTACGGTACCGTCACACCGGCACTCCCGTCGC (Kpn Ⅰ酶切位点用下划线标出) | |
| R2 | CGATATGGATCCCTTGTGATCGCCGACTGTCTGG (BamH Ⅰ酶切位点用下划线标出) |
LB培养基(g/L):蛋白胨10.0,酵母提取物5.0,NaCl 10.0,pH 7.0。固体添加15.0 g琼脂粉,1×105 Pa灭菌30 min备用。
1.1.3 主要试剂与仪器限制性核酸内切酶、高保真DNA聚合酶PrimeSTAR、DNA连接酶和DNA标准品等购自TaKaRa公司;DNA回收试剂盒和质粒提取试剂盒购自Omega公司。其他常规试剂均为国产分析纯。氨苄青霉素(Ampicillin,Amp)的工作终浓度为100 μg/mL,卡那霉素(Kanamycin,Kan)的工作终浓度为50 μg/mL。PCR引物由生工生物工程(上海)股份有限公司合成,DNA测序由广州擎科公司完成。
PCR仪、台式大容量多功能冷冻离心机、小型台式高速离心机、Concentrator plus旋转浓缩仪,Eppendorf公司;凝胶成像系统,Bio-Rad公司;超声波破碎仪,SONICS公司;高效液相色谱仪,Agilent公司;手性分析型色谱柱CRS10W柱(Mitsubishi,50 mm×4.6 mm,3 μm),MCI GEL公司。
1.2 dsaD、dsaE基因和接头序列的克隆以Desotamides产生菌Streptomyces scopuliridis SCSIO ZJ46的基因组DNA为模板,F1和R1为引物PCR扩增大小为375 bp的dsaE基因DNA片段(图 2A)。PCR反应体系(25 μL):模板1 ng,dNTPs 100 μmol/L,DMSO 5%,2×PrimeSTAR buffer 12.5 μL,上、下游引物各400 μmol/L,添加灭菌双蒸水至总体积25 μL。PCR反应条件:98 ℃ 4 min;98 ℃ 10 s,58 ℃ 15 s,72 ℃ 30 s,28个循环;72 ℃ 10 min。PCR产物依次经过胶回收、TA克隆和测序验证,得到正确的重组载体pGEMT-dsaE;同样以S. scopuliridis SCSIO ZJ46基因组DNA为模板,F2和R2为引物PCR扩增大小为1 248 bp含接头序列(Linker)和dsaD基因序列的DNA片段(图 2A)。PCR反应体系(25 μL):模板1 ng,dNTPs 100 μmol/L,DMSO 5%,2×PrimeSTAR buffer 12.5 μL,上、下游引物各400 μmol/L,添加灭菌双蒸水至总体积25 μL。PCR反应条件:98 ℃ 4 min;98 ℃ 10 s,58 ℃ 15 s,72 ℃ 60 s,28个循环;72 ℃ 10 min。PCR产物依次经过胶回收、TA克隆和测序验证,得到正确的重组载体pGEMT-dsaD- linker。
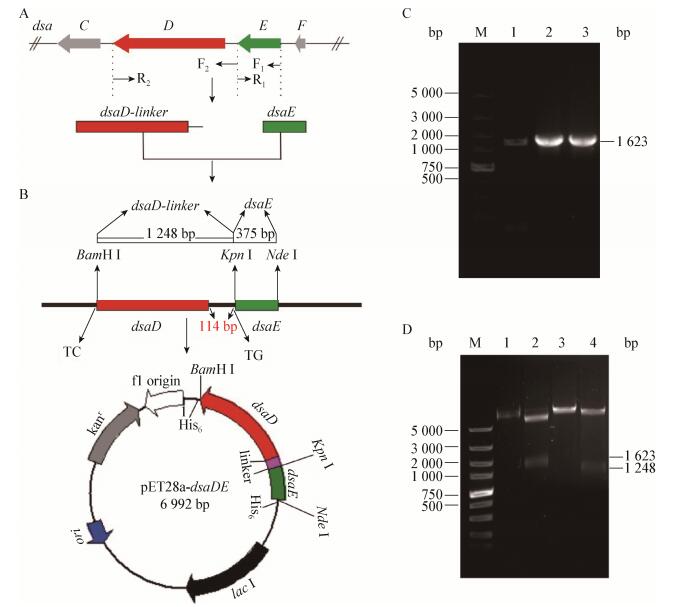
|
| 图 2 融合表达载体pET28a-dsaDE的构建 Figure 2 Construction of the overexpression vector pET28a-dsaDE 注:A、B:融合表达载体pET28a-dsaDE构建的示意图. M:DNA marker. C:PCR鉴定融合表达载体pET28a-dsaDE;1:对照;2和3:分别为不同克隆的dsaDE. D:酶切验证融合表达载体pET28a-dsaDE;1:pET28a(+)对照;2:用Nde Ⅰ和BamH Ⅰ酶切pET28a-dsaDE;3:用Nde Ⅰ和Kpn Ⅰ酶切pET28a-dsaDE;4:用Kpn Ⅰ和BamH Ⅰ酶切pET28a-dsaDE. Note: A, B: Schematic representation for construction of pET28a-dsaDE. M: DNA marker. C: PCR analyses of the recombinant vector pET28a-dsaDE; 1: Negative control using S. scopuliridis SCSIO ZJ46 genomic DNA as template; 2 and 3: Using different clones of E. coli DH5α/pET28a-dsaDE as template. D: Enzyme digestion of the recombinant vector pET28a-dsaDE; 1: pET28a(+) empty vector; 2: Recombinant vector pET28a-dsaDE digested with Nde Ⅰ and BamH Ⅰ; 3: Recombinant vector pET28a-dsaDE digested with Kpn Ⅰ and Nde Ⅰ; 4: Recombinant vector pET28a-dsaDE digested with Kpn Ⅰ and BamH Ⅰ. |
|
|
将测序正确的pGEMT-dsaE载体进行Nde Ⅰ/ Kpn Ⅰ双酶切,同时将pGEMT-dsaD-linker载体进行Kpn Ⅰ/BamH Ⅰ双酶切;回收的目的片段连接到Nde Ⅰ/BamH Ⅰ双酶切的pET28a(+)载体中,连接产物转化E. coli DH5α;利用引物F1和R2进行菌落PCR验证,阳性克隆经质粒提取后进行双酶切验证,将验证正确的重组表达载体pET28a-dsaDE转化E. coli BL21(DE3),从而得到表达菌株E. coli BL21(DE3)/pET28a-dsaDE。
1.4 融合蛋白DsaDE的表达和纯化将重组表达菌株E. coli BL21(DE3)/pET28a- dsaDE于37 ℃、200 r/min振荡培养12 h,按照1%的接种量转接至10瓶含50 μg/mL卡那霉素的250 mL LB培养基中(1 000 mL三角瓶),于37 ℃、200 r/min振荡培养至OD600约为0.4时,加入0.1 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(IPTG),置于16 ℃、150 r/min继续振荡培养约18 h。4 000 r/min离心15 min收集菌体,转移至50 mL离心管中进行蛋白纯化操作或置于–80 ℃备用。
将得到的菌体用磷酸盐缓冲液(50 mmol/L NaH2PO4,pH 8.0)洗涤2次后,用30 mL上样缓冲液(50 mmol/L NaH2PO4,300 mmol/L NaCl,5 mmol/L咪唑,pH 8.0)悬浮,于冰上超声破碎(超声5 s,暂停5 s,共超声5 min),之后10 000 r/min离心40 min取上清。用15 mL上样缓冲液(50 mmol/L NaH2PO4,pH 8.0,300 mmol/L NaCl,10 mmol/L咪唑,10%甘油)将Ni-NTA亲和层析柱进行预平衡后,将上清装载到Ni-NTA亲和层析柱上。先用20 mL洗涤缓冲液Ⅰ (50 mmol/L NaH2PO4,pH 8.0,300 mmol/L NaCl,10 mmol/L咪唑,10%甘油)洗涤,接着用10 mL洗涤缓冲液Ⅱ (50 mmol/L NaH2PO4,pH 8.0,300 mmol/L NaCl,34 mmol/L咪唑,10%甘油)洗涤,再用4 mL洗涤缓冲液Ⅲ (50 mmol/L NaH2PO4,pH 8.0,300 mmol/L NaCl,59 mmol/L咪唑,10%甘油)洗涤,最后用6 mL洗脱缓冲液(50 mmol/L NaH2PO4,pH 8.0,300 mmol/L NaCl,250 mmol/L咪唑,10%甘油)洗脱。分别收集各个洗脱组分,进行SDS-PAGE检测,合并含有目标蛋白的洗脱组分用PD-10脱盐柱(GE Healthcare)脱盐,随后用10 K Amicon Ultra-15超滤管离心浓缩,最后储存于储存缓冲液(50 mmol/L NaH2PO4,pH 8.0,10%甘油)中,于–80 ℃保存备用。使用Bradford法[10]对蛋白浓度进行测定。
1.5 融合蛋白DsaDE的酶催化反应和HPLC检测融合蛋白DsaDE的体外生化反应参考Li等[9]并略有改动,反应体系为(100 μL):5 μmol/L融合蛋白DsaDE,1 mmol/L底物L-Ile或L-allo-Ile,50 mmol/L磷酸盐缓冲液(50 mmol/L NaH2PO4,pH 8.0),30 ℃反应4 h。反应结束后,用200 μL冷甲醇终止反应,沉淀的蛋白质经高速离心(室温,13 000 r/min,20 min)除去。上清液经真空离心缩仪旋干,残留物重新溶于40 μL 2 mmol/L CuSO4水溶液,取25 μL进行手性HPLC分析。使用MCI GEL CRS10W柱(Mitsubishi,50 mm×4.6 mm,3 μm)在Agilent Technologies 1260 Infinity系统上进行手性HPLC分析,分析条件为:流动相为2 mmol/L CuSO4水溶液,使用1 mL/min的流速等梯度洗脱30 min,紫外检测波长为254 nm。
2 结果与分析 2.1 DsaDE融合表达载体的构建在Desotamides的生物合成基因簇中,氨基转移酶和异构酶的编码基因dsaD和dsaE相邻,且dsaE基因位于dsaD的上游,两者之间有112 bp的基因间隔区(图 2A)。为了保证两个酶顺利融合表达,在设计引物扩增dsaE基因片段时,下游引物R1去掉了dsaE的终止密码子,并在上、下游引物中加上Nde Ⅰ (F1)和Kpn Ⅰ (R1)两个酶切位点(表 1和图 2B)。为了保证2个蛋白融合表达时能够正确折叠,减少2个蛋白之间的空间位阻,获得可溶性表达,设计利用dsaE和dsaD之间的基因间隔区作为接头序列(Linker)将2个基因进行衔接,因为此基因间隔区为112 bp,不是3的倍数,为了防止移码,在设计引物扩增dsaD-linker片段时,于上游引物F2的Kpn Ⅰ酶切位点之后引入GT碱基(表 1和图 2B)。为了保证Ni-NTA亲和层析法纯化时融合DsaDE与Ni-NTA填料具有较好的特异性结合能力,设计一个N-端和C-端均融合6个组氨酸标签的融合蛋白His6-DsaDE-His6,在设计引物扩增dsaD-linker片段时,下游引物R2中去除dsaD的终止密码子,并在酶切位点BamH Ⅰ之前引入CT碱基以防止C-端的组氨酸标签移码(表 1和图 2B)。
将扩增的dsaE和dsaD-linker片段经酶切、连接后克隆至pET28a(+)表达载体的Nde Ⅰ和BamH Ⅰ之间。首先,利用引物F1和R2对所构建的pET28a-dsaDE融合表达载体进行菌落PCR验证,结果表明,获得大小约为1.6 kb的DNA片段(图 2B和C),与预测大小一致。将PCR验证正确的阳性克隆提取质粒后,分别用Nde Ⅰ和Kpn Ⅰ以及Kpn Ⅰ和BamH Ⅰ对质粒pET28a-dsaDE进行酶切鉴定,分别获得大小约为1 623 bp和1 248 bp的DNA片段(图 2B和D),与预测结果一致。以上结果说明,dsaE和dsaD-linker已经正确连接并克隆至pET28a(+)中。
2.2 融合蛋白DsaDE的表达和纯化将构建成功的融合表达载体pET28a(+)-dsaDE转化E. coli BL21(DE3)后,放大发酵,利用Ni-NTA亲和层析法对融合表达蛋白进行纯化。利用SDS-PAGE对诱导细胞的裂解物样品进行检测,发现融合蛋白DsaDE在上清中获得较好的可溶性表达,同时也有部分在沉淀中以包涵体的形式存在(图 3A)。对纯化过程中的各洗脱组分进行SDS-PAGE分析,结果表明目标蛋白主要存在于洗脱缓冲液的相应组分中,而在洗涤缓冲液Ⅲ相应组分中也有分布,但量较少。因此,仅对洗脱缓冲液洗脱组分进行脱盐和浓缩,经SDS-PAGE检测,纯化的融合蛋白DsaDE纯度达到95%以上(图 3B)。纯化的融合蛋白DsaDE浓度测定为23.97 mg/mL。

|
| 图 3 DsaDE的SDS-PAGE分析 Figure 3 SDS-PAGE analysis of DsaDE 注:M:Marker;1:诱导表达细胞裂解物的可溶性上清;2:诱导表达细胞裂解物的沉淀;3:纯化后的DsaDE. Note: M: Marker; 1: The soluble lysate of induced cells; 2: The insoluble lysate of induced cells; 3: Purified DsaDE. |
|
|
为证明DsaDE融合蛋白同时具有氨基转移酶和异构酶的功能,分别以L-异亮氨酸和L-别异亮氨酸底物对以上纯化的融合蛋白DsaDE进行体外酶反应分析。利用HPLC对酶反应产物的分析结果表明:当以L-异亮氨酸为底物时,与不添加酶的空白对照相比较,在添加了DsaDE融合蛋白的反应中可以检测到保留时间(13.5 min)与L-别异亮氨酸标准品完全一致的峰(图 4A,图谱iii和iv);同样,当以L-别异亮氨酸为底物时,与不添加酶的空白对照相比较,在添加了DsaDE融合蛋白的反应中可以检测到保留时间(18 min)与L-异亮氨酸标准品完全一致的峰(图 4B,图谱iii和iv)。以上结果说明,融合蛋白DsaDE同时具备了氨基转移酶和异构酶的功能,能够催化L-异亮氨酸和L-别异亮氨酸的相互转化。

|
| 图 4 DsaDE体外酶反应产物的HPLC分析 Figure 4 HPLC analyses of the reaction mixtures catalyzed by DsaDE 注:A:以L-Ile为底物的HPLC分析;i:L-Ile标准品;ii:L-allo-Ile标准品;iii:L-Ile为底物不加酶的对照;iv:L-Ile为底物加入DsaDE酶反应. B:以L-allo-Ile为底物的HPLC分析;i:L-Ile标准品;ii:L-allo-Ile标准品;iii:L-allo-Ile为底物不加酶的对照;iv:L-allo-Ile为底物加入DsaDE酶反应. Note: A: HPLC analyses of the reaction mixtures using L-Ile as substrate; i: L-Ile standard; ii: L-allo-Ile standard; iii: Negative control lacks DsaDE; iv: L-Ile incubated with DsaDE. B: HPLC analyses of the reaction mixtures using L-allo-Ile as substrate; i: L-Ile standard; ii: L-allo-Ile standard; iii: Negative control lacks DsaDE; iv: L-allo-Ile incubated with DsaDE. |
|
|
L-IIe与L-allo-Ile之间的体外相互转化需要在氨基转移酶和异构酶共同作用下完成[9]。虽然该反应在前人的努力下可以通过酶催化实现,但是菌种的选育、优化尤其是多个酶的纯化等过程都比较复杂,限制了大规模的工业生产应用。通过基因工程等方法将反应所需的氨基转移酶和异构酶整合到单一菌株内,使大规模的工业生产模式更为简单,生产过程更易调控。在本研究中,氨基转移酶和异构酶融合的设计是一个关键点,dsaE和dsaD之间的基因间隔区为112 bp,为了保证两种酶的融合表达,因此需要在基因间隔区的上游引物酶切位点之后加入两个碱基GT防止移码。因为要将融合蛋白设计为N-末端和C-末端均融合表达组氨酸标签,所以将dsaD的终止密码子去掉,并在BamH Ⅰ酶切位点之前加上两个碱基CT,以防止移码。最终两个酶位于同一个开放阅读框(ORF)之内,获得了融合基因dsaDE,并将其插入到了大肠杆菌表达载体pET28a(+)中。PCR和酶切鉴定结果显示,本研究成功构建了pET28a-dsaDE融合表达载体,将该重组载体转化到E. coli BL21(DE3)中后,经诱导融合蛋白可以成功在大肠杆菌中可溶性表达,经过Ni-NTA亲和层析柱的一步纯化就可以得到纯度达到95%以上的融合蛋白。因为设计使用天然间隔区作为碱基接头,所以融合蛋白DsaDE在体外酶反应中显示了较好的活性。但是在大肠杆菌中表达融合蛋白的稳定性和pET系列表达载体的蛋白容易形成包涵体[11],这是融合蛋白在表达时需要注意的问题。
在未来的工业生产中,只有新型的酶是远远不够的,反应条件的变化和生产过程中杂质的产生都容易使酶失活,而且酶的分离、纯化和大规模制备困难[12],但是酶的固定化是解决这些问题的重要方法,因此,未来可以将融合蛋白DsaDE与有机高分子材料载体、无机载体(玻璃、金属氧化物)和生物大分子进行固定化,将会更进一步提升融合蛋白DsaDE在实际生产中的价值。
| [1] |
van Dam-Bakker AWI. Isoleucine and allo-isoleucine[J]. Nature, 1958, 181(4602): 116-117. DOI:10.1038/181116a0 |
| [2] |
Ikai K, Takesako K, Shiomi K, et al. Structure of aureobasidin A[J]. The Journal of Antibiotics, 1991, 44(9): 925-933. DOI:10.7164/antibiotics.44.925 |
| [3] |
Kiho T, Nakayama M, Yasuda K, et al. Synthesis and antimicrobial activity of novel globomycin analogues[J]. Bioorganic & Medicinal Chemistry Letters, 2003, 13(14): 2315-2318. |
| [4] |
Song YX, Li QL, Liu X, et al. Cyclic hexapeptides from the deep south China Sea-derived Streptomyces scopuliridis SCSIO ZJ46 active against pathogenic gram-positive bacteria[J]. Journal of Natural Products, 2014, 77(8): 1937-1941. DOI:10.1021/np500399v |
| [5] |
Zhou X, Huang HB, Li J, et al. New anti-infective cycloheptadepsipeptide congeners and absolute stereochemistry from the deep sea-derived Streptomyces drozdowiczii SCSIO 10141[J]. Tetrahedron, 2014, 70(42): 7795-7801. DOI:10.1016/j.tet.2014.02.007 |
| [6] |
Schadewaldt P, Bodner-Leidecker A, Hammen HW, et al. Significance of L-allo-isoleucine in plasma for diagnosis of maple syrup urine disease[J]. Clinical Chemistry, 1999, 45(10): 1734-1740. |
| [7] |
Li QL, Song YX, Qin XJ, et al. Identification of the biosynthetic gene cluster for the anti-infective desotamides and production of a new analogue in a heterologous host[J]. Journal of Natural Products, 2015, 78(4): 944-948. DOI:10.1021/acs.jnatprod.5b00009 |
| [8] |
Liu J, Wang B, Li HZ, et al. Biosynthesis of the anti-infective marformycins featuring pre-NRPS assembly line N-formylation and O-methylation and post-assembly line C-hydroxylation chemistries[J]. Organic Letters, 2015, 17(6): 1509-1512. DOI:10.1021/acs.orglett.5b00389 |
| [9] |
Li QL, Qin XJ, Liu J, et al. Deciphering the biosynthetic origin of S-allo-isoleucine[J]. Journal of the America Chemistry Society, 2016, 138(1): 408-415. DOI:10.1021/jacs.5b11380 |
| [10] |
Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [11] |
Mierendorf R, Yeager K, Novry R. The pET system: Your choice for expression[J]. Advanced Products and Protocols for Molecular Biology Research, 1994, 1(1): 1-3. |
| [12] |
Li Y. Enzymes immobilization and their applications[J]. Journal of Molecular Catalysis (China), 2008, 22(1): 86-96. (in Chinese) 李晔. 酶的固定化及其应用[J]. 分子催化, 2008, 22(1): 86-96. |
 2018, Vol. 45
2018, Vol. 45




