扩展功能
文章信息
- 王彩霞, 王毅波, 刘鹏远, 吴霖, 孙延瑜, 胡晓珂
- WANG Cai-Xia, WANG Yi-Bo, LIU Peng-Yuan, WU Lin, SUN Yan-Yu, HU Xiao-Ke
- 渤海三湾表层水域细菌群落结构多样性及其环境因子分析
- Diversity of bacterial community structure and its driving factors in three bays of Bohai Sea
- 微生物学通报, 2018, 45(9): 1956-1971
- Microbiology China, 2018, 45(9): 1956-1971
- DOI: 10.13344/j.microbiol.china.180001
-
文章历史
- 收稿日期: 2018-01-01
- 接受日期: 2018-03-15
- 网络首发日期(www.cnki.net): 2018-05-17
2. 中国科学院大学 北京 100049;
3. 烟台大学 山东 烟台 264005
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Yantai University, Yantai, Shandong 264005, China
大量研究已经阐明海洋微生物在海洋生态系统中占据着重要的地位[1-2]。海洋微生物群落组成主要包括细菌、古菌、原生生物、真菌和病毒,它们直接或间接参与了海洋生物地球化学循环过程,主要包括碳、氮、磷、硫循环等。这些生物主要包括光能生产者和化能生产者,也包括异养的二级生产者,主要通过微生物环对溶解性有机质和营养物质进行代谢和利用[3-4]。近年来关于海洋微生物群落结构动态变化的研究,很大一部分是基于时间尺度展开的,从昼夜变化到年际变化,不仅仅阐明了环境因子与微生物群落之间的关系,还揭示了微生物群落之间的互作关系以及作为一个整体在生态系统中的作用[5]。更重要的是,这些研究还表明微生物群落不仅仅是动态的,还是弹性的,这也意味着在典型的区域内,随着昼夜、季节以及年际变化,它们的动态变化是可以预测的[6]。微生物在体现海洋生态系统功能中发挥着重要的作用[3],我们可以通过微生物系统分类学和代谢组学的理论和方法来研究其在自然进化中的多样性表现[7]。
研究海洋微生物群落结构多样性的分子生态学方法主要有分子标记技术、变性梯度凝胶电泳技术(DGGE)和宏基因组学技术等[8]。尽管在海洋生物多样性的研究中,微生物多样性的研究仍然是一个比较难的领域,但是估算海洋微生物多样性仍然是理解生物地理学、群落构建和生态过程必不可少的一部分。研究海洋微生物多样性不仅能帮助我们更好地了解海洋微生物的特征分布及其在海洋生态系统中发挥的功能,认识在海洋生物地球化学循环和生态系统中起作用的菌群[9],更有助于开发利用和保护海洋微生物的多样性,维持海洋生态资源的可持续发展[10-11]。鉴于微生物能够在多变的物理化学环境中生存,以及对环境的适应性和在维持生态系统平衡过程中所做的贡献,研究微生物群落结构多样性具有重要的意义。
近海生态系统是全球生态系统的重要组成部分,是受人类活动干扰较为严重的区域,因此,保护近海生态系统的栖息安全和生态健康、维持近海生态系统可持续发展具有重要的意义。近岸海域由于受到河口输出以及人类活动的干扰,环境因子和时空变化显著,是复杂动态的水环境系统[12]。河口的输出导致近岸区域盐度梯度明显,pH、温度和营养盐发生了显著的变化,近岸海域微生物群落的生理机能也随之发生了明显的改变[13-15]。其中最明显的变化就是海水菌群向淡水转移,尤其在英国泰晤士河和欧洲多瑙河河口区域,通常在淡水系统中占y优势地位的种群主要有α-变形菌纲(Alphaproteobacteria)、β-变形菌纲(Betaproteobacteria)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)[16-17],由于受到河口输出以及人类活动的干扰,一些海水优势菌群例如α-变形菌纲(Alphaproteobacteria),主要是远洋杆菌科(Pelagibacterales)、红杆菌科(Rhodobacteraceae)、γ-变形菌纲(Gammaproteobacteria)、聚球藻属(Synechococcus sp.)、原绿球藻属(Prochlorococcus sp.)和拟杆菌门(Bacteroidetes)被发现存在于淡水中[18-19]。
渤海位于北纬37.07°−37.41°和东经117.35°−121.1°之间,作为一个半封闭的海域,西边主要由陆地环绕,东边由渤海海峡与黄海连接,最大水深约为86 m,平均水深约为25 m,主要包括辽东湾、莱州湾和渤海湾[20]。作为近岸海域,随着经济的发展,渤海饱受人类活动和环境污染的影响,严重危及渤海微生物多样性和生态系统的可持续发展[21]。因此,本研究通过高通量测序技术研究渤海三湾细菌群落结构多样性及其环境因子分析,以期为更好地保护渤海海域生态系统平衡发展和开发利用生物资源提供科学依据。
1 材料与方法 1.1 样品采集水样采集于2015年8月17日到25日,位于渤海三湾包括渤海湾、辽东湾和莱州湾3个断面表层。采样点位置分别为渤海湾S46 (38.501°N,118.98°E)、S47 (38.669°N,118.952°E)、S48 (38.831°N,118.973°E)、S49 (38.983°N,118.982°E);辽东湾S50 (39.308°N,119.707°E)、S51 (39.183°N,120.071°E)、S53 (39.057°N,120.608°E)、S54 (39.002°N,120.806°E);莱州湾S68 (37.758°N,119.394°E)、S69 (37.749°N,119.651°E)、S70 (37.749°N,119.933°E)、S71 (37.748°N,120.106°E)。全部12个站位的样品利用Niskin瓶子(体积为12 L)采集水样,取2 L表层水经过0.22 μm聚碳酸酯膜(直径为47 mm)采用负压过滤的方法将微生物样品收集到滤膜上[22-23]。水样过滤完成之后迅速将滤膜放于无菌的冻存管中置于液氮中保存,回到实验室之后转移到−80 ℃环境保存待分析,样品收集完成一个月之内完成DNA样品的提取。
1.2 主要试剂和仪器DNA提取试剂盒采用FastDNA® Spin Kit for Soil, MP Biomedicals公司。Illumina HiSeq 2500测序仪,Illumina公司;PCR仪,Bio-Rad公司;CTD (Conductivity temperature-depth)采水器,Sea-Bird公司。
1.3 理化参数的测定渤海三湾3个断面表层水的温度和盐度由CTD采水器记录获得。表层水中的溶解性有机质如硝酸盐、磷酸盐、铵盐和硅酸盐的浓度参照先前的研究由营养盐自动分析仪测定[24]。
1.4 DNA的提取和高通量测序将采集的滤膜样品剪碎,按照DNA提取试剂盒的步骤说明进行DNA提取。利用NanoDrop核酸测定仪选取高浓度的DNA样品进行16S rRNA基因V3−V4区PCR扩增。PCR反应条件:95 ℃ 10 min;95 ℃ 45 s,55 ℃ 1 min,72 ℃ 45 s,35个循环;72 ℃ 10 min;4 ℃保温。细菌引物为515F (5′-GTGC CAGCMGCCGCGGTAA-3′)和806R (5′-GGACTAC HVGGGTWTCTAAT-3′)[25]。扩增后得到的PCR产物利用1%的琼脂糖凝胶电泳进行检测。然后将PCR产物送至诺禾致源生物信息科技有限公司,利用Illumina HiSeq 2500进行双端测序。
1.5 数据分析与处理为保证后续数据的准确性,对高通量测序得到的数据进行质控分析得到去掉Barcode的Clean数据。利用USEARCH软件[26]对序列进行拼接去重复,将相似度 > 97%的物种聚类为一个分类操作单元(OTU)。通过Greengenes数据库对所得到的OTU进行分类比对,利用Mothur软件[27]对序列进行抽平计算多样性指数Sobs、Shannon、Simpson、Ace、Chao1指数和Coverage。利用QIIME软件制成稀释曲线(图 1),进行主成分分析(Principal component analysis,PCA),绘制相关性热图(Heatmap)。本研究所得到的原始序列均已上传SRA数据库中,其中生成的序列号为SRR6429180−SRR6429191。

|
| 图 1 稀释曲线 Figure 1 Rarefaction curves of OTU numbers |
|
|
不同类型的水体理化参数如表 1所示,由表 1中数据可以看出莱州湾水体盐度明显偏低,营养盐浓度尤其是硝酸盐浓度显著高于渤海湾和辽东湾。莱州湾断面靠近黄河口的站位S68,其磷酸盐(PO4-P)含量达到26.22 μg/L,总的硝酸盐(NO3-N+NO2-N)含量达到329.263 μg/L,铵盐(NH4-N)含量为324.616 μg/L,明显高于其他站位其他断面的营养盐含量。纵观3个断面,温度的变化差异不是很大,莱州湾断面靠近黄河口位置的盐度略低于其他断面。
| 样品 Samples |
温度 Temperature (℃) |
盐度 Salinity (PSU) |
溶解氧 DO (μmol/L) |
磷酸盐 PO4-P (μg/L) |
硝酸盐 NO3-N+NO2-N (μg/L) |
铵盐 NH4-N (μg/L) |
亚硝酸盐 NO2-N (μg/L) |
硅酸盐 SiO2 (mg/L) |
| S46 | 25.08 | 30.809 | 6.113 | 5.30 | 12.103 | 14.848 | 12.985 | 0.300 |
| S47 | 25.43 | 30.965 | 6.733 | 6.35 | 37.833 | 21.819 | 9.803 | 0.250 |
| S48 | 24.87 | 30.890 | 6.841 | 5.44 | 36.281 | 10.861 | 1.868 | 0.252 |
| S49 | 24.15 | 30.870 | 5.703 | 11.45 | 76.344 | 41.306 | 4.744 | 0.272 |
| S50 | 25.12 | 30.894 | 6.957 | 7.77 | 26.517 | 34.029 | 11.572 | 0.587 |
| S51 | 24.83 | 30.899 | 5.212 | 15.40 | 55.759 | 76.613 | 8.433 | 0.845 |
| S53 | 22.73 | 30.975 | 6.587 | 9.41 | 64.853 | 19.199 | 2.320 | 0.356 |
| S54 | 21.03 | 31.319 | 7.709 | 9.02 | 14.333 | 26.836 | 9.433 | 0.206 |
| S68 | 25.79 | 29.558 | 5.927 | 26.22 | 329.263 | 324.616 | 3.584 | 0.449 |
| S69 | 26.41 | 29.819 | 6.019 | 10.02 | 192.664 | 170.298 | 11.439 | 0.506 |
| S70 | 25.68 | 29.536 | 5.911 | 9.78 | 238.513 | 199.646 | 5.991 | 0.193 |
| S71 | 26.19 | 29.659 | 6.164 | 11.97 | 153.585 | 71.590 | 4.574 | 0.501 |
通过Silva数据库对所得数据进行比对,根据分类注释结果对物种组成进行分类,合并丰度 < 1%的数值,分别从属(Genus)、科(Family)、目(Order)、纲(Class)、门(Phylum)水平以及相似性 > 97%的OTU水平上对物种进行分类统计(图 2)。由图 2A发现在属水平上,渤海湾断面的聚球藻属(Synechococcus)平均丰度相对较高,莱州湾平均丰度相对较低,尤其站位S46是与黄河口较接近的位置,该属的丰度能达到46.3%。在科水平上如图 2B所示,浮霉菌科(Planctomycetaceae)在渤海湾断面和辽东湾断面都表现出较高的丰度,其中在渤海湾断面S48站位其丰度为8.9%,在辽东湾断面的S50站位其丰度为15.6%。在目水平上如图 2C所示,酸微菌目(Acidimicrobiales)在辽东湾的平均丰度最高,在莱州湾的平均丰度次之,在渤海湾的平均丰度最低,其中在辽东湾断面S51站位其丰度最高为11.8%。在纲水平上(图 2D)看物种组成可以发现,蓝细菌(Cyanobacteria)在渤海湾和辽东湾断面的平均丰度均高于莱州湾断面,其中在S46站位丰度最高,可以达到47.7%。从门水平上(图 2E)观测发现,莱州湾浮霉菌门(Planctomycetes)所占的比例较小,渤海湾和辽东湾断面浮霉菌门丰度相对较大,其中S50站位丰度最高,为16.6%。而变形菌门(Proteobacteria)在莱州湾断面平均丰度最高,其中S69站位丰度最高,为64.8%。从相似性 > 97%的OTU水平上分析(图 2F),OTU572在渤海湾断面的丰度最高,丰度最高站位为S46,达到42.4%。
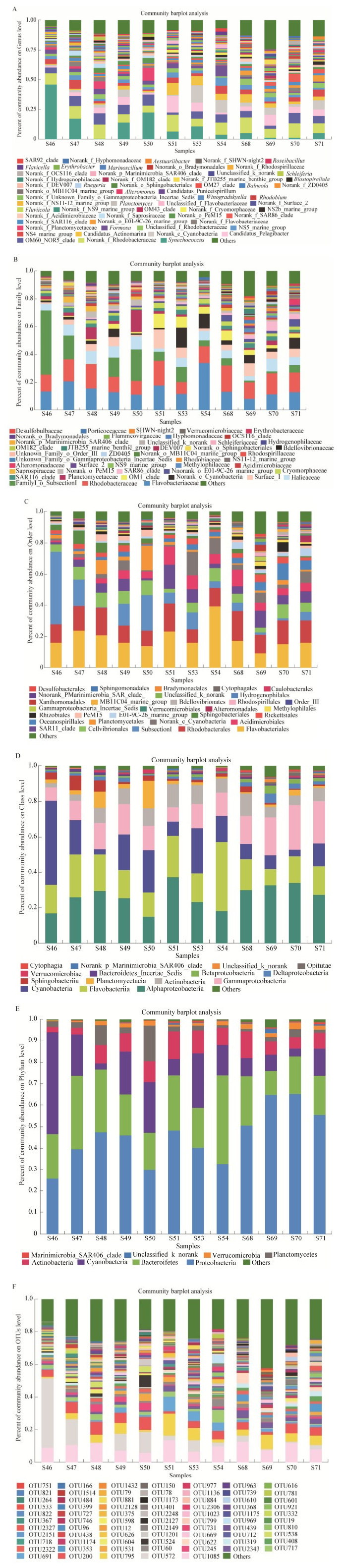
|
| 图 2 物种组成分布图 Figure 2 Community bar plot analysis 注:选取相对丰度 > 1%的物种进行物种丰度的统计. A:属(Genus)水平上的群落组成;B:科(Family)水平的物种群落组成;C:目(Order)水平的群落组成;D:纲(Class)水平的群落组成;E:门(Phylum)水平的群落组成;F:相似性 > 97%的OTU水平的群落组成. Note: Species with relative abundance (> 1%) were chosen for the statistics. A: Community composition of genus level; B: Community composition of family level; C: Community composition of order level; D: Community composition of class level; E: Community composition of phylum level; F: Community composition of OTU level. |
|
|
从优势菌群组成分析可以看出,渤海海域夏季主要优势菌群有变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)。根据多级物种组成分析(图 3)可以看出这几类优势菌群在渤海湾、莱州湾和辽东湾的分布有明显的区别。其中,在渤海湾断面物种组成分布主要为变形菌门(Proteobacteria)约占39.8%,拟杆菌门(Bacteroidetes)占25.7%,蓝细菌门(Cyanobacteria)占22.4%,放线菌门(Actinobacteria)占5.85%,浮霉菌门(Planctomycetes)占4.38%。在辽东湾断面物种组成分布情况为变形菌门(Proteobacteria)约占37.8%,拟杆菌门(Bacteroidetes)占25.7%,蓝细菌门(Cyanobacteria)占17.8%,放线菌门(Actinobacteria)占10.4%,浮霉菌门(Planctomycetes)占5.64%。而在莱州湾优势菌群的分布与前两者比较有较大的差异,莱州湾断面优势菌群所占比例为变形菌门(Proteobacteria)约占59.0%,拟杆菌门(Bacteroidetes)占17.5%,蓝细菌门(Cyanobacteria)占8.2%,放线菌门(Actinobacteria)占7.88%。与渤海湾断面和辽东湾断面比较,莱州湾断面没有浮霉菌门,相应的变形菌门占主导地位,是主要的菌群。
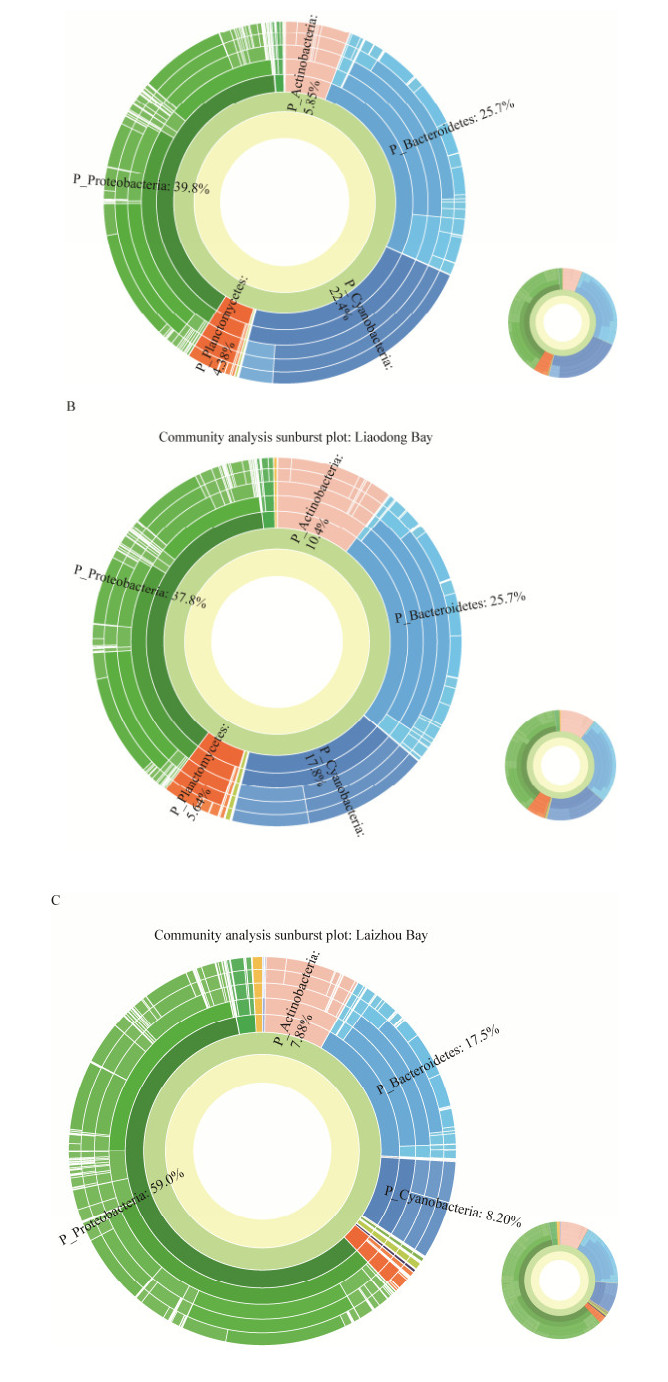
|
| 图 3 多级物种群落组成分析图 Figure 3 Community analysis sunburst plot on Phylum level 注:A:渤海湾断面;B:辽东湾断面;C:莱州湾断面. Note: A: Bohai Bay; B: Liaodong Bay; C: Laizhou Bay. |
|
|
通过高通量测序数据对测序结果进行比对,并对采集样品进行α-多样性分析,得出多样性指数统计表(表 2)。根据表 2可以看出所有样品的覆盖度均在99%以上,说明测序数据是有效可靠的,可以作为分析的依据。其中Sobs指数是指实际观测到的OTU数目,Shannon指数和Simpson指数主要用来衡量物种的多样性情况,Ace指数和Chao1指数主要用来衡量物种的丰富度,Coverage指数主要用来检测测序对物种的覆盖度。由表 2可以看出,Sobs指数为莱州湾 > 渤海湾 > 辽东湾。根据Shannon指数和Simpson指数可以看出,莱州湾断面Shannon指数显著高于其他2个断面,Simpson指数显著低于其他2个断面,说明莱州湾的多样性显著高于其他2个断面。根据Chao1指数和Ace指数结果发现,Chao1指数和Ace指数大小顺序为莱州湾 > 渤海湾 > 辽东湾,说明莱州湾的微生物群落丰富度是最高的,其次为渤海湾和辽东湾。以上结果表明渤海典型海域莱州湾、渤海湾和辽东湾水体中的物种丰度和多样性存在明显的差异。
| Types | Samples | Sobs | Shannon | Simpson | Ace | Chao1 | Coverage |
| 渤海湾 | S46 | 536 | 3.125 | 0.194 | 675.509 | 657.852 | 0.997 |
| Bohai Bay | S47 | 654 | 4.100 | 0.049 | 1 128.142 | 924.647 | 0.996 |
| S48 | 807 | 4.400 | 0.034 | 1 105.497 | 1 101.409 | 0.995 | |
| S49 | 1 057 | 4.570 | 0.031 | 1 454.500 | 1 461.503 | 0.993 | |
| Sum | 3 054 | 16.196 | 0.308 | 4 363.648 | 4 145.411 | 3.980 | |
| 辽东湾 | S50 | 670 | 4.017 | 0.044 | 1 064.782 | 972.165 | 0.995 |
| Liaodong Bay | S51 | 736 | 3.989 | 0.053 | 1 222.283 | 1 068.905 | 0.995 |
| S53 | 762 | 4.514 | 0.026 | 953.306 | 951.150 | 0.996 | |
| S54 | 727 | 4.248 | 0.033 | 974.955 | 972.310 | 0.995 | |
| Sum | 2 895 | 16.767 | 0.156 | 4 215.326 | 3 964.530 | 3.981 | |
| 莱州湾 | S68 | 1 053 | 4.397 | 0.034 | 1 505.742 | 1 447.744 | 0.992 |
| Laizhou Bay | S69 | 1 533 | 5.135 | 0.021 | 1 790.362 | 1 759.939 | 0.993 |
| S70 | 899 | 4.540 | 0.029 | 1 477.174 | 1 241.045 | 0.994 | |
| S71 | 984 | 4.513 | 0.025 | 1 684.054 | 1 387.673 | 0.993 | |
| Sum | 4 469 | 18.585 | 0.108 | 6 457.332 | 5 836.401 | 3.972 |
根据Bray-curtis距离算法,对物种进行非度量多维尺度(Non-metric multidi-mensional scaling,NMDS)分析(图 4),发现渤海湾、莱州湾和辽东湾3个断面的样品在维度NMDS1和维度NMDS2能够很好地被区分开,其中Stress值为0.095,很好地证明了数据的可靠性。
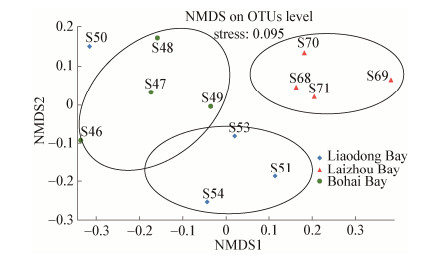
|
| 图 4 基于相似性 > 97%的OTU水平上非度量多维度分析 Figure 4 NMDS plot on OTU level (similarity over 97%) |
|
|
根据门水平主成分分析(图 5),发现莱州湾、渤海湾和辽东湾断面各样品之间存在着明显的差异,它们分别与不同的环境因子之间存在着密切的联系,其中盐度(P < 0.01)和硝酸盐(P < 0.05)的浓度对门水平上物种的分布和组成有显著的影响。而且,主成分分析在PC1维度的解释度为67.49%,在PC2维度的解释度为22.37%,说明该分析有一定的可靠性,能够很好地解释主要成分的结构和主要环境因子的作用。

|
| 图 5 门水平上主成分分析 Figure 5 Principal component analysis (PCA) of phylum level 注:Tem:温度;Nitra:硝酸盐;Ammon:铵盐;Silic:硅酸盐;Phosp:磷酸盐;Nitri:亚硝酸盐;Longi:经度;Latit:纬度;Do:溶解氧;Sal:盐度. Note: Tem: Temperature; Nitra: Nitrate; Ammon: Ammonium; Silic: Silicate; Phosp: Phosphate; Nitri: Nitrite; Longi: Longitude; Latit: Latitude; Do: Dissolved oxygen; Sal: Salinity. |
|
|
通过Heatmap相关性分析,展现了在门分类水平上不同微生物类群对渤海水环境的适应性及水体微生物与水体环境因子在梯度上的分布格局。通过Spearman相关性计算,对环境因子和物种层级利用求平均的方式进行聚类,选取门水平上丰度为前30的物种进行Heatmap相关性分析(图 6)。结果发现温度、磷酸盐、硝酸盐和铵盐与门水平上物种分布有明显的正相关关系(P < 0.01),而溶解氧、纬度和盐度与门水平上物种组成有明显的负相关关系(P < 0.05)。按物种分布来看,Lgnavibacteriae、Aminicenantes、脱铁杆菌门(Deferribacteres)、粘胶球形菌门(Lentisphaerae)、变形菌门(Proteobacteria)、出芽单胞菌门(Gemmatimonadetes)、绿屈扰菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、Latescibacteria和硝化螺旋菌门(Nitrospirae)分布较为密集,距离较为相近,并且与环境因子溶解氧、纬度、盐度、温度、磷酸盐、硝酸盐和铵盐有显著的相关性,说明渤海三湾水体中这些微生物物种对环境因子的变化比较敏感。

|
| 图 6 门水平上Heatmap相关性分析 Figure 6 Heatmap correlationship analysis on Phylum level 注:Tem:温度;Nitra:硝酸盐;Ammon:铵盐;Silic:硅酸盐;Phosp:磷酸盐;Nitri:亚硝酸盐;Longi:经度;Latit:纬度;Do:溶解氧;Sal:盐度. *:P < 0.05;**:P < 0.01;***:P < 0.001. Note: Tem: Temperature; Nitra: Nitrate; Ammon: Ammonium; Silic: Silicate; Phosp: Phosphate; Nitri: Nitrite; Longi: Longitude; Latit: Latitude; Do: Dissolved oxygen; Sal: Salinity. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
|
|
通过群落Weighted-unifrac距离算法和环境因子Bray-curtis距离算法对环境因子与门水平物种之间的相关性进行Mantel test统计检验(表 3),检验结果发现环境因子与门水平物种之间有很大的相关性,尤其是硝酸盐对门水平物种的影响最为显著(P < 0.01),该检验结果验证了我们对微生物类群与环境因子之间相关性的分析结果,表明我们的分析具有一定的可靠性。
| Environmental factors | Mantel test (r statistics) | P-value | Number of permu | Tail type |
| 铵盐Ammonia | 0.259 82 | 0.074 | 999 | Two sided |
| 溶解氧Dissolved oxygen | 0.115 83 | 0.546 | 999 | Two sided |
| 纬度Latitude | 0.215 15 | 0.077 | 999 | Two sided |
| 经度Longitude | −0.038 54 | 0.804 | 999 | Two sided |
| 硝酸盐Nitrate | 0.488 40 | 0.001 | 999 | Two sided |
| 亚硝酸盐Nitrite | −0.036 21 | 0.817 | 999 | Two sided |
| 磷酸盐Phosphate | −0.011 96 | 0.970 | 999 | Two sided |
| 盐度Salinity | 0.221 84 | 0.149 | 999 | Two sided |
| 硅酸盐Silicate | −0.025 84 | 0.876 | 999 | Two sided |
| 温度Temperature | 0.098 45 | 0.686 | 999 | Two sided |
我们对渤海三湾水体微生物群落结构在属、科、目、纲、门、OTU水平进行分析,根据分布特征显示,微生物群落结构组成呈现出少数比较常见的物种在渤海3个断面中均出现相对较高的比例,为3个断面中共同的、所占比例相对较高的优势菌群。而一些相对丰度较低的微生物种群在各个断面中所占的比例差别较大,呈现出较大的差异,表明各断面间多样性的不同。通过研究属水平群落组成发现,在渤海三湾3个断面的群落组成中,聚球藻属(Synechococcus)为优势菌群,所占比例最大。研究表明,聚球藻属(Synechococcus)属于蓝细菌门,它们在营养充足、环境稳定的条件下容易大量增殖,而且聚球藻属(Synechococcus)的最适生长温度为25−35 ℃,而夏季渤海三湾的温度均在此范围之内,因此我们的结果与先前的研究结果一致[28]。在科和目水平上观察微生物群落组成发现黄杆菌(Flavobacterium)占优势地位。由于夏季光照充足,条件适宜,黄杆菌科等异养细菌可以通过降解来源于蓝细菌等藻类的有机质来获得自身生长的能量来源,因而表现出较高的丰度[29]。而在纲水平上α-变形菌纲(Alphaproteobacteria)属于优势菌群,在三湾断面上所占相对丰度最高。在门水平上变形菌门(Proteobacteria)所占相对丰度最高,是所有菌群中的优势菌群。已有关于北黄海和秦皇岛海域微生物群落结构的研究发现,水体中占优势地位的微生物群体主要有变形杆菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)等,渤海海域和北黄海水体在一个层级水平上有一定的相似性[30-31]。变形杆菌门(Proteobacteria)广泛存在于海洋环境中,渤海三湾断面门水平上优势菌群的分布与先前的研究有一定的相似性。渤海三湾微生物群落组成分布特点验证了生态学上群落组成分布的模式,即并非所有物种的分布模式都是均匀的,物种的分布无论是海洋环境还是热带雨林环境,都会以大量稀有物种和少量常见物种分布的模式呈现,而且这种分布模式会出现在各种生物类群中[32-33]。
3.2 渤海三湾水体微生物多样性与环境因子关系通过研究海洋微生物群落结构和所处的生境条件来揭示微生物群落动态变化和功能菌群多样性是目前研究者们关心的热点问题[34]。由于湾口所处的特殊地理位置以及多种因子之间交互作用导致湾口处微生物多样性极其复杂。渤海三湾处于特殊的地理位置,受到人类活动和河口输出的影响尤为严重[35]。已有研究报道黄渤海有机质的分布情况由于受到陆源河口输出影响,近岸河口区域有机质的含量明显高于远岸区域[36]。细菌群落结构与营养盐的浓度有极大的相关性,研究发现在舟山及其邻近海域,蓝细菌(Cyanobacteria)与硝酸盐的浓度有显著的相关性,而Parcubacteria的丰度会随着温度的变化有明显的改变,海洋微生物群落多样性会随着环境因子的变化做出响应[37]。而根据我们的研究发现渤海三湾微生物多样性指数和丰富度指数大小依次为莱州湾 > 渤海湾 > 辽东湾,莱州湾微生物多样性明显高于渤海湾和辽东湾。经过相关性分析发现,门水平上相对丰度大于30的菌群中,Lgnavibacteriae、Aminicenantes、脱铁杆菌门(Deferribacteres)、粘胶球形菌门(Lentisphaerae)、变形菌门(Proteobacteria)、出芽单胞菌门(Gemmatimonadetes)、绿屈扰菌门(Chloroflexi)、酸杆菌门(Acidobacteria)、Latescibacteria和硝化螺旋菌门(Nitrospirae)等类群与溶解氧、盐度和纬度呈现明显的负相关关系,与温度、磷酸盐、硝酸盐和铵盐有明显的正相关关系。通过理化参数分析发现,莱州湾由于受黄河口输出影响较大,其营养盐浓度明显偏高,这与莱州湾较高的微生物多样性和丰富度是相对应的。在本研究中我们发现变形菌门、拟杆菌门、蓝细菌门、放线菌门和浮霉菌门有相对较高的丰度分布,这些类群与石油烃的降解和外来无机化合物的降解有很大的关系[30]。而拟杆菌门中的黄杆菌纲对海洋赤潮有着重要的预警作用,在海洋聚合物的微生物降解中发挥着重要的作用,对于海洋生态系统的健康发展具有非常重要的作用[38-39]。而渤海海域由于处于特殊的位置,受到河口输出和人类活动干扰尤为严重,因此造成碳、氮、磷等营养物质的汇集,致使微生物多样性和丰富度也趋于复杂。
4 结论通过高通量测序技术对渤海三湾断面微生物群落结构多样性进行分析发现:莱州湾、渤海湾和辽东湾3个断面之间的多样性指数差异显著,根据Shannon和Simpson指数表明,微生物多样性为莱州湾 > 渤海湾 > 辽东湾。根据Chao1指数和Ace指数表明微生物丰富度为莱州湾 > 渤海湾 > 辽东湾。而依据β-多样性分析也发现,莱州湾、渤海湾和辽东湾3个组别之间有明显的差异。
综上所述,渤海三湾微生物群落主要以变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、蓝细菌门(Cyanobacteria)、放线菌门(Actinobacteria)和浮霉菌门(Planctomycetes)为主,微生物群落结构和物种组成有较高的多样性,在不同区域差异较大。渤海海域三湾微生物多样性受地理分布和环境因子共同影响。渤海三湾受河口输出和人类活动影响频繁,研究渤海海域微生物群落结构多样性和驱动因子有助于开发渤海海域特殊功能菌群,并为保护渤海生态环境可持续发展提供更好的理论基础。
| [1] |
Fuhrman JA. Marine viruses and their biogeochemical and ecological effects[J]. Nature, 1999, 399(6736): 541-548. DOI:10.1038/21119 |
| [2] |
Azam F, Malfatti F. Microbial structuring of marine ecosystems[J]. Nature Reviews Microbiology, 2007, 5(10): 782-791. DOI:10.1038/nrmicro1747 |
| [3] |
Falkowski PG, Fenchel T, Delong EF. The microbial engines that drive earth's biogeochemical cycles[J]. Science, 2008, 320(5879): 1034-1039. DOI:10.1126/science.1153213 |
| [4] |
Azam F, Fenchel T, Field JG, et al. The ecological role of water-column microbes in the sea[J]. Marine Ecology Progress Series, 1983, 10: 257-263. DOI:10.3354/meps010257 |
| [5] |
Hewson I, Steele JA, Capone DG, et al. Temporal and spatial scales of variation in bacterioplankton assemblages of oligotrophic surface waters[J]. Marine Ecology Progress Series, 2006, 311: 67-77. DOI:10.3354/meps311067 |
| [6] |
Lie AAY, Kim DY, Schnetzer A, et al. Small-scale temporal and spatial variations in protistan community composition at the San Pedro Ocean Time-series station off the coast of southern California[J]. Aquatic Microbial Ecology, 2013, 70(2): 93-110. DOI:10.3354/ame01652 |
| [7] |
Pace NR. A molecular view of microbial diversity and the biosphere[J]. Science, 1997, 276(5313): 734-740. DOI:10.1126/science.276.5313.734 |
| [8] |
Li Y, Zheng W, Zheng TL. Advances in research of marine microbial diversity and molecular ecology[J]. Microbiology China, 2013, 40(4): 655-668. (in Chinese) 李祎, 郑伟, 郑天凌. 海洋微生物多样性及其分子生态学研究进展[J]. 微生物学通报, 2013, 40(4): 655-668. |
| [9] |
Martiny JBH, Bohannan BJM, Brown JH, et al. Microbial biogeography: putting microorganisms on the map[J]. Nature Reviews Microbiology, 2006, 4(2): 102-112. DOI:10.1038/nrmicro1341 |
| [10] |
Zang HM, Fan JF, Wang B, et al. Research progress on marine microbial diversity[J]. Marine Environmental Science, 2006, 25(3): 96-100. (in Chinese) 臧红梅, 樊景凤, 王斌, 等. 海洋微生物多样性的研究进展[J]. 海洋环境科学, 2006, 25(3): 96-100. DOI:10.3969/j.issn.1007-6336.2006.03.026 |
| [11] |
He JY, Zhao RT, Chen YY, et al. Research techniques and advances on the marine microbial diversity[J]. Chinese Bulletin of Life Sciences, 2012, 24(6): 526-530. (in Chinese) 何建瑜, 赵荣涛, 陈永妍, 等. 海洋微生物多样性研究技术进展[J]. 生命科学, 2012, 24(6): 526-530. DOI:10.3969/j.issn.1007-7847.2012.06.011 |
| [12] |
Morris AW, Allen JI, Howland RJM, et al. The estuary plume zone: source or sink for land-derived nutrient discharges?[J]. Estuarine, Coastal and Shelf Science, 1995, 40(4): 387-402. DOI:10.1006/ecss.1995.0027 |
| [13] |
Lindh MV, Riemann L, Baltar F, et al. Consequences of increased temperature and acidification on bacterioplankton community composition during a mesocosm spring bloom in the Baltic Sea[J]. Environmental Microbiology Reports, 2013, 5(2): 252-262. DOI:10.1111/emi4.2013.5.issue-2 |
| [14] |
Lozupone CA, Knight R. Global patterns in bacterial diversity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(27): 11436-11440. DOI:10.1073/pnas.0611525104 |
| [15] |
Fodelianakis S, Papageorgiou N, Pitta P, et al. The pattern of change in the abundances of specific bacterioplankton groups is consistent across different nutrient-enriched habitats in crete[J]. Applied and Environmental Microbiology, 2014, 80(13): 3784-3792. DOI:10.1128/AEM.00088-14 |
| [16] |
Read DS, Gweon HS, Bowes MJ, et al. Catchment-scale biogeography of riverine bacterioplankton[J]. The ISME Journal, 2015, 9(2): 516-526. DOI:10.1038/ismej.2014.166 |
| [17] |
Winter C, Hein T, Kavka G, et al. Longitudinal changes in the bacterial community composition of the Danube River: a whole-river approach[J]. Applied and Environmental Microbiology, 2007, 73(2): 421-431. DOI:10.1128/AEM.01849-06 |
| [18] |
Bouvier TC, del Giorgio PA. Compositional changes in free-living bacterial communities along a salinity gradient in two temperate estuaries[J]. Limnology and Oceanography, 2002, 47(2): 453-470. DOI:10.4319/lo.2002.47.2.0453 |
| [19] |
Crump BC, Peranteau C, Beckingham B, et al. Respiratory succession and community succession of bacterioplankton in seasonally anoxic estuarine waters[J]. Applied and Environmental Microbiology, 2007, 73(21): 6802-6810. DOI:10.1128/AEM.00648-07 |
| [20] |
Wang CX, Wang YB, Paterson JS, et al. Macroscale distribution of virioplankton and heterotrophic bacteria in the Bohai Sea[J]. FEMS Microbiology Ecology, 2016, 92(3): fiw017. DOI:10.1093/femsec/fiw017 |
| [21] |
Shen D, Jiao LL, Chang Y, et al. Ecosystem health assessment of Yellow Sea and Bohai coastal areas[J]. Chinese Journal of Ecology, 2015, 34(8): 2362-2372. (in Chinese) 申丹, 焦琳琳, 常禹, 等. 黄海和渤海沿海地区生态系统健康评价[J]. 生态学杂志, 2015, 34(8): 2362-2372. |
| [22] |
Liu LM, Yang J, Yu Z, et al. The biogeography of abundant and rare bacterioplankton in the lakes and reservoirs of China[J]. The ISME Journal, 2015, 9(9): 2068-2077. DOI:10.1038/ismej.2015.29 |
| [23] |
Cram JA, Chow CET, Sachdeva R, et al. Seasonal and interannual variability of the marine bacterioplankton community throughout the water column over ten years[J]. The ISME Journal, 2015, 9(3): 563-580. DOI:10.1038/ismej.2014.153 |
| [24] |
Yu SL, Yao P, Liu JW, et al. Diversity, abundance, and niche differentiation of ammonia-oxidizing prokaryotes in mud deposits of the eastern China marginal seas[J]. Frontiers in Microbiology, 2016, 7: 137. |
| [25] |
Wang H, Wang B, Dong WW, et al. Co-acclimation of bacterial communities under stresses of hydrocarbons with different structures[J]. Scientific Reports, 2016, 6: 34588. DOI:10.1038/srep34588 |
| [26] |
Edgar RC. Search and clustering orders of magnitude faster than BLAST[J]. Bioinformatics, 2010, 26(19): 2460-2461. DOI:10.1093/bioinformatics/btq461 |
| [27] |
Kozich JJ, Westcott SL, Baxter NT, et al. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform[J]. Applied and Environmental Microbiology, 2013, 79(17): 5112-5120. DOI:10.1128/AEM.01043-13 |
| [28] |
González-García C, Forja J, González-Cabrera MC, et al. Annual variations of total and fractionated chlorophyll and phytoplankton groups in the Gulf of Cadiz[J]. Science of the Total Environment, 2018, 613-614: 1551-1565. DOI:10.1016/j.scitotenv.2017.08.292 |
| [29] |
Xue JZ, Xiao NY, Wang Q, et al. Seasonal variation of bacterial community diversity in Yangshan Port[J]. Acta Ecologica Sinica, 2016, 36(23): 7758-7767. (in Chinese) 薛俊增, 肖南燕, 王琼, 等. 洋山港海域细菌群落多样性的季节变化[J]. 生态学报, 2016, 36(23): 7758-7767. |
| [30] |
He YD, Sen B, Zhou SY, et al. Distinct seasonal patterns of bacterioplankton abundance and dominance of phyla α-Proteobacteria and Cyanobacteria in Qinhuangdao coastal waters of the Bohai Sea[J]. Frontiers in Microbiology, 2017, 8: 1579. DOI:10.3389/fmicb.2017.01579 |
| [31] |
Fu XH, Liu GN, He JL, et al. Analysis of microbial community diversity in the Bohai Sea marine protected areas of the Shandong Province[J]. Marine Sciences, 2017, 41(1): 39-47. (in Chinese) 付新华, 刘国宁, 何健龙, 等. 山东省渤海海洋保护区典型海域表层海水微生物群落多样性分析[J]. 海洋科学, 2017, 41(1): 39-47. |
| [32] |
Magurran AE. Measuring Biological Diversity[M]. Malden, MA: Blackwell Publication, 2004.
|
| [33] |
McGill BJ, Etienne RS, Gray JS, et al. Species abundance distributions: moving beyond single prediction theories to integration within an ecological framework[J]. Ecology Letters, 2007, 10(10): 995-1015. DOI:10.1111/ele.2007.10.issue-10 |
| [34] |
Yutin N, Suzuki MT, Teeling H, et al. Assessing diversity and biogeography of aerobic anoxygenic phototrophic bacteria in surface waters of the Atlantic and Pacific Oceans using the global ocean sampling expedition metagenomes[J]. Environmental Microbiology, 2007, 9(6): 1464-1475. DOI:10.1111/emi.2007.9.issue-6 |
| [35] |
Yan WJ. Summary of human activities on global nutrient export from watersheds to estuaries and coastal water: biogeochemical cycles and modeling[J]. Geographical Research, 2006, 25(5): 825-835. (in Chinese) 晏维金. 人类活动影响下营养盐向河口/近海的输出和模型研究[J]. 地理研究, 2006, 25(5): 825-835. DOI:10.3321/j.issn:1000-0585.2006.05.008 |
| [36] |
Liu J, Yu ZG, Zang JY, et al. Distribution and budget of organic carbon in the Bohai and Yellow Seas[J]. Advances in Earth Science, 2015, 30(5): 564-578. (in Chinese) 刘军, 于志刚, 藏家业, 等. 黄渤海有机碳的分布特征及收支评估研究[J]. 地球科学进展, 2015, 30(5): 564-578. |
| [37] |
Liu Q, Zhao BX, Li RW, et al. Bacterial community structure in different functional sea areas of Zhoushan archipelago[J]. Acta Microbiologica Sinica, 2018, 58(2): 247-263. (in Chinese) 刘强, 赵本宣, 李汝伟, 等. 舟山群岛不同功能区划海域细菌群落结构分析[J]. 微生物学报, 2018, 58(2): 247-263. |
| [38] |
Teeling H, Fuchs BM, Becher D, et al. Substrate-controlled succession of marine bacterioplankton populations induced by a phytoplankton bloom[J]. Science, 2012, 336(6081): 608-611. DOI:10.1126/science.1218344 |
| [39] |
Williams TJ, Wilkins D, Long E, et al. The role of planktonic Flavobacteria in processing algal organic matter in coastal East Antarctica revealed using metagenomics and metaproteomics[J]. Environmental Microbiology, 2013, 15(5): 1302-1317. DOI:10.1111/emi.2013.15.issue-5 |
 2018, Vol. 45
2018, Vol. 45




