扩展功能
文章信息
- 刘鹏远, 陈庆彩, 胡晓珂
- LIU Peng-Yuan, CHEN Qing-Cai, HU Xiao-Ke
- 渤海湾湾口表层沉积物中的核心细菌群落结构及其对环境因子的响应
- zuoStructure characteristics of core bacterial communities in surface sediments and analysis on their responses to environmental factors in the inlet of Bohai Bay
- 微生物学通报, 2018, 45(9): 1940-1955
- Microbiology China, 2018, 45(9): 1940-1955
- DOI: 10.13344/j.microbiol.china.180363
-
文章历史
- 收稿日期: 2018-05-08
- 接受日期: 2018-07-25
- 网络首发日期(www.cnki.net): 2018-07-30
2. 青岛海洋科学与技术试点国家实验室 海洋生物学与生物技术功能实验室 山东 青岛 266237;
3. 中国科学院大学 北京 100049
2. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao, Shandong 266237, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
渤海湾是中国渤海的三大海湾之一,是华北地区的海运枢纽和京津冀的海上门户。渤海湾地区人口稠密,周围被天津、秦皇岛、唐山、东营等工业发达的城市环绕,加上油田开采、近海养殖以及曹妃甸等工业区的发展给渤海湾地区带来了极大的生态压力。由于渤海湾是半封闭型内海,污染物自净能力受到严重限制,致使渤海湾目前已成为全国海洋环境受破坏较为严重的海域之一。海洋沉积物是微生物群落的优良居住场所之一,微生物在海洋中参与元素循环并在海洋环境能量流动与物质循环中扮演了重要的角色[1-3]。环境因子的改变直接或间接影响着沉积物中微生物群落多样性、生物量及群落结构[4-6],微生物群落结构的稳定是生态系统的重要组成及基本生态功能实现的保障[7],也是生态功能强弱及周围环境变化的敏感指示[8-12],某些微生物的种类和数量可直接影响群落功能的完整性。因此研究特定环境的微生物群落结构和功能对调控目标区域微生物功能、解释微生物与其生境的联系具有重大意义[13]。
目前研究者们对渤海湾的研究致力于沉积物性质[14-15]、重金属[16]和污染物[17-18]分布特征以及底栖动物群落特征[19]等,对渤海湾微生物群落特征的研究主要集中在潮间带及入海口流域[20-22]。渤海湾湾口是湾内与外海的连接纽带,北岸有外海高盐水的注入,南岸有黄河泥沙的大量涌入,两股水流在湾口中部交汇[23],因此湾口处沉积物性质、水文地貌特征、水动力条件、营养要素等自然条件复杂多变。但针对渤海湾湾口海域表层沉积物微生物群落的研究还相对匮乏,因此,本实验在渤海湾湾口区采集了21个站位的表层沉积物作为研究对象,通过高通量测序分析并结合相关环境因子,从地表径流和人为影响两个方面分析沉积物中的细菌群落组成,探讨海洋环境因素与沉积物微生物群落构成、分布与多样性的联系,进一步完善渤海沉积物中细菌群落结构的研究成果。
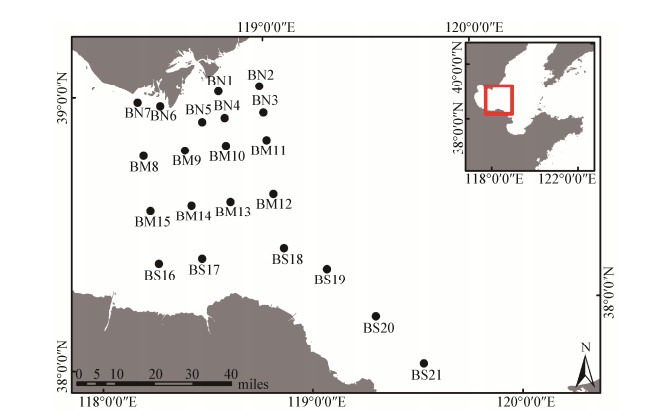
1 材料与方法 1.1 样品采集2013年10月采集了渤海湾湾口的21个站位(图 1),按照地理空间的分布大致将21个站位划分成3个小区域:渤海湾湾口北部7个站位(BN1、BN2、BN3、BN4、BN5、BN6、BN7);渤海湾湾口中部8个站位(BM8、BM9、BM10、BM11、BM12、BM13、BM14、BM15);渤海湾湾口南部6个站位(BS16、BS17、BS18、BS19、BS20、BS21)。沉积物由箱式采样器打捞,收集0−5 cm表层沉积物样品,混匀后用5 mL的冻存管分装并立即液氮速冻用于DNA的提取,另保存300–500 g样品在−20 ℃冰箱用于理化因子的测定。带回实验室的样品在冷冻干燥机中冷冻干燥72 h,研钵研磨,存于自封袋中避光保存备用。
|
| 图 1 渤海湾湾口站位图 Figure 1 Distribution of sampling sites in the inlet of Bohai Bay |
|
|
PowerSoilTM DNA Isolation Kit,Mo Bio公司;Phusion® High-Fidelity PCR Kit、Next® UltraTM DNA Library Prep Kit,New England Biolabs公司。紫外分光光度计,Thermo Scientific公司;Illumina HiSeq 2500测序仪,Illumina公司;冷冻干燥机,Christ公司;激光粒度仪,Malvern Instruments公司;元素分析仪,Elmentar公司;连续流动分析仪,Seal公司。
1.3 沉积物理化因子测定(1) 粒径检测:冷冻干燥后的样品过2 mm筛网去除大颗粒杂质,取出适量用激光粒度仪检测粒径的大小。
(2) 总碳氮检测:冷冻干燥后的沉积物样品过100目筛网后称取1 g于10 mL棕色瓶中,每个样品设置3个平行;向棕色瓶中加入1 mol/L的盐酸3 mL,功率300 W下超声作用1 h使其充分混匀,室温下放置1 h;用滴管吸出上清后再向棕色瓶中加1 mol/L的盐酸直至无气泡产生,超声1 h后室温放置24 h;用滴管吸出上清后加3 mL超纯水,混匀后置于60 ℃烘箱中烘干表层水,再重复加水烘干,直至上清液的pH呈中性为止;烘干样品并利用元素分析仪测定。
(3) 三态氮检测:样品经100目筛网过滤后称取2.5 g于50 mL的塑料瓶,加入2 mol/L的KCl溶液25 mL,振荡1 h浸提;用注射器吸取上清液,过0.45 μm滤膜至3个15 mL离心管中(每个样品设置3个平行)并用连续流动分析仪进行测定。
1.4 基因组DNA的提取、PCR扩增及高通量测序21个站位沉积物样品中的DNA提取采用的是PowerSoilTM DNA Isolation Kit,实验流程参照试剂盒说明书。DNA纯度和浓度的检测在紫外分光光度计上完成。采用Phusion® High-Fidelity PCR Kit来PCR扩增细菌16S rRNA基因的V3−V4高变区,引物使用了带6个碱基的Barcode的正向引物341F (5′-CCTACGGGNBGCASCAG-3′)和反向引物785R (5′-GACTACNVGGGTATCTAATCC-3′)[24]。PCR反应体系:2×Phusion® High-Fidelity PCR Master Mix with GC Buffer 15 μL,DNA模板100−200 ng,正、反向引物(10 μmol/L)各1 μL,用无菌双蒸水补齐到30 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 1 min,50 ℃ 1 min,72 ℃ 1 min,25个循环;72 ℃ 7 min;4 ℃保存。PCR产物经过电泳检测,胶回收得到PCR产物使用Next® Ultra™ DNA Library Prep Kit for Illumina建库试剂盒构建文库。双末端测序使用Illumina HiSeq 2500平台,测序工作在北京市计算中心生物计算事业部完成。
1.5 数据处理和多样性分析2 381 737条原始序列在QIIME (V.1.8.0)[25]和Mothur (V.1.36)[26]完成数据处理和分析。数据的质控经历了严格的标准,包括测序质量 > 20,引物没有错配,没有模糊碱基,同聚体 < 7等。数据库Greengene (V.13.5)和USEARCH V.61软件被用来去除嵌合体。基于生成的OTU表,利用Mothur分析样品的α多样性(包括Chao1、Shannon和Simpson指数等),β多样性利用Primer V6.0 (Primer-E Ltd.)计算出的Euclidean距离和加权Bray-Curtis距离,作NMDS图和样品聚类分析(Cluster)。
1.6 统计分析利用SPSS (V.16.0)统计软件进行Pearson相关性检验,以P < 0.05作为差异显著水平;群落结构与环境因子关系的分析使用了CANOCO 4.5及蒙特卡罗置换检验(Monte Carlo permutation test,permutation=999);环境因子间的相关性分析由R软件(V.3.1.3)完成。
2 结果与分析 2.1 多样性指数分析21个样品的数据经过一系列的严格质控,共获得了2 094 757条有效序列(表 1),并且在97%以上相似水平上划分出231 014个操作分类单元(Operational taxonomic units,OTUs)。覆盖度指数全部在98.58%−99.43%,说明测序结果可以较全面地反映调查区域环境微生物群落的真实情况。本文所有的原始序列已上传至NCBI数据库,获得的序列号为SRR7062257−SRR7062277。
| 样品 Samples |
有效数列数 Valid sequences number |
OTU数 OTUs number |
覆盖度 Coverage (%) |
Chao1 index | Shannon index | Simpson index |
| BN1 | 111 839 | 15 051 | 0.995 | 3 021.498 | 6.179 | 0.989 |
| BN2 | 125 892 | 15 077 | 0.997 | 3 008.172 | 6.385 | 0.993 |
| BN3 | 131 942 | 13 095 | 0.997 | 2 886.009 | 6.211 | 0.992 |
| BN4 | 96 550 | 12 732 | 0.996 | 3 010.410 | 6.387 | 0.993 |
| BN5 | 129 365 | 13 199 | 0.997 | 2 959.388 | 6.271 | 0.992 |
| BN6 | 124 310 | 11 934 | 0.996 | 2 875.796 | 5.986 | 0.990 |
| BN7 | 123 852 | 12 368 | 0.996 | 2 871.744 | 5.976 | 0.989 |
| BM8 | 58 397 | 5 805 | 0.988 | 1 857.659 | 5.234 | 0.979 |
| BM9 | 89 024 | 11 045 | 0.994 | 2 987.891 | 6.259 | 0.991 |
| BM10 | 74 915 | 11 273 | 0.992 | 2 934.017 | 6.444 | 0.995 |
| BM11 | 66 895 | 9 102 | 0.990 | 2 462.277 | 6.030 | 0.992 |
| BM12 | 41 685 | 6 288 | 0.986 | 2 185.645 | 5.866 | 0.990 |
| BM13 | 106 000 | 11 536 | 0.996 | 2 970.029 | 6.176 | 0.991 |
| BM14 | 87 754 | 9 479 | 0.994 | 2 850.593 | 6.138 | 0.989 |
| BM15 | 115 317 | 10 385 | 0.997 | 2 841.268 | 6.047 | 0.987 |
| BS16 | 118 329 | 10 328 | 0.996 | 2 728.175 | 5.964 | 0.988 |
| BS17 | 117 601 | 8 924 | 0.996 | 2 589.900 | 5.787 | 0.986 |
| BS18 | 83 622 | 9 800 | 0.994 | 2 793.421 | 6.061 | 0.989 |
| BS19 | 86 966 | 10 659 | 0.995 | 2 855.383 | 6.142 | 0.990 |
| BS20 | 110 943 | 12 174 | 0.996 | 2 833.793 | 6.134 | 0.989 |
| BS21 | 93 559 | 10 760 | 0.994 | 2 777.472 | 5.913 | 0.980 |
Chao1指数用来反映菌群丰富度,指数越大说明物种总数越多;Shannon和Simpson指数用来估算菌群多样性(Community diversity)。本实验Chao1指数的变化范围在3 021.5−1 857.7,指数最大的3个站位依次是BN1、BN4、BN2,所含物种数量最大;而指数最低的3个站位是BM8、BM12、BM11,群落丰富度低。Shannon指数和Simpson指数在BM10、BN4、BN2站位的值较高,表明该处微生物多样性较高,种群丰富并且分配均匀;而BM8、BS17、BM12站位的值较小,群落结构相对较为简单。3个指数反映的趋势一致,物种数量越多的区域群落结构越复杂、均一性越高。微生物多样性呈现渤海湾湾口北环及近岸处高和中部低的趋势。
2.2 细菌群落分析21个站位的原核微生物16S rRNA基因测序结果与Silva数据库作比对且注释分类,共得到23门55纲42科77种,其中7个门为主要核心类群,约占到总体的90.7%。渤海湾湾口南、中、北3个区域的物种组成差异显著(P=0.001)。
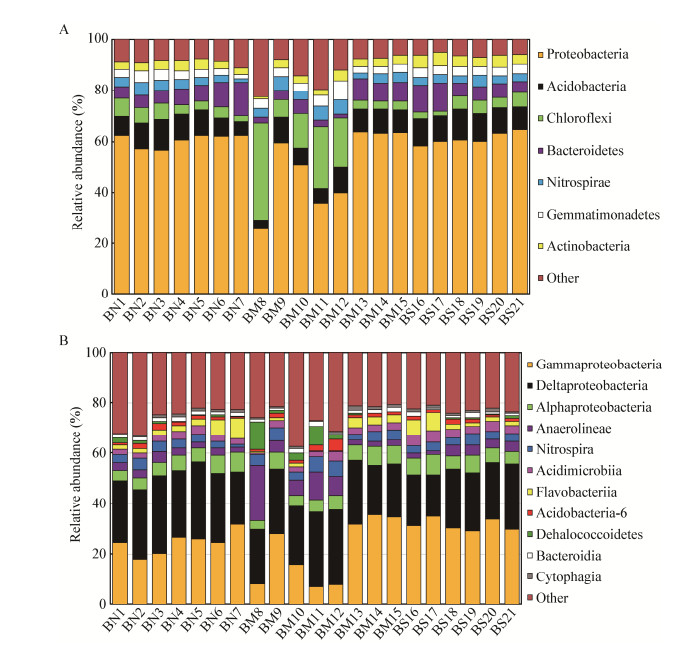
从门水平上看,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)是渤海湾湾口沉积物存在的主要核心细菌类群(图 2A);此外,拟杆菌门(Bacteroidetes)、硝化螺旋菌门(Nitrospirae)、芽单胞菌门(Gemmatimonadetes)、放线菌门(Actinobacteria)、泉古菌门(Crenarchaeota)在所有站位中也广泛分布。
|
| 图 2 海湾湾口沉积物细菌群落结构差异 Figure 2 Differences in bacterial community in sediments of Bohai Bay inlet 注:A:门水平上的群落组成;B:纲水平上的群落组成.丰度低于1%及无法准确匹配的物种归为Other. Note: A: Community composition base on phylum level; B: Community composition based on class level. Low relative abundance (< 1%) species were classified as Other. |
|
|
变形菌门的相对丰度高达56.8%,为所有站位的优势菌群(BM8优势菌门为绿弯菌门除外),相对丰度较高的3个站位依次为BS21 (64.6%)、BM13 (63.7%)、BM15 (63.4%),相对丰度较低的3个站位为BM8 (26.0%)、BM11 (35.95)、BM12 (39.9%),其空间分布特征为湾口中部比重显著低于南、北沿岸海域(P < 0.005;P < 0.005)。变形菌门中丰富度较高的纲,主要有γ-变形菌纲(Gammaproteobacteria)、δ-变形菌纲(Deltaproteobacteria)、α-变形菌纲(Alphaproteobacteria) (图 2B)。其中γ-变形菌纲相对丰度最高的3个站位是BM14 (35.6%)、BS17 (34.8%)、BM15 (34.7%),而最低的3个站位是BM11 (6.0%)、BM8 (6.2%)、BM12 (7.1%);δ-变形菌纲相对丰度最高的站位依次为BN2 (31.2%)、BN3 (30.9%)、BN5 (30.0%),丰度较低站位为BS17 (16.4%)、BM8 (16.7%)、BM14 (19.6%);α-变形菌纲相对丰度最高站位是BS17 (8.3%)、BN7 (8.2%)、BN6 (7.5%),相对丰度最低的站位为BM8 (2.7%)、BM11 (4.3%)、BN1 (4.3%)。
酸杆菌门占总丰度的8.9%,其中相对丰度较高的3个站位为BN3 (12.1%)、BS18 (12.1%)、BS16 (10.7%),相对丰度较低的3个站位是BM8 (3.3%)、BM11 (5.6%)、BM10 (7.0%),空间分布特征为渤海湾湾口南岸海域显著高于中部(P=0.04)。
渤海湾湾口中部绿弯菌门的相对丰度超过酸杆菌门,其中BM8站位绿弯菌门相对丰度(31.8%)甚至超过变形菌门(26.0%)成为该站位的优势菌,绿弯菌门相对丰度较高的3个站位依次为BM8 (38.1%)、BM11 (24.5%)、BM12 (19.4%),相对丰度较低的3个站位是BS17 (1.7%)、BN7 (2.2%)、BS16 (2.9%),空间分布特征为渤海湾湾口中部相对丰度显著高于南、北沿岸海区(P=0.04;P=0.04)。厌氧绳菌纲(Anaerolineae)是绿弯菌门中的重要组成,其相对丰度较高的站位为BM8 (16.9%)、BM11 (9.5%)、BM10 (6.9%),相对丰度较低的站位为BS17 (1.3%)、BN7 (1.8%)、BS16 (1.9%)。
除以上核心菌外,拟杆菌门空间分布特征为渤海湾湾口西部海域大于东部,在BN7站位比例最高,BM12站位比例最低,主要由黄杆菌纲(Flavobacteriia)组成。硝化螺旋菌门和芽单胞菌门的空间分布特征均与拟杆菌门相反,为渤海湾湾口东部海域相对丰度略高,并且比例都在BM12站位最高且BN7站位最低,在硝化螺旋菌门中含量最多的主要是硝化螺旋菌纲(Nitrospira)。放线菌门空间分布特征与变形菌门、酸杆菌门相似,最低丰度出现在渤海湾湾口中部区域,最高站位为BS17,最低站位为BM8,主要由酸微菌纲(Acidimicrobiia)组成。泉古菌门在渤海湾湾口中部相对丰度较高,在BM8站位高达21.4%,仅次于绿弯菌门,成为第二优势菌类;在渤海湾湾口西南部海域泉古菌门的相对丰度低至1%以下。
根据欧式距离(Euclidean distance)算法对物种进行非度量多维尺度分析(Non-metric multidi-mensional scaling,NMDS) (图 3),其胁强系数(Stress)为0.03表明该图可以较好地展现样品间群落结构的相似性程度。渤海湾湾口北部、中部与南部3个区域样品在二维的NMDS图上有较好的区分度和分布规律。根据站位聚类分析(图 4),发现渤海湾湾口北、中、南部海域沉积物样品与其他站位相比有明显区别,渤海湾湾口中部站位BM8、BM10、BM11、BM12相似性更大,结合渤海湾湾口沉积物主要细菌类型的相对丰度比较(表 2)得知,渤海湾湾口南、北海域细菌群落结构及相对丰度较为相似,只在δ-变形菌纲、放线菌门的相对丰度上有显著差异;而南北沿岸与中部海域比较有显著差异的类群较多,包括:γ-变形菌纲、厌氧绳菌纲、Dehalococcoidetes、纤维粘网菌纲(Cytophagia),其在中部海域中厌氧绳菌纲、Dehalococcoidetes菌显著增多,并且γ-变形菌纲、纤维粘网菌纲数量显著减少。

|
| 图 3 基于欧式距离的细菌群落非度量多维尺度排序 Figure 3 NMDS ordination based on Euclidean similarities of bacterial community structure 注:虚线指示渤海湾湾口北、中、南部区域的划分. Note: Dashed lines indicate the northern, middle and southern of Bohai Bay inlet. |
|
|

|
| 图 4 基于Bray-Curtis距离的站位聚类图 Figure 4 Plots of station cluster scaling based on Bray-Curtis distance |
|
|
| Taxonomy | 北沿岸 BN |
南沿岸 BS |
沿岸 BN+BS |
中部 BM |
BN vs. BM |
BN vs. BS |
BM vs. BS |
BN+BS vs. BM |
| Proteobacteria | 60.59±0.97 | 61.19±0.93 | 60.87±0.65 | 50.30±5.20 | 0.05* | 0.91 | 0.05* | < 0.01** |
| Gammaproteobacteria | 25.51±1.67 | 31.47±0.93 | 28.26±1.28 | 20.84±4.63 | 0.31 | 0.23 | 0.04* | < 0.01** |
| Deltaproteobacteria | 28.12±1.32 | 21.93±1.35 | 25.26±1.27 | 23.33±1.33 | 0.02* | 0.01** | 0.47 | 0.47 |
| Alphaproteobacteria | 6.00±0.52 | 6.21±0.52 | 6.10±0.36 | 5.52±0.55 | 0.53 | 0.79 | 0.38 | 0.61 |
| Acidobacteria | 8.86±0.87 | 10.40±0.44 | 9.57±0.54 | 7.92±0.85 | 0.39 | 0.20 | 0.04* | 0.36 |
| Acidobacteria-6 | 1.48±0.27 | 1.36±0.11 | 1.43±0.15 | 1.70±0.38 | 0.60 | 0.78 | 0.44 | 0.24 |
| Chloroflexi | 4.79±0.69 | 4.05±0.68 | 4.45±0.48 | 13.94±4.48 | 0.04* | 0.87 | 0.04* | < 0.01** |
| Anaerolineae | 3.07±0.34 | 3.21±0.53 | 3.13±0.29 | 6.44±1.78 | 0.06 | 0.94 | 0.08 | 0.01** |
| Dehalococcoidetes | 0.97±0.29 | 0.38±0.17 | 0.70±0.19 | 2.71±1.11 | 0.11 | 0.61 | 0.05* | < 0.01** |
| Bacteroidetes | 7.07±1.21 | 7.00±1.25 | 7.04±0.83 | 4.85±0.96 | 0.17 | 0.97 | 0.20 | 0.76 |
| Flavobacteriia | 3.56±0.98 | 3.34±1.02 | 3.46±0.68 | 1.74±0.53 | 0.13 | 0.86 | 0.20 | 0.06 |
| Bacteroidia | 1.36±0.07 | 1.21±0.24 | 1.29±0.11 | 1.29±0.16 | 0.76 | 0.53 | 0.73 | 0.61 |
| Cytophagia | 1.03±0.07 | 0.95±0.09 | 1.00±0.06 | 0.84±0.15 | 0.24 | 0.64 | 0.51 | 0.01** |
| Nitrospirae | 3.42±0.45 | 3.37±0.22 | 4.16±0.39 | 3.40±0.25 | 0.17 | 0.93 | 0.17 | 0.31 |
| Nitrospira | 3.42±0.45 | 3.37±0.22 | 4.16±0.39 | 3.40±0.25 | 0.17 | 0.93 | 0.17 | 0.31 |
| Gemmatimonadetes | 3.27±0.33 | 3.60±0.06 | 3.42±0.18 | 3.86±0.55 | 0.31 | 0.60 | 0.66 | 0.10 |
| Actinobacteria | 3.31±0.22 | 4.22±0.28 | 3.73±0.21 | 2.84±0.35 | 0.27 | 0.05* | 0.01** | 0.83 |
| Acidimicrobiia | 2.73±0.18 | 3.79±0.28 | 3.22±0.22 | 2.35±0.34 | 0.33 | 0.02* | < 0.01** | 0.74 |
| 注:*:差异显著(P≤0.05);** :差异极显著(P≤0.01). Note: *: Significance at 0.05 level; ** : Significance at 0.01 level. |
||||||||
剩余各细菌类群在21个不同站位所占的OTU比例均很少,仅个别细菌类群空间分布上存在特异性。例如螺旋体门(Spirochaetes)只在渤海湾湾口中部数量较多,而其他站位比例均在1%以下;蓝藻细菌(Cyanobacteria)只在BN6与BN7站位中比例高于1%;浮霉菌门(Planctomycetes)只在BM8站位中未发现;迷踪菌门(Elusimicrobia)只发现于BM8站位等。
2.3 渤海湾湾口沉积物理化因子渤海湾湾口南、中、北海域表层沉积物环境因子差异极显著(P=0.001),中部海域与南部和北部均显著不同(P=0.002;P=0.01)。
沉积物粒径整体上呈现渤海湾湾口南北区域粒径偏大,而中部海域黏土含量居多(表 3)。BS21、BS20、BS19、BS18、BS17、BS16、BN5、BN4、BN3、BN2、BN1、BN6、BN7站位离河流入海口较近,黄河、滦河在入海过程中携带了大量的泥沙,使得北部沙粒粒径(P < 0.05)显著大于中部,其中北部站位以粗砂为主要特征,南部站位多为细砂粒和粉砂,中部海域站位小粒径颗粒极显著于南北环黏土数目(P < 0.01)。
| 样品 Samples |
粒径 Particle size (%) |
深度 Depth (m) |
温度 Temperature (℃) |
有机碳 TOC (%) |
有机氮 TON (%) |
无机氮 Inorganic nitrogen |
||||
| 黏土Clay (< 4 μm) |
粉砂Silt (4−63 μm) |
沙粒Sand (> 63 μm) |
NH4+ (mg/L) |
NO2− (μg/L) |
NO3− (mg/L) |
|||||
| BN1 | 19.84 | 72.29 | 7.87 | 29.00 | 8.16 | 0.73 | 0.07 | 0.74 | 6.70 | 0.10 |
| BN2 | 8.38 | 31.00 | 60.62 | 23.00 | 8.21 | 0.18 | 0.02 | 0.09 | 6.73 | 0.11 |
| BN3 | 13.41 | 47.21 | 39.39 | 28.00 | 8.22 | 0.36 | 0.03 | 0.07 | 6.77 | 0.10 |
| BN4 | 14.01 | 48.16 | 37.83 | 31.00 | 8.20 | 0.47 | 0.03 | 0.08 | 7.10 | 0.13 |
| BN5 | 21.80 | 68.31 | 9.89 | 33.80 | 8.18 | 0.85 | 0.04 | 0.27 | 7.40 | 0.10 |
| BN6 | 19.83 | 68.14 | 12.03 | 22.60 | 8.08 | 0.74 | 0.07 | 4.09 | 7.90 | 0.12 |
| BN7 | 17.97 | 71.51 | 10.52 | 11.800 | 8.19 | 0.93 | 0.08 | 0.64 | 7.07 | 0.09 |
| BM8 | 29.52 | 70.19 | 0.28 | 25.00 | 8.29 | 1.34 | 0.07 | 0.46 | 7.27 | 0.15 |
| BM9 | 23.70 | 75.79 | 0.52 | 26.00 | 8.27 | 1.27 | 0.06 | 0.40 | 7.20 | 0.12 |
| BM10 | 26.17 | 71.39 | 2.45 | 25.50 | 8.25 | 1.03 | 0.06 | 0.36 | 7.07 | 0.14 |
| BM11 | 23.25 | 76.55 | 0.21 | 27.00 | 8.26 | 1.02 | 0.06 | 0.28 | 6.83 | 0.09 |
| BM12 | 21.23 | 78.26 | 0.51 | 23.80 | 8.19 | 1.08 | 0.06 | 0.18 | 7.47 | 0.10 |
| BM13 | 16.92 | 75.57 | 7.51 | 21.50 | 8.27 | 1.19 | 0.07 | 0.35 | 7.23 | 0.11 |
| BM14 | 20.09 | 78.99 | 0.92 | 30.00 | 8.46 | 1.32 | 0.07 | 0.28 | 8.27 | 0.14 |
| BM15 | 18.08 | 80.84 | 1.09 | 16.00 | 8.21 | 1.26 | 0.05 | 0.36 | 7.33 | 0.16 |
| BS16 | 10.98 | 71.14 | 17.88 | / | / | 0.86 | 0.03 | 0.29 | 8.10 | 0.21 |
| BS17 | 6.82 | 38.50 | 54.69 | 16.00 | 8.15 | 0.86 | 0.03 | 0.51 | 6.67 | 0.17 |
| BS18 | 16.67 | 81.70 | 1.63 | 20.60 | 8.08 | 1.33 | 0.05 | 0.58 | 6.60 | 0.15 |
| BS19 | 16.99 | 77.74 | 5.27 | 19.50 | 8.11 | 1.03 | 0.04 | 1.22 | 70.00 | 0.13 |
| BS20 | 12.65 | 72.84 | 14.51 | 17.50 | 8.18 | 0.84 | 0.03 | 0.31 | 7.37 | 0.11 |
| BS21 | 15.22 | 70.38 | 14.40 | / | 8.24 | 1.02 | 0.04 | 0.26 | 7.55 | 0.10 |
| 注:/:数据缺失.
Note: /: Missing data. |
||||||||||
渤海湾湾口北部TOC含量(图 5A)显著低于中南区域(P < 0.01),最高的站位主要集中在BM8 (1.34)、BS18 (1.33)、BM14 (1.32)、BM9 (1.27)、BM15 (1.26)处,分别位于渤海湾湾口中、南海域及黄河入海口处,并呈辐射状降低,在北部BN2 (0.18)、BN3 (0.36)、BN1 (0.73)的含量达到最少。

|
| 图 5 环境因子等值线分布趋势图 Figure 5 Distribution trend of environmental factors 注:A:有机碳;B:有机氮;C:亚硝态氮;D:硝态氮;E:氨态氮. Note: A: TOC; B: TON; C: NO2−; D: NO3−; E: NH4+. |
|
|
本实验中TON含量(图 5B)最高的点主要在BM7 (0.08)站位,其次为BN8 (0.07)、BN6 (0.07)站位,其他站位含量较少,即渤海湾湾口TON含量的分布特征在西北部区域出现高值。研究表明TON是海洋沉积物中氮的主要存在形式(约占62%)[27],而沉积物中的无机氮分为NO2−、NO3−、NH4+。由图 5C−E可以看出NO2− (6.60−8.27 μg/L)含量整体较少,仅有BM14 (8.27)、BS16 (8.10)这2个站位的含量稍高;NO3− (0.09−0.21 mg/L)的含量在BS16站位附近含量较高,并呈放射状降低趋势;NH4+ (0.07−4.09 mg/L)的含量在渤海湾湾口入海口处的含量多于其他站位。因此渤海湾湾口沉积物各种形态氮元素含量呈现出近岸高于远岸,说明了陆源输入对海洋沉积物中氮元素含量及分布起着关键作用。
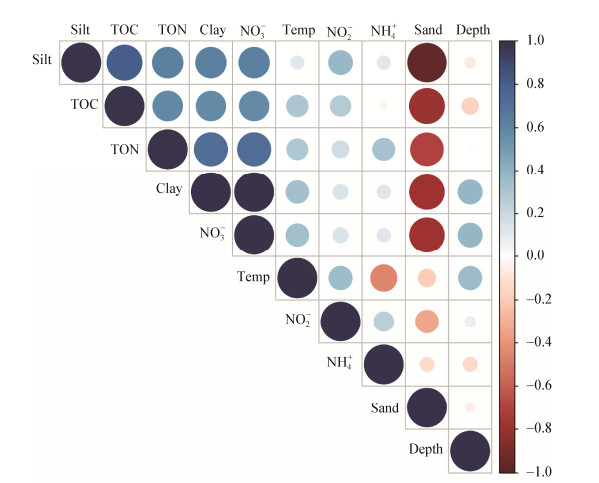
海洋环境中部分理化因子之间的变化具有一定的规律性和相关关系,这与海水中生物的活动密切相关[28]。调查区域内TOC与黏土、粉砂、沙粒的相关系数分别为0.57、0.80、−0.80且相关性极显著(P < 0.01)。TON与黏土、NO3−、沙粒的相关系数分别为0.73、0.61、−0.71,并且显著相关(P < 0.01)。TOC和TON的含量与沉积物的黏土、粉砂呈正相关,而与沙粒呈负相关,这与先前的报道结果一致[29],TOC和TON之间也显示出了显著的正相关性(P < 0.01),其相关系数为0.58。NO3−与TON的规律相似,与黏土、粉砂、沙粒的相关系数分别为1.00、0.61、−0.79,其相关性都为极显著(P < 0.01);NO3−与TOC、TON的相关系数分别为0.57 (P < 0.01)和0.73 (P < 0.01) (图 6)。
|
| 图 6 环境因子的相关性分析图 Figure 6 Correlation analysis of environmental factors |
|
|
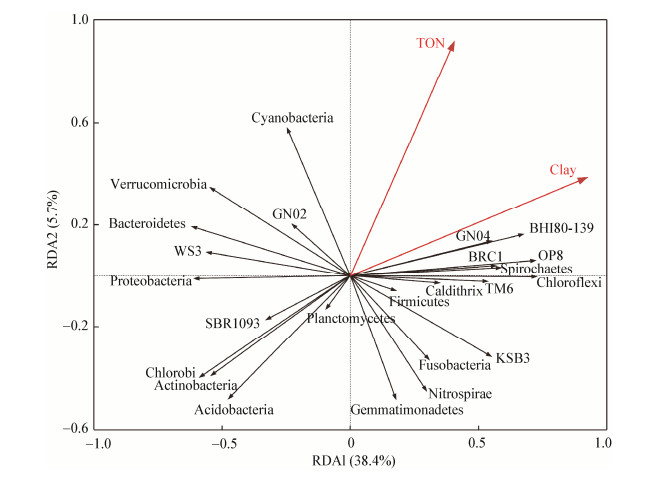
在门分类水平上对OTU相对丰度作降趋势对应分析(Detrended correspondence analysis,DCA),最大长度为1.12,因此选用了冗余性分析(Redundancy analysis,RDA)来探究菌群分布与环境因子之间的关系(图 7)。发现黏土、TON两个环境因子与细菌群落结构的相关关系显著(P < 0.05),而其他环境因素的影响作用较小。
|
| 图 7 门水平上的冗余性分析 Figure 7 Redundancy analysis based on phylum level |
|
|
绿弯菌门(Chloroflexi)、OP8、螺旋体门(Spirochaetes)、GN04、梭杆菌门(Fusobacteria)在渤海湾湾口中部的丰度相对较高,而且都与黏土含量呈正相关;变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、绿菌门(Chlorobi)在渤海湾湾口的空间分布特征为南北近岸海域相对丰度高于中部海域,而且都与黏土含量呈负相关。与TON含量呈负相关的微生物有酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿菌门(Chlorobi)。
3 讨论与结论 3.1 微生物群落多样性和时空分布差异近海沉积物中细菌群落是海洋生态系统变化的灵敏指示计,而近年来由于受人为因素影响导致渤海环境恶化严重,引起了许多学者对黄渤海流域的关注和研究。刘欣等[30]对胶州湾沉积物微生物进行了研究,发现胶州湾细菌含有14个门类,优势菌群为变形菌门的γ-和δ-变形菌纲,其次为拟杆菌门、浮霉菌门和放线菌门。姜会超等[31]发现莱州湾沉积物中优势类群为变形菌门中的α-和γ-变形菌纲,其次为酸杆菌门、疣微菌门和浮霉菌门。白洁等[32]对黄海西北部沉积物中细菌群落多样性的研究同样表明γ-和δ-变形菌纲为主要优势类群。本实验在渤海湾湾口沉积物中共发现23个细菌门类,优势菌为变形菌门的γ-、δ-和α-变形菌纲,表明渤海湾湾口的细菌多样性与近海沉积物细菌多样性的总体规律一致[33],并且微生物多样性高于渤海的其他海域。
γ-变形菌广泛分布于海洋环境中,参与有机物的降解与硫氧化过程,在厌氧条件下参与厌氧氨氧化作用[34];δ-变形菌在海洋中的功能多与硫酸盐相关;α-变形菌纲参与海洋中二甲基硫的转化,因此推测硫的生物地球化学循环对于渤海湾生态稳定具有关键作用。变形菌门中的β-和ε-变形菌纲在渤海湾湾口的所有站位里相对丰度都较低,β-变形菌是一类好氧和兼性厌氧类细菌,多出现在河口等淡水或半咸水环境,因此相比其他站位距离河口较近的BN6、BN7中的β-变形菌相对丰度较高;而ε-变形菌纲多存在于人类与动物的消化道中,BS21站位临近黄河旅游生态景区,港口区域内人类活动明显,因此ε-变形菌纲数量较高。
此外酸杆菌门、绿弯菌门、拟杆菌门、芽孢单菌门、硝化螺旋菌门等在渤海湾湾口各站位均有分布且站位间差异较大,揭示了环境对微生物的选择性,微生物多样性存在着空间分布差异。酸杆菌门多存在于重金属污染或酸性较强的环境[35],而本实验中酸杆菌门的平均相对丰度达到8.9%,并且南北沿岸海域高于中部,暗示渤海湾湾口沿岸海域陆源污染情况不可忽视。绿弯菌门中含量较多的主要是厌氧绳菌纲,属于兼性厌氧细菌,并在产甲烷生态系统中降解碳水化合物和其他细胞材料如氨基酸等[36]。实验发现拟杆菌门的成员主要为黄杆菌纲,多为严格好氧的化能异样细菌类群,能够降解生物大分子如纤维素、几丁质、DNA和琼脂,它们与浮游植物初级生产力(光合作用)高度相关,并且是海洋有机物矿化的主力军,在水生生态系统中具有重要的生态意义。而渤海湾湾口沿岸有机物含量高,沉积物表层的底栖动物扰动及海流能动提供了充足氧气,这些都促进了黄杆菌的增殖[37]。硝化螺旋菌可以将亚硝酸盐氧化成硝酸盐对水生植物非常重要,由于受到黄河、海河及滦河带入的大量污染物影响及沿岸重工业造成的环境破环,沉积物形成了不利于硝化螺旋菌生存的缺氧环境,造成渤海湾湾口近岸硝化螺旋菌数量的减少。
实验发现渤海湾湾口中部站位的菌群组成明显区别于沿岸站位,在中部海域厌氧绳菌纲、Dehalococcoidetes菌显著增多,同时γ-变形菌纲、纤维粘网菌纲数量显著减少,可能是近岸的污染未能波及中部海域,营养结构相对近岸较为贫瘠。而渤海湾湾口沿岸由于工业发展、近海养殖、旅游业兴起及城市生活污水的排放导致有机物质含量升高,为多数微生物提供了充足养料,造成近岸微生物多样性高于中部海域,但同时也不能排除样品采集处理、测序的偏好性等因素所引入的误差。
3.2 环境因子分布特征黄河每年平均携带约1.1×109 t泥沙进入海洋[38],沙粒在河流、海流的搬运和冲刷作用下向周围环境扩散并破碎成小的颗粒,在适宜的条件下沉积于海底,所以在深海处小粒径黏土含量显著,而入海口及近岸区多为河流冲刷下来粒径较大的沙粒。
黄河入海不仅携带大量的泥沙,还将有机物一起汇入渤海湾,因此黄河入海口处的TOC含量最高,并向周围呈梯度减少。而渤海西部临近重工业基地,半封闭型海湾结构导致水质循环对流相对较差,也会使有机质积累、含量增高。
由于BN6和BN7站位距离曹妃甸工业区较近,滦河和海河陆源输入携带了大量TON进入渤海[39],所以TON含量在渤海湾湾口西北部出现最高值。在浮游动物、植物及细菌的共同作用下海洋氮循环中的NO2−、NO3−和NH4+会进行相互转换,并且当达到平衡时主要以NO3−的形式存在。实验选取站位中NO3−的浓度相对较高并在黄河入海口处出现高峰,表明湾内无机氮浓度变化主要受陆源性因素的影响,并且渤海湾湾口地区氮的转化达到平衡。
统计分析发现沉积物粒径与多种环境因子相关,TOC、TON、黏土和粉沙的含量有明显的正相关性,而与沙粒含量有明显的负相关性。沉积物颗粒越小,其表面积越大,越能吸附糖类、蛋白质与氨基酸等物质,并且粒径间彼此紧密结合不宜被外力破环;而粒度较大的颗粒与有机物结合后,在水流搬运的过程中与周围颗粒摩擦脱落,不利于有机质的保存。
3.3 群落结构对环境因子的响应研究表明特定的环境更适合特定的菌群生存,环境相似的条件下菌群结构也较为相似[40]。有学者对油田周围海域的研究表明苯系物及总碳含量是研究区域表层沉积物中微生物群落结构的驱动者[41];Zheng等[22]在潮间带的研究表明沉积物的粒径和溶解氧是主要的环境驱动者;而温度更被认为是重要的环境驱动者[42-43];李友训[44]对胶州湾微生物与环境因子相关性分析也发现不同环境因子对细菌具有选择作用,并影响着胶州湾微生物群落结构的空间分布。
通过相关性分析,我们发现渤海湾湾口沉积物黏土与TON含量对细菌具有显著驱动性。原因是沉积物粒径越小越有利于有机物质的保存与运输,从而影响微生物营养物质的来源与摄取。
渤海湾北部站位临近曹妃甸工业区,工业废水入海可能是TON含量在此处出现最高值的重要原因之一。之前的研究表明氮含量的增高会降低某些细菌的相对丰度,例如Fierer等[45]研究发现随着施氮量的增加,农田里植被种类急剧减少的同时,酸杆菌门的相对丰度降低;Ramirez等[46]发现氮量的增加会降低酸杆菌门和疣微菌门(Firmicute)的数量。本实验发现TON含量增高会导致酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、绿菌门(Chlorobi)数量的降低。
实验发现渤海湾湾口沉积物中微生物多样性较高的区域分别为黄河口及滦河口,并以这2个区域为中心向外逐步降低,这与刘欣等[27]在胶州湾的研究显示近岸及湾口处沉积物中的细菌多样性要低于中部海域的结论相反。这些研究结果表明地表径流对渤海湾湾口沉积物中微生物群落结构起着不可忽视的调控作用:河水径流及河口沿岸排污,使得水体中携带大量有机物质利于微生物附着生长,加之河口流域海水盐度低等因素均利于微生物的生长繁衍;另外,渤海湾与莱州湾生态环境、采样时间及温度等多方面原因都可能引起渤海湾湾口与胶州湾沉积物的细菌多样性差异。
3.4 结论对渤海湾湾口21个站位表层沉积物群落结构及环境因子的分析得到以下结论:(1)渤海湾21个站位的主要细菌类群包括:变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes)。变形菌门中主要包括γ-变形菌纲、δ-变形菌纲、α-变形菌纲,并且γ-变形菌纲是优势菌群。(2)研究区域中环境因子分布特征为:TOC和TON浓度分布呈入海口及沿岸较高,并向周围逐渐降低的趋势,低值位于海湾中部深水区域。(3) TOC、TON和NO3−含量与沉积物黏土、粉沙含量有明显的正相关性,与沙粒含量呈负相关性,并且TOC和TON之间呈显著的正相关。(4)本研究发现沉积物的黏土特性和TON可能是影响渤海湾湾口沉积物细菌群落结构的主要驱动因子。
| [1] |
Reysenbach AL, Gotz D, Yernool D. Microbial diversity of marine and terrestrial thermal springs[A]//Staley JT, Reysenbach AL. Biodiversity of Microbial Life[M]. New York: Wiley Liss, 2002: 345-421
|
| [2] |
O'Sullivan LA, Weightman AJ, Fry JC. New degenerate Cytophaga-Flexibacter-Bacteroides-specific 16S ribosomal DNA-targeted oligonucleotide probes reveal high bacterial diversity in River Taff epilithon[J]. Applied and Environmental Microbiology, 2002, 68(1): 201-210. DOI:10.1128/AEM.68.1.201-210.2002 |
| [3] |
Catania V, Santisi S, Signa G, et al. Intrinsic bioremediation potential of a chronically polluted marine coastal area[J]. Marine Pollution Bulletin, 2015, 99(1/2): 138-149. |
| [4] |
Smit E, Leeflang P, Wernars K. Detection of shifts in microbial community structure and diversity in soil caused by copper contamination using amplified ribosomal DNA restriction analysis[J]. FEMS Microbiology Ecology, 1997, 23(3): 249-261. DOI:10.1111/j.1574-6941.1997.tb00407.x |
| [5] |
Kandeler F, Kampichler C, Horak O. Influence of heavy metals on the functional diversity of soil microbial communities[J]. Biology and Fertility of Soils, 1996, 23(3): 299-306. DOI:10.1007/BF00335958 |
| [6] |
Kozdrój J, Van Elsas JD. Structural diversity of microbial communities in arable soils of a heavily industrialised area determined by PCR-DGGE fingerprinting and FAME profiling[J]. Applied Soil Ecology, 2001, 17(1): 31-42. DOI:10.1016/S0929-1393(00)00130-X |
| [7] |
Kim TY, Park SK, Cho SY, et al. Adsorption of heavy metals by brewery biomass[J]. Korean Journal of Chemical Engineering, 2005, 22(1): 91-98. DOI:10.1007/BF02701468 |
| [8] |
Sun MY, Dafforn KA, Brown MV, et al. Bacterial communities are sensitive indicators of contaminant stress[J]. Marine Pollution Bulletin, 2012, 64(5): 1029-1038. DOI:10.1016/j.marpolbul.2012.01.035 |
| [9] |
Ford T, Sorci J, Ika R, et al. Interactions between metals and microbial communities in New Bedford Harbor, Massachusetts[J]. Environmental Health Perspectives, 1998, 106(suppl 4): 1033-1039. DOI:10.1289/ehp.98106s41033 |
| [10] |
Powell SM, Bowman JP, Snape I, et al. Microbial community variation in pristine and polluted nearshore Antarctic sediments[J]. FEMS Microbiology Ecology, 2003, 45(2): 135-145. DOI:10.1016/S0168-6496(03)00135-1 |
| [11] |
LaMontagne MG, Leifer I, Bergmann S, et al. Bacterial diversity in marine hydrocarbon seep sediments[J]. Environmental Microbiology, 2004, 6(8): 799-808. DOI:10.1111/emi.2004.6.issue-8 |
| [12] |
Yakimov MM, Denaro R, Genovese M, et al. Natural microbial diversity in superficial sediments of Milazzo Harbor (Sicily) and community successions during microcosm enrichment with various hydrocarbons[J]. Environmental Microbiology, 2005, 7(9): 1426-1441. DOI:10.1111/emi.2005.7.issue-9 |
| [13] |
Che YL, Wang H, Hu HY, et al. Research progresses on analytical technologies used in microbial community structure and diversity[J]. Ecology and Environment, 2005, 14(1): 127-133. (in Chinese) 车玉伶, 王慧, 胡洪营, 等. 微生物群落结构和多样性解析技术研究进展[J]. 生态环境, 2005, 14(1): 127-133. DOI:10.3969/j.issn.1674-5906.2005.01.027 |
| [14] |
Meng W, Lei K, Zheng BH, et al. Modern sedimentation rates in the intertidal zone on the west coast of the Bohai Gulf[J]. Acta Oceanologica Sinica, 2005, 24(3): 46-53. |
| [15] |
Lei K, Meng W, Zheng BH, et al. Grain size distributions of sediments in the intertidal zone on the west coast of the Bohai Bay[J]. Marine Science Bulletin, 2006, 25(1): 54-61. (in Chinese) 雷坤, 孟伟, 郑丙辉, 等. 渤海湾西岸潮间带沉积物粒度分布特征[J]. 海洋通报, 2006, 25(1): 54-61. DOI:10.3969/j.issn.1001-6392.2006.01.008 |
| [16] |
Xu YY, Song JM, Li XG, et al. Variation characteristics and potential ecological risk assessment of heavy metals in the surface sediments of Bohai Bay[J]. Environmental Science, 2012, 33(3): 732-740. (in Chinese) 徐亚岩, 宋金明, 李学刚, 等. 渤海湾表层沉积物各形态重金属的分布特征与生态风险评价[J]. 环境科学, 2012, 33(3): 732-740. |
| [17] |
Zhang P, Song JM, Yuan HM. Persistent organic pollutant residues in the sediments and mollusks from the Bohai Sea coastal areas, North China: an overview[J]. Environment International, 2009, 35(3): 632-646. DOI:10.1016/j.envint.2008.09.014 |
| [18] |
Ma M, Feng Z, Guan C, et al. DDT, PAH and PCB in sediments from the intertidal zone of the Bohai Sea and the Yellow Sea[J]. Marine Pollution Bulletin, 2001, 42(2): 132-136. DOI:10.1016/S0025-326X(00)00118-1 |
| [19] |
Wang Y, Liu LS, Liu CQ, et al. Community structure characteristics of macrobenthos in the coastal seawaters of Bohai Bay in spring[J]. Research of Environmental Sciences, 2010, 23(4): 430-436. (in Chinese) 王瑜, 刘录三, 刘存歧, 等. 渤海湾近岸海域春季大型底栖动物群落特征[J]. 环境科学研究, 2010, 23(4): 430-436. |
| [20] |
Xiao H, Tang XX, Qiao XD, et al. The abundance of benthic bacteria in Tianjin nearshore waters in the Bohai Bay and its correlation with environmental factors[J]. Periodical of Ocean University of China, 2010, 40(6): 87-90, 160. (in Chinese) 肖慧, 唐学玺, 乔旭东, 等. 渤海湾天津近岸表层沉积物中细菌丰度及其与环境因子的相关性研究[J]. 中国海洋大学学报, 2010, 40(6): 87-90, 160. |
| [21] |
Wang LP, Liu LS, Zheng BH, et al. Analysis of the bacterial community in the two typical intertidal sediments of Bohai Bay, China by pyrosequencing[J]. Marine Pollution Bulletin, 2013, 72(1): 181-187. DOI:10.1016/j.marpolbul.2013.04.005 |
| [22] |
Zheng BH, Wang LP, Liu LS. Bacterial community structure and its regulating factors in the intertidal sediment along the Liaodong Bay of Bohai Sea, China[J]. Microbiological Research, 2014, 169(7/8): 585-592. |
| [23] |
Zhao BR, Zhuang GW, Cao DM, et al. Circulation, tidal residual currents and their effects on the sedimentations in the Bohai Sea[J]. Oceanologia et Limnologia Sinica, 1995, 26(5): 466-473. (in Chinese) 赵保仁, 庄国文, 曹德明, 等. 渤海的环流、潮余流及其对沉积物分布的影响[J]. 海洋与湖沼, 1995, 26(5): 466-473. DOI:10.3321/j.issn:0029-814X.1995.05.003 |
| [24] |
Naylor D, DeGraaf S, Purdom E, et al. Drought and host selection influence bacterial community dynamics in the grass root microbiome[J]. The ISME Journal, 2017, 11(12): 2691-2704. DOI:10.1038/ismej.2017.118 |
| [25] |
Caporaso JG, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [26] |
Schloss PD, Westcott SL, Ryabin T, et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities[J]. Applied and Environmental Microbiology, 2009, 75(23): 7537-7541. DOI:10.1128/AEM.01541-09 |
| [27] |
Kan WJ, Zhang QF, Shi HM, et al. Study on variation trend of nutrient salts in Bohai Bay[J]. Marine Environmental Science, 2010, 29(2): 238-241. (in Chinese) 阚文静, 张秋丰, 石海明, 等. 近年来渤海湾营养盐变化趋势研究[J]. 海洋环境科学, 2010, 29(2): 238-241. DOI:10.3969/j.issn.1007-6336.2010.02.017 |
| [28] |
Song JM, Ma HB, Lü XX, et al. Biogeochemical functions of nitrogen in Bohai sediments[J]. Studia Marina Sinica, 2003(1): 86-100. (in Chinese) 宋金明, 马红波, 吕晓霞, 等. 渤海沉积物氮的生物地球化学功能[J]. 海洋科学集刊, 2003(1): 86-100. |
| [29] |
Wang RM, Tang JH, Huang GP, et al. Provenance of organic matter in estuarine and marine surface sediments around the Bohai Sea[J]. Oceanologia et Limnologia Sinica, 2015, 46(3): 497-507. (in Chinese) 王润梅, 唐建辉, 黄国培, 等. 环渤海地区河流河口及海洋表层沉积物有机质特征和来源[J]. 海洋与湖沼, 2015, 46(3): 497-507. |
| [30] |
Liu X, Xiao T, Zhang WY, et al. Diversity of bacterial community in sediments of Jiaozhou Bay[J]. Marine Sciences, 2010, 34(10): 1-6, 27. (in Chinese) 刘欣, 肖天, 张文燕, 等. 胶州湾海域表层沉积物细菌多样性[J]. 海洋科学, 2010, 34(10): 1-6, 27. |
| [31] |
Jiang HC, Liu AY, Ren LH, et al. PCR-RFLP Analysis of Bacteria 16S rDNA in Laizhou Bay[J]. Transactions of Oceanology and Limnology, 2014(3): 127-134. (in Chinese) 姜会超, 刘爱英, 任利华, 等. 莱州湾海域海水和沉积物中的细菌多样性分析[J]. 海洋湖沼通报, 2014(3): 127-134. |
| [32] |
Bai J, Li HY, Zhang J, et al. Diversity of bacterial community in the sediments of the Northern Yellow Sea[J]. China Environmental Science, 2009, 29(12): 1277-1284. (in Chinese) 白洁, 李海艳, 张健, 等. 黄海西北部沉积物中细菌群落16S rDNA多样性解析[J]. 中国环境科学, 2009, 29(12): 1277-1284. DOI:10.3321/j.issn:1000-6923.2009.12.009 |
| [33] |
Li L, Kato C, Horikoshi K. Microbial diversity in sediments collected from the deepest cold-seep area, the Japan Trench[J]. Marine Biotechnology, 1999, 1(4): 391-400. DOI:10.1007/PL00011793 |
| [34] |
Freitag TE, Prosser JI. Community structure of ammonia-oxidizing bacteria within anoxic marine sediments[J]. Applied and Environmental Microbiology, 2003, 69(3): 1359-1371. DOI:10.1128/AEM.69.3.1359-1371.2003 |
| [35] |
Barns SM, Cain EC, Sommerville L, et al. Acidobacteria phylum sequences in uranium-contaminated subsurface sediments greatly expand the known diversity within the phylum[J]. Applied and Environmental Microbiology, 2007, 73(9): 3113-3116. DOI:10.1128/AEM.02012-06 |
| [36] |
Yamada T, Sekiguchi Y, Imachi H, et al. Diversity, localization, and physiological properties of filamentous microbes belonging to Chloroflexi subphylum Ⅰ in mesophilic and thermophilic methanogenic sludge granules[J]. Applied and Environmental Microbiology, 2005, 71(11): 7493-7503. DOI:10.1128/AEM.71.11.7493-7503.2005 |
| [37] |
Chen XH. Study on the diversity of Cytophaga-Flavobacteria cluster in typical areas of the China Seas and the Bering Sea[D]. Xiamen: Master's Thesis of Xiamen University, 2006 (in Chinese) 陈喜涵.中国典型海域及白令海Cytophaga-Flavobacteria类群多样性研究[D].厦门: 厦门大学硕士学位论文, 2006 http://cdmd.cnki.com.cn/Article/CDMD-10384-2007055737.htm |
| [38] |
Qiao SQ, Shi XF, Bai YZ, et al. Distribution of organic carbon, nitrogen in suspended and surface sediments and their controlling factors off the Huanghe (Yellow River) Mouth and the nearby Bohai Sea[J]. Acta Sedimentologica Sinica, 2011, 29(2): 354-362. (in Chinese) 乔淑卿, 石学法, 白亚之, 等. 黄河口及邻近渤海海域悬浮体和沉积物中有机碳、氮的分布特征及其影响因素[J]. 沉积学报, 2011, 29(2): 354-362. |
| [39] |
Jiang HH, Liu SM. Distribution and burial flux of phosphorus in sediments of the Bohai Sea[J]. Acta Scientiae Circumstantiae, 2013, 33(1): 125-132. (in Chinese) 江辉煌, 刘素美. 渤海沉积物中磷的分布与埋藏通量[J]. 环境科学学报, 2013, 33(1): 125-132. |
| [40] |
Muangchinda C, Chavanich S, Viyakarn V, et al. Abundance and diversity of functional genes involved in the degradation of aromatic hydrocarbons in Antarctic soils and sediments around Syowa Station[J]. Environmental Science and Pollution Research, 2015, 22(6): 4725-4735. DOI:10.1007/s11356-014-3721-y |
| [41] |
Yang FL, Yang JS, Deng CP, et al. Bacterial communities and their hydrocarbon bioremediation potential in the Bohai Sea, China[J]. Marine Ecology Progress Series, 2015, 538: 117-130. DOI:10.3354/meps11489 |
| [42] |
Gao MH, Liu JW, Qiao YL, et al. Diversity and abundance of the denitrifying microbiota in the sediment of Eastern China Marginal Seas and the impact of environmental factors[J]. Microbial Ecology, 2017, 73(3): 602-615. DOI:10.1007/s00248-016-0906-6 |
| [43] |
Zhou JZ, Deng Y, Zhang P, et al. Stochasticity, succession, and environmental perturbations in a fluidic ecosystem[J]. Proceedings of the National Academy of Sciences of the United States of America, 2014, 111(9): E836-E845. DOI:10.1073/pnas.1324044111 |
| [44] |
Li YX. Microbial diversity in sediments of Jiaozhou Bay and East Pacific seamounts (~13°N)[D]. Qingdao: Doctoral Dissertation of Institute of Oceanology, Chinese Academy of Sciences, 2008 (in Chinese) 李友训.胶州湾和东太平洋海隆(~13°N)沉积物微生物多样性研究[D].青岛: 中国科学院海洋研究所博士学位论文, 2008 http://cdmd.cnki.com.cn/Article/CDMD-80068-2008117219.htm |
| [45] |
Fierer N, Lauber CL, Ramirez KS, et al. Comparative metagenomic, phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients[J]. The ISME Journal, 2012, 6(5): 1007-1017. DOI:10.1038/ismej.2011.159 |
| [46] |
Ramirez KS, Craine JM, Fierer N. Consistent effects of nitrogen amendments on soil microbial communities and processes across biomes[J]. Global Change Biology, 2012, 18(6): 1918-1927. DOI:10.1111/gcb.2012.18.issue-6 |
 2018, Vol. 45
2018, Vol. 45




