扩展功能
文章信息
- 祁自忠, 杨匡, 程成, 刘子夏, 韩茵
- QI Zi-Zhong, YANG Kuang, CHENG Cheng, LIU Zi-Xia, HAN Yin
- 固定化硝化菌群联合芽孢杆菌处理对虾养殖废水
- Treatment of shrimp wastewater by combination of immobilized nitrifying bacterial consortia and selected Bacillus population
- 微生物学通报, 2018, 45(9): 1922-1939
- Microbiology China, 2018, 45(9): 1922-1939
- DOI: 10.13344/j.microbiol.china.180358
-
文章历史
- 收稿日期: 2018-05-07
- 接受日期: 2018-07-06
- 网络首发日期(www.cnki.net): 2018-08-02
2. 青岛贝宝海洋科技有限公司 山东 青岛 266400
2. Qingdao BeiBao Marine Science and Technology Co. Ltd., Qingdao, Shandong 266400, China
水产养殖集约化的快速发展带来了显著的经济效益,但同时也面临最大的难题:养殖系统中水污染控制,特别是养殖过程中产生的废料残饵、动物排泄物等引起的氨氮、亚硝酸盐和有机污染物超标的自身污染问题。养殖水体自身污染不仅极大地影响水产养殖动物的正常生长和健康,同时这些污染物超标的养殖废水未经处理被任意排放,可直接导致近海水域的富营养化和周边生态环境的破坏,严重阻碍了水产养殖的健康可持续发展[1]。据报道,在高密度养殖水体中氨氮与亚硝酸盐含量可达10 mg/L以上,化学需氧量(Chemical oxygen demand,COD)可达40 mg/L以上[2-4]。而我国《海水水质标准》[5]中要求海水养殖水质的非离子氨浓度不高于0.02 mg/L。美国环境保护署和欧洲渔业咨询委员会推荐水生环境中氨氮分别应控制在0.016 mg/L和0.021 mg/L[6]。Cheng等[7]和Le Moullac等[8]研究发现过高的氨氮浓度可显著降低日本对虾血液中的血淋巴蛋白含量和血细胞数量;彭自然等[9]研究发现氨氮对于南美白对虾幼虾的安全浓度为0.787 mg/L。过高的氨氮还会导致鱼类体内血液氨氮浓度和pH的升高,从而抑制生物体内多种酶的活性[10-11]。尽管我国水产养殖水质标准中还未对亚硝酸盐含量做出限定,但多项研究认为养殖水体中的亚硝酸盐含量应控制在0.08 mg/L[12]。曾祥玲等[13]发现凡纳滨对虾仔虾对亚硝酸盐的耐受浓度最高为0.041 mg/L;亚硝酸盐是强氧化剂,可导致鱼虾血淋巴功能下降,扰乱氮排泄并造成缺氧。鄧学智[6]指出0.1 mg/L亚硝酸盐可造成鱼慢性中毒,导致体内血液中血红蛋白的数量减少,血液载氧能力下降;亚硝酸盐浓度更高时可造成鱼急性中毒,出现体内代谢功能失常、体力严重衰退、昏迷等症状。
随着国家对环保的日益重视,水产养殖业的污染防治工作也将迎来最严厉的监管,仅2017年近20%水产养殖户因不符合废水排放要求而被迫关停。根据我国《海水养殖排放水要求》[14]规定养殖废水排放至少需要达到二级排放水要求,即COD不得超过20 mg/L,无机氮含量不得超过1 mg/L。尤其是高排污的南美白对虾养殖业,有效去除养殖废水中的有机物、氨氮与亚硝酸盐已成为环保的关键问题。利用微生物处理净化污染物是进行大面积环境污染治理和生态修复的最有效且经济的方法之一。已有不少利用芽孢杆菌和硝化细菌降解养殖水体中的有机物、氨氮和亚硝酸盐的报道。孟睿等[15]用芽孢杆菌处理罗非鱼养殖废水,6 d后COD和亚硝酸盐分别降至84.44 mg/L和0.07 mg/L,降解率为50.32%和99.15%,对氨氮无明显降解;用硝化细菌处理6 d后氨氮和亚硝酸盐分别降至2.09 mg/L和0.09 mg/L,降解率为74.48%和98.90%,对COD无明显降解。高金伟等[16]利用硝化细菌与枯草芽孢杆菌联合处理淡水鱼类养殖废水,在第5天氨氮降解率可达82.16%,亚硝酸氮降解率可达94.62%,COD降解率仅为25%左右。由此可见,在养殖废水处理中仅有芽孢杆菌或硝化细菌单一菌种均无法同步去除废水中的有机物、氨氮和亚硝酸盐,芽孢杆菌和硝化细菌以游离菌方式联合处理无法实现同步高效降解。
国内外大量研究表明:固定化微生物技术具有能纯化和保持高效菌种、承受有毒物质冲击能力及高效降解废水的功能。Shan等[17]报道利用陶土颗粒固定化硝化细菌处理对虾养殖废水,6 d后氨氮从3.5 mg/L降至0 mg/L;Manju等[18]利用木屑颗粒固定化硝化细菌处理对虾养殖废水,7 d后氨氮从15 mg/L降至0 mg/L。李秋芬等[19]利用海水中分离的枯草杆菌、亚硝化单胞菌、盐单胞菌、红球菌制成复合菌剂,并采用游离菌和生物膜法连用方法处理大菱鲆育苗养殖废水,5 d后COD和氨氮分别降至1.57 mg/L和0.06 mg/L,降解率为73.1%和80.0%,亚硝酸盐保持在0.016−0.052 mg/L的低水平。
目前国内商业化的硝化细菌制剂多为淡水型,适用于海水的产品很少[20],且缺乏硝化细菌在海水养殖中应用研究报道[21]。本论文从南美白对虾养殖塘底泥中富集硝化细菌并连续培养,筛选COD降解能力强的解淀粉芽孢杆菌,采用吸附力强和成球效果好的无毒材质进行分别固定化,并通过优化固定化提高机械强度,探究硝化细菌和芽孢杆菌联合使用在对虾养殖废水中的处理效果,以期实现同步高效降解海水养殖废水中的有机物、氨氮和亚硝酸盐,为规模化应用于南美白对虾高密度养殖提供科学依据。
1 材料与方法 1.1 材料 1.1.1 菌株5株芽孢杆菌:解淀粉芽孢杆菌(B. amyloliquefacien YL-10)、巨大芽孢杆菌(B. megaterium H-1)、枯草芽孢杆菌(B. subtilis YL-9)、地衣芽孢杆菌(B. lincheniformis GE6-1)、短小芽孢杆菌(B. pumilus YL-2),来自南美白对虾肠道和养殖环境,由中国海洋大学海洋生命学院应用微生物技术实验室分离纯化并鉴定[22]。
硝化菌群来自青岛胶南南美白对虾养殖塘底泥,由中国海洋大学海洋生命学院应用微生物技术实验室进行自养富集、连续培养和菌群组成分析。
1.1.2 培养基胰蛋白胨大豆肉汤培养基(TSB) (g/L):胰蛋白胨17.0,大豆蛋白胨3.0,氯化钠5.0,磷酸氢二钾2.5,葡萄糖2.5,pH调至7.5,1×105 Pa灭菌30 min。
硝化细菌富集培养基:(NH4)2SO4 0.15–0.20 g/L,NaNO2 0.15–0.30 g/L,海水(盐度28%)配制的初始氨氮浓度为20−30 mg/L、初始亚硝酸盐浓度为10−20 mg/L的无菌富集培养液,用NaHCO3调pH至8.3。
硝化细菌生长培养液:(NH4)2SO4 3.3 g/L,KH2PO4 0.41 g/L,1 mol/L MgSO4 0.75 mL,1 mol/L CaCl2 0.2 mL,30 mmol/L FeSO4+50 mmol/L EDTA 0.33 mL,50 mmol/L CuSO4 0.02 mL,1 000 mL H2O。
1.1.3 主要试剂和仪器海藻酸钠、氢氧化钠、无水氯化钙、碘酸钾等化学试剂均购自国药集团化学试剂有限公司;TSB生化培养基购自北京陆桥公司;贝壳粉(自制);无菌海水:青岛近海海水经0.45 μm滤膜过滤后封存放置备用。
台式离心机,Sigma公司;可见光分光光度计,上海精研有限公司;恒温摇床,上海精宏实验设备有限公司;高温高压灭菌锅,上海博迅实业有限公司;超净工作台,苏净集团安泰公司;−20 ℃医用冰箱,海尔股份有限公司。
1.2 方法 1.2.1 硝化细菌的自养富集和连续培养自养富集阶段:无菌条件下采集100 g养殖虾塘底泥置于3 L无菌密封培养瓶中,加入1 L无菌富集培养液,用NaHCO3调pH至8.3,通入无菌空气进行定向富集培养。当pH下降至7.0时,补加NaHCO3调回。当氨氮浓度和亚硝酸浓度低于0.1 mg/L时,加入灭菌硝化细菌生长培养液,调至氨氮终浓度为10−15 mg/L。25 ℃,继续充气培养。当培养液的氨氮和亚硝酸浓度多次出现低于0.1 mg/L时,取上层培养液进行连续培养。
连续培养阶段:取上层培养液以1:1比例接种于无菌海水中,加入灭菌硝化细菌生长培养液,至氨氮终浓度为10−15 mg/L,调pH至8.3,进行充气培养。每2−4 d测氨氮和亚硝酸盐浓度以及pH,当氨氮浓度和亚硝酸浓度低于0.1 mg/L时,及时补加生长培养液至氨氮终浓度为10−15 mg/L;补加NaHCO3维持pH 7.0以上。镜检活菌数,达到107−108个/mL。
氨氮的测定:根据国标GB17378.4-2007[23]使用次溴酸盐氧化法测定氨氮浓度。
亚硝酸盐的测定:根据国标GB17378.4-2007[23]使用萘乙二胺分光光度法测定亚硝酸盐浓度。
1.2.2 硝化菌群高通量测序分析取连续培养的硝化菌群15 mL,用10%盐酸预处理后置于100 mL离心管,13 000×g离心20 min,弃去上清液收集沉淀于2 mL离心管中。采用北京天根公司快速DNA提取检测试剂盒提取DNA,于–20 ℃冻存备用。DNA浓度和纯度通过超微量分光光度计测定。
委托上海派森诺生物科技股份有限公司,利用Illumina MiSeq平台对16S rRNA基因V4区进行高通量测序,采用滑动窗口法对双端的FASTQ序列做质量过滤,利用软件FLASH (Version 1.2.7,http://ccb.jhu.edu/software/FLASH/)[24]对通过质量过滤的序列进行连接,对连接上的序列进行过滤和去除嵌合体,得到优质序列。基于OTU聚类和注释的分析结果,在各分类水平上进行群落结构的统计分析和物种丰度差异分析。
1.2.3 模拟海水养殖废水的制备取24 L无菌海水加入36 g饲料混匀后沉降48 h,取上清加入适量亚硝酸钠和氯化铵溶液。测定模拟废水的COD为55.79±1.02 mg/L,氨氮测定值为4.52±0.09 mg/L,亚硝酸盐测定值为4.51±0.07 mg/L。
1.2.4 芽孢杆菌的筛选配制TSB培养基进行芽孢杆菌的培养。在37 ℃、160 r/min培养18 h后,测定OD600并计数、离心。按照1.2.3制备模拟海水养殖废水。以1×108 CFU/mL使用浓度将5株芽孢杆菌分别加入500 mL的模拟海水养殖废水中,平行3组。将未加菌的模拟海水养殖废水设为空白对照组。室温20−25 ℃,保持水体持续充气,每24 h测定一次废水中COD、氨氮及亚硝酸盐浓度,并对结果进行显著性分析。
COD的测定:根据国标GB17378.4-2007[23]使用碱性高锰酸钾法测定化学需氧量。
1.2.5 固定化配方优化及固定化小球的制备固定化采用安全无毒的多孔贝壳粉(40−60目)作为吸附载体结合海藻酸钠作为包埋剂。以海藻酸钠、贝壳粉及氯化钙的浓度作为3个因素,使用SPSS软件设计多因子正交试验,以固定化小球的机械强度为主要指标(表 1)。参考了巩元娇[25]的测定方法,将载玻片放置于电子天平上,取同组等大的小球三枚,正三角形放置于载玻片上,将盖玻片从正上方水平盖住,天平调零,向盖玻片上垂直施加均匀递增的力直至小球破裂,读出微球所能承受的最大质量Mi (g),然后换算成压力Fi (mN),单个微球的机械强度表示为Fi=G×Mi/3,G=9.8 g/mN。
| 组别 Groups |
贝壳粉 Shell powder (g/100 mL) |
海藻酸钠 Sodium alginate (g/100 mL) |
氯化钙 Calcium chloride (g/100 mL) |
| A1 | 2 | 3.0 | 4.0 |
| A2 | 2 | 3.5 | 4.5 |
| A3 | 2 | 4.0 | 5.0 |
| B1 | 5 | 3.0 | 4.0 |
| B2 | 5 | 3.5 | 4.5 |
| B3 | 5 | 4.0 | 5.0 |
| C1 | 10 | 3.0 | 4.0 |
| C2 | 10 | 3.5 | 4.5 |
| C3 | 10 | 4.0 | 5.0 |
在80 ℃水浴下按照海藻酸钠3%、贝壳粉5%的比例,加入到50 mL生理盐水中,搅拌均匀。冷却至室温后,加入定量离心浓缩后的硝化菌群或芽孢杆菌,混合均匀。用注射器滴入4% CaCl2溶液中,通过磁力搅拌器不断搅拌成球,于4 ℃交联24 h后用蒸馏水洗涤包埋小球2−3次,4 ℃保存备用。
1.2.6 固定化对硝化菌群硝化作用和芽孢杆菌COD降解率的影响按照1.2.3制备模拟海水养殖废水。硝化菌群或芽孢杆菌分别以包埋和未包埋(游离态)形式加入500 mL的模拟海水养殖废水中,终浓度为1×108 CFU/mL,平行3组。分别将未加菌和仅加等量空白固定化小球(不含菌)的模拟海水养殖废水设为空白对照组和空白固定化小球对照组。室温20−25 ℃,保持水体持续充气,每24 h测定一次模拟海水养殖废水中COD、氨氮及亚硝酸盐浓度,并进行结果分析。
1.2.7 硝化菌群和芽孢杆菌最适使用浓度的探究按照1.2.3制备模拟海水养殖废水。保持固定化硝化菌群使用浓度为1×107 CFU/mL,联合不同使用浓度梯度的固定化芽孢杆菌YL-10 (分别为1×106、1×107、1×108 CFU/mL),加入500 mL上述模拟海水养殖废水中,平行3组。
保持固定化芽孢杆菌YL-10使用浓度为1×107 CFU/mL,联合不同使用浓度梯度的固定化硝化菌群(分别为1×106、1×107、1×108 CFU/mL),加入500 mL模拟海水养殖废水中,平行3组。
将未加菌的模拟海水养殖废水设为空白对照组。室温20−25 ℃,保持水体持续充气,每24 h测定一次模拟海水养殖废水中COD、氨氮及亚硝酸盐浓度,并进行结果分析。
1.2.8 固定化硝化菌群和芽孢杆菌联合处理南美白对虾养殖废水采集青岛胶南南美白对虾养殖塘的养殖废水,测定废水的COD为65.29±1.14 mg/L;氨氮测定值为6.32±0.12 mg/L;亚硝酸盐测定值为5.69±0.11 mg/L。
选择硝化菌群和芽孢杆菌最适使用浓度,分别固定化后共同加入30 L的养殖废水中,平行3组。将未加菌的南美白对虾养殖废水设为空白对照组。水温26−28 ℃,保持水体持续充气,每24 h测定一次模拟废水中COD、氨氮及亚硝酸盐浓度,并进行结果分析。
1.2.9 实验数据的统计分析显著性分析使用SPSS19.0软件t检验法进行检验,存在差异以P < 0.05为条件,同质性分析使用SPSS19.0软件多重比较法(TukeyHSD)进行检验。
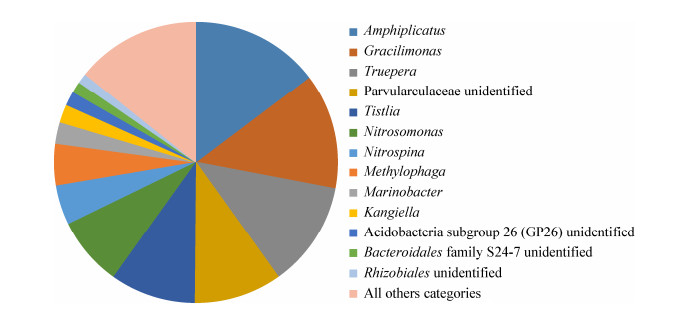
2 结果与分析 2.1 硝化菌群群落结构组成及功能菌群分析 2.1.1 硝化菌群群落结构的组成来自对虾养殖塘底泥的硝化菌群经16S rRNA基因高通量测序,共获得30 056条优质序列,在97%相似性水平上共获得867个OTU。对获得的OTU依次进行门(Phylum)、纲(Class)、目(Order)、科(Family)、属(Genus)分类信息分析显示,共涉及细菌域的21个门和225个属。其中,序列丰度≥1%的优势门包括:变形菌门(Proteobacteria,61.10%)、拟杆菌门(Bacteroidetes,16.11%)、异常球菌门(Deinococcus-Thermus,12.12%)、硝化刺菌门(Nitrospinae,4.55%)、厚壁菌门(Firmicutes,2.82%)以及酸杆菌门(Acidobacteria,1.75%) (图 1)。变形菌门占绝对优势,以α-变形菌纲(Alphaproteobacteria,40.48%)、γ-变形菌纲(Gammaproteobacteria,11.04%)和β-变形菌纲(Betaproteobacteria,8.76%)为主。在属的层次中,序列丰度≥1%有9个已知属和4个未知属(图 2),分别为:Amphiplicatus (14.71%)、Gracilimonas (13.31%)、特吕珀菌属(Truepera,12.10%)、Tistlia (9.74%)、亚硝化单胞菌属(Nitrosomonas,7.88%)、硝化刺菌属(Nitrospina,4.55%)、噬甲基菌属(Methylophaga,4.85%)、海杆菌属(Marinobacter,2.46%)、Kangiella (2.08%)以及短小盒菌科未鉴定属(Parvularculaceae unidentified,10.02%)、酸杆菌门未鉴定属类(Acidobacteria GP26 unidentified,1.65%)、拟杆菌S24-7科未鉴定属类(Bacteroidales family S24-7 unidentified,1.28%)、根瘤菌目未鉴定属类(Rhizobiales unidentified,1.14%)。

|
| 图 1 硝化菌群NBC优势门相对丰度 Figure 1 The relative abundance of dominant phylum of NBC |
|
|
|
| 图 2 硝化菌群NBC优势属的相对丰度 Figure 2 The relative abundance of dominant genus of NBC |
|
|
在硝化菌群中,具有自养硝化功能的类群占总丰度的12.69%,主要包括亚硝化单胞菌属(Nitrosomonas,7.88%)、硝化刺菌属(Nitrospina,4.55%)、硝化球菌属(Nitrococcus,0.19%)、硝化杆菌属(Nitrobacter,0.04%)和硝化螺菌目(Nitrospirales,0.03%)。具有氨氧化功能的有亚硝化单胞菌属[26]和硝化螺菌目[27],占总丰度的7.91%;具有亚硝酸氧化功能的有硝化刺菌属[28]、硝化球菌属[29]、硝化杆菌属[30]和硝化螺菌目[27],占总丰度的4.81%。硝化菌群还包含了一些具有异养硝化功能的类群,如放线菌门(Actinobacteria,0.81%)、不动杆菌属(Acinetobacter,0.48%),以及具有缺氧氨氧化功能的浮霉菌门(Planctomycetes,0.03%)[31-33]。
此外,硝化菌群中还包含大量的光合细菌,如红螺菌目(Rhodospirillales,11.10%)、赤干菌科(Erythrobacteraceae,0.74%)、红游动菌科(Rhodobiaceae,0.63%)、红细菌目(Rhodobacterales,0.22%)、绿弯菌门(Chloroflexi,0.12%)、蓝细菌门(Cyanobacteria,0.03%)、红环菌目(Rhodocyclales,0.01%)等,占总丰度的12.85%,以上菌群大部分种属被报道能够利用水体中的氨氮、亚硝酸盐、硝酸盐等无机氮,在无氮源情况下可以切换到固氮模式[34-40]。
硝化菌群中参与氮循环的优势菌群(序列丰度≥1%)有短小盒菌科(Parvularculaceae,24.74%)、Gracilimonas (13.31%)、噬甲基菌属(Methylophaga,4.85%)、海杆菌属(Marinobacter,2.46%)和Kangiella (2.08%)等,以上菌群中大部分种属被报道具有好氧反硝化功能或者潜在反硝化功能[41-46],该类功能菌群占总丰度的47.44%。
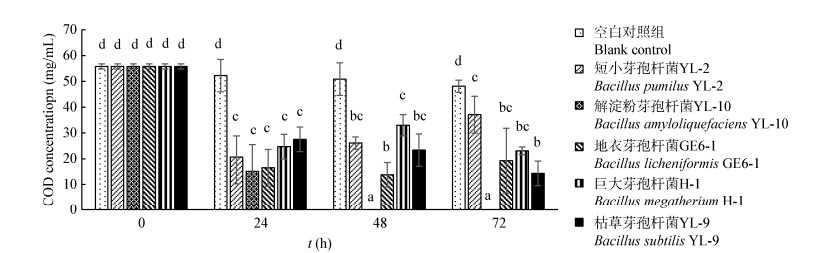
2.2 芽孢杆菌的筛选如图 3所示,模拟海水养殖废水中的COD浓度(55.79±1.02 mg/L)经5株芽孢杆菌处理后均呈显著降低趋势(P < 0.05)。其中解淀粉芽孢杆菌COD降解能力最强,48 h内COD浓度降至0 mg/L,降解率达100%。其次为地衣芽孢杆菌和枯草芽孢杆菌,48 h内COD浓度分别降解至13.74±4.76 mg/L (降解率为73.95%)和23.37±6.30 mg/L (降解率为55.73%)。运用TukeyHSD法对结果进行分析,显示解淀粉芽孢杆菌的COD降解效率显著优于其他4株芽孢杆菌(P < 0.05)。但是,5株芽孢杆菌对废水中氨氮及亚硝酸盐浓度均无显著影响。因此,选择解淀粉芽孢YL-10与硝化菌群联合处理养殖废水。
|
| 图 3 5株芽孢杆菌对COD的降解 Figure 3 COD degradation of five Bacillus strains 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|
正交试验结果显示(表 2):固定化小球在贝壳粉、海藻酸钠、氯化钙与水体质量体积比分别为5%、3%、4%条件下,成球好且机械强度最高,为129.68 mN (图 4)。
| 组别 Groups |
机械强度 Mechanical strength (mN) |
| A1 | 65.33 |
| A2 | 33.97 |
| A3 | 72.52 |
| B1 | 129.68 |
| B2 | 22.54 |
| B3 | 56.18 |
| C1 | 11.43 |
| C2 | 17.20 |
| C3 | 21.56 |

|
| 图 4 固定化小球样品 Figure 4 Samples of the immobilized pellets |
|
|
如图 5和图 6所示,固定化组的氨氮浓度在24 h和48 h内分别由最初的4.52±0.09 mg/L降至1.30±0.12 mg/L和0.05±0.01 mg/L,降解率分别为71.17%和98.92%;亚硝酸盐浓度在24 h和48 h内分别由最初的4.51±0.07 mg/L降至1.65±0.14 mg/L和0.06±0.01 mg/L,降解率为63.41%和98.58%。而未固定化组的氨氮浓度24 h和48 h内分别降至2.93±0.26 mg/L和2.56±0.04 mg/L,降解率为35.39%和43.36%;亚硝酸盐浓度24 h和48 h内分别降至3.19±0.17 mg/L和2.60±0.13 mg/L,降解率为29.42%和42.84%。与未固定化组相比,固定化组的氨氮和亚硝酸盐48 h内降解率分别显著提高了128.13%和130.11% (P < 0.05)。固定化为硝化细菌提供了适宜的生存环境,显著提高了硝化菌群的硝化能力。

|
| 图 5 固定化对硝化菌群氨氮降解的影响 Figure 5 The effect of immobilization on ammonia degradation of NBC 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|

|
| 图 6 固定化对硝化菌群亚硝酸盐降解的影响 Figure 6 The effect of immobilization on nitrite degradation of NBC 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|
此外,投放空白固定化小球对照组的氨氮和亚硝酸盐浓度在24 h内显著低于空白对照组(P < 0.05),氨氮浓度在24 h和48 h内分别降至3.43±0.07 mg/L和3.24±0.02 mg/L;亚硝酸盐浓度在24 h和48 h内分别降至3.52±0.07 mg/L和3.40±0.06 mg/L。说明固定化小球对水中游离的氨氮和亚硝酸盐具有良好的吸附作用,为硝化细菌营造了局部富含氨氮和亚硝酸盐的适宜生境。
2.3.3 固定化对解淀粉芽孢杆菌COD降解效率的影响如图 7所示,固定化组COD浓度在24 h内由初始55.79±1.02 mg/L降至9.53±2.70 mg/L,降解率为83.44%;未固定化组在24 h内降至11.77±3.88 mg/L,降解率为79.55%。在48 h内两组的COD浓度均降至0。两组之间无显著差异,固定化对解淀粉芽孢杆菌COD降解效率无影响。空白对照组和投放空白小球对照组的COD浓度在24 h和48 h内无显著差异,固定化小球对有机物无吸附作用。

|
| 图 7 固定化对解淀粉芽孢杆菌COD降解的影响 Figure 7 The effect of immobilization on COD degradation B. amyloliquefacien 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|
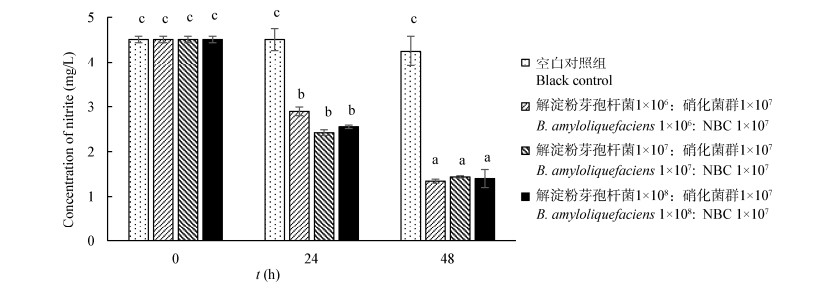
保持固定化硝化菌群的使用浓度1×107 CFU/mL,联合不同使用浓度梯度的固定化解淀粉芽孢杆菌YL-10 (分别为1×106、1×107、1×108 CFU/mL)进行模拟海水养殖废水的处理。如图 8所示,添加固定化硝化菌群和不同浓度固定化芽孢杆菌YL-10的3个实验组在48 h内氨氮浓度由初始4.52±0.09 mg/L降至1.02±0.06、0.98±0.13 mg/L和0.84±0.14 mg/L,降解率分别为77.38%、78.27%和81.37%,TukeyHSD分析显示三者之间具有同质性,无显著差异,说明解淀粉芽孢杆菌不同的使用浓度对氨氮降解效率无影响。3个实验组在48 h内亚硝酸盐浓度由初始4.51±0.07 mg/L降至1.34±0.04、1.44±0.02 mg/L和1.40±0.20 mg/L,降解率分别为70.35%、68.14.%和69.03% (图 9)。TukeyHSD分析显示三者之间具有同质性,无显著差异,说明解淀粉芽孢杆菌不同的使用浓度对亚硝酸盐降解效率无影响。然而,解淀粉芽孢杆菌不同的使用浓度显著影响COD降解效率。如图 10所示,随着芽孢杆菌YL-10使用浓度的增大,COD降解效率显著提高(P < 0.05),3个实验组在48 h内COD浓度由初始55.79±1.02 mg/L分别降至16.24±3.11、9.76±1.23和0 mg/L,降解率分别为70.89%、82.51%和100%。

|
| 图 8 解淀粉芽孢杆菌不同使用浓度对硝化菌群氨氮降解的影响 Figure 8 The effect of different use concentrations of B. amyloliquefacien on ammonia degradation 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|
|
| 图 9 解淀粉芽孢杆菌不同使用浓度对硝化菌群亚硝酸盐降解的影响 Figure 9 The effect of different use concentrations of B. amyloliquefacien on nitrite degradation 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|

|
| 图 10 解淀粉芽孢杆菌不同使用浓度对COD降解的影响 Figure 10 The effect of different use concentrations of B. amyloliquefacien on COD degradation 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|
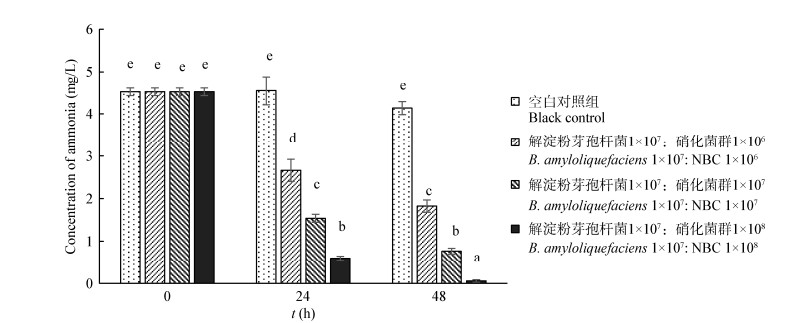
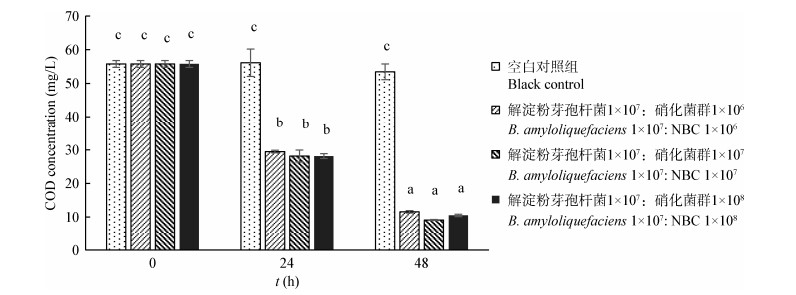
保持固定化芽孢杆菌YL-10使用浓度为1×107 CFU/mL,联合使用不同浓度梯度的固定化硝化菌群(分别为1×106、1×107、1×108 CFU/mL)进行人工模拟养殖废水的处理。如图 11所示,添加固定化芽孢杆菌YL-10和不同浓度固定化硝化菌群的3个实验组在24 h内氨氮浓度由初始4.52±0.09 mg/L分别降至2.66±0.26、1.54±0.09和0.60±0.05 mg/L,降解率分别为41.15%、65.93%和86.73%;在48 h内分别降至1.82±0.14、0.77±0.07和0.06±0.03 mg/L,降解率分别为59.72%、82.96%和98.67%。随着硝化菌群使用浓度的增大,氨氮降解效率显著提高(P < 0.05)。同样,3个实验组在24 h内亚硝酸盐浓度由初始4.51± 0.07 mg/L分别降至2.71±0.18、1.85±0.08和0.52±0.07 mg/L,降解率分别为39.91%、58.98%和88.47%;在48 h内分别降至1.47±0.13、0.79±0.02和0.07±0.02 mg/L,降解率分别为67.41%、82.48%和98.44% (图 12)。随着硝化菌群使用浓度的增大,亚硝酸盐降解效率显著提高(P < 0.05)。然而,硝化菌群不同的使用浓度对COD的降解无显著影响。如图 13所示,3个实验组在48 h内COD浓度由初始55.79±1.02 mg/L降至11.56±0.37、9.14±0.13和10.50±0.36 mg/L,降解率分别为79.28%、83.61%和82.18%。TukeyHSD分析显示三者之间具有同质性,无显著差异。
|
| 图 11 硝化菌群不同使用浓度对氨氮降解的影响 Figure 11 The effect of different use concentrations of NBC on ammonia degradation 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|

|
| 图 12 硝化菌群不同使用浓度对亚硝酸盐降解的影响 Figure 12 The effect of different use concentrations of NBC on nitrite degradation 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|
|
| 图 13 硝化菌群不同使用浓度对COD降解的影响 Figure 13 The effect of different use concentrations of NBC on COD degradation 注:不同的小写字母表示显著性差异(P < 0.05). Note: The data with different little letters show significant difference (P < 0.05). |
|
|
依据以上实验结果,选择1×108 CFU/mL为固定化解淀粉芽孢杆菌YL-10与固定化硝化菌群的最适使用浓度,联合进行南美白对虾养殖废水的处理。如表 3所示,废水中的氨氮浓度在48 h内由初始6.32±0.12 mg/L降至0.03±0.03 mg/L,降解率为99.57%;亚硝酸盐浓度在48 h内由初始5.69±0.11 mg/L降至0.06±0.01 mg/L,降解率为99.03%;COD浓度在48 h内由初始65.29±1.14 mg/L降至0 mg/L,降解率为100%。
| 时间 Time (h) |
氨氮/降解率 Ammonia (mg/L)/Degradation rate (%) |
亚硝酸盐/降解率 Nitrite (mg/L)/Degradation rate (%) |
COD/降解率 COD (mg/L)/Degradation rate (%) |
| 0 | 6.32±0.12 | 5.69±0.11 | 65.29±1.14 |
| 24 | 0.69±0.17 (89.08) | 0.79±0.31 (86.11) | 12.19±0.83 (81.32) |
| 48 | 0.03±0.03 (99.57) | 0.06±0.01 (99.03) | 0 (100) |
本文采集南美白对虾养殖池塘底泥进行硝化细菌自养富集和连续培养,获得107−108个/mL的硝化菌群。经16S rRNA基因高通量测序分析,变形菌门(61.10%)占绝对优势,以α-变形菌纲(40.48%)、γ-变形菌纲(11.04%)和β-变形菌纲(8.76%)为主。张健龙等[47]也报道了变形菌门为南美白对虾养殖塘挂膜式生物滤器内主要的优势类群,高比例变形菌门对于系统脱氮具有重要作用。硝化菌群中具有自养硝化功能的类群占总丰度的12.69%并多样性高。其中,亚硝化单胞菌属为β-变形菌纲中绝对优势种类,丰度达7.88%。硝化刺菌门(4.55%)为第四大优势门。Rani等[48]发现硝化刺菌是海洋沉积物中主要的硝化细菌。此外,硝化菌群中还有γ-变形菌纲硝化球菌属(0.19%)、α-变形菌纲硝化杆菌属(0.04%)和硝化螺菌门(0.03%)。最新研究发现部分硝化螺菌能够进行完整的硝化作用,同时具有氨氧化功能和亚硝酸盐氧化功能[28]。硝化菌群中具有氨氧化功能的菌群丰度为7.91%,具有亚硝酸氧化功能的菌群丰度为4.81%。硝化菌群的丰度、相对含量和菌群结构是影响硝化效果的主要因素,曾薇等[49]研究发现污水处理系统内的氨氧化菌(Ammonia-Oxidizing Bacteria,AOB)和亚硝酸氧化菌(Nitrite-Oxidizing Bacteria,NOB)的丰度分别为0.30%和5.65%,水力停留时间为9.5 h,氨氮浓度从41.2 mg/L降到0.72 mg/L,无亚硝酸盐积累(仅为0.03 mg/L)。张健龙等[47]报道南美白对虾生物滤器挂膜上AOB和NOB平均丰度分别为1.70%和6.99%,通过自养富集可有效提高硝化细菌的丰度。
另外,硝化菌群中的放线菌门(0.81%)和不动杆属(0.48%)等具有异养硝化功能的细菌以及具有缺氧氨氧化功能的浮霉菌门(0.03%),在硝化作用中也是不可或缺的群体,尤其在高有机负荷的养殖废水中。硝化菌群中还包含丰度达12.85%的光合细菌,是高有机负荷下硝化作用的重要补充。许多研究表明[50-53]:光合细菌能够在不同的生境通过多种氮代谢途径有效利用水体中无机氮,进行氨同化和反硝化作用,在缺氮条件下进行固氮。值得注意的是,硝化菌群中还有丰度达47.44%的具有反硝化功能或者潜在反硝化功能的优势菌群:短小盒菌科(24.74%)、Gracilimonas (13.31%)、噬甲基菌属(4.85%)、海杆菌属(2.46%)和Kangiella (2.08%)等,它们被报道能够进行反硝化作用实现真正脱氮[54-55]。
当前养殖水体中氨氮、亚硝酸盐和有机污染物超标已成为重要的污染源之一,为国家环保关注的重点之一。饲料残饵与动物的排泄物为养殖水体中的异养细菌提供了适宜的生长环境和营养,使养殖水体中异养细菌数目远远超过自养硝化细菌,抑制了硝化细菌的生长繁殖,无法进行有效的硝化作用,从而造成养殖水体氨氮和亚硝酸盐的大量积累。固定化微生物技术将硝化细菌高度密集并保持生物活性,有利于抵抗不利环境的影响。本文以多孔贝壳粉为吸附载体,采用包埋剂海藻酸钠与交联剂氯化钙,对来自虾塘底泥的硝化菌群进行固定化,显著提高了硝化作用(P < 0.05);并通过优化固定化增强了固定化小球的机械强度,提高使用效率。与游离态的硝化菌群(未固定化)相比,固定化硝化菌群的氨氮和亚硝酸盐降解率在48 h内分别显著提高了128.13%和130.11% (P < 0.05) (图 5和6)。晋凯迪等[56]报道了利用聚乙烯醇和海藻酸钠小球包埋硝化细菌降解河水水样中的氨氮,2 d后固定化组氨氮去除率达到96.78%,而游离菌组去除率为70.29%,固定化组较游离组氨氮降解率提高了37.69%。利用多孔贝壳粉的吸附作用及弱碱性(主要成分碳酸钙),将氨氮和亚硝酸盐迅速吸附在固定化小球内,使硝化作用的底物浓度局部升高,在有机物含量高的养殖废水中为硝化细菌创造了适宜的生境。如图 5和图 6所示,投放空白固定化小球对照组的氨氮和亚硝酸盐浓度显著低于空白对照组(P < 0.05),氨氮浓度在24 h内由初始4.52±0.09 mg/L降至3.43±0.07 mg/L,吸附率达24%;亚硝酸盐浓度在24 h内由初始4.51±0.09 mg/L降至3.52±0.07 mg/L,吸附率达22%。贝壳粉因具有众多互相连通的微孔及较强的吸附能力,对水中氮、磷等成分有良好的吸附作用[57]。高健发等[58]以粉煤灰、污泥、贝壳粉等烧制成颗粒,氨氮吸附量为0.055 mg/g。为了进一步提高固定化小球的使用效率,本文通过正交实验优化固定化配方,在贝壳粉、海藻酸钠、氯化钙与水体质量比分别为5%、3%和4%的条件下,成球好且机械强度最大(129.68 mN)。包木太等[59]采用海藻酸钠与活性炭制备包埋小球机械强度为73.5 mN。宋丽敏等[60]使用海藻酸钠与壳聚糖制备包埋小球机械强度为89.2 mN。经优化的固定化小球与同类相比,机械强度有较大提升。
养殖废水中的残饵是COD的主要来源,筛选COD降解能力强的芽孢杆菌对于养殖废水有机物的处理至关重要。研究发现5株芽孢杆菌均有显著的COD降解能力(P < 0.05) (图 3),其中解淀粉芽孢杆菌YL-10的COD降解能力最强,在48 h内COD从初始55.79±1.02 mg/L降至0 mg/L,降解率达100%。Luo等[61]利用巨大芽孢杆菌处理废水,3 d后可将COD降至12.8 mg/L,降解率可达64.04%;辛美丽等[62]利用枯草芽孢杆菌、巨大芽孢杆菌、嗜碱性芽孢杆菌联合处理模拟海参养殖废水,6 d后可将COD从初始658.56 mg/L降至235.20 mg/L,降解率可达64.29%。解淀粉芽孢杆菌YL-10不仅高效降解了养殖废水中的有机物,同时减少了高浓度的有机物对自养硝化细菌生长的抑制[63]。为了提高使用效率和避免异养芽孢杆菌对硝化细菌的竞争,本文对YL-10也进行了固定化,固定化对于YL-10的COD降解能力无显著影响;但在与硝化菌群联合使用时,显著提高了初期硝化菌群的硝化作用(P < 0.05);1×107 CFU/mL固定化芽孢杆菌YL-10与固定化硝化菌群(浓度为1×108 CFU/mL)联合使用时,24 h内氨氮和亚硝酸盐浓度分别降为0.60±0.05 mg/L和0.52±0.07 mg/L,降解率分别为86.73%和88.24% (图 11和12);而仅单纯使用1×108 CFU/mL固定化硝化菌群,24 h内氨氮和亚硝酸盐浓度分别降为1.30±0.12 mg/L和1.65±0.14 mg/L,降解率分别为71.17%和63.41% (图 5和6);固定化芽孢杆菌的联合作用使氨氮和亚硝酸盐降解率在初始24 h内显著提高了14.49%和25.05% (P < 0.05)。高金伟等[16]报道利用游离态硝化细菌处理淡水鱼类养殖废水,5 d后氨氮和亚硝酸盐去除率分别为75.41%和92.22%,而联合枯草芽孢杆菌组氨氮和亚硝酸盐去除率分别为82.16%和94.62%,较硝化细菌组氨氮去除率提高了8.9%,但亚硝酸盐去除率无明显提升。化能自养型硝化细菌难以在有机物含量高的养殖水体中与其他异养细菌(包括芽孢杆菌)竞争而易被淘汰,从而影响对氨氮与亚硝酸盐的降解[20]。通过芽孢杆菌迅速降解养殖水体中的有机物,降低有机物浓度,使异养细菌失去营养和适宜的环境,减弱了对硝化细菌的抑制[64]。固定化使芽孢杆菌与硝化细菌在空间上相互隔离,避免了形成竞争关系,保证了有机废水中硝化细菌的竞争优势并提高硝化作用,实现同步高效地降解养殖水体中的有机物、氨氮和亚硝酸盐。
参照《海水水质标准》[5]中水产养殖水质要求和《海水养殖排放水要求》[14]一级排放水标准,本文探究了硝化菌群和芽孢杆菌的最适使用浓度,确定为1×108 CFU/mL。1×108 CFU/mL的硝化菌群和芽孢杆菌YL-10在48 h内可将模拟海水养殖废水的COD降至0,降解率100% (图 10);氨氮降至0.06±0.03 mg/L,降解率98.67% (图 11);亚硝酸盐降至0.07±0.02 mg/L,降解率98.44% (图 12)。1×108 CFU/mL的硝化菌群和芽孢杆菌YL-10联合用于对虾养殖废水的处理,亚硝酸盐、氨氮及COD浓度在48 h内分别从初始的6.32±0.12、5.69±0.11 mg/L和65.29±1.14 mg/L降至0.03±0.03、0.06±0.01 mg/L和0 (P < 0.05),降解率分别为99.57%、99.03%和100%,实现了同步高效降解对虾养殖水体中的有机物、氨氮和亚硝酸盐。
综上所述,本文通过自养富集获得虾塘底泥的土著硝化菌群,具有良好的适应性;联合优筛的COD降解能力强的解淀粉芽孢杆菌;选用吸附和成球效果好的无毒包埋材料并优化固定化;使异养芽孢杆菌对自养硝化细菌的抑制关系转变为促进作用,显著提高硝化作用,实现同步高效降解养殖水体中的有机物、亚硝酸盐和氨氮。下一步将在南美白对虾工厂化养殖系统中开展应用研究,通过固定化硝化菌群联合芽孢杆菌实时去除水体中有机物,将氨氮、亚硝酸盐和硝酸盐控制在适宜对虾生长的安全浓度范围内,保障南美白对虾产业的健康可持续发展。
| [1] |
Wu W, Fan LM. Pollution and control measures of aquaculture environment[J]. Journal of Agricultural Science and Technology, 2014, 16(2): 26-34. (in Chinese) 吴伟, 范立民. 水产养殖环境的污染及其控制对策[J]. 中国农业科技导报, 2014, 16(2): 26-34. |
| [2] |
Chen YB, Song GB, Zhao WX, et al. Estimating pollutant loadings from mariculture in China[J]. Marine Environmental Science, 2016, 35(1): 1-6, 12. (in Chinese) 陈一波, 宋国宝, 赵文星, 等. 中国海水养殖污染负荷估算[J]. 海洋环境科学, 2016, 35(1): 1-6, 12. |
| [3] |
Tseng IT, Chen JC. The immune response of white shrimp Litopenaeus vannamei and its susceptibility to Vibrio alginolyticus under nitrite stress[J]. Fish & Shellfish Immunology, 2004, 17(4): 325-333. |
| [4] |
Ma M, Zhu CX, Liang HL, et al. Repairing effect of several plants on the aquaculture wastewate of fisheries[J]. Environmental Science & Technology, 2011, 34(S1): 18-22. (in Chinese) 马旻, 朱昌雄, 梁浩亮, 等. 几种植物对水产养殖废水的修复效果[J]. 环境科学与技术, 2011, 34(S1): 18-22. |
| [5] |
National Environmental Protection Agency. GB 3097-1997 Marine water quality standard[S]. Beijing: Environmental Science Press, 2004 (in Chinese) 国家环境保护总局. GB 3097-1997海水水质标准[S].北京: 环境科学出版社, 2004 |
| [6] |
Deng XZ. Study on effect of 4 kingds of carrier minerals on the enrichment culture of marine nitrifying bacteria[D]. Qingdao: Master's Thesis of Qingdao University of Technology, 2015 (in Chinese) 鄧学智.四种矿物质载体对海水硝化细菌富集培养的影响研究[D].青岛: 青岛理工大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10429-1016054062.htm |
| [7] |
Cheng SY, Shieh LW, Chen JC. Changes in hemolymph oxyhemocyanin, acid-base balance, and electrolytes in Marsupenaeus japonicus under combined ammonia and nitrite stress[J]. Aquatic Toxicology, 2013, 130-131: 132-138. DOI:10.1016/j.aquatox.2012.12.015 |
| [8] |
Le Moullac G, Haffner P. Environmental factors affecting immune responses in Crustacea[J]. Aquaculture, 2000, 191(1/3): 121-131. |
| [9] |
Peng ZR, Zang WL, Gao Y, et al. Toxic effects of ammonia and nitrite on Penaeus vannamei juvenile[J]. Journal of Shanghai Fisheries University, 2004, 13(3): 274-278. (in Chinese) 彭自然, 臧维玲, 高杨, 等. 氨和亚硝酸盐对凡纳滨对虾幼虾的毒性影响[J]. 上海水产大学学报, 2004, 13(3): 274-278. |
| [10] |
Zhang WQ, Zhu Y. Advances on the research of the hazard of ammonia nitrogen in aquaculture water and its determination method[J]. Journal of Environmental Hygiene, 2012, 2(6): 324-327. (in Chinese) 张卫强, 朱英. 养殖水体中氨氮的危害及其检测方法研究进展[J]. 环境卫生学杂志, 2012, 2(6): 324-327. |
| [11] |
Li B, Fan QX, Yang K, et al. Effects of chronic ammonia stress on foraging, growth, and haematological parameters of Yellow Catfish (Pelteobagrus fulvidraco) Juveniles[J]. Chinese Journal of Applied and Environmental Biology, 2011, 17(6): 824-828. (in Chinese) 李波, 樊启学, 杨凯, 等. 慢性氨氮胁迫对黄颡鱼摄食、生长及血液指标的影响[J]. 应用与环境生物学报, 2011, 17(6): 824-828. |
| [12] |
He YJ. Study on ammonia and nitrite reducing in the pond using microorganism[D]. Nanjing: Master's Thesis of Nanjing Agricultural University, 2007 (in Chinese) 何义进.微生态制剂降解养殖水体氨氮及亚硝酸盐的研究[D].南京: 南京农业大学硕士学位论文, 2007 http://cdmd.cnki.com.cn/Article/CDMD-10307-2008197449.htm |
| [13] |
Zeng XL, Wang AL. Change pattern of nitrite-nitrogen and ammonian-nitrogen in nursery tank water of rearing the Penaeus vannamei larvae and effect on the larvae[J]. Science Technology and Engineering, 2006, 6(16): 2433-2437. (in Chinese) 曾祥玲, 王安利. 凡纳对虾育苗水中氨氮和亚硝酸盐氮的变化及对幼体的影响[J]. 科学技术与工程, 2006, 6(16): 2433-2437. DOI:10.3969/j.issn.1671-1815.2006.16.003 |
| [14] |
The Ministry of Agriculture of the People's Republic of China. SC/T 9103-2007 Water drainage standard for sea water mariculture[S]. 2007 中华人民共和国农业部. SC/T 9103-2007海水池塘水排放要求[S]. 2007 |
| [15] |
Meng R, He LS, Xi BD, et al. Experimental study on purifying aquaculture wastewater between Bacillus and nitrifying bacteria[J]. Environmental Science & Technology, 2009, 32(11): 28-31. (in Chinese) 孟睿, 何连生, 席北斗, 等. 芽孢杆菌与硝化细菌净化水产养殖废水的试验研究[J]. 环境科学与技术, 2009, 32(11): 28-31. DOI:10.3969/j.issn.1003-6504.2009.11.007 |
| [16] |
Gao JW, Zhang HH, Chen RN, et al. Effects of nitrifying bacteria and Bacillus subtilis on controlling aquaculture water qualities[J]. Journal of Tianjin Agricultural University, 2014, 21(1): 5-8. (in Chinese) 高金伟, 张海红, 陈瑞楠, 等. 硝化细菌与枯草芽孢杆菌对养殖水质调控作用研究[J]. 天津农学院学报, 2014, 21(1): 5-8. DOI:10.3969/j.issn.1008-5394.2014.01.002 |
| [17] |
Shan H, Obbard JP. Ammonia removal from prawn aquaculture water using immobilized nitrifying bacteria[J]. Applied Microbiology and Biotechnology, 2001, 57(5/6): 791-798. |
| [18] |
Manju NJ, Deepesh V, Achuthan C, et al. Immobilization of nitrifying bacterial consortia on wood particles for bioaugmenting nitrification in shrimp culture systems[J]. Aquaculture, 2009, 294(1/2): 65-75. |
| [19] |
Li QF, Zhang Y, Wang YG. Study on purifying effect of multi-strain probiotics product on water of intensive turbot breeding[J]. Journal of Fisheries of China, 2006, 30(6): 852-856. (in Chinese) 李秋芬, 张艳, 王印庚. 复合有益菌剂对工厂化大菱鲆育苗水净化效果研究[J]. 水产学报, 2006, 30(6): 852-856. |
| [20] |
Kong XR. Effects of nitrifying bacteria on construction of nitrification function in marine aquarium and analysis of related factors[D]. Qingdao: Master's Thesis of Qingdao University of Technology, 2010 (in Chinese) 孔小蓉.硝化细菌制剂对海水系统硝化功能建立的影响及相关因素分析[D].青岛: 青岛理工大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/Article/CDMD-10429-1011258436.htm |
| [21] |
Liu YY, Xu ZC, Zeng D, et al. Research on screening of nitrifying bacteria from mariculture wastewater sediments and bioremediation inorganic nitrogen[J]. Environmental Pollution & Control, 2017, 39(8): 817-821, 828. (in Chinese) 刘彦彦, 许振成, 曾东, 等. 海水养殖废水沉积物中硝化细菌的分离及修复无机氮污染的研究[J]. 环境污染与防治, 2017, 39(8): 817-821, 828. |
| [22] |
You L, Han Y, Zhang K, et al. Profiling the enzyme activities of bacillus cultures and their dietary effects on growth and digestive enzymes of Litopenaeus vannamei[J]. Periodical of Ocean University of China, 2018, 48(3): 80-87. (in Chinese) 游龙, 韩茵, 张凯, 等. 芽孢杆菌产胞外酶的活性分析及其对凡纳滨对虾的作用[J]. 中国海洋大学学报, 2018, 48(3): 80-87. DOI:10.3969/j.issn.1672-335X.2018.03.012 |
| [23] |
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB 17378.4-2007 The specification for marine monitoring—Part 4: seawater analysis[S]. Beijing: Standards Press of China, 2008 (in Chinese) 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 17378.4-2007海洋监测规范第4部分: 海水分析[S].北京: 中国标准出版社, 2008 |
| [24] |
Magoč T, Salzberg SL. FLASH: fast length adjustment of short reads to improve genome assemblies[J]. Bioinformatics, 2011, 27(21): 2957-2963. DOI:10.1093/bioinformatics/btr507 |
| [25] |
Gong YJ. The research on oily-wastewater treatment by immobilized microorganisms[D]. Qingdao: Master's Thesis of Ocean University of China, 2010 (in Chinese) 巩元娇.固定化微生物处理含油污水的研究[D].青岛: 中国海洋大学硕士学位论文, 2010 http://cdmd.cnki.com.cn/article/cdmd-10423-1011029674.htm |
| [26] |
Rotthauwe JH, Witzel KP, Liesack W. The ammonia monooxygenase structural gene amoA as a functional marker: molecular fine-scale analysis of natural ammonia-oxidizing populations[J]. Applied and Environmental Microbiology, 1997, 63(12): 4704-4712. |
| [27] |
van Kessel MAH, Speth DR, Albertsen M, et al. Complete nitrification by a single microorganism[J]. Nature, 2015, 528(7583): 555-559. DOI:10.1038/nature16459 |
| [28] |
Zehr JP, Kudela RM. Nitrogen cycle of the open ocean: from genes to ecosystems[J]. Annual Review of Marine Science, 2011, 3: 197-225. DOI:10.1146/annurev-marine-120709-142819 |
| [29] |
Lücker S, Nowka B, Rattei T, et al. The genome of Nitrospina gracilis illuminates the metabolism and evolution of the major marine nitrite oxidizer[J]. Frontiers in Microbiology, 2013, 4: 27. |
| [30] |
Huang ZH, Gedalanga PB, Asvapathanagul P, et al. Influence of physicochemical and operational parameters on Nitrobacter and Nitrospira communities in an aerobic activated sludge bioreactor[J]. Water Research, 2010, 44(15): 4351-4358. DOI:10.1016/j.watres.2010.05.037 |
| [31] |
Su JF, Ma F, Wang JH, et al. Nitrification and denitrification characteristics of new heterotrophic nitrifying bacteria[J]. Journal of Tianjin University, 2007, 40(10): 1205-1208. (in Chinese) 苏俊峰, 马放, 王继华, 等. 新型异养硝化细菌的硝化和反硝化特性[J]. 天津大学学报, 2007, 40(10): 1205-1208. DOI:10.3969/j.issn.0493-2137.2007.10.012 |
| [32] |
Yao S, Ni J, Ma T, et al. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium, Acinetobacter sp. HA2[J]. Bioresource Technology, 2013, 139: 80-86. DOI:10.1016/j.biortech.2013.03.189 |
| [33] |
van Niftrik L, Geerts WJC, van Donselaar EG, et al. Cell division ring, a new cell division protein and vertical inheritance of a bacterial organelle in anammox planctomycetes[J]. Molecular Microbiology, 2009, 73(6): 1009-1019. DOI:10.1111/mmi.2009.73.issue-6 |
| [34] |
Díaz-Cárdenas C, Patel BKC, Baena S. Tistlia consotensis gen. nov., sp. nov., an aerobic, chemoheterotrophic, free-living, nitrogen-fixing alphaproteobacterium, isolated from a Colombian saline spring[J]. International Journal of Systematic and Evolutionary Microbiology, 2010, 60(Pt 6): 1437-1443. |
| [35] |
Brown CM, Herbert RA. Ammonia assimilation in members of the Rhodospirillaceae[J]. FEMS Microbiology Letters, 1977, 1(1): 43-45. DOI:10.1111/fml.1977.1.issue-1 |
| [36] |
Hiraishi A, Urata K, Satoh T. A new genus of marine budding phototrophic bacteria, Rhodobium gen. nov., which includes Rhodobium orientis sp. nov. and Rhodobium marinum comb. nov[J]. International Journal of Systematic and Evolutionary Microbiology, 1995, 45(2): 226-234. |
| [37] |
Waidner LA, Kirchman DL. Aerobic anoxygenic phototrophic bacteria attached to particles in turbid waters of the Delaware and Chesapeake estuaries[J]. Applied and Environmental Microbiology, 2007, 73(12): 3936-3944. DOI:10.1128/AEM.00592-07 |
| [38] |
Sunja C, Takahashi Y, Fujii N, et al. Nitrogen removal performance and microbial community analysis of an anaerobic up-flow granular bed anammox reactor[J]. Chemosphere, 2010, 78(9): 1129-1135. DOI:10.1016/j.chemosphere.2009.12.034 |
| [39] |
Mohan G, Vinoth R, Kumar TTA. An experimental study on ammonia assimilation through Cyanobacteria in marine ornamental fish culture[J]. International Journal of Applied Environmental Sciences, 2010, 5(5): 659-667. |
| [40] |
Hesselsoe M, Füreder S, Schloter M, et al. Isotope array analysis of Rhodocyclales uncovers functional redundancy and versatility in an activated sludge[J]. The ISME Journal, 2009, 3(12): 1349-1364. DOI:10.1038/ismej.2009.78 |
| [41] |
Zhang ZL, Zhang XQ, Wu N, et al. Amphiplicatus metriothermophilus gen. nov., sp. nov., a thermotolerant alphaproteobacterium isolated from a hot spring[J]. International Journal of Systematic and Evolutionary Microbiology, 2014, 64(Pt 8): 2805-2811. DOI:10.1099/ijs.0.062471-0 |
| [42] |
Cho JC, Giovannoni SJ. Parvularcula bermudensis gen. nov., sp. nov., a marine bacterium that forms a deep branch in the α-proteobacteria[J]. International Journal of Systematic and Evolutionary Microbiology, 2003, 53(4): 1031-1036. DOI:10.1099/ijs.0.02566-0 |
| [43] |
Choi DH, Zhang GI, Noh JH, et al. Gracilimonas tropica gen. nov., sp. nov., isolated from a Synechococcus culture[J]. International Journal of Systematic and Evolutionary Microbiology, 2009, 59(Pt 5): 1167-1172. |
| [44] |
Auclair J, Lépine F, Parent S, et al. Dissimilatory reduction of nitrate in seawater by a Methylophaga strain containing two highly divergent narG sequences[J]. The ISME Journal, 2010, 4(10): 1302-1313. DOI:10.1038/ismej.2010.47 |
| [45] |
Li RP, Zi XL, Wang XF, et al. Marinobacter hydrocarbonoclasticus NY-4, a novel denitrifying, moderately halophilic marine bacterium[J]. Springerplus, 2013, 2: 346. DOI:10.1186/2193-1801-2-346 |
| [46] |
Yoon JH, Oh TK, Park YH. Kangiella koreensis gen. nov., sp. nov. and Kangiella aquimarina sp. nov., isolated from a tidal flat of the Yellow Sea in Korea[J]. International Journal of Systematic and Evolutionary Microbiology, 24, 54(5): 1829-1835. |
| [47] |
Zhang JL, Jiang M, Wang CF, et al. Microbial diversity in Bio-Filter of the recirculating aquaculture system for Litopenaeus vannamei[J]. Progress in Fishery Sciences, 2017, 38(5): 73-82. (in Chinese) 张健龙, 江敏, 王城峰, 等. 凡纳滨对虾(Litopenaeus vannamei)循环水养殖塘挂膜式生物滤器内微生物的多样性[J]. 渔业科学进展, 2017, 38(5): 73-82. |
| [48] |
Rani S, Koh HW, Rhee SK, et al. Detection and diversity of the nitrite oxidoreductase Alpha Subunit (nxrA) gene of Nitrospina in marine sediments[J]. Microbial Ecology, 2016, 73(1): 111-122. |
| [49] |
Zeng W, Zhang LM, Wang AQ, et al. Community structures and population dynamics of nitrifying bacteria in activated sludges of wastewater treatment plants[J]. China Environmental Science, 2015, 35(11): 3257-3265. (in Chinese) 曾薇, 张丽敏, 王安其, 等. 污水处理系统中硝化菌的菌群结构和动态变化[J]. 中国环境科学, 2015, 35(11): 3257-3265. DOI:10.3969/j.issn.1000-6923.2015.11.008 |
| [50] |
Hargreaves JA. Photosynthetic suspended-growth systems in aquaculture[J]. Aquacultural Engineering, 2006, 34(3): 344-363. DOI:10.1016/j.aquaeng.2005.08.009 |
| [51] |
Jeong SK, Cho JS, Kong IS, et al. Purification of aquarium water by PVA gel-immobilized photosynthetic bacteria during goldfish rearing[J]. Biotechnology and Bioprocess Engineering, 2009, 14(2): 238-247. DOI:10.1007/s12257-008-0195-0 |
| [52] |
Qi ZZ, Zhang XH, Boon N, et al. Probiotics in aquaculture of China—current state, problems and prospect[J]. Aquaculture, 2009, 290(1/2): 15-21. |
| [53] |
Huang XJ, Yang C, Luo YX, et al. Research progress of photosynthetic bacteria in water pollution governance[J]. China Biotechnology, 2014, 34(11): 119-124. (in Chinese) 黄雪娇, 杨冲, 罗雅雪, 等. 光合细菌在水污染治理中的研究进展[J]. 中国生物工程杂志, 2014, 34(11): 119-124. |
| [54] |
Wu W, Zhou GQ, Du X. Effects of compound microbes preparation on variety of nitrogen-cycle bacteria in pond water[J]. Journal of Agro-Environment Science, 2005, 24(4): 790-794. (in Chinese) 吴伟, 周国勤, 杜宣. 复合微生态制剂对池塘水体氮循环细菌动态变化的影响[J]. 农业环境科学学报, 2005, 24(4): 790-794. DOI:10.3321/j.issn:1672-2043.2005.04.039 |
| [55] |
van de Pas-Schoonen KT, Schalk-Otte S, Haaijer S, et al. Complete conversion of nitrate into dinitrogen gas in co-cultures of denitrifying bacteria[J]. Biochemical Society Transactions, 2005, 33(Pt 1): 205-209. |
| [56] |
Jin KD, Yu LJ, Chen HM, et al. The optimization and nitrogen removal performance of nitrification bacteria's adsorption and embedding immobilization method[J]. Technology of Water Treatment, 2015, 41(7): 57-60, 64. (in Chinese) 晋凯迪, 于鲁冀, 陈慧敏, 等. 亚硝化细菌吸附-包埋固定化方法的优化及其脱氮性能[J]. 水处理技术, 2015, 41(7): 57-60, 64. |
| [57] |
Wang JT. The Efficiency and characteristic research on enhanced biological denitrification and phosphorus removal of CSFM-BF[D]. Ji'nan: Master's Thesis of University of Jinan, 2015 (in Chinese) 王娟婷.钙硅滤料-生物滤池强化生物脱氮除磷效能及特性研究[D].济南: 济南大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10427-1015443660.htm |
| [58] |
Gao JF, Zhou XQ, Cao YC, et al. Preparation of ceramic filter and its application in wastewater treatment[J]. Ship & Ocean Engineering, 2009, 38(2): 103-105. (in Chinese) 高健发, 周小琴, 曹玉成, 等. 陶粒的研制及其在污水处理中的应用[J]. 船海工程, 2009, 38(2): 103-105. DOI:10.3963/j.issn.1671-7953.2009.02.033 |
| [59] |
Bao MT, Tian YM, Chen QG. Application of alginate embedded immobilized microbes in oil wastewater treatment[J]. Environmental Science & Technology, 2012, 35(2): 167-172. (in Chinese) 包木太, 田艳敏, 陈庆国. 海藻酸钠包埋固定化微生物处理含油废水研究[J]. 环境科学与技术, 2012, 35(2): 167-172. DOI:10.3969/j.issn.1003-6504.2012.02.036 |
| [60] |
Song LM, Li M, Ni YX, et al. Preparation of beta-cypermethrin/sodium alginate/chitosan hydrogel microsphere[J]. Applied Chemical Industry, 2016, 45(11): 2118-2120, 2124. (in Chinese) 宋丽敏, 李明, 倪雅欣, 等. 高效氯氰菊酯/海藻酸钠/壳聚糖凝胶微球的制备[J]. 应用化工, 2016, 45(11): 2118-2120, 2124. |
| [61] |
Luo L, Zhao ZG, Huang XL, et al. Isolation, identification, and optimization of culture conditions of a bioflocculant-producing bacterium Bacillus megaterium SP1 and its application in aquaculture wastewater treatment[J]. Biomed Research International, 2016, 2016: 2758168. |
| [62] |
Xin ML, Song AH, Wang ZG, et al. Study on COD degradation capability of Bacillus combinations[J]. Journal of Guangxi Academy of Sciences, 2016, 32(3): 215-220. (in Chinese) 辛美丽, 宋爱环, 王志刚, 等. 芽孢杆菌组合对海水养殖水体COD的降解效果[J]. 广西科学院学报, 2016, 32(3): 215-220. |
| [63] |
Zhong N, Deng ZX, Wei Y, et al. Effect of concentration of organic matter on the composition of microbial community on carrier surfaces in BAF[J]. Environmental Science & Technology, 2015, 38(S1): 30-33. (in Chinese) 钟宁, 邓志新, 魏艳, 等. BAF有机物浓度对填料生物相的影响研究[J]. 环境科学与技术, 2015, 38(S1): 30-33. |
| [64] |
Li ZJ, Lin L, Yang YY, et al. Influence of Bacillus on the microbial communities in shrimp ponds[J]. Journal of Agro-Environment Science, 2007, 26(3): 1183-1189. (in Chinese) 李卓佳, 林亮, 杨莺莺, 等. 芽孢杆菌制剂对虾池环境微生物群落的影响[J]. 农业环境科学学报, 2007, 26(3): 1183-1189. DOI:10.3321/j.issn:1672-2043.2007.03.075 |
 2018, Vol. 45
2018, Vol. 45




