扩展功能
文章信息
- 杨艺滢, 陈偿, 罗鹏, 丁雄祺, 谢媚
- YANG Yi-Ying, CHEN Chang, LUO Peng, DING Xiong-Qi, XIE Mei
- 环介导等温扩增技术快速检测施罗氏弧菌(Vibrio shilonii)
- Detection of Vibrio shilonii by using Loop-mediated isothermal amplification (LAMP)
- 微生物学通报, 2018, 45(9): 1871-1880
- Microbiology China, 2018, 45(9): 1871-1880
- DOI: 10.13344/j.microbiol.china.170999
-
文章历史
- 收稿日期: 2017-11-26
- 接受日期: 2018-03-21
- 网络首发日期(www.cnki.net): 2018-03-22
2. 中国科学院南海海洋研究所 广东省应用海洋生物学重点实验室 广东 广州 510301;
3. 中国科学院南海海洋研究所 西沙、南沙深海海洋环境观测研究站 广东 广州 510301;
4. 中国科学院大学 北京 100049
2. Guangdong Provincial Key Laboratory of Applied Marine Biology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou, Guangdong 510301, China;
3. Xisha/Nansha Ocean Oberservation and Research Station, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangzhou, Guangdong 510301, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
珊瑚礁是一个复杂的生境,其生态系统是海洋中生产力水平极高的生态系统之一,具有极其重要的生态功能[1],有“海洋中的热带雨林”之称[2]。但近年来全球范围内的珊瑚礁生态系统正在遭受严重威胁与破坏,最直观的表现就是珊瑚白化。珊瑚白化是由于珊瑚虫及其体内共生的虫黄藻所组成的共生体系崩溃而导致珊瑚变白的生态现象[3-4]。珊瑚礁白化日益严重,甚至没有停止的迹象[5]。
前人的研究报道指出大规模的珊瑚漂白事件与全球变化密切相关[6],如气候变化导致的海水温度升高和海洋酸化;而海水污染日益严重,淤泥颗粒淤积过多、过度捕捞、天敌长棘海星的暴发和暴风雨等多种因素也可导致珊瑚白化[7]。另外,由细菌引起的珊瑚疾病暴发也频有发生[8],如溶珊瑚弧菌(Vibrio coralliilyticus)在海水温度较高的情况下,可使紫色柳珊瑚[9-10]和鹿角珊瑚[3-4]产生白化和死亡;污水中常见的一种人类机会致病菌粘质沙雷氏菌(Serratia marcescens)可导致鹿角珊瑚患白斑病[11-13]。本研究的对象施罗氏弧菌(Vibrio shilonii ATCC BAA-91)是一种珊瑚细胞病原菌,它能侵入枇杷珊瑚细胞内部感染共生虫黄藻,导致枇杷珊瑚白化[14-16]。施罗氏弧菌与地中海弧菌(Vibrio mediterranei)同物异名,但地中海弧菌是否可以导致珊瑚白化还尚未得知[17]。
施罗氏弧菌的发病机制在过去的10年间被广泛研究[18],Toren和Banin等很好地阐明了施罗氏弧菌对枇杷珊瑚的致病机理,施罗氏弧菌粘附到珊瑚表面后渗透到珊瑚虫体内,其为了在珊瑚细胞内生存而产生的超氧化物歧化酶可保护自身免受氧化应激的伤害,最后产生光合作用抑制肽Toxin P抑制虫黄藻的光合作用,使珊瑚逐渐白化[19-20]。2006年,Reshef等根据施罗氏弧菌-枇杷珊瑚白化模式系统的研究提出珊瑚益生菌假说,其研究表明,珊瑚确实可通过改变自身的共生菌群以迅速适应环境的变化,最终能产生抵抗珊瑚致病菌的抵抗力[21]。但在实验室感染实验中,施罗氏弧菌能在珊瑚组织中繁殖及保留至少2周[16]。然而,施罗氏弧菌感染的宿主范围、流行病学和诊断技术的研究十分有限,因此,建立一种特异性好、灵敏度高且高效的检测方法迫在眉睫。
环介导等温扩增(Loop-mediated isothermal amplification,LAMP)检测技术是由日本学者Tomita等发明的,是在PCR的基础上建立起来的一种新型核酸扩增技术[22]。自LAMP技术发明以来就被广泛应用于各种人畜致病菌[23-27]、寄生虫病[28-29]和流感病毒[30]的快速检测。在此基础上,LAMP还被不同的研究者针对各自的研究需要进行了不同程度的改造,如Ge等[31]研发了一种以纳米粒子作为传感器进行级联入侵的耦合多重反转录的新型LAMP检测方法,可用于流感病毒3种亚型的同时检测。通过在NCBI数据库中对不同种的施罗氏弧菌以及其他弧菌属的rpoD基因进行比对分析后,本研究基于施罗氏弧菌管家基因rpoD (RNA polymerase subunit D)的种内高度保守性和种间高度特异性,建立环介导等温扩增快速检测技术,从而为野外现场快速检测以及预防珊瑚白化提供技术支撑。
1 材料与方法 1.1 材料 1.1.1 实验菌株施罗氏弧菌(Vibrio shilonii ATCC BAA-91)购自美国菌种保藏中心,溶藻弧菌(Vibrio alginolyticus XSBZ-14)[32]由海南大学海洋学院谢珍玉老师惠赠,大肠杆菌DH5α感受态细胞购自天根生化科技(北京)有限公司。副溶血弧菌(Vibrio parahaemolyticus TF2)、创伤弧菌(Vibrio vulnificus TF3)、霍乱弧菌(Vibrio cholerae HN375)、金黄色葡萄球菌(Staphylococcus aureus)[33]由本实验室提供。欧文氏弧菌(Vibrio owensii DY05)、弗尼斯弧菌(Vibrio furnissii)、坎氏弧菌(Vibrio campbellii)、嗜气芽孢杆菌(Bacillus aerophilus)分离自南海健康滨珊瑚的粘液,并已进行16S rRNA基因菌种鉴定以及各项生理生化指标检测,现由本实验室保存。
1.1.2 培养基、主要试剂和仪器2216E (Marine Broth)液体培养基,BD公司。TCBS琼脂培养基、LB液体培养基、TSB (Tryptic Soy Broth)液体培养基,广东环凯微生物技术有限公司。
pClone007 Simple Vector Kit,广州擎科新业生物技术有限公司;Premix Taq、PrimeSTAR Max Premix (2×)、DL2000 DNA Marker,6×Loading Buffer,TaKaRa公司;氨苄青霉素,广州康龙生物科技有限公司;质粒提取试剂盒、DNA纯化回收试剂盒,康宁公司;Bst 2.0 DNA聚合酶,New England BioLabs公司;Calcein、10×dNTP Mix,生工生物工程(上海)股份有限公司。
梯度PCR仪,广州誉维生物科技仪器有限公司;恒温金属水浴锅,杭州博日科技有限公司;离心机,Thermo Fisher Scientific有限公司;可调式混匀仪,SCILOGES公司;电泳仪,Hoefer公司;凝胶成像系统,Bio-Rad公司;Thermal Cycle Dice Real Time System Ⅲ,TaKaRa公司;落地普通型大容量全温度恒温培养振荡器,上海智城分析仪器制造有限公司。
1.2 方法 1.2.1 细菌基因组DNA的提取分别将单克隆的Vibrio shilonii ATCC BAA-91、Vibrio alginolyticus XSBZ-14、Vibrio parahaemolyticus TF2、Vibrio vulnificus TF3、Vibrio cholerae HN375、Vibrio owensii DY05、Vibrio furnissii、Vibrio campbellii、Staphylococcus aureus、Bacillus aerophilus接种至2216E液体培养基中,30 ℃、200 r/min培养过夜。采用煮沸法,取500 μL菌液12 000×g离心2 min,去上清,加入100 μL灭菌的去离子水重悬,100 ℃金属浴10 min后,置于冰上2 min,12 000 ×g离心2 min,上清液作为扩增模板,-20 ℃保存备用。
1.2.2 LAMP特异性引物设计与合成根据GenBank中公布的Vibrio mediterranei CECT7873[17]的rpoD基因序列(登录号为HF542090.1),在NCBI上进行BLASTn比对分析后,基于rpoD基因的特异性区域,利用软件Primer Designer设计6条特异性引物,分别为外引物F3/B3、内引物FIP/BIP和环引物LoopF/LoopB,见表 1和图 1,引物交由广州擎科新业生物技术有限公司合成。
| 引物名称 Primers |
引物序列 Sequences (5′→3′) |
| F3 | AGACGAAGACGACGAAGA |
| B3 | CTTCACTTGACTCATTACCAGT |
| FIP* | GGCTGTCGTAACCATATTCGTTGATGAGGAAGAGGAAGAAGATACA |
| BIP* | CACATGAGTTGGTCCAAGAAGTCTCGCATGATCAGACGCTC |
| LoopF | ACCAGTTGAAGGTCTTGATAGC |
| LoopB | CGCACTTCTATGGATCGTGTA |
| 注:*:FIP与BIP分别由F1c和F2、B1c和B2组成. Note: *: FIP and BIP consist of F1c and F2, B1c and B2 respectively. | |

|
| 图 1 各引物的序列顺序及其在基因序列中的对应位置 Figure 1 Sequence of primers and the binding regions of primers |
|
|
扩增反应体系参考庞耀珊等的方法[34]并进行一定优化:25 μL反应体系:10×Isothermal Amplification Buffer 2.5 μL,8 U/μL Bst DNA polymerase 1 μL,100 mmol/L MgSO4 1.5 μL,10 mmol/L dNTP Mix 3.5 μL,40 μmol/L FIP/BIP 1 μL,10 μmol/L F3/B3 0.5 μL,10 μmol/L LoopF/LoopB 1 μL,10 mmol/L MnCl2 1.25 μL,10 mmol/L甜菜碱4 μL,1 mmol/L钙黄绿素2 μL,待检测菌株DNA 2 μL (阴性对照以2 μL灭菌水替代),灭菌水补充至25 μL。反应条件为:65 ℃金属浴反应60 min,80 ℃灭活10 min。反应结束后,直接观察反应结果颜色的变化,或者用1.5%的琼脂糖凝胶电泳30 min,电压135 V,检测扩增结果。
1.2.4 LAMP特异性检测Vibrio shilonii ATCC BAA-91、Vibrio alginolyticus XSBZ-14、Vibrio parahaemolyticus TF2、Vibrio vulnificus TF3、Vibrio cholerae HN375、Vibrio owensii DY05、Vibrio furnissii、Vibrio campbellii、Staphylococcus aureus、Bacillus aerophilus共10株菌用于验证1.2.3中建立的LAMP检测方法针对Vibrio shilonii的特异性,基于以上10株细菌的基因组进行LAMP检测,反应体系和反应条件同1.2.3。
1.2.5 LAMP灵敏度检测根据GenBank中公布的Vibrio mediterranei的rpoD基因序列(登录号为HF542090.1),利用Primer Primer 5软件设计特异性引物对rpoD-F/rpoD-R,利用Primer Express 3.0.1设计荧光定量PCR引物对QrpoD1-F/QrpoD1-R (表 2),引物交由广州擎科新业生物技术有限公司合成。
| 引物名称 Primers |
引物序列 Sequences (5′→3′) |
| rpoD-F | CTGAGCTTTCTGAAGCGGA |
| rpoD-R | GTCAGAGGCAAGTACTTC |
| M13F | TGTAAAACGACGGCCAGT |
| M13R | CAGGAAACAGCTATGACC |
| QrpoD1-F | TCGACCCTGAACTTGCTCTAGAG |
| QrpoD1-R | ACCTGTGGGCTGTCGTAACC |
以施罗氏弧菌DNA为模板,基于表 2中设计的引物对rpoD-F/rpoD-R PCR扩增一段大小为425 bp的序列,此序列包含LAMP检测方法的靶序列。PCR反应条件:95.0 ℃ 5 min;95 ℃ 20 s,55 ℃ 20 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。
用DNA纯化回收试剂盒对PCR扩增产物进行纯化得到目的片段,将其克隆到pClone007 Simple Vector中,构建重组质粒pClone007-rpoD,然后转化到大肠杆菌DH5α中,于添加100 mg/mL氨苄青霉素抗性的LB平板上挑取克隆,再利用引物对M13F/M13R通过菌液PCR检测含有目的片段的重组子,测序验证。
将测序结果正确的重组子放大培养,用质粒提取试剂盒提取质粒pClone007-rpoD,浓度为90 ng/μL。根据公式[35]计算质粒的拷贝数为3.641×1013 cps/mL。将pClone007-rpoD重组质粒用灭菌水进行梯度稀释得到不同浓度的质粒作为扩增模板,浓度分别为1012-101 cps/mL,阴性对照添加无菌水替代质粒。分别用常规PCR、LAMP和荧光定量PCR法,利用1.5%琼脂糖凝胶电泳鉴定检测常规PCR和LAMP扩增结果,并比较3种方法的灵敏度。
1.2.6 海水样品检测采集珊瑚养殖缸中的人工海水50 mL。将施罗氏弧菌BAA-91接种至TSB液体培养基中培养过夜,再用所采集的人工海水对施罗氏弧菌BAA-91进行不同浓度的稀释:(1)将稀释后的各稀释液取100 μL分别涂布于TCBS平板上进行菌落计数;(2)同时取1 mL各稀释液直接用水煮法提取DNA,再取2 μL DNA作为LAMP扩增模板,每个稀释浓度做3个平行。在反应结束后,观察反应产物的颜色变化,并利用1.5%琼脂糖凝胶电泳鉴定扩增结果。
1.2.7 LAMP扩增结果检测LAMP扩增结果可视化采用钙黄绿素显色法,通过肉眼观察反应产物的颜色变化,阳性反应产物呈亮绿色,而阴性对照则为浅橙黄色。此外,反应产物还可用凝胶电泳检测扩增结果,阳性反应其产物电泳结果呈梯状条带,反之则无条带。
2 结果与分析 2.1 LAMP检测方法的建立及其特异性检测LAMP扩增反应结束后,钙黄绿素荧光显色法检测结果显示,11个扩增反应中,只有Vibrio shilonii的基因组DNA呈现亮绿色,判断为阳性,其他10个对照样品,分别为Vibrio alginolyticus XSBZ-14、Vibrio parahaemolyticus TF2、Vibrio vulnificus TF3、Vibrio cholerae HN375、Vibrio campbellii、Vibrio owensii DY05、Vibrio furnissii、Bacillus aerophilus、Staphylococcus aureus以及阴性对照(添加无菌水),扩增前后均无颜色变化,呈浅橙黄色,判断为阴性(图 2A)。凝胶电泳检测结果显示,11个扩增反应中,只有Vibrio shilonii的基因组DNA呈现LAMP特异性梯状条带,而其他9种细菌和阴性对照均未见LAMP特异性梯状条带(图 2B)。实验结果表明,基于rpoD基因建立的LAMP检测方法对Vibrio shilonii具有较高的特异性。

|
| 图 2 LAMP特异性检测钙黄绿素显色结果(A)和凝胶电泳结果(B) Figure 2 The product specificity of LAMP viualized with Calcein (A) and agarose gel electrophoresis (B) 注:M:100 bp DNA ladder;1:施罗氏弧菌;2:溶藻弧菌;3:副溶血弧菌;4:创伤弧菌;5:霍乱弧菌;6:坎氏弧菌;7:欧文氏弧菌;8:嗜气芽孢杆菌;9:弗尼斯弧菌;10:金黄色葡萄球菌;N:阴性对照. Note: M: 100 bp DNA ladder; 1: Vibrio shilonii ATCC BAA-91; 2: Vibrio alginolyticus XSBZ-14; 3: Vibrio parahaemolyticus TF2; 4: Vibrio vulnificus TF3; 5: Vibrio cholerae HN375; 6: Vibrio campbellii; 7: Vibrio owensii DY05; 8: Bacillus aerophilus; 9: Vibrio furnissii; 10: Staphylococcus aureus; N: Negative control. |
|
|
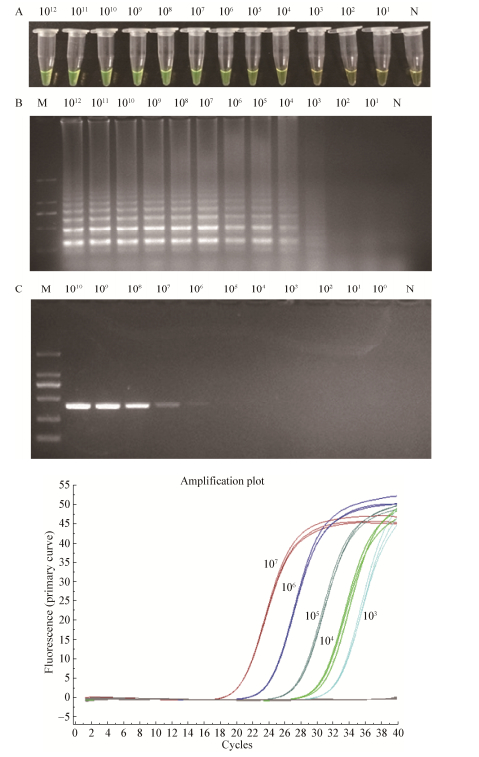
通过构建包含rpoD基因的重组质粒,检测LAMP方法的灵敏性,同时与荧光定量PCR以及普通PCR进行灵敏度比较分析。实验结果显示,LAMP对10倍系列稀释的质粒DNA最低检测限为103拷贝(图 3A、B),与荧光定量PCR方法相当(图 3D),但比常规PCR敏感1 000倍(图 3C)。
|
| 图 3 LAMP灵敏度检测钙黄绿素显色结果(A)、凝胶电泳结果(B)、常规PCR结果(C)和荧光定量PCR结果(D) Figure 3 The detection sensitivity of LAMP (A and B), comparison to conventional PCR (C) and real-time PCR (D) 注:N:阴性对照;M:Marker DL2000. Note: N: Negative control; M: Marker DL2000. |
|
|
海水样品中添加了Vibrio shilonii ATCC BAA-91以制备模拟样品。经平板计数,浓度为1.3×107 CFU/mL,图 4显示的是人工模拟样品的检测结果。如图 4所示,LAMP在模拟海水样品中的检测灵敏度为1.3×102 CFU/mL,当菌浓度低于1.3×101 CFU/mL时无显色反应,与电泳结果一致(图 4)。

|
| 图 4 海水样品检测钙黄绿素检测结果(A)和凝胶电泳结果(B) Figure 4 The detection limit directly from sea water visualized with Calcein (A) and agarose gel electrophoresis (B) 注:M:Marker DL2000;N:阴性对照. Note: M: Marker DL2000; N: Negative control. |
|
|
珊瑚白化正在严重威胁和破坏着全球珊瑚礁的健康,严重影响了珊瑚礁生态系统的平衡,其中由细菌引起的导致主要造礁珊瑚死亡白化是阻碍珊瑚礁生态恢复的一个重要因素[36]。随着全球气候的变化,如海水温度异常升高、海洋酸化等加大了珊瑚致病菌的危害,施罗氏弧菌作为导致珊瑚白化的重要致病菌之一[14-16],其感染的宿主范围、流行病学和诊断技术的研究十分有限,因此建立特异性好、灵敏度高且准确性好的施罗氏弧菌检测技术,对野外现场快速检测以及预防珊瑚白化具有重要意义。
本实验针对施罗氏弧菌的rpoD基因设计了6条特异性引物,从而保证了LAMP反应的特异性和灵敏度。本研究中应用了具有链置换活性的高效Bst DNA聚合酶,使得LAMP可以在等温条件下快速反应。通过灵敏度测试发现,LAMP比常规PCR敏感1 000倍(图 3B、C),具有与荧光定量PCR等同的灵敏度,最低检测限度可达到3.641×103 cps/mL (图 3B、D);此外,通过模拟野外海水样品检测发现,LAMP对海水样品中施罗氏弧菌的检测限度可达1.3×102 CFU/mL,具有与其他研究者相当的检测限度[25],说明海水成分中高浓度的盐离子对LAMP检测体系以及检测结果影响不大。综合比较分析本研究的3种检测方法,常规PCR和荧光定量PCR需要依赖昂贵的PCR仪,而LAMP仅需一个恒温水浴锅,操作简单方便,因此在上述3种检测方法中LAMP法在野外现场病原菌检测中最具优势。
早期LAMP技术针对靶基因的6个区域设计4条特异引物,随着技术的改进,添加2条环引物使得DNA合成效率大大增加。LAMP扩增产物的检测方法主要有浊度检测[37]、荧光显色[38]和凝胶电泳检测。LAMP反应过程中,随着DNA大量合成,形成一种副产物焦磷酸根离子,而焦磷酸根离子与体系中的镁离子结合形成沉淀。沉淀的产生引起反应液浊度的变化,可利用浊度仪实时监测并记录浊度的变化,当浊度达到一定浓度时[26],可通过凝胶电泳形成特异性“梯形条带”。钙黄绿素是一种螯合剂,在锰离子存在时被淬灭不发光。随着LAMP反应的进行,阳性反应会形成大量的焦磷酸根,与钙黄绿素竞争锰离子,当钙黄绿素游离出来便可自发荧光,由原本的橘黄色变成亮绿色。本实验中,我们在反应体系中加入2 μL 1 mmol/L的钙黄绿素和1.25 μL 10 mmol/L的MnCl2,使得反应从开始至结束均不需要打开反应管,可避免产生假阳性,检测时间短,直接观察颜色变化,就可判读反应结果。
综上所述,本研究所建立的LAMP检测技术检测速度快、灵敏度高、特异性好,还简化了检测操作和设备要求,适用于实验条件差的野外现场珊瑚致病菌的快速检测。
| [1] |
Zhao MX, Yu KF, Zhang QM. Review on coral reefs biodiversity and ecological function[J]. Acta Ecologica Sinica, 2006, 26(1): 186-194. (in Chinese) 赵美霞, 余克服, 张乔民. 珊瑚礁区的生物多样性及其生态功能[J]. 生态学报, 2006, 26(1): 186-194. DOI:10.3321/j.issn:1000-0933.2006.01.025 |
| [2] |
Wang LR, Zhao HT. The general characteristics of the coral reef ecosystem[J]. Chinese Journal of Ecology, 2001, 20(6): 41-45. (in Chinese) 王丽荣, 赵焕庭. 珊瑚礁生态系的一般特点[J]. 生态学杂志, 2001, 20(6): 41-45. DOI:10.3321/j.issn:1000-4890.2001.06.011 |
| [3] |
Ben-Haim Y, Thompson FL, Thompson CC, et al. Vibrio coralliilyticus sp. nov., a temperature-dependent pathogen of the coral Pocillopora damicornis[J]. International Journal of Systematic & Evolutionary Microbiology, 2013, 53(1): 309-315. |
| [4] |
Li S, Yu KF. Recent development in coral reef bleaching research[J]. Acta Ecologica Sinica, 2007, 27: 2059-2069. (in Chinese) 李淑, 余克服. 珊瑚礁白化研究进展[J]. 生态学报, 2007, 27(5): 2059-2069. DOI:10.3321/j.issn:1000-0933.2007.05.047 |
| [5] |
Zhao J. The severe phenomenon of coral reef bleaching in the world[J]. Ecological Economy, 2016, 32(8): 2-5. (in Chinese) 赵静. 全球珊瑚礁白化现象严重[J]. 生态经济, 2016, 32(8): 2-5. DOI:10.3969/j.issn.1671-4407.2016.08.001 |
| [6] |
Ben-Haim Y, Zicherman-Keren M, Rosenberg E. Temperature-regulated bleaching and lysis of the coral Pocillopora damicornis by the novel pathogen Vibrio coralliilyticus[J]. Applied and Environmental Microbiology, 2003, 69(7): 4236-4242. DOI:10.1128/AEM.69.7.4236-4242.2003 |
| [7] |
Anthony KRN, Connolly SR, Hoegh-Guldberg O. Bleaching, energetics, and coral mortality risk: Effects of temperature, light, and sediment regime[J]. Limnology and Oceanography, 2007, 52(2): 716-726. DOI:10.4319/lo.2007.52.2.0716 |
| [8] |
Hoegh-Guldberg O. Climate change, coral bleaching and the future of the world's coral reefs[J]. Marine and Freshwater Research, 1999, 50(8): 839-866. DOI:10.1071/MF99078 |
| [9] |
Bally M, Garrabou J. Thermodependent bacterial pathogens and mass mortalities in temperate benthic communities: a new case of emerging disease linked to climate change[J]. Global Change Biology, 2007, 13(10): 2078-2088. DOI:10.1111/gcb.2007.13.issue-10 |
| [10] |
Vezzulli L, Colwell RR, Pruzzo C. Ocean warming and spread of pathogenic Vibrios in the aquatic environment[J]. Microbial Ecology, 2013, 65(4): 817-825. DOI:10.1007/s00248-012-0163-2 |
| [11] |
Patterson KL, Porter JW, Ritchie KB, et al. The etiology of white pox, a lethal disease of the Caribbean elkhorn coral, Acropora palmata[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(13): 8725-8730. DOI:10.1073/pnas.092260099 |
| [12] |
Sutherland KP, Ritchie KB. White pox disease of the Caribbean Elkhorn Coral, Acropora palmate[A]//Rosenberg E, Loya Y. Coral Health and Disease[M]. Herdelberg, Berlin: Springer, 2004: 289-300 https://link.springer.com/chapter/10.1007%2F978-3-662-06414-6_16
|
| [13] |
Sutherland KP, Shaban S, Joyner JL, et al. Human pathogen shown to cause disease in the threatened eklhorn coral Acropora palmata[J]. PLoS One, 2011, 6(8): e23468. DOI:10.1371/journal.pone.0023468 |
| [14] |
Kushmaro A, Banin E, Loya Y, et al. Vibrio shiloi sp. nov., the causative agent of bleaching of the coral Oculina patagonica[J]. International Journal of Systematic and Evolutionary Microbiology, 2001, 51(4): 1383-1388. DOI:10.1099/00207713-51-4-1383 |
| [15] |
Banin E, Israely T, Kushmaro A, et al. Penetration of the coral-bleaching bacterium Vibrio shiloi into Oculina patagonica[J]. Applied and Environmental Microbiology, 2000, 66(7): 3031-3036. DOI:10.1128/AEM.66.7.3031-3036.2000 |
| [16] |
Banin E, Israely T, Fine M, et al. Role of endosymbiotic zooxanthellae and coral mucus in the adhesion of the coral-bleaching pathogen Vibrio shiloi to its host[J]. FEMS Microbiology Letters, 2001, 199(1): 33-37. DOI:10.1111/fml.2001.199.issue-1 |
| [17] |
Fabiano FL, Hoste B, Thompson CC, et al. The coral bleaching Vibrio shiloi Kushmaro et al. 2001 is a later synonym of Vibrio mediterranei Pujalte and Garay 1986[J]. Systematic and Applied Microbiology, 2001, 24(4): 516-519. DOI:10.1078/0723-2020-00065 |
| [18] |
Rosenberg E, Falkovitz L. The Vibrio shiloi/Oculina patagonica model system of coral bleaching[J]. Annual Review of Microbiology, 2004, 58: 143-159. DOI:10.1146/annurev.micro.58.030603.123610 |
| [19] |
Toren A, Landau L, Kushmaro A, et al. Effect of temperature on adhesion of Vibrio strain AK–1 to Oculina patagonica and on coral bleaching[J]. Applied and Environmental Microbiology, 1998, 64(4): 1379-1384. |
| [20] |
Banin E, Vassilakos D, Orr E, et al. Superoxide dismutase is a virulence factor produced by the coral bleaching pathogen Vibrio shiloi[J]. Current Microbiology, 2003, 46(6): 418-422. DOI:10.1007/s00284-002-3912-5 |
| [21] |
Reshef L, Koren O, Loya Y, et al. The coral probiotic hypothesis[J]. Environmental Microbiology, 2006, 8(12): 2068-2073. DOI:10.1111/emi.2006.8.issue-12 |
| [22] |
Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products[J]. Nature Protocols, 2008, 3(5): 877-882. DOI:10.1038/nprot.2008.57 |
| [23] |
Wang H, Huang Q, Huang JF, et al. Rapid detections of OprD2 gene in Pseudomoas aeruginosa using loop-mediated isothermal amplification[J]. Chinese Journal of Laboratory Medicine, 2013, 36(6): 543-547. (in Chinese) 王欢, 黄庆, 黄君富, 等. 铜绿假单胞菌OprD2基因环介导等温扩增快速检测技术的研究[J]. 中华检测医学杂志, 2013, 36(6): 543-547. |
| [24] |
Xu YM, Zhou DY, Tang F, et al. Design and analysis of LAMP primers used in differentially detecting Yersinia enterocolitica and Brucella spp.[J]. Chinese Journal of Laboratory Diagnosis, 2013, 17(1): 19-22. (in Chinese) 徐云明, 周德颖, 唐峰, 等. 区别检测小肠结肠炎耶尔森氏菌与布鲁氏菌LAMP引物的设计与分析[J]. 中国实验诊断学, 2013, 17(1): 19-22. DOI:10.3969/j.issn.1007-4287.2013.01.006 |
| [25] |
Xiao LP. Application and study of LAMP technique in the detection of Salmonella in infectious diarrhea[J]. Chinese Journal of Health Laboratory Technology, 2015, 25(24): 4240-4242. (in Chinese) 肖丽萍. 环介导技术在感染性腹泻沙门菌检测中的应用与研究[J]. 中国卫生检验杂志, 2015, 25(24): 4240-4242. |
| [26] |
Zhou Y, Wang Q, Cai ZH, et al. Loop-mediated isothermal amplification-based rapid detection for Shigella dysenteriae in food samples[J]. Microbiology China, 2017, 44(9): 2247-2254. (in Chinese) 周杨, 万强, 蔡芷荷, 等. 环介导等温扩增技术在食品中痢疾志贺氏菌快速检测[J]. 微生物学通报, 2017, 44(9): 2247-2254. |
| [27] |
Ding WC, Hu JR, Shi YH, et al. Establishment of loop-mediated isothermal amplification for detection of Vibrio alginolyticus[J]. Journal of Molecular Cell Biology, 2009, 42(1): 70-76. (in Chinese) 丁文超, 胡健饶, 史雨红, 等. 环介导恒温扩增技术快速检测溶藻弧菌[J]. 分子细胞生物学报, 2009, 42(1): 70-76. |
| [28] |
Zhang YY, Ye Q, Wang ZR, et al. Preliminary exploration of loop-mediated isothermal amplification based on cox2 gene of Echinococcus granulosus[J]. Chinese Journal of Parasitology and Parasitic Diseases, 2017, 35(2): 169-172. (in Chinese) 张艳艳, 叶倩, 王正荣, 等. 基于cox2基因的细粒棘球绦虫环介导等温扩增检测方法的初步建立[J]. 中国寄生虫学与寄生虫病杂志, 2017, 35(2): 169-172. |
| [29] |
Ponce C, Kaczorowski F, Perpoint T, et al. Diagnostic accuracy of loop-mediated isothermal amplification (LAMP) for screening patients with imported malaria in a non-endemic setting[J]. Parasite, 2017, 24: 53. DOI:10.1051/parasite/2017054 |
| [30] |
Sharma V, Chaudhry D, Kaushik S. Evaluation of clinical applicability of reverse transcription-loop-mediated isothermal amplification assay for detection and subtyping of Influenza a viruses[J]. Journal of Virological Methods, 2018, 253: 18-25. DOI:10.1016/j.jviromet.2017.12.005 |
| [31] |
Ge YY, Zhou Q, Zhao KC, et al. Detection of influenza viruses by coupling multiplex reverse-transcription loop-mediated isothermal amplification with cascade invasive reaction using nanoparticles as a sensor[J]. International Journal of Nanomedicine, 2017, 2017(12): 2654-2656. |
| [32] |
Xie ZY, Ke SW, Hu CQ, et al. First characterization of bacterial pathogen, Vibrio alginolyticus, for Porites andrewsi White syndrome in the South China Sea[J]. PloS One, 2013, 8(9): e75425. DOI:10.1371/journal.pone.0075425 |
| [33] |
Tian YS, Chen T, Huang W, et al. A new L-type lectin (LvLTLC1) from the shrimp Litopenaeus vannamei facilitates the clearance of Vibrio harveyi[J]. Fish and Shellfish Immunology, 2018, 73: 185-191. DOI:10.1016/j.fsi.2017.12.011 |
| [34] |
Pang YS, Xie ZX, Xie LJ, et al. Development and application of visual loop mediated isothermal amplification (LAMP) assay for shrimp (Penacus orientalis) White spot syndrome virus[J]. Journal of Agricultural Biotechnology, 2013, 21(8): 1002-1008. (in Chinese) 庞耀珊, 谢芝勋, 谢丽基, 等. 对虾白斑综合征病毒可视化环介导等温扩增(LAMP)检测技术的建立与应用[J]. 农业生物技术学报, 2013, 21(8): 1002-1008. DOI:10.3969/j.issn.1674-7968.2013.08.014 |
| [35] |
Tarazona E, Lucena T, Arahal DR, et al. Multilocus sequence analysis of putative Vibrio mediterranei strains and description of Vibrio thalassae sp. nov.[J]. Systematic and Applied Microbiology, 2014, 37(5): 320-328. DOI:10.1016/j.syapm.2014.05.005 |
| [36] |
Zhao Z, Ren CH, Jiang X, et al. Comparative study of specificity and sensitivity for IHHNV detection between Real-time PCR and LAMP methods[J]. Acta Hydrobiologica Sinica, 2010, 34(5): 984-989. (in Chinese) 赵哲, 任春华, 江晓, 等. 荧光定量PCR与LAMP检测IHHNV的特异性和灵敏性比较[J]. 水生生物学报, 2010, 34(5): 984-989. |
| [37] |
Huang LY, Yu KF. Review on coral disease: types, ecological influences and the relationships with environmental factors[J]. Acta Ecologica Sinica, 2010, 30(5): 1328-1340. (in Chinese) 黄玲英, 余克服. 珊瑚疾病的主要类型、生态危害及其与环境的关系[J]. 生态学报, 2010, 30(5): 1328-1340. |
| [38] |
Mekata T, Sudhakaran R, Kono T, et al. Real-time reverse transcription loop-mediated isothermal amplification for rapid detection of yellow head virus in shrimp[J]. Journal of Virological Methods, 2009, 162(1/2): 81-87. |
| [39] |
Zhang YW, Li XN, Guo PP, et al. Fluorescent reagent in detection of porcine reproductive and respiratory syndrome virus by Loop-mediated isothermal amplification (LAMP)[J]. Journal of Agricultural Biotechnology, 2010, 18(3): 508-513. (in Chinese) 张跃伟, 李旭妮, 郭盼盼, 等. 荧光显色在环介导等温扩增(LAMP)检测猪繁殖与呼吸综合征病毒的应用[J]. 农业生物技术学报, 2010, 18(3): 508-513. DOI:10.3969/j.issn.1674-7968.2010.03.015 |
 2018, Vol. 45
2018, Vol. 45




