扩展功能
文章信息
- 朱振宇, 华垚堃, 胡婷婷, 张梦君, 杨宇, 高宇
- ZHU Zhen-Yu, HUA Yao-Kun, HU Ting-Ting, ZHANG Meng-Jun, YANG Yu, GAO Yu
- 微生物金属响应蛋白研究进展
- Advances in microbial metal response proteins
- 微生物学通报, 2018, 45(8): 1794-1803
- Microbiology China, 2018, 45(8): 1794-1803
- DOI: 10.13344/j.microbiol.china.170447
-
文章历史
- 收稿日期: 2017-06-22
- 接受日期: 2017-12-28
- 网络首发日期(www.cnki.net): 2018-07-14
金属离子对生物体的生长代谢具有重要意义,尤其在细菌中,大部分蛋白质功能结构的实现都需要金属的参与。由于低浓度的金属离子也有可能对细胞造成毒害,所以对细菌来说,以某种方式感应金属存在并迅速适应外界环境是非常重要的,这需要多个金属响应蛋白家族的参与。本实验室在对隐藏嗜酸菌Cr(Ⅵ)还原特性及相关基因的差异表达研究中,发现菌种金属响应蛋白在微生物抗逆性、金属氧化还原能力等有着重要的作用,进而开展金属响应蛋白下游基因结合位点等方面的进一步研究[1]。
环境中金属含量、生物有效性变化及细菌本身代谢活动都能引起金属内需变化,如含氧量、含水量、pH值、吸附/解吸过程、盐度、有机质含量、硫酸盐和碳酸盐含量等外界环境变化,都能使细菌遭遇金属过量或缺乏的状况。因此,金属响应转录调节因子必须起到调节金属内稳态的作用,包括调节细胞代谢与环境金属生物有效性。
目前,在细菌中研究较为透彻的金属响应蛋白主要有7个家族[2],分为Ars R-Smt B、Mer R、Cso R-Rcn R、Cop Y、Dtx R、Fur和Nik R。金属响应蛋白属于调节蛋白家族,其主要功能为调节下游相关基因的转录,不属于主要与金属感应相关的感应蛋白家族,不包括金属响应(Extra cytoplasmic function,ECF)起始转录因子和双组分调节系统。
1 金属响应蛋白家族简介金属响应蛋白的7个主要家族中,每个家族的不同代表蛋白响应不同的金属以调节基因的表达,而不同家族的代表蛋白也可能响应相同的金属。如表 1所示:Fur家族包括铁吸收调节蛋白Fur、锌吸收调节蛋白Zur[3-4]、锰吸收调节蛋白Mur和镍吸收调节蛋白Nur[5]。Dtx R家族包括铁响应蛋白(白喉毒素调节蛋白Dtx R,铁依赖性调节蛋白Ide R,葡萄球菌铁调节阻遏物Sir R)、锰和镉响应蛋白(锰转运调节蛋白Mnt R,链球菌共聚焦-介电粘合调节蛋白Sca R)、锰和锌响应蛋白(操纵子调节蛋白Tro R)[6-8]。Nik R家族代表只响应镍,为镍响应蛋白[9]。Mer R家族包含汞响应蛋白Mer R[10],镉、铅、锌响应蛋白(锌输送调节蛋白Znt R[11],铅响应调节蛋白Pbr R[12],铜和金响应蛋白(铜外排调节蛋白Cue R;金抗逆性响应蛋白Gol S)[13-14],钴响应蛋白(钴输送P型ATPase调节蛋白Coa R)。Ars R-Smt B家族包含锌响应蛋白(金属硫蛋白调节蛋白Smt B;锌转运P型ATP酶调节蛋白Zia R),锌和钴响应蛋白(钴和锌抗逆性调节蛋白Czr A)[15],砷、锑、铋响应蛋白(砷调节蛋白Ars R)[16],镉、铅、锌响应蛋白(镉抗逆性调节蛋白Cad C[17],鱼腥藻锌转运调节蛋白Azt R[18]),镉、铅响应蛋白(结核分枝杆菌调节蛋白Cmt R[19]),镍、钴响应蛋白(镍结核分枝杆菌调节蛋白Nmt R;镍结核分枝杆菌调节蛋白Kmt R)[20],铜、银、锌、镉响应蛋白(颤藻属短的P型ATP酶和金属硫蛋白调节蛋白Bxm R)[21]。Cso R-Rcn R家族包括铜响应蛋白(铜响应操纵子调节蛋白Cso R[22-23]),镍、钴响应蛋白(钴和镍阻遏物调节蛋白Rcn R)[24]。Cop Y家族代表全为铜离子响应蛋白,为铜P型ATPase调节蛋白[25]。
| Type | Metal responsive proteins families | Metal availability | Family other representatives |
| Co-repression | Fur | Fe, Zn, Mn, Ni | Zur, Mur, Nur |
| Dtx R | Fe, Mn, Cd, Zn | Ide R, Mnt R, Sca R, Sir R, Tro R | |
| Nik R | Ni | None | |
| Activition | Mer R | Hg, Zn, Cd, Pb, Cu, Au, Ag, Co | Znt R, Pbr R, Cue R, Gol S, Coa R |
| De-repression | Ars R-Smt B | As, Sb, Bi, Zn, Cd, Pb, Co, Ni, Cu, Ag | Cad C, Azt R, Zia R, Cmt R, Czr A, Nmt R, Kmt R, Bxm R |
| Cso R-Rcn R | Cu, Ni, Co | None | |
| Cop Y | Cu | None |
此外,还有一些属于其他结构不同调节因子的金属响应蛋白,其家族成员并不主要参与金属响应[26],但能调节下游基因表达。如:Tet R家族锌响应蛋白,Scz A[27]和Lys R家族钼酸盐响应蛋白Mod E等[28-29];还存在多个双组分调节系统,能通过检测细胞质膜外金属水平以控制相关基因的表达[30],如Cus R/S双组分系统响应大肠杆菌细胞周质中的过剩铜,并触发Cus系统控制的铜离子输出泵[30-31]。胞质内(ECF) σ因子也可以通过跨膜信号传导级联响应胞外金属效应物而改变基因表达[32-34],与大肠杆菌Fec ⅠRA信号级联类似,即在Fec Ⅰ二核酸柠檬酸铁与外膜中的Fec A结合的情况下,将信号传递到细胞质膜中的Fec R,诱导细胞溶质Fec Ⅰ的激活进而启动了fec ABCDE转运基因的转录[32]。
2 金属响应蛋白调节机制简述金属响应蛋白家族的调节反应,需要结合正确的金属效应物(金属离子、金属伴侣蛋白、金属转运蛋白等),继而引发基因表达的变构调控。金属响应转录调节因子可以响应胞内不同金属离子水平,这些金属响应蛋白的特异性来源于每个响应蛋白对特定金属效应物具有高度亲和力,而对其他金属效应物亲和力较弱。这些蛋白质的金属亲和力可能遵循一种普遍的偏好顺序。对于必需的二价金属离子,遵循Irving-Williams稳定性顺序:Mn2+ < Fe2+ < Ni2+ < Cu2+(Cu+) > Zn2+。因此,稳定性顺序中,位置越高的金属(如锌和铜)倾向于与所有金属响应蛋白具有高度亲和力。
此外,影响金属响应蛋白结合并响应金属效应物的因素,还包括响应蛋白与金属转运蛋白或金属伴侣蛋白的特异性相互作用。例如,来自肠球菌的铜响应蛋白Cop Y可以从Cop Z铜伴侣蛋白中获得铜。因此,响应蛋白与特定金属转运蛋白形成异源二聚体的能力也可以确定它们是否可以结合细菌内的特定金属效应物[35]。所以,对于一些金属响应蛋白,可能通过金属效应物与相应的氨基酸残基结合来感应金属,也可能通过与其他蛋白质附加配体相结合来感应。
一些金属响应蛋白作用于单个靶基因,而另一些金属响应蛋白作为全局调控因子起作用,并响应于特定金属的含量从而改变多个基因的表达,包括编码主要参与金属内稳态的蛋白质基因,如金属离子的输入、输出、隔离(如金属硫蛋白)、储存(如储铁蛋白)、解毒(如金属还原酶和氧化酶)和胞内金属转运(金属伴侣蛋白)。此外,一些金属响应蛋白还具有调控除金属稳态以外的蛋白表达,如氧化应激抗逆性(Nur和Fur)、酸适应性(Nik R)、白喉毒素合成(Dtx R)[8]、呼吸(Fur)[36-37]和核糖体生物合成(Zur)[38]。
大肠杆菌金属响应蛋白调节机制如图 1A所示,大肠杆菌Fur控制多种基因的铁依赖性表达,在铁吸收、铁储存、三羧酸循环、致病性和氧化还原应激抗逆性中都有作用[37]。虽然它主要作为阻遏物存在,但Fur还可以直接和间接地作为转录激活因子,并涉及Ryh B的基因调节[39]。Mnt R响应锰和镉的金属含量水平,负调节表达锰质子的协同载体Mnt H[40]。两种锌响应蛋白Zur和Znt R分别调节了ABC型锌特异性输入泵(Znu ABC)[41]和锌输出泵P型ATP酶(Znt A)的表达。Nik R抑制了编码Nik ABCDE输入转运蛋白的Nik操纵子响应镍的转录[42-43],而Rcn R触发金属输出蛋白Rcn A响应于镍和钴水平升高的表达[24]。Cue R响应铜(附加银和金),并激活铜输出的P型ATP酶(Cop A)和赋予铜抗逆性的多铜氧化酶(Cue O)的转录[44]。Ars R响应砷,以触发砷抗逆性操纵子的表达。Mod E响应钼酸盐并调控钼酸盐吸收(mod)、钼喋呤合成(moa)、钼霉素硝酸还原酶(nap)、二甲基亚砜还原酶(dms)、发酵性二氢生产(fdh F和hyc)和呼吸性硝酸还原酶(nar XL)。

|
| 图 1 大肠杆菌(A)和枯草芽孢杆菌(B)中的可溶性金属响应蛋白 Figure 1 The complement of soluble metal-sensors in Escherichia coli (A) and Bacillus subtilis (B) 注:不包括双组分调节蛋白系统和ECF起始转录因子. Note: Two component regulator systems and ECF sigma factors are not included. |
|
|
枯草芽孢杆菌金属响应蛋白调节机制如图 1B所示,枯草芽孢杆菌的Fur也对多种基因进行全局性的调节,以协调铁消耗过程中的铁摄取和铁储备反应,包括储铁蛋白质合成如琥珀酸脱氢酶、乌头碱、细胞色素以及血红素、半胱氨酸和支链氨基酸的生物合成酶的下调[36]。锰响应蛋白Mnt R抑制编码ABC型锰输入泵和质子锰协同载体Mnt H的2个操纵子[45]。Zur具有锌限制性调控,Zur控制锌摄取基因(包括Znu ABC)的表达,以及几种响应锌水平升高的核糖体蛋白质旁系同源物Czr A,其调节2个锌输出泵Czc D和Cad A的表达[46]。2个相关的砷响应蛋白(Ars R和Ase R)调节具有砷抗逆性作用的基因。Cso R感应铜并触发铜输出泵的P型ATP酶(Cop A)和铜金属伴侣蛋白(Cop Z)的表达[47-48]。
经图 1对比分析大肠杆菌和枯草芽孢杆菌中金属响应转录调控因子的调节机制,可以发现在大肠杆菌中,Znt R和Cue R可以分别响应被Mer R家族激活蛋白提高的锌和铜水平,但在枯草芽孢杆菌中,这2种金属浓度水平的提高分别被去阻遏物Czr A和Cso R响应。在这2种情况下,这些响应蛋白都起着引发参与锌和铜抗逆性蛋白质表达的作用。所以,不同的细菌所含有的金属响应蛋白类型可能不同,但通常结构不同的响应蛋白在不同的细菌中可能起到相似的作用,这与金属响应蛋白的特异性及下游基因结合位点的结构特征有关,可能由于细菌横向基因转移以及广泛的融合和协调演化而产生。下面,对最具代表性的2个响应蛋白家族Ars R-Smt B和Fur进行详细介绍。
3 Ars R-Smt B响应蛋白家族及结合位点结构特征简述 3.1 Ars R-Smt B响应蛋白家族Ars R-Smt B家族金属调节蛋白是目前在细菌中研究较为透彻的金属响应蛋白之一,该家族包含多种金属效应物的响应(表 2),并可对下游基因转录进行全局性调节。
| Metal availability | Inhibitory factor | Resistant protein | Resistant protein regulating mode |
| Zn2+, Co2+, Cd2+ | Smt B | Smt A | Metallothionein |
| As3+, Sb3+ | Ars R (Ars D) | (Ars A) Ars B, Ars C | Atpase exporter Diffusion transporter Arsenate reductase |
| Zn2+ | Zia R | Zia R | Atpase exporter |
| Cd2+, Pb2+, Bi3+, Zn2+ | Cad C | Cad A | Atpase exporter |
| Zn2+, Co2+ | Czr A | Czr B | Diffusion transporter |
| Ni2+, Co2+ | Nmt R | Nmt A | Atpase exporter |
Ars R-Smt B家族已经进化出不同的家族成员以响应不同离子半径、配合物结构和价态的金属离子。如:聚球藻属PCC 7942菌的Smt B作为Zn(Ⅱ)响应阻遏物,在缺乏金属离子的情况下,抑制smt A基因的转录,编码包含螯合过量Zn的Ⅱ类金属硫蛋白(Smt A Ⅱ)。虽然Smt B还在体内和体外的某些条件下也响应Co(Ⅱ)和Cd(Ⅱ)变化,但Zn(Ⅱ)是特异性与亲和力最高的金属效应离子[49]。聚球藻属PCC 7942菌的Smt B在集胞藻属PCC 6803中称为Zia R,是一种高度Zn(Ⅱ)的特异性响应蛋白[50],与聚球藻属PCC 7942菌的Smt B有大于50%的序列相似性,并调节相异的zia操纵子的表达,如编码Zia R和Zia A (P型ATPase金属外排泵)。金黄色葡萄球菌还含有染色体的Zn(Ⅱ)或Co(Ⅱ)特异性金属调节转录抑制子Czr A (也称为Znt R),负调控czr操纵子的表达,能编码除Czr A之外的阳离子扩散促进蛋白家族的膜结合Zn(Ⅱ)转运体Czr B (Znt A)[51-52]。Czr A与Smt B具有最高的序列相似性,与Zn(Ⅱ)是smt、czr和zia操纵子最强的诱导物一致。金黄色葡萄球菌还含有Cad C,其编码在多重抗逆性质粒pI258上或在一些菌株中整合到细菌染色体中[53],在质粒pI258上编码的Cad C在体内和体外结合包括Cd(Ⅱ)、Pb(Ⅱ)和Bi(Ⅲ)以及Zn(Ⅱ)等亲硫的有毒金属离子。Cad C还调节编码膜结合Cd(Ⅱ)/Pb(Ⅱ)特异性P型ATP酶外排泵的cad操纵子的表达。
最近又确定了一种称为结核分枝杆菌的Nmt R的Ni(Ⅱ)/Co(Ⅱ)响应阻遏物[54-55]。nmt操纵子包含nmt A基因,其蛋白质产物与来自蓝藻集胞藻属的与Co(Ⅱ)输出的ATP酶输出泵相关的Coa T具有序列相似性;Nmt A也被认为在结核分枝杆菌中具有相同的功能[49]。
3.2 Ars R-Smt B响应蛋白家族结合位点结构特征对金属敏感性蓝细菌apo-Smt B操纵子建模,预测了同源二聚体apo-Smt B结构的三维模型。在使用乙酸汞浸泡apo-Smt B晶体后获得的差异电子密度图表明每个二聚体具有2个对称相关的金属结合位点。体内外研究证实了每对二聚体有两对金属结合位点(图 2),一对与α3螺旋相关,包括由相对单体(α3N)位点的氨基末端区域提供的2个配体,和桥联反平行羧基末端α5螺旋(α5位点)的第二对位点。
4 Fur家族调节因子调节机制Fur响应蛋白家族在国内研究相对较少,其主要负责调控细菌中铁、锌、锰、镍等二价金属离子的吸收。Fur蛋白属于普遍存在的保守的超家族原核调节因子,参与维持不同金属离子和氧化应激反应的内稳态[57]。刘晓隽等[58]也对Fur蛋白家族的研究现状进行了讨论。由于Fur响应蛋白家族具有极强的金属依赖性,并具有在多个位点上结合启动子的寡聚体化能力,是研究金属依赖性DNA转录调节因子的理想调节蛋白。
Roncarati等[59]使用幽门螺杆菌Fur调节因子作为模型来探索参与转录调控的金属依赖性短链DNA缩合机制[60],如图 3所示。为此,通过DNase I足迹,AFM和启动子功能分析相结合来研究受Fur调节的ars R (细菌耐酸性调节基因)启动子,即Fur靶向调节ars RS操纵子[61-62]。为了研究金属稳态调节如何转录进入Ars R调节子,从对数期幽门螺杆菌培养物提取总RNA进行天然Pars R启动子的引物延伸分析,并比较在不同的遗传背景下,用不同金属离子(Fe2+和Ni2+)或铁螯合蛋白(Dipy)处理Fur引起Pars R启动子的变化。

|
| 图 3 Pars R启动蛋白中操纵子布局的推断示意图 Figure 3 Inferred schematic representation of the operator layout in the Pars R promoter 注:蓝色框为f OP Ⅰ,f OP Ⅱ和f OP Ⅲ的Fur操纵子;红色框为n OP Ⅰ和n OP Ⅱ的Nik R操纵子;apo-Fur为缺铁条件下的Fur调节蛋白;holo-Fur为铁结合状态的Fur调节蛋白;apo-Nik R为缺镍状态的Nik R调节蛋白;holo-Nik R为镍结合状态下的Nik R调节蛋白. Note: Fur operators named f OPⅠ, f OP Ⅱ and f OP Ⅲ are depicted as blue boxes; While Nik R operators named n OP Ⅰ and n OP ⅠI are depicted as red boxes; apo-Fur is iron-sensitive operators and holo-Fur is iron-dependent operators; apo-Nik R is nickel-sensitive operators; holo-Nik R is nickel-dependent operators. |
|
|
结果表明,基本的Ars R酸响应操纵子处于由Fur和Nik R调节的金属离子通路的转录控制之下,前者作为金属响应的主阻遏物(Fe OFF),holo-Fur结合Pars R启动子抑制Pars R表达,后者作为ars R转录的正调节蛋白,可以作为I类激活蛋白直接激活ars启动子,或间接地通过阻止Fur与ars R启动子结合的抗抑制机制。通过DNase I足迹研究,ars R调控的分子机制也被探明。
Fur响应蛋白家族能够根据蛋白质的金属结合状态而诱导不同的DNA缩合反应。在低铁浓度时,apo-Fur与上游操纵子f OPⅠ和f OP Ⅱ结合形成二聚体,使中间DNA环化,但开放了启动子元件对RNAP的结合和转录。在铁浓度较高时,holo-Fur形成四聚体和高级寡聚体,其通过结合到f OPⅠ,f OPⅡ和f OPⅢ的3个操纵子位点而缩合启动子DNA,从而封闭RNAP的结合(Fe OFF)。在镍的存在下,holo-Nik R结合操纵子n OPⅠ和n OPⅡ,阻止Fur与启动子结合,激活了RNAP结合和ars R转录(Nik R ON)的条件[59]。
Seo等[63]研究了大肠杆菌中Fur蛋白除了铁代谢之外的复杂调控作用。共研究了81个Fur下游靶基因,结果显示,Fur利用负反馈回路连接铁运输和利用酶来维持铁稳态,且发现Fur也直接参与DNA合成,能量代谢和生物膜发育调控等方面。许多学者的研究结果都显示,Fur表现出全局调节作用,影响与铁代谢有关的许多基本细胞过程,包括协调大肠杆菌对铁的可利用性的总体反应,如图 4所示。
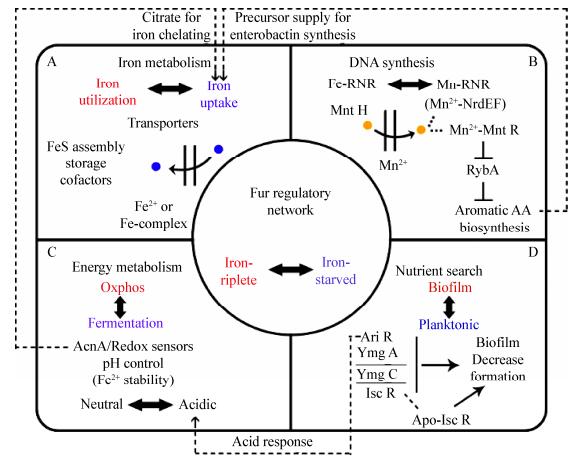
|
| 图 4 Fur调控网络在大肠杆菌中的全局调控作用 Figure 4 Global coordination roles of the Fur regulatory network in E. coli 注:A:铁代谢相关基因;B:DNA合成;C:向发酵途径重新定向代谢;D:生物膜形成.这些网络通过Fur扮演不同的角色而相互联系. Note: A: Iron metabolism; B: DNA synthesis; C: Redirection of metabolism towards fermentative pathways; D: Biofilm formation. These networks are linked through the coordination role that Fur plays. |
|
|
细菌金属响应转录因子常与金属内稳态基因的调控有关,影响细胞中金属的生物有效性。因此,它们对其金属效应物的亲和力被认为与这些金属在细胞中的阈值相关,其水平高于该值导致它们抑制金属输入泵基因的转录和/或触发金属抗逆性、隔离或储存相关基因的表达。因此,为保证金属响应蛋白的有效结合,需要维持特定的金属效应物浓度。
金属响应蛋白对金属效应物的亲和力随着金属在Irving-Williams顺序中位置的上升而增加。因此,更具竞争力的金属(如锌和铜)的响应蛋白会将这些金属维持在极低的浓度,从而防止其与其他的竞争力较小的金属响应蛋白(如锰和铁)结合位点相结合。而竞争较弱的金属的响应蛋白为有效结合其效应物将维持更高的金属效应物浓度。
大肠杆菌中,Zur和Znt R的2个锌响应蛋白具有10-15 mol/L的锌亲和力[64],因此在高于平均摩尔浓度的锌浓度下,锌结合的Zur抑制编码Znu ABC基因的转录和锌结合的Znt R激活锌输出的P型ATP酶(Znt A)的表达[65-66]。因此,当Zur和Znt R检测到的锌浓度非常低,这意味着锌输入泵受到调节,并且所有过量胞质锌必须被结合和储存,以保持极低的游离锌浓度。类似地,大肠杆菌铜响应蛋白Cue R的铜亲和力估计为10-21 mol/L,与Cue R调节铜输出泵所需感应的铜浓度一致[67],枯草芽孢杆菌锰感应蛋白Mnt R对锰的亲和力相对较低(约10-4 mol/L),但与根据大肠杆菌中Mnt R亲和力所估计的10-5 mol/L相一致[68]。
综上,在不同细菌中细胞内金属含量的差异可以改变响应蛋白在胞内的金属特异性,说明在不同的物种中金属响应蛋白所响应的金属效应物的浓度可以不同,响应蛋白的体内金属特异性可能受特定细胞胞质溶胶中的该组响应蛋白的相对亲和力的影响[69]。因此,尽管Irving-Williams级数下游的金属响应蛋白可能在体外结合或响应更具竞争力的金属,但在体内,竞争性金属对其金属结合位点的结合可能会因同一胞质溶胶中存在该金属的第二响应蛋白而被抑制。这意味着,特定金属响应蛋白需要在细菌体内维持金属效应物在一个特定的浓度,可以通过检测金属效应物在细菌体内的浓度,推测其金属响应蛋白的分类与亲和力大小。
6 小结与展望细菌在长久的进化过程中,产生了一系列的金属响应转录调节家族,可以在金属过量或缺乏时响应特定的金属效应物来调节相关基因表达,从而维持稳定的细胞内金属平衡。结构不同的金属响应蛋白家族可能在不同生物体中发挥相同的作用,而结构相似的金属响应蛋白也可以响应不同的金属效应物,并对不同的靶基因起作用。这与金属响应蛋白演变的“混合匹配”方式一致,并且也可能由于横向基因转移以及广泛的融合和协调演化而产生。
金属响应转录调节家族具有广阔的研究前景。研究金属响应转录调节家族,将对细菌代谢过程与基因调控过程的研究具有重要意义。如Ars R-Smt B响应蛋白的研究可以深入了解结核分枝杆菌细胞毒性,为设计破坏这些金属应力或破坏细菌病原体金属抗逆性的药物提供理论指导。存在于不同致病菌中的金属响应蛋白,其靶基因以及影响其金属特异性因素的研究成果将更好地为未来的控制策略提供信息,并增加基于金属调节的治疗方式的可能性。此外,对金属响应蛋白的深入研究,对工业工程菌株的改造具有重要的指导意义,如对Fur响应蛋白的研究,可深入了解A. ferrooxidans等铁代谢嗜酸菌株的代谢过程与基因调控过程,针对其金属抗逆性、金属氧化/还原、酸适应性等能力做工程改造;对Mer R等重金属离子响应蛋白等的研究,可通过基因改造提高Acidiphilium cryptum XTS等菌株对极端环境的抗逆性及Cr等重金属污染的治理能力。金属响应蛋白必将成为生物医学、生物冶金与重金属污染生物治理等领域的重要研究手段之一。
| [1] |
Yang Y, Huang L, Yang L, et al. Reduction characteristics and differential expression of Acidiphilium cryptum XTS Cr(Ⅵ)-reduced related gene[J]. Microbiology China, 2015, 42(1): 64-73. 杨宇, 黄露, 杨罗, 等. 隐藏嗜酸菌Acidiphilium cryptum XTS的Cr(Ⅵ)还原特性及相关基因的差异表达[J]. 微生物学通报, 2015, 42(1): 64-73. |
| [2] |
Waldron KJ, Robinson NJ. How do bacterial cells ensure that metalloproteins get the correct metal?[J]. Nature Reviews Microbiology, 2009, 7(1): 25-35. DOI:10.1038/nrmicro2057 |
| [3] |
Choi SH, Lee KL, Shin JH, et al. Zinc-dependent regulation of zinc import and export genes by zur[J]. Nature Communications, 2017, 8: 15812. DOI:10.1038/ncomms15812 |
| [4] |
Shin JH, Helmann JD. Molecular logic of the zur-regulated zinc deprivation response in Bacillus subtilis[J]. Nature Communications, 2016, 7: 12612. DOI:10.1038/ncomms12612 |
| [5] |
Musiani F, Zambelli B, Bazzani M, et al. Nickel-responsive transcriptional regulators[J]. Metallomics: Integrated Biometal Science, 2015, 7(9): 1305-1318. DOI:10.1039/C5MT00072F |
| [6] |
Liu Y, Li W, Wei YZ, et al. Efficient preparation and metal specificity of the regulatory protein tror from the human pathogen Treponema pallidum[J]. Metallomics, 2013, 5(10): 1448-1457. DOI:10.1039/c3mt00163f |
| [7] |
Stoll KE, Draper WE, Kliegman JI, et al. Characterization and structure of the manganese-responsive transcriptional regulator scar[J]. Biochemistry, 2009, 48(43): 10308-10320. DOI:10.1021/bi900980g |
| [8] |
Leyn SA, Rodionov DA. Comparative genomics of DtxR family regulons for metal homeostasis in Archaea[J]. Journal of Bacteriology, 2015, 197(3): 451-458. DOI:10.1128/JB.02386-14 |
| [9] |
Wang SC, Dias AV, Zamble DB. The "metallo-specific" response of proteins: a perspective based on the Escherichia coli transcriptional regulator NikR[J]. Dalton Transactions, 2009(14): 2459-2466. DOI:10.1039/b818167p |
| [10] |
Allen RC, Tu YK, Nevarez MJ, et al. The mercury resistance (mer) operon in a marine gliding flavobacterium, Tenacibaculum discolor 9A5[J]. Fems Microbiology Ecology, 2013, 83(1): 135-148. DOI:10.1111/fem.2012.83.issue-1 |
| [11] |
Shusterman E, Beharier O, Shiri L, et al. ZnT-1 extrudes zinc from mammalian cells functioning as a Zn2+/H+ exchanger[J]. Metallomics, 2014, 6(9): 1656-1663. DOI:10.1039/C4MT00108G |
| [12] |
Julian DJ, Kershaw CJ, Brown NL, et al. Transcriptional activation of MerR family promoters in Cupriavidus metallidurans CH34[J]. Antonie van Leeuwenhoek, 2009, 96(2): 149-159. DOI:10.1007/s10482-008-9293-4 |
| [13] |
Checa SK, Espariz M, Audero MEP, et al. Bacterial sensing of and resistance to gold salts[J]. Molecular Microbiology, 2007, 63(5): 1307-1318. DOI:10.1111/mmi.2007.63.issue-5 |
| [14] |
Wei W, Zhu TZ, Wang Y, et al. Engineering a gold-specific regulon for cell-based visual detection and recovery of gold[J]. Chemical Science, 2012, 3(6): 1780-1784. DOI:10.1039/c2sc01119k |
| [15] |
Valencia EY, Braz VS, Guzzo C, et al. Two RND proteins involved in heavy metal efflux in Caulobacter crescentus belong to separate clusters within proteobacteria[J]. BMC Microbiology, 2013, 13: 79. DOI:10.1186/1471-2180-13-79 |
| [16] |
Yu XF, Zheng W, Bhat S, et al. Transcriptional and posttranscriptional regulation of Bacillus sp. CDB3 arsenic-resistance operon ars1[J]. PeerJ, 2015, 3: e1230. DOI:10.7717/peerj.1230 |
| [17] |
Ye J, Kandegedara A, Martin P, et al. Crystal structure of the Staphylococcus aureus pI258 CadC Cd(Ⅱ)/Pb(Ⅱ)/Zn(Ⅱ)-responsive repressor[J]. Journal of Bacteriology, 2005, 187(12): 4214-4221. DOI:10.1128/JB.187.12.4214-4221.2005 |
| [18] |
Liu T, Golden JW, Giedroc DP. A zinc(Ⅱ)/lead(Ⅱ)/cadmium(Ⅱ)- inducible operon from the cyanobacterium anabaena is regulated by AztR, an α3N ArsR/SmtB metalloregulator[J]. Biochemistry, 2005, 44(24): 8673-8683. DOI:10.1021/bi050450+ |
| [19] |
Cavet JS, Graham AI, Meng WM, et al. A cadmium-lead-sensing ArsR-SmtB repressor with novel sensory sites. Complementary metal discrimination by NmtR AND CmtR in a common cytosol[J]. Journal of Biological Chemistry, 2003, 278(45): 44560-44566. DOI:10.1074/jbc.M307877200 |
| [20] |
Campbell DR, Chapman KE, Waldron KJ, et al. Mycobacterial cells have dual nickel-cobalt sensors: sequence relationships and metal sites of metal-responsive repressors are not congruent[J]. Journal of Biological Chemistry, 2007, 282(44): 32298-32310. DOI:10.1074/jbc.M703451200 |
| [21] |
Liu T, Chen XH, Ma Z, et al. A CuI-sensing arsr family metal sensor protein with a relaxed metal selectivity profile[J]. Biochemistry, 2008, 47(40): 10564-10575. DOI:10.1021/bi801313y |
| [22] |
Lee CW, Chakravorty DK, Chang FMJ, et al. Solution structure of Mycobacterium tuberculosis NmtR in the apo state: insights into Ni(Ⅱ)-mediated allostery[J]. Biochemistry, 2012, 51(12): 2619-2629. DOI:10.1021/bi3001402 |
| [23] |
Smaldone GT, Helmann JD. CsoR regulates the copper efflux operon copZA in Bacillus subtilis[J]. Microbiology, 2007, 153(Pt 12): 4123-4128. |
| [24] |
Iwig JS, Leitch S, Herbst RW, et al. Ni(Ⅱ) and Co(Ⅱ) sensing by Escherichia coli RcnR[J]. Journal of the American Chemical Society, 2008, 130(24): 7592-7606. DOI:10.1021/ja710067d |
| [25] |
Matsuzaki S, Enomoto T, Serada S, et al. Annexin A4-conferred platinum resistance is mediated by the copper transporter ATP7A[J]. International Journal of Cancer, 2014, 134(8): 1796-1809. DOI:10.1002/ijc.28526 |
| [26] |
Ma Z, Jacobsen FE, Giedroc DP. Coordination chemistry of bacterial metal transport and sensing[J]. Chemical Reviews, 2009, 109(10): 4644-4681. DOI:10.1021/cr900077w |
| [27] |
Kloosterman TG, van der Kooi-Pol MM, Bijlsma JJE, et al. The novel transcriptional regulator SczA mediates protection against Zn2+ stress by activation of the Zn2+- resistance gene czcD in Streptococcus pneumoniae[J]. Molecular Microbiology, 2007, 65(4): 1049-1063. DOI:10.1111/mmi.2007.65.issue-4 |
| [28] |
Tao H, Hasona A, Do PM, et al. Global gene expression analysis revealed an unsuspected deo operon under the control of molybdate sensor, ModE protein, in Escherichia coli[J]. Archives of Microbiology, 2005, 184(4): 225-233. DOI:10.1007/s00203-005-0039-7 |
| [29] |
Hoffmann MC, Wagner E, Langklotz S, et al. Proteome profiling of the Rhodobacter capsulatus molybdenum response reveals a role of IscN in nitrogen fixation by Fe-nitrogenase[J]. Journal of Bacteriology, 2016, 198(4): 633-643. DOI:10.1128/JB.00750-15 |
| [30] |
Ogawa T, Bao DH, Katoh H, et al. A two-component signal transduction pathway regulates manganese homeostasis in Synechocystis 6803, a photosynthetic organism[J]. Journal of Biological Chemistry, 2002, 277(32): 28981-28986. DOI:10.1074/jbc.M204175200 |
| [31] |
Jacob K, Rasmussen A, Tyler P, et al. Regulation of acetyl-CoA synthetase transcription by the CrbS/R two-component system is conserved in genetically diverse environmental pathogens[J]. PLoS One, 2017, 12(5): e0177825. DOI:10.1371/journal.pone.0177825 |
| [32] |
Braun V, Mahren S, Ogierman M. Regulation of the feci-type ECF sigma factor by transmembrane signalling[J]. Current Opinion in Microbiology, 2003, 6(2): 173-180. DOI:10.1016/S1369-5274(03)00022-5 |
| [33] |
Grosse C, Friedrich S, Nies DH. Contribution of extracytoplasmic function sigma factors to transition metal homeostasis in Cupriavidus metallidurans strain CH34[J]. Journal of Molecular Microbiology and Biotechnology, 2007, 12(3/4): 227-240. |
| [34] |
Helmann JD. Bacillus subtilis extracytoplasmic function (ECF) sigma factors and defense of the cell envelope[J]. Current Opinion in Microbiology, 2016, 30: 122-132. DOI:10.1016/j.mib.2016.02.002 |
| [35] |
Corbett D, Schuler S, Glenn S, et al. The combined actions of the copper-responsive repressor CsoR and copper-metallochaperone CopZ modulate CopA-mediated copper efflux in the intracellular pathogen Listeria monocytogenes[J]. Molecular Microbiology, 2011, 81(2): 457-472. DOI:10.1111/mmi.2011.81.issue-2 |
| [36] |
Gaballa A, Antelmann H, Aguilar C, et al. The Bacillus subtilis iron-sparing response is mediated by a fur-regulated small RNA and three small, basic proteins[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(33): 11927-11932. DOI:10.1073/pnas.0711752105 |
| [37] |
McHugh JP, Rodríguez-Quiñones F, Abdul-tehrani H, et al. Global iron-dependent gene regulation in Escherichia coli. A new mechanism for iron homeostasis[J]. Journal of Biological Chemistry, 2003, 278(32): 29478-29486. DOI:10.1074/jbc.M303381200 |
| [38] |
Gabriel SE, Helmann JD. Contributions of zur-controlled ribosomal proteins to growth under zinc starvation conditions[J]. Journal of Bacteriology, 2009, 191(19): 6116-6122. DOI:10.1128/JB.00802-09 |
| [39] |
Lee JW, Helmann JD. Functional specialization within the Fur family of metalloregulators[J]. BioMetals, 2007, 20(3/4): 485-499. |
| [40] |
Kliegman JI, Griner SL, Helmann JD, et al. Structural basis for the metal-selective activation of the manganese transport regulator of Bacillus subtilis[J]. Biochemistry, 2006, 45(11): 3493-3505. DOI:10.1021/bi0524215 |
| [41] |
Bobrov AG, Kirillina O, Fetherston JD, et al. The Yersinia pestis siderophore, yersiniabactin, and the ZnuABC system both contribute to zinc acquisition and the development of lethal septicaemic plague in mice[J]. Molecular Microbiology, 2014, 93(4): 759-775. DOI:10.1111/mmi.2014.93.issue-4 |
| [42] |
Chivers PT, Benanti EL, Heil-Chapdelaine V, et al. Identification of Ni-(L-His)₂ as a substrate for NikABCDE-dependent nickel uptake in Escherichia coli[J]. Metallomics, 2012, 4(10): 1043-1050. DOI:10.1039/c2mt20139a |
| [43] |
Barberzucker S, Shaanan B, Zarivach R. Transition metal binding selectivity in proteins and its correlation with the phylogenomic classification of the cation diffusion facilitator protein family[J]. Scientific Reports, 2017, 7(1): 16381. DOI:10.1038/s41598-017-16777-5 |
| [44] |
Wijekoon CJK, Udagedara SR, Knorr RL, et al. Copper atpase copa from Escherichia coli: quantitative correlation between atpase activity and vectorial copper transport[J]. Journal of the American Chemical Society, 2017, 139(12): 4266-4269. DOI:10.1021/jacs.6b12921 |
| [45] |
Moore CM, Helmann JD. Metal ion homeostasis in Bacillus subtilis[J]. Current Opinion in Microbiology, 2005, 8(2): 188-195. DOI:10.1016/j.mib.2005.02.007 |
| [46] |
Harvie DR, Andreini C, Cavallaro G, et al. Predicting metals sensed by ArsR-SmtB repressors: allosteric interference by a non-effector metal[J]. Molecular Microbiology, 2006, 59(4): 1341-1356. DOI:10.1111/mmi.2006.59.issue-4 |
| [47] |
Porto TV, Wilson MT, Worrall JAR. Copper and nickel bind via two distinct kinetic mechanisms to a CsoR metalloregulator[J]. Dalton Transactions, 2015, 44(46): 20176-20185. DOI:10.1039/C5DT03484A |
| [48] |
Stoyanov JV, Mancini S, Lu ZH, et al. The stress response protein Gls24 is induced by copper and interacts with the CopZ copper chaperone of Enterococcus hirae[J]. FEMS Microbiology Letters, 2010, 302(1): 69-75. DOI:10.1111/fml.2010.302.issue-1 |
| [49] |
Cavet JS, Meng WM, Pennella MA, et al. A nickel-cobalt-sensing ArsR-SmtB family repressor. Contributions of cytosol and effector binding sites to metal selectivity[J]. Journal of Biological Chemistry, 2002, 227(41): 3841-38448. |
| [50] |
Mahadev SR, Hayashi H, Ikegami T, et al. Improved protein overexpression and purification strategies for structural studies of cyanobacterial metal-responsive transcription factor, SmtB from marine Synechococcus sp. PCC 7002[J]. The Protein Journal, 2013, 32(8): 626-634. DOI:10.1007/s10930-013-9525-y |
| [51] |
Henshall SM, Afar DEH, Rasiah KK, et al. Expression of the zinc transporter ZnT4 is decreased in the progression from early prostate disease to invasive prostate cancer[J]. Oncogene, 2003, 22(38): 6005-6012. DOI:10.1038/sj.onc.1206797 |
| [52] |
Lasry I, Seo YA, Ityel H, et al. A dominant negative heterozygous G87R mutation in the zinc transporter, ZnT-2 (SLC30A2), results in transient neonatal zinc deficiency[J]. Journal of Biological Chemistry, 2012, 287(35): 29348-29361. DOI:10.1074/jbc.M112.368159 |
| [53] |
Hoogewerf AJ, van Dyk LA, Buit TS, et al. Functional characterization of a cadmium resistance operon in Staphylococcus aureus ATCC12600: CadC does not function as a repressor[J]. Journal of Basic Microbiology, 2015, 55(2): 148-159. DOI:10.1002/jobm.v55.2 |
| [54] |
Reyes-Caballero H, Lee CW, Giedroc DP. Mycobacterium tuberculosis NmtR harbors a nickel sensing site with parallels to Escherichia coli RcnR[J]. Biochemistry, 2011, 50(37): 7941-7952. DOI:10.1021/bi200737a |
| [55] |
Lee CW, Giedroc DP. 1H, 13C, and 15N resonance assignments of NmtR, a Ni(Ⅱ)/Co(Ⅱ) metalloregulatory protein of Mycobacterium tuberculosis[J]. Biomolecular NMR Assignments, 2013, 7(2): 145-148. DOI:10.1007/s12104-012-9397-7 |
| [56] |
Cook WJ, Kar SR, Taylor KB, et al. Crystal structure of the cyanobacterial metallothionein repressor SmtB: a model for metalloregulatory proteins[J]. Journal of Molecular Biology, 1998, 275(2): 337-346. DOI:10.1006/jmbi.1997.1443 |
| [57] |
Fillat MF. The FUR (ferric uptake regulator) superfamily: diversity and versatility of key transcriptional regulators[J]. Archives of Biochemistry and Biophysics, 2014, 546: 41-52. DOI:10.1016/j.abb.2014.01.029 |
| [58] |
Liu XJ, Wang T, Qiu GZ, et al. Research progresses on fur uptake regulator[J]. Life Science Research, 2014, 18(4): 357-362. 刘晓隽, 王涛, 邱冠周, 等. 铁吸收调节蛋白的研究现状[J]. 生命科学研究, 2014, 18(4): 357-362. |
| [59] |
Roncarati D, Pelliciari S, Doniselli N, et al. Metal-responsive promoter DNA compaction by the ferric uptake regulator[J]. Nature Communications, 2016, 7: 12593. DOI:10.1038/ncomms12593 |
| [60] |
Dorman CJ. Genome architecture and global gene regulation in bacteria: making progress towards a unified model?[J]. Nature Reviews Microbiology, 2013, 11(5): 349-355. DOI:10.1038/nrmicro3007 |
| [61] |
Danielli A, Roncarati D, Delany I, et al. In vivo dissection of the Helicobacter pylori fur regulatory circuit by genome-wide location analysis[J]. Journal of Bacteriology, 2006, 188(13): 4654-4662. DOI:10.1128/JB.00120-06 |
| [62] |
Gancz H, Censini S, Merrell DS. Iron and pH homeostasis intersect at the level of fur regulation in the gastric pathogen Helicobacter pylori[J]. Infection and Immunity, 2006, 74(1): 602-614. DOI:10.1128/IAI.74.1.602-614.2006 |
| [63] |
Seo SW, Kim D, Latif H, et al. Deciphering fur transcriptional regulatory network highlights its complex role beyond iron metabolism in Escherichia coli[J]. Nature Communications, 2014, 5: 4910. DOI:10.1038/ncomms5910 |
| [64] |
Kim JH, Hwang IH, Jang SP, et al. Zinc sensors with lower binding affinities for cellular imaging[J]. Dalton Transactions, 2013, 42(15): 5500-5507. DOI:10.1039/c3dt33024a |
| [65] |
Maynaud G, Brunel B, Yashiro E, et al. CadA of Mesorhizobium metallidurans isolated from a zinc-rich mining soil is a PIB-2-type ATPase involved in cadmium and zinc resistance[J]. Research in Microbiology, 2014, 165(3): 175-189. DOI:10.1016/j.resmic.2014.02.001 |
| [66] |
Lu MM, Li ZF, Liang JQ, et al. Zinc resistance mechanisms of P1B-type ATPases in Sinorhizobium meliloti CCNWSX0020[J]. Scientific Reports, 2016, 6: 29355. DOI:10.1038/srep29355 |
| [67] |
Kajikawa T, Sugiyama R, Kataoka K, et al. A novel resting form of the trinuclear copper center in the double mutant of a multicopper oxidase, CueO, Cys500Ser/Glu506Ala[J]. Journal of Inorganic Biochemistry, 2015, 149: 88-90. DOI:10.1016/j.jinorgbio.2015.03.005 |
| [68] |
Golynskiy MV, Gunderson WA, Hendrich MP, et al. Metal binding studies and EPR spectroscopy of the manganese transport regulator MntR[J]. Biochemistry, 2006, 45(51): 15359-15372. DOI:10.1021/bi0607406 |
| [69] |
Osman D, Cavet JS. Bacterial metal-sensing proteins exemplified by ArsR-SmtB family repressors[J]. Natural Product Reports, 2010, 27(5): 668-680. DOI:10.1039/b906682a |
 2018, Vol. 45
2018, Vol. 45