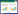扩展功能
文章信息
- 张冰, 李虹悦, 梁超, 彭丽萍, 任彤彤, 李建荣, 喻其林, 李明春
- ZHANG Bing, LI Hong-Yue, LIANG Chao, PENG Li-Ping, REN Tong-Tong, LI Jian-Rong, YU Qi-Lin, LI Ming-Chun
- 白假丝酵母Vps74蛋白的鉴定及其功能
- Characterization of Vps74 in Candida albicans
- 微生物学通报, 2018, 45(8): 1746-1756
- Microbiology China, 2018, 45(8): 1746-1756
- DOI: 10.13344/j.microbiol.china.180120
-
文章历史
- 收稿日期: 2018-02-07
- 接受日期: 2018-05-18
- 网络首发日期(www.cnki.net): 2018-06-05
白假丝酵母(Candida albicans)是临床上重要的条件致病性真菌,普遍存在于健康人群的口腔、肠道、阴道及泌尿系统中。一般情况下,白假丝酵母并不会感染人体,但当人体免疫力下降或免疫功能不全时,则极易出现白假丝酵母感染,严重时甚至会危及生命[1-2]。近年来,随着免疫缺陷患者的增多,白假丝酵母的感染逐渐趋于普遍,引起了学术界广泛关注。目前,在科研工作中,亟需找到针对该病原真菌的有效治疗靶点,从而为开发针对该条件致病真菌的靶向治疗药物提供理论依据。
白假丝酵母的致病能力主要决定于3个方面[1-2]。(1)形态发生能力。白假丝酵母是典型的二相型真菌,在宿主体内,白假丝酵母可以适时实现酵母形态和菌丝形态之间的相互转换,菌丝形态有助于其侵入宿主组织,而酵母形态有助于其在宿主体内的散播。(2)压力应答能力。宿主本身具有强大的免疫系统,该系统会对异常侵染的病原体进行清除,通常以造成外源压力的方式[例如巨噬细胞产生活性氧(Reactive oxygen species,ROS)]将其杀死,以避免侵染的发生。白假丝酵母在长期进化过程中形成了完善的信号压力应答途径(例如钙信号途径、氧化压力应答途径、药物压力应答途径等),从而在面临外界压力时能够将其激活,维持其在宿主组织中的生存。(3)胞外酶。白假丝酵母可分泌胞外酶,有助于其降解宿主组织或摄取外源营养物质,保证其在宿主体内的存活及进一步的侵染。
目前研究发现,磷脂酰肌醇(Phosphatidyl inositol,PI)信号通路是普遍存在于真核细胞中的信号传递方式,在胞内信号传递和胞内细胞器识别过程中发挥关键作用,该过程主要是通过磷脂酰肌醇激酶产生的磷酸化产物作用于下游效应蛋白所实现,并由磷脂酰肌醇磷酸酶的去磷酸化作用所终止[3]。在酿酒酵母(Saccharomyces cerevisiae)中,Vps74是磷脂酰肌醇-4-磷酸(Phosphatidylinositol-4-phosphate,PI4P)的关键效应因子,该蛋白可以促进糖基转移酶(Glycosyltransferases)与COPI有被小泡(COPI-coated vesicles)的融合,进而维持糖基转移酶在高尔基体(Golgi)上的定位,影响高尔基体上的蛋白糖基化修饰过程[4]。vps74基因缺失导致甘露糖转移酶Kre2p、Mnn2p、Mnn5p、Och1p定位紊乱,从而导致高尔基体上N-糖基化和O-糖基化严重缺陷[4-5]。Vps74在哺乳动物中的同源蛋白为GOLPH3,该蛋白也具有与磷脂酰肌醇-4-磷酸(PI4P)结合的能力,并且该蛋白可以通过结合肌球蛋白MYO18A,调节肌动蛋白介导的高尔基体转运及形态[6]。此外,GOLPH3可参与mTOR信号通路,进而影响肿瘤细胞对雷帕霉素(Rapamycin)的敏感性[7]。通过移植瘤模型也发现,GOLPH3的敲除会导致肿瘤细胞增殖、迁移、侵润能力的降低,从而降低肿瘤在体内的生长速度。此外,在黑腹果蝇(Drosophila melanogaster)中的研究发现,GOLPH3可以通过影响磷脂酰肌醇下游信号通路参与肌动蛋白的动态组织及囊泡在胞内的转运过程,从而影响精母细胞的分裂[8]。然而在致病性真菌白假丝酵母中是否同样存在Vps74/GOLPH3的同源蛋白,以及该蛋白是否具有多种生理功能,至今尚未见报道。
本研究通过序列比对和同源性分析,在白假丝酵母中鉴定了一个潜在的Vps74/GOLPH3同源蛋白CaVps74,通过基因敲除手段并采用反向遗传学方法分析了该蛋白在白假丝酵母中的功能,结果发现该蛋白在蛋白分泌、形态发生等过程中发挥重要功能,从而影响白假丝酵母的致病性。
1 材料与方法 1.1 菌株、质粒和引物| Strains and plasmids | Genotype and description | References |
| C. albicans strains | ||
| BWP17 (Wild type) | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG | This study |
| vps74Δ/VPS74 | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG vps74::arg4/vps74 | This study |
| vps74Δ/Δ | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG vps74::arg4/vps74::ura3-dpl200 | This study |
| VPS74c | ura3Δ::λimm434/ura3Δ::λimm434 his1::hisG/his1::hisG arg4::hisG/arg4::hisG vps74::arg4/vps74::ura3-dpl200 vps74 | This study |
| Plasmids | ||
| pRS-ARG4ΔSpeI | Containing arg4 marker, Ampr | [9] |
| pDDB57 | Containing ura3 marker, Ampr | [9] |
| pDDB78 | Containing his1 marker, Ampr | [9] |
| pDDB78-vps74 | Containing his1 marker, Ampr, vps74 | This study |
| Primers name | Sequences (5′→3′) |
| vps74-5DR | TTGAACTCATTTAAATATTAATTTAGTTGAATAATTGGATAGCAGGTAAAAGTTTTGTCATTTCCCAGTCACGACGTT |
| vps74-5DR | TATTATATTGAAACCCTTGACTATATGTACTTATATATATATATATGCTAGACTTCTTGTTGGAATTGTGAGCGGATA |
| vps74-5det | CCCAATCAATCTCAACTTTTTCATT |
| vps74-3det | TGATCAACTAGGTGGTGTGGA |
| vps74-5com | CCGGAATTCTTAATACTTGTGAGGATT |
| vps74-5com | CCCATCGATTGGTGTGGAAGTACTTGA |
| Iner-vps74-3det | TCTCAGCACTAACATACTC |
醋酸锂、聚乙二醇3350等购自Sigma公司;RNase A、dNTPs、牛血清白蛋白(bovine serum albumin,BSA)等购自北京鼎国生物技术有限责任公司;RPMI-1640、M199培养基粉末购自Gibco公司;Taq DNA聚合酶、DNA分子量标准购自天根生化科技(北京)有限公司;其余试剂和药品均为国产分析纯。PCR仪,Gene公司;凝胶成像仪,UVP公司;蛋白电泳仪,Bio-Rad公司;荧光显微镜,Olympus公司。
1.3 培养基YPD和SC培养基(SC-ura除外)均添加终浓度为80 mg/L的无菌尿苷[9]。药物敏感性测定培养基:将灭菌完成的YPD培养基冷却至50 ℃,按照相应浓度要求[5 mmol/L过氧化氢(H2O2)、4 g/L特比萘酚(Terbinafine)、2 g/L两性霉素B (Amphotericine B)或0.2 mg/L卡泊芬净(Caspofungi)]将药物加入培养基中,倒平板,待平板冷却凝固后即可。沙氏葡萄糖培养基(g/L):蛋白胨10.0,MgSO4 1.2,葡萄糖40.0,氨水1% (质量体积比),充分搅拌后采用0.45 μm滤膜过滤,调整pH至5.4,1×105 Pa灭菌30 min。BSA培养基:葡萄糖10.0 g/L,1 000×微量元素溶液0.1%,1 000×维生素溶液0.1%,调pH至4.4,1×105 Pa灭菌30 min后冷却至50 ℃,添加0.1% (质量体积比)的BSA,固体培养基添加20 g/L的琼脂粉。1 000×微量元素溶液(g/L):ZnSO4·7H2O 22.0,H3BO3 11.0,MnCl2·4H2O 5.0,FeSO4·7H2O 5.0,CoCl2·6H2O 1.7,CuSO4·5H2O 1.6,Na4·EDTA 50.0。1 000×维生素溶液(g/L):生物素0.1,吡哆醇0.1,维生素B1 0.1,核黄素0.1,对氨基苯甲酸0.1,烟酸0.1。RPMI-1640培养基(g/L):RPMI-1640粉末10.4,丙磺酸4.18,碳酸钠2.0,调pH至7.0-7.4,过滤除菌,使用前添加终浓度为80 mg/L的无菌尿苷。M199培养基(g/L):M199粉末9.5,4-羟乙基哌嗪乙磺酸35.75,调pH至7.0-7.4,过滤除菌,使用前添加终浓度为80 mg/L的无菌尿苷。Spider培养基(g/L):营养肉汤10.0,甘露醇10.0,K2HPO4 2.0,调pH至7.0-7.4,固体培养基添加2%的琼脂粉,1×105 Pa灭菌30 min。
1.4 白假丝酵母的转化白假丝酵母的转化使用醋酸锂转化法,具体方法参见文献[9]。
1.5 白假丝酵母vps74基因缺失菌株和回补菌株的构建使用PCR介导的同源重组方法构建基因缺失菌株vps74Δ/Δ,具体方法参照文献[9]。回补菌株的构建采用非原位同源重组方法,将vps74基因(包括启动子、ORF区、终止子等区域)克隆至载体质粒pDDB78上,将其转化进入缺失菌株vps74Δ/Δ,构建回补菌株VPS74c。菌株的鉴定采用PCR方法[9]。
1.6 分泌性酸性磷酸酶(SAPs)的糖基化水平分析[9]将30 ℃、180 r/min培养过夜的菌体转接至沙氏葡萄糖培养基中,调整初始菌液浓度OD600为0.1,30 ℃、180 r/min振荡培养16 h,充分诱导SAPs的表达。4 000 r/min离心2 min收集菌体细胞,用无菌水洗涤2遍,重悬于500 μL非变性裂解液中,加入200 μL玻璃珠,振荡破碎菌体。将细胞裂解液于4 ℃、13 000 r/min条件下离心30 min,得到上清液即为总蛋白。测定蛋白样品的浓度后将各样品蛋白量进行统一,采用非变性聚丙烯酰胺凝胶电泳对等量的蛋白样品进行分离,采用SAPs染色法对凝胶进行染色[9],观察SAPs的泳动速度以反映其糖基化水平。
1.7 压力敏感性测定将30 ℃、180 r/min培养过夜的菌体转接至新鲜的YPD培养基中,调整初始OD600为0.1,30 ℃、180 r/min振荡培养4-6 h,使菌体细胞处于旺盛分裂的对数初期。4 000 r/min离心2 min收集菌体细胞,用无菌PBS溶液洗涤一遍,重悬于PBS中,调整OD600为0.2。进行10倍梯度稀释,稀释4-5个梯度。取2 μL菌液,将各稀释度的菌液按顺序点种于YPD平板及各种药物敏感培养基平板上。各平板在30 ℃恒温培养箱内静置培养1-2 d,观察菌株生长情况。
1.8 蛋白分泌能力测定将30 ℃、180 r/min培养过夜的菌体转接至新鲜的YPD培养基中,调整初始菌体浓度OD600为0.1,30 ℃、180 r/min振荡培养4-6 h,使菌体细胞处于旺盛分裂的对数初期。固体观察测定方法:4 000 r/min离心2 min收集菌体细胞,用无菌PBS洗涤一遍,重悬于PBS中,调整菌体浓度OD600为0.5,取2 μL菌液点种于BSA平板上,将平板置于37 ℃恒温培养箱内静置培养5-7 d,观察蛋白水解圈的形成。液体培养测定方法:将菌体转接至液体BSA培养基中,调整OD600为0.5,置于30 ℃、180 r/min振荡培养8-30 h,取等量培养液上清,经SDS-PAGE分离后,采用考马斯亮蓝R-250染色液进行染色,脱色后观察BSA的降解情况。
1.9 白假丝酵母形态发生能力的测定将30 ℃、180 r/min培养过夜的菌体转接到新鲜YPD培养基中,继续培养4-6 h至对数初期。固体测定方法:室温、4 000 r/min离心2 min收集菌体,用无菌PBS洗涤一遍,调整OD600至0.8,取2 μL菌液按顺序点种于RPMI-1640、M199、Spider平板上,置于37 ℃培养箱中培养6-8 d,观察菌落周围菌丝的形成状况。液体测定方法:4 000 r/min离心2 min收集菌体,用无菌PBS洗涤一遍,转接至RPMI-1640培养基中,调整OD600至0.05,于37 ℃、120 r/min振荡培养3-6 h,分别在培养3 h和6 h时收集菌体,置于显微镜下观察菌丝形成情况。
1.10 白假丝酵母系统性感染能力检测将30 ℃、180 r/min培养过夜的菌体4 000 r/min离心2 min,收集菌体沉淀重悬于0.9%的无菌生理盐水中,调整菌体浓度为5×106个细胞/mL。选取健康状况良好的4周龄雌性ICR小鼠(体重15-20 g)作为白念珠菌感染宿主,采用尾静脉注射方式进行感染,每只小鼠注射菌液剂量为100 μL (等同于5×105个细胞),每种菌株感染10只小鼠。自注射感染后第1天开始观察并记录小鼠死亡情况,绘制生存曲线。在感染第8天时对小鼠进行解剖,取其肾脏进行菌落计数以反映菌株的深部感染能力。
2 结果与分析 2.1 白假丝酵母Vps74蛋白的鉴定通过NCBI同源序列比对分析,发现在白假丝酵母中存在Vps74/GOLPH3同源蛋白,由orf19.1514编码,将其命名为CaVps74。该蛋白由340个氨基酸组成,其编码基因全长1 023 bp。通过NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi)序列比对分析发现(图 1A),CaVps74与酿酒酵母ScVps74的氨基酸序列相似性最高,一致性为60%。同时发现,Vps74/GOLPH3在生物界也相对保守,CaVps74与哺乳动物HsGOLPH3、果蝇DmGOLPH3的一致性分别为49%和42%。保守结构域分析发现(图 1B),CaVps74、ScVps74、HsGOLPH3、DmGOLPH3均含有典型的GPP34结构域,并且在氨基酸序列N端均具有典型的精氨酸(R)保守基序[10-11],推测CaVps74蛋白在功能上也相对保守。
|
| 图 1 不同生物Vps74/GOLPH3蛋白序列比对及保守结构域分析 Figure 1 Sequence alignment and conserved domain analysis of Vps74/GOLPH3 in different organisms 注:A:NCBI在线序列比对分析不同生物(白假丝酵母Ca、酿酒酵母Sc、人Hs、黑腹果蝇Dm)中Vps74/GOLPH3蛋白的一致性;B:蛋白保守结构分析. Note: A: Sequences alignment of Vps74/GOLPH3 homologous among C. albicans, S. cerevisiae, Homo sapiens and D. melanogaster; B: Conserved GPP34 domain of the Vps74/GOLPH3 homologous in different organisms. |
|
|
为进一步利用反向遗传学方法研究Vps74在白假丝酵母中的生物学功能,构建了白假丝酵母基因缺失菌株。白假丝酵母是二倍体生物,因此构建基因缺失菌株需要逐次将vps74基因的2个拷贝进行敲除。我们采用PCR介导的同源重组技术进行基因缺失菌株vps74Δ/Δ的构建[9],利用敲除片段大小的差异性进行了PCR验证。单拷贝基因缺失菌株(杂合子vps74Δ/VPS74)预期可以得到2 572 bp (arg4片段)和1 554 bp (vps74片段),双拷贝基因缺失菌株(纯合子vps74Δ/Δ)预期能够得到2 541 bp (arg4片段)和2 189 bp (ura3片段)。由图 2A可见,PCR验证结果符合预期,获得了正确的基因缺失菌株(纯合子vps74Δ/Δ)。回补菌株的构建采用非原位同源重组方法,将完整的vps74表达框重组至his1基因位点。同样采用PCR方法进行验证,预期得到911 bp的片段。由图 2B可见,回补菌株VPS74c构建成功。

|
| 图 2 白假丝酵母vps74基因缺失菌株vps74Δ/Δ及回补菌株VPS74c的验证 Figure 2 Identification of vps74Δ/Δ and VPS74c by PCR 注:A:单拷贝基因缺失菌株(杂合子vps74Δ/VPS74)和双拷贝基因缺失菌株(纯合子vps74Δ/Δ)的PCR验证;B:回补菌株VPS74c的PCR验证. Note: A: vps74Δ/VPS74 and vps74Δ/Δ identification by PCR; B: vps74Δ/Δ identification by PCR with the wild type as control. |
|
|
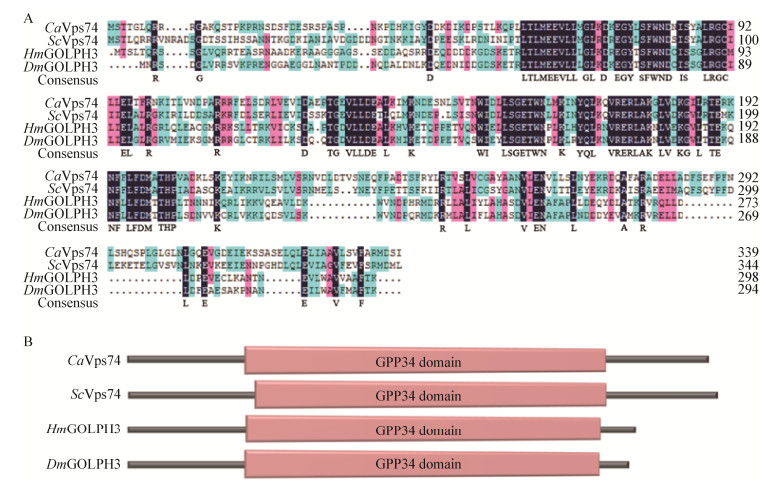
酿酒酵母vps74基因的缺失会导致糖基转移酶Ktr1等多种糖基转移酶由高尔基体转移至液泡分布,进而导致酿酒酵母的糖基化功能缺陷[4-5]。为了验证Vps74在白假丝酵母中是否也参与糖基化过程,首先对白假丝酵母糖基转移酶Mnt1 (与酿酒酵母Ktr1同源)进行GFP (green fluorescent protein)标记,观察了Mnt1-GFP在细胞内的定位。结果发现(图 3A),野生型菌株中Mnt1-GFP呈现斑点状分布,与高尔基体的分布状态一致,说明Mnt1在白假丝酵母中也定位于高尔基体,而vps74缺失后导致Mnt1-GFP集中分布在液泡中,无法观察到类似于高尔基体的斑点分布状态。上述结果表明,在白假丝酵母中,Vps74参与维持糖基转移酶Mnt1在高尔基体上的定位。
|
| 图 3 vps74基因缺失对白假丝酵母糖基化能力的影响 Figure 3 Deletion of vps74 affects glycosylation of C. albicans 注:A:糖基转移酶Mnt1定位分析,比例尺为5 μm;B:分泌性酸性磷酸酶(SAPs)糖基化水平检测. Note: A: The intracellular localization of glycosyltransfease Mnt1-GFP in wild-type strain and vps74Δ/Δ mutant; Bar=5 μm; B: Glycosylation assays of SAPs. |
|
|
分泌性酸性磷酸酶(Secreted acid phosphatases,SAPs)是白假丝酵母中一类重要的糖基化蛋白,其糖基化水平可反映高尔基体糖基化功能的完整性。SAPs的糖基化水平可通过非变性凝胶分离及染色的方法进行测定,成熟的SAPs具有大量糖基化特征,因而在PAGE凝胶中泳动较慢,而糖基化修饰缺陷的SAPs分子量变小,会出现泳动速度加快的现象,可通过SAPs在凝胶中的泳动速度判断其糖基化水平。为了进一步验证vps74缺失后导致的糖基转移酶异常定位是否会影响胞内的糖基化修饰过程,采用蛋白染色方法测定了SAPs的糖基化水平。结果如图 3B所示,野生型及回补菌株的SAPs距离点样孔较近,泳动速度明显较慢,而vps74Δ/Δ菌株的SAPs泳动速度明显加快,说明vps74基因缺失导致了SAPs糖基化水平的显著降低。
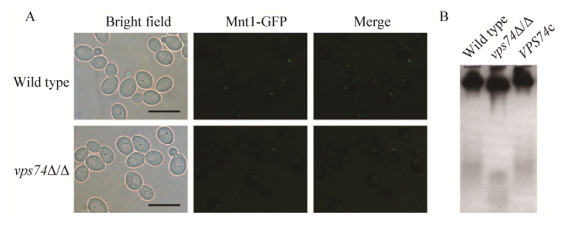
2.4 vps74缺失对白假丝酵母应对外源氧化压力及药物压力能力的影响白假丝酵母在宿主体内面临着各种压力,尤其是来自于宿主免疫细胞的氧化压力及外源抗真菌药物的压力[12-13],其压力应答能力是衡量致病能力的重要因素之一。利用梯度稀释方法测定了vps74缺失对白假丝酵母应对外源压力能力的影响,结果表明(图 4),vps74缺失并不会造成白假丝酵母应对氧化压力(H2O2)及抗真菌药物[特比萘酚(Terbinafine)、两性霉素B (Amphotericine B)、卡泊芬净(Caspofungi)]压力能力的改变。说明Vps74在白假丝酵母压力耐受方面并不发挥主要功能。
|
| 图 4 vps74基因缺失对白假丝酵母压力耐受性的影响 Figure 4 Effect of vps74 deletion on stress response in C. albicans |
|
|
白假丝酵母在侵染宿主组织时,会分泌酸性蛋白酶(主要为天冬氨酸蛋白酶)帮助降解宿主细胞外基质、角蛋白及免疫球蛋白等[1, 14],一方面有助于白假丝酵母摄取外源营养,另一方面有助于其黏附并进一步侵染宿主组织。采用牛血清白蛋白培养基(BSA培养基)测定了Vps74在白假丝酵母蛋白分泌过程中的作用,固体水解圈观测结果表明(图 5A),vps74缺失导致蛋白水解圈减小,提示白假丝酵母降解BSA的能力降低。液体培养液中BSA残留量检测(图 5B)结果进一步表明,相对于野生型菌株和回补菌株而言,在短时间培养条件下(8 h),vps74Δ/Δ表现出较弱的降解BSA的能力,而经过长时间(30 h)的培养之后,vps74Δ/Δ与对照菌株的BSA降解能力则不表现出明显的差异性。上述结果表明,vps74缺失导致了白念珠菌分泌胞外蛋白酶能力的削弱,但并没有导致分泌能力的完全丧失。
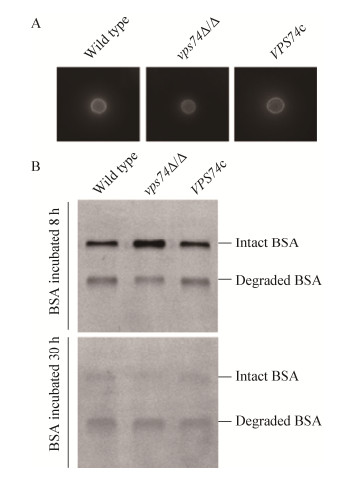
|
| 图 5 vps74基因缺失对白假丝酵母蛋白分泌能力的影响 Figure 5 Deletion of vps74 affects protein secretion of C. albicans 注:A:固体BSA平板检测蛋白水解圈大小,反映白假丝酵母蛋白分泌及降解外源蛋白的能力;B:液体培养菌体后培养基中BSA残余量检测. Note: A: The secretory ability detection by evaluating the area hydrolytic halo on BSA plate; B: The secretory ability was reflected by the ratio of residual integrated BSA and degraded BSA in liquid medium. |
|
|
鉴于胞内蛋白加工修饰的紊乱会影响白假丝酵母的形态发生[13, 15],进一步探究了Vps74对白假丝酵母形态发生能力的影响。固体菌丝诱导结果(图 6A)表明,在RPMI-1640、M199、Spider培养基中,vps74Δ/Δ菌落周边菌丝明显减少,菌丝形成能力显著降低。液体RPMI-1640培养结果(图 6B)显示,菌丝诱导3 h后,野生型及回补菌株能够形成伸展平滑的菌丝,而vps74Δ/Δ形成的菌丝明显较短,伴随少量的酵母细胞存在。将培养时间延长至6 h后,上述差异更为显著,野生型及回补菌株形成了具有明显分枝的菌丝网络,而vps74Δ/Δ菌丝较短,并且呈现弯曲及不规则分枝的状态。菌丝长度统计结果(图 6C)表明,vps74Δ/Δ形成的菌丝长度约为对照菌株的1/2,且该差异并不依赖于菌丝诱导时间的变化。进一步对视野中各种形态的细胞[菌丝型(Hyphae)、假菌丝型(Pseudohyphae)及酵母型(Yeast)细胞]所占比例进行统计(图 6D),发现vps74缺失造成菌丝诱导条件下酵母型细胞及假菌丝型细胞显著增多,菌丝型细胞则相对减少。以上结果表明,Vps74在白假丝酵母形态发生方面发挥重要功能。
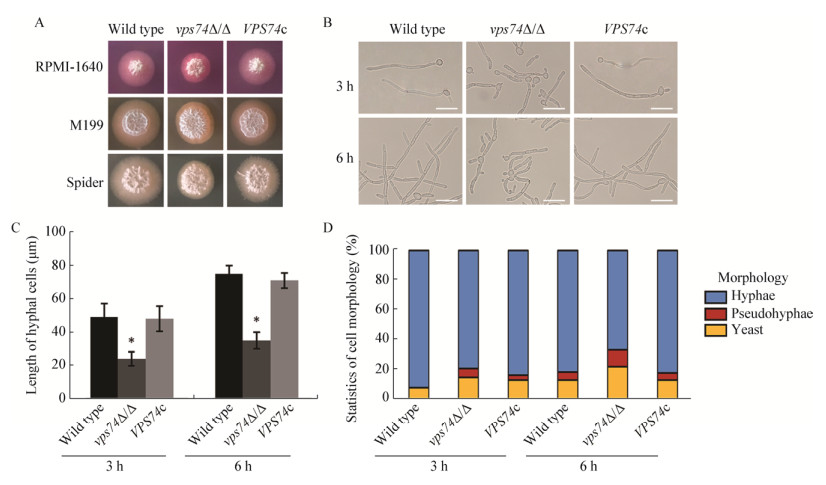
|
| 图 6 vps74基因缺失对白假丝酵母形态发生能力的影响 Figure 6 Deletion of vps74 affects yeast-to-hypha morphogenesis of C. albicans 注:A:不同固体菌丝诱导条件下,观察不同菌株的菌丝诱导情况;B:液体菌丝诱导条件下,显微镜下观察不同菌株的菌丝形态,比例尺为20 μm;C:液体菌丝诱导条件下不同菌株形成的菌丝长度比较,*:与对照组相比较差异显著(P < 0.05);D:液体菌丝诱导条件下,菌丝型、假菌丝型及酵母型细胞的比例. Note: A: Colonial morphology of different strains under solid hyphal-inducing condition; B: The mophology of different strains under liquid RPMI-1640 hyphal-inducing condition (bar=20 μm); C: Hyphal length statistics of different strains under liquid hyphal-inducing condition. *: There was significant different with control group (P < 0.05); D: Cell form statistics of different strains under liquid hyphal-inducing condition. |
|
|
除形态发生能力之外,白假丝酵母的黏附能力及嵌入式生长能力均对其致病能力具有重要影响[15-16]。采用体外聚乙烯孔板模型测定了Vps74在白假丝酵母黏附方面的功能,结果表明(图 7A),vps74缺失后导致白假丝酵母黏附能力显著下降。嵌入式生长测定结果表明(图 7B),野生型及回补菌株能够在培养基中形成繁茂的发散状菌丝,而vps74Δ/Δ形成菌丝的能力显著减弱,不能够很好地嵌入到培养基内部,说明Vps74在白假丝酵母嵌入式生长过程中发挥重要功能。综上所述,Vps74对白假丝酵母黏附及嵌入式生长至关重要。
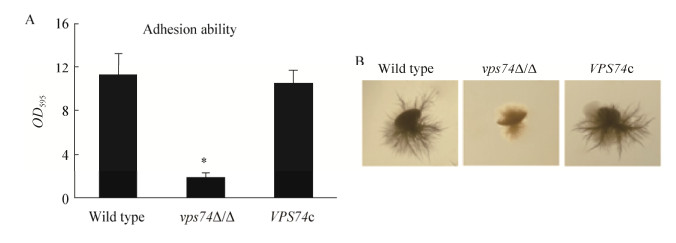
|
| 图 7 vps74基因缺失对白假丝酵母黏附和嵌入式生长能力的影响 Figure 7 Deletion of vps74 affects adhesion and embedded growth of C. albicans 注:A:采用聚乙烯孔板模型检测白假丝酵母黏附能力,*:与对照组相比较差异显著(P < 0.05);B:白假丝酵母低温嵌入式生长能力检测. Note: A: The adhesion ability detection of different strains with polyethylene orifice plate. *: There was significant different with control group (P < 0.05). B: The embedded growth was assayed with YPD plate under 25 ℃. |
|
|
基于Vps74在白假丝酵母分泌能力、形态发生、黏附及嵌入式生长等方面均发挥重要作用,采用小鼠感染模型探讨了该蛋白在白假丝酵母系统性感染宿主过程中的功能。小鼠存活率统计结果表明(图 8A),野生型菌株及回补菌株在感染小鼠15 d内全部死亡,而vps74缺失后导致白假丝酵母完全丧失了系统性感染小鼠的能力,感染后的小鼠一直正常存活。此外,肾脏真菌负载量检测结果(图 8B)表明,野生型菌株及回补菌株在感染小鼠8 d后,肾脏明显出现感染的肿胀症状,而且肾脏中能够分离获得大量的白假丝酵母,而vps74Δ/Δ感染后的小鼠肾脏中完全没有白假丝酵母的存在,说明Vps74在白假丝酵母造成深部感染过程中发挥重要作用,是造成系统性感染不可或缺的重要因子。
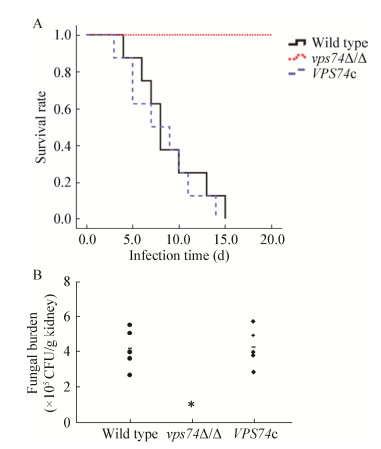
|
| 图 8 vps74缺失对白假丝酵母系统性感染宿主能力的影响 Figure 8 Deletion of vps74 affects the pathogenicity of C. albicans 注:A:小鼠被白假丝酵母感染后的存活情况统计;B:感染小鼠肾脏中真菌负载量统计,*:P < 0.05. Note: A: The survival situation of mice infected by different strains; B: The fungal burden in the kidney was evaluated by CFU. *: There was significant different with control group (P < 0.05). |
|
|
序列比对分析结果表明,白假丝酵母Vps74蛋白具有保守的GPP34结构域及氨基酸肽链N端具有的典型精氨酸(R)保守基序[11],提示该蛋白结构与其他生物具有高度同源性并可能参与高尔基体蛋白加工及物质转运过程。在酿酒酵母中的研究发现,Vps74/GOLPH3是参与高尔基体蛋白糖基化修饰的关键蛋白,并且是重要的PI4P效应因子[3-4]。本研究发现,vps74基因的缺失导致糖基转移酶Mnt1由高尔基体定位转移至液泡,并导致分泌性酸性磷酸酶(SAPs)糖基化修饰的严重缺陷,证明该蛋白在糖基化功能方面具有保守性,并且该调节依赖于Vps74参与调节的糖基转移酶Mnt1在高尔基体上的定位。此外,本研究证实,Vps74在维持酸性蛋白酶分泌过程中发挥重要作用,由于蛋白糖基化修饰的紊乱会导致蛋白分泌途径异常,进一步削弱白假丝酵母降解外源蛋白的能力,因此推测Vps74参与调节的分泌途径也与糖基化修饰过程有关。然而,vps74缺失后仍能继续降解外源蛋白,说明其在分泌途径中发挥的并非关卡性作用,或者胞内有其他蛋白与Vps74存在冗余性功能。此外,本研究还发现,Vps74对白假丝酵母黏附过程至关重要,而白假丝酵母的黏附能力也依赖于细胞表面黏附因子的分泌,进一步证实了Vps74对于蛋白分泌的重要性,说明其参与的蛋白分泌过程并不局限于酸性蛋白酶的分泌。
形态发生能力检测结果表明,Vps74在形态发生过程中发挥正调控作用。vps74缺失不会造成菌丝形成能力的完全丧失,但菌丝形态表现出延伸能力的缺陷。此外,嵌入式生长能力检测进一步表明,vps74缺失后白假丝酵母在低温下嵌入式生长能力显著降低,也表现为菌丝的延伸受到抑制,说明Vps74在菌丝的极性生长过程中发挥重要作用。而白假丝酵母在极性生长过程中需要多种特异蛋白的共同作用[1, 15],多数蛋白均需要经过糖基化修饰成熟,所以推测Vps74参与的菌丝延伸过程可能与其发挥的蛋白加工修饰过程相关。
小鼠系统性感染试验结果证明,vps74缺失可以完全阻断白假丝酵母对宿主组织的深部感染过程,其原因可能与Vps74参与蛋白分泌过程、黏附过程、形态发生过程均紧密相关。因此,基于白假丝酵母Vps74在深部感染过程中发挥的重要功能,可进一步以Vps74为药物靶点,开发靶向治疗白假丝酵母药物,为临床应用提供有用的参考。
| [1] |
Mayer FL, Wilson D, Hube B. Candida albicans pathogenicity mechanisms[J]. Virulence, 2013, 4(2): 119-128. DOI:10.4161/viru.22913 |
| [2] |
Gow NAR, van de Veerdonk FL, Brown AJP, et al. Candida albicans morphogenesis and host defence: discriminating invasion from colonization[J]. Nature Reviews Microbiology, 2012, 10(2): 112-122. DOI:10.1038/nrmicro2711 |
| [3] |
Graham TR, Burd CG. Coordination of Golgi functions by phosphatidylinositol 4-kinases[J]. Trends in Cell Biology, 2011, 21(2): 113-121. DOI:10.1016/j.tcb.2010.10.002 |
| [4] |
Tu LN, Tai WCS, Chen L, et al. Signal-mediated dynamic retention of glycosyltransferases in the Golgi[J]. Science, 2008, 321(5887): 404-407. DOI:10.1126/science.1159411 |
| [5] |
Schmitz KR, Liu JX, Li SQ, et al. Golgi localization of glycosyltransferases requires a Vps74p oligomer[J]. Developmental Cell, 2008, 14(4): 523-534. DOI:10.1016/j.devcel.2008.02.016 |
| [6] |
Dippold HC, Ng MM, Farber-Katz SE, et al. GOLPH3 bridges phosphatidylinositol-4-phosphate and actomyosin to stretch and shape the Golgi to promote budding[J]. Cell, 2009, 139(2): 337-351. DOI:10.1016/j.cell.2009.07.052 |
| [7] |
Scott KL, Kabbarah O, Liang MC, et al. GOLPH3 modulates mTOR signalling and rapamycin sensitivity in cancer[J]. Nature, 2009, 459(7250): 1085-1090. DOI:10.1038/nature08109 |
| [8] |
Sechi S, Colotti G, Belloni G, et al. GOLPH3 is essential for contractile ring formation and Rab11 localization to the cleavage site during cytokinesis in Drosophila melanogaster[J]. PLoS Genetics, 2014, 10(5): e1004305. DOI:10.1371/journal.pgen.1004305 |
| [9] |
Zhang B. Identification and functional study of Sac1 in Candida albicans[D]. Tianjin: Master's Thesis of Nankai University, 2015 (in Chinese) 张冰. 白念珠菌Sac1蛋白的鉴定及其功能的研究[D]. 天津: 南开大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10055-1015361056.htm |
| [10] |
Makowski SL, Tran TTT, Field SJ. Emerging themes of regulation at the Golgi[J]. Current Opinion in Cell Biology, 2017, 45: 17-23. DOI:10.1016/j.ceb.2017.01.004 |
| [11] |
Tu LN, Chen L, Banfield DK. A conserved N-terminal arginine-motif in GOLPH3-family proteins mediates binding to coatomer[J]. Traffic, 2012, 13(11): 1496-1507. DOI:10.1111/j.1600-0854.2012.01403.x |
| [12] |
Qiao JJ, Liu W, Li RY. Molecular resistance mechanisms of Candida albicans to antifungal agents[J]. Microbiology China, 2007, 34(2): 393-396. 乔建军, 刘伟, 李若瑜. 白念珠菌耐药的分子机制研究进展[J]. 微生物学通报, 2007, 34(2): 393-396. |
| [13] |
Yu QL, Wang H, Xu N, et al. Spf1 strongly influences calcium homeostasis, hyphal development, biofilm formation and virulence in Candida albicans[J]. Microbiology, 2012, 158(9): 2272-2282. |
| [14] |
Schaller M, Borelli C, Korting HC, et al. Hydrolytic enzymes as virulence factors of Candida albicans[J]. Mycoses, 2005, 48(6): 365-377. |
| [15] |
Sudbery PE. Growth of Candida albicans hyphae[J]. Nature Reviews Microbiology, 2011, 9(10): 737-748. DOI:10.1038/nrmicro2636 |
| [16] |
Kumamoto CA, Vinces MD. Alternative Candida albicans lifestyles: growth on surfaces[J]. Annual Review of Microbiology, 2005, 59(1): 113-133. DOI:10.1146/annurev.micro.59.030804.121034 |
 2018, Vol. 45
2018, Vol. 45