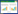扩展功能
文章信息
- 胡晓霞, 于瑞嵩, 司伏生, 陈冰清, 董世娟, 宋增福, 李震
- HU Xiao-Xia, YU Rui-Song, SI Fu-Sheng, CHEN Bing-Qing, DONG Shi-Juan, SONG Zeng-Fu, LI Zhen
- ORF3蛋白促进猪流行性腹泻病毒在Vero细胞上的增殖
- ORF3 protein promotes the proliferation of porcine epidemic diarrhea virus on Vero cells
- 微生物学通报, 2018, 45(7): 1508-1517
- Microbiology China, 2018, 45(7): 1508-1517
- DOI: 10.13344/j.microbiol.china.171048
-
文章历史
- 收稿日期: 2017-12-12
- 接受日期: 2018-04-19
- 网络首发日期(www.cnki.net): 2018-05-11
2. 水产科学国家级实验教学示范中心(上海海洋大学) 上海 201306;
3. 上海农业遗传育种重点实验室 上海 201106
2. National Demonstration Center for Experimental Fisheries Science Education (Shanghai Ocean University), Shanghai 201306, China;
3. Shanghai Key Laboratory of Agricultural Genetics and Breeding, Shanghai 201106, China
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)感染猪而引起的一种急性接触性肠道传染病,常导致病猪水样腹泻、呕吐、脱水、消化道粘膜发炎、出血及糜烂。不同年龄和不同品种的猪都会感染,1-2周龄哺乳仔猪更容易感染,其发病率和死亡率高达100%[1-2]。自从1971年英国首次报道PEDV以来,相继在比利时、德国、加拿大、日本、瑞士等多个国家均有此病发生的报道[3-4],中国从1976年开始陆续有PEDV的报道[5]。自20世纪90年代后期,随着PED疫苗的广泛使用,疫情得到有效控制[6]。从2010年起,PED再次在国内外养猪场大规模暴发,给养猪业造成了重大经济损失。目前PED在世界范围内仍呈广泛流行趋势,由于对PEDV免疫机理及侵入机制知之甚少,至今仍缺乏有效的PED防治措施。
orf3位于PEDV的s基因和e基因之间的第3阅读框,是目前被发现的PEDV的唯一一个附属基因,编码附属蛋白ORF3。研究者对其他冠状病毒的附属基因及编码蛋白的功能开展了较为详细的研究,如Müller等[7]研究发现HCoV-NL63的ORF3蛋白是与ERGIC中的结构蛋白共定位的糖基化蛋白,ORF3蛋白被整合进病毒粒子中参与病毒粒子的组装;Lu等[8]证明SARS-CoV orf3编码一种形成离子通道并调节病毒释放的新型结构蛋白3a;Kint等[9]研究表明IBV ORF3a蛋白对其抗Ⅰ型干扰素的功能至关重要。但对于PEDV orf3基因及其编码蛋白功能的研究处于起步阶段,目前认为ORF3蛋白与病毒的毒力有关[10-12],但不同研究者的研究结论仍存在争议。
本研究采用本实验室建立的基于靶向RNA重组技术的PEDV反向遗传学操作技术[13],以PEDV DR13弱毒株(GenBank登录号JQ023162)为骨架,拯救了携带不同orf3基因及orf3基因缺失的重组PEDV,检测这些重组病毒在细胞上的增殖能力,并绘制重组病毒在Vero细胞上的生长曲线,同时对不同重组病毒感染细胞一定时间后残留的完整细胞数量进行计数,并对感染后的细胞活力进行测定,以此探究ORF3蛋白对PEDV体外增殖的影响以及可能的作用机制。
1 材料与方法 1.1 细胞、质粒与毒株非洲绿猴肾细胞(Vero)和小鼠成纤维细胞(LR7),PEDV DR13弱毒株(GenBank登录号JQ023162),mPEDV [以鼠肝炎病毒(MHV)的s基因替换PEDV DR13弱毒株的s基因],orf3基因被PEDV DR13强毒株orf3基因替换的重组PEDV rDR13att-ORF3wt和重组质粒pDR13att-ORF3wt,均为本实验室保存。
1.2 主要试剂和仪器DNA胶回收试剂盒、质粒小提试剂盒、AxyPrep体液病毒DNA/RNA小量试剂盒,康宁生命科学有限公司;TOP10感受态细胞,天根生化科技(北京)有限公司;T4 DNA连接酶、限制性内切酶、酶标仪、mMESSAGE mMACHINETMT7转录试剂盒,Thermo Scientific公司;反转录酶M-MLV Reverse transcriptase、M-MLV-5×Reaction buffer、dNTP Mix、Ribonuclease inhibitor,Promega公司;TRIzol总RNA提取试剂盒,Invitrogen公司;CCK-8试剂盒,上海翊圣生物科技有限公司。凝胶图像分析系统,UVItec公司;全自动细胞计数分析仪,Nexcelom公司。
1.3 RNA提取及cDNA的合成病毒RNA提取使用AxyPrep体液病毒DNA/RNA小量试剂盒;粪便中的病毒RNA提取使用Invitrogen公司的TRIzol总RNA提取试剂盒。
以病毒RNA为模板反转录合成cDNA。反应过程:RNA (9 μL)与PCR下游引物(1 μL)混匀;70 ℃ 5 min,冰上放置2 min,依次添加M-MLV-5xReaction buffer 5 μL、200 μmol/L dNTP mix 1.5 μL,Ribonuclease inhibitor 0.5 μL、M-MLV Reverse transcriptase 1 μL、DEPC水6 μL,混匀后简短离心;42 ℃ 1 h;70 ℃ 10 min;即得cDNA。cDNA立即使用或-80 ℃保存备用。
1.4 重组质粒的构建以pDR13att-ORF3wt为模板,用引物4和引物5 (表 1) PCR扩增基因片段S-E1。反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 20 s,35个循环;72 ℃ 10 min。以CV777 (GenBank登录号AF353511) RNA为模板反转录合成cDNA,并以其为模板,以引物1和2 (表 1) PCR扩增ORF3CV777。反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 43 s,25个循环;72 ℃ 10 min。以某猪场采集的病猪粪便RNA为模板合成cDNA,并以其为模板,以引物1和2 (表 1) PCR扩增目的基因片段ORF3NY。反应条件:95 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 43 s,25个循环;72 ℃ 10 min。用Eco72 Ⅰ和BshT Ⅰ双酶切PCR产物和重组质粒pDR13att-ORF3wt,连接并转化大肠杆菌TOP10感受态细胞得到重组质粒pDR13att-∆ORF3、pDR13att-ORF3CV777和pDR13att-ORF3NY,重组质粒进行酶切及测序验证。
| 引物 Primer |
位置 Locationa |
序列 Sequence (5′→3′) |
PCR产物 PCR product |
| 1 | 24 737–24 786 | TGAAAAGGTCCACGTGCAGTGATGTTTCTTGGACTTTTTCAATACACGAT | ORF3wt |
| 2 | 25 363–25 412 | AAAGTATGACATTAACTGCTAGACCATTATCATTCACTAATTGTAGCATA | ORF3CV777 |
| 3 | 24 608–24 628 | TCTCATCTTTGTTGTGTCATT | ORF3NY |
| 4 | 25 480–25 500 | ATAGGTGTGTAAACTGCGCTA | S-E2 |
| 5 | 24 726–25 378 | TACGAAGCTTTTGAAAAGGTCCACGTGCAGTGAACTCAATTCAACTAGACGAGTATGCTACAATTAGTG | S-E1 |
| 注:a:引物的位置参考PEDV DR13毒株(GenBank登录号JQ023162)的全长基因组序列. Note: a: The location of primers is relative to the full genome sequence of the PEDV DR13 strain (GenBank accession number JQ023162). |
|||
重组病毒的拯救参照Li等[13]进行,将重组质粒进行线性化并用mMESSAGE mMACHINETMT7转录试剂盒转录RNA,-80 ℃保存备用。mPEDV感染LR7细胞24 h,待出现90% CPE时将转录后的RNA通过电穿孔的方法转染LR7细胞,并将转染后的LR7细胞铺到Vero细胞上于37 ℃细胞培养箱中培养,观察重组病毒在Vero细胞上的病变情况;以终末稀释法纯化得到的重组病毒并通过RT-PCR、测序验证;参照Karber法测定病毒的TCID50 (50% Tissue culture infective dose)。
1.6 重组病毒的鉴定 1.6.1 RT-PCR以rDR13att-ORF3wt、rDR13att-ORF3NY、rDR13att-ORF3CV777的RNA为模板,利用引物2 (表 1)反转录合成cDNA,以合成的cDNA为模板,利用引物1和引物2 (表 1) PCR扩增orf3基因并测序验证;重组病毒rDR13att-∆ORF3鉴定以引物5 (表 1)反转录合成cDNA,以合成的cDNA为模板,利用引物3和引物4及引物4和引物5 (表 1) PCR扩增S-E1和S-E2片段并测序验证。
1.6.2 免疫组化(Immunohistochemistry,IHC)Vero细胞以2×105个/mL的细胞密度接种于24孔细胞培养板,CO2培养箱37 ℃培养24 h;重组病毒以MOI为0.1感染Vero细胞,37 ℃吸附1 h后,弃病毒接种液,PBS洗2次,每孔加入3 mL DMEM培养液继续培养18 h后免疫组化分析。具体步骤:PBS洗2次,以3.7%多聚甲醛固定15 min;PBS洗3次,每孔加入200 μL 0.1% TritonX-100,15 min后弃0.1% TritonX-100,以封闭液(5%羊血清)洗1次,每孔加入200 μL封闭液室温封闭1 h;以兔抗ORF3多抗为一抗(1:50)室温孵育1 h,用含0.1% Tween-20的PBS洗3次;以HRP标记的羊抗兔IgG为二抗(1:200)孵育40 min,PBST洗3次;用DAB显色液显色5-8 min;弃显色液,每孔加入200 μL PBS终止反应,显微镜下观察、拍照。
1.7 病毒生长曲线的绘制及细胞计数Vero细胞以2×105个/mL的细胞密度接种于6孔细胞培养板,CO2培养箱37 ℃培养24 h;重组病毒以MOI为0.1感染Vero细胞;37 ℃吸附1 h后,弃病毒接种液,PBS洗2次,每孔加入3 mL DMEM培养液;在不同时间点终止感染并取样分别做病毒生长曲线和细胞计数。病毒生长曲线样品处理:6孔细胞培养板反复冻融3次后收集各孔的病毒液及细胞,4 ℃、5 000 r/min离心10 min,取上清,-20 ℃冻存,测定TCID50。细胞计数样品处理:PBS洗2次,0.5 mL胰酶消化1 min,0.5 mL重悬,全自动细胞计数分析仪计数。
1.8 病毒感染Vero细胞后细胞活力的测定Vero细胞以2×105个/mL的细胞密度接种于96孔板,CO2培养箱37 ℃培养24 h;重组病毒以MOI为0.1感染Vero细胞,以只有细胞的孔为阴性对照,即为A(0加药);只有培养基溶液的孔为空白对照,即为A(空白),试验组和对照组各6个重复孔;37 ℃培养一段时间后,向每孔内加10 μL CCK-8溶液;37 ℃孵育1 h后用酶标仪测定在450 nm处的吸光度。细胞活力按如下所示公式计算:
细胞活力(%)=[A(加药)-A(空白)]/[A(0加药)-A(空白)]×100;
A(加药):具有细胞、CCK8溶液和药物溶液孔的吸光度;
A(空白):具有培养基和CCK8溶液而没有细胞孔的吸光度;
A(0加药):具有细胞、CCK8溶液而没有药物溶液孔的吸光度。
1.9 数据分析生长曲线及细胞计数每个试验重复3次,取平均值。采用SPSS 17.0对所得数据统计分析。
2 结果与分析 2.1 S-E1、ORF3CV777、ORF3NY的扩增及重组质粒的鉴定为了构建携带不同orf3基因或orf3基因缺失的重组质粒并利用基于RNA同源重组的PEDV反向遗传学技术拯救携带不同orf3基因或orf3基因缺失的重组PEDV毒株,首先通过PCR扩增得到了191 bp的S-E1片段和725 bp的ORF3CV777和ORF3NY基因(图 1A);测序结果表明得到了正确的目的DNA片段。用Eco72Ⅰ和BshTⅠ双酶切鉴定构建的重组质粒pDR13att-ΔORF3、pDR13att-ORF3wt、pDR13att-ORF3NY、pDR13att-ORF3CV777,酶切后pDR13att-ΔORF3可以得到130 bp左右的DNA条带;另外3个质粒可以得到770 bp左右的orf3基因片段(图 1B);重组质粒测序结果也证实其序列正确。
|
| 图 1 S-E1、ORF3CV777、ORF3NY的PCR扩增(A)及重组质粒的鉴定(B) Figure 1 PCR amplification of S-E1, ORF3CV777 and ORF3NY (A) and confirmation of recombinant plasmids by digestion with restriction enzymes (B) 注:A:M:DL2000 marker;1、6:阴性对照;2:S-E1;3:ORF3wt;4:ORF3CV777;5:ORF3NY. B:M:DL15000 marker;1:pDR13att-ΔORF3;2:pDR13att-ORF3wt;3:pDR13att-ORF3NY;4:pDR13att-ORF3CV777. Note: A: M: DL2000 marker; 1, 6: Negative control; 2-5: PCR products of S-E1, ORF3wt, ORF3CV777 and ORF3NY, respectively. B: M: DL15000 marker; 1: pDR13att-ΔORF3; 2: pDR13att-ORF3wt; 3: pDR13att-ORF3NY; 4: pDR13att-ORF3CV777. |
|
|
将构建成功的重组质粒pDR13att-ΔORF3、pDR13att-ORF3NY、pDR13att-ORF3CV777体外转录成RNA并电转至mPEDV感染的LR7细胞,在Vero细胞上筛选重组PEDV,分别在电转后的第60、52、52 h观察到Vero细胞上病变产生。以终末稀释法纯化得到的重组病毒,在Vero细胞上有CPE出现(图 2)。

|
| 图 2 重组病毒的拯救 Figure 2 The rescue of recombinant viruses Note: A: Mock; B: rDR13att-ORF3NY; C: rDR13att-ORF3CV777; D: rDR13att-ORF3wt; E: rDR13att-∆ORF3. |
|
|
采用RT-PCR对所拯救的重组病毒进行鉴定,结果如图 3所示。重组病毒rDR13att-ORF3wt、rDR13att-ORF3NY、rDR13att-ORF3CV777可以扩增出725 bp的条带,rDR13att-∆ORF3可以扩增出191 bp和309 bp的条带。测序结果也表明扩增的DNA片段的序列与目标序列完全一致,表明重组病毒拯救成功。

|
| 图 3 重组病毒RT-PCR鉴定 Figure 3 Confirmation of recombinant viruses by RT-PCR 注:M:DL2000 marker;1、3、8:阴性对照;2、4:rDR13att-ΔORF3;5:rDR13att-ORF3wt;6:rDR13att-ORF3CV777;7:rDR13att-ORF3NY. 1、2利用引物4和引物5扩增,3、4利用引物3和引物5扩增,5-8利用引物1和引物2扩增. Note: M: DL2000 marker; 1, 3 and 8: Negative control; 2, 4: rDR13att-ΔORF3; 5: rDR13att-ORF3wt; 6: rDR13att-ORF3CV777; 7: rDR13att-ORF3NY. 1 and 2 were amplified with primer 4 and primer 5, 3 and 4 were amplified with primer 3 and primer 5, and 5 to 8 were amplified with primer 1 and primer 2. |
|
|
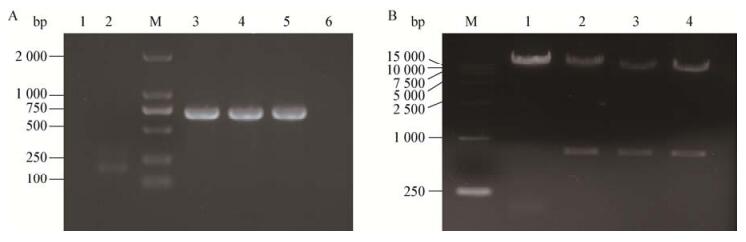
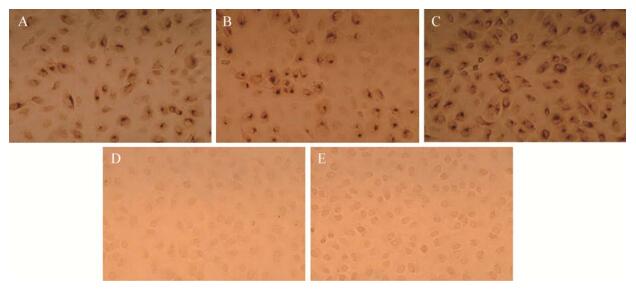
以兔抗ORF3多抗为一抗免疫组化鉴定获得重组病毒,结果表明重组病毒rDR13att -ORF3wt、rDR13att-ORF3CV777和rDR13att-ORF3NY都可以被兔抗ORF3多抗特异性识别,表明ORF3蛋白可以在Vero细胞中合成;而Mock对照和重组病毒rDR13att-ΔORF3不能被ORF3多抗识别(图 4)。
|
| 图 4 重组病毒的免疫组化分析 Figure 4 IHC analysis of Vero cells infected with recombinant viruses Note: A: rDR13att-ORF3wt; B: rDR13att-ORF3CV777; C: rDR13att-ORF3NY; D: Mock; E: rDR13att-∆ORF3. |
|
|
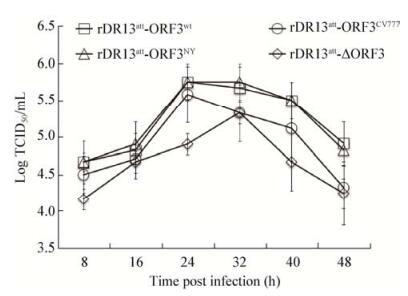
4株重组病毒rDR13att-ORF3wt、rDR13att- ORF3NY、rDR13att-ORF3CV777、rDR13att-∆ORF3具有相似的生长特性,其病毒滴度(TCID50)分别在感染的第24、24、24、32 h达到最高(图 5)。重组病毒rDR13att-ORF3wt和rDR13att-ORF3NY的达到滴度最高,rDR13att-ORF3CV777次之。同其他3株重组病毒相比,重组病毒rDR13att-∆ORF3的LogTCID50在整个感染过程中均低,其最高滴度仅为rDR13att- ORF3wt或rDR13att-ORF3NY的90%,为rDR13att-∆ORF3的95%。SPPS 17.0分析表明,重组病毒rDR13att-∆ORF3的TCID50显著低于其他病毒(P < 0.05),表明ORF3促进PEDV在Vero细胞上的增殖。
|
| 图 5 重组病毒生长曲线 Figure 5 Growth curves of recombinant viruses 注:病毒以MOI为0.1感染Vero细胞,在不同时间点收集样品并测定其TCID50. Note: Vero cells were infected with each recombinant PEDV at a MOI of 0.1, and viral titers (TCID50) at different time points post infection were determined. |
|
|
4株重组病毒以MOI为0.1感染Vero细胞,分别在感染25 h和36 h对细胞瓶内的细胞进行计数,并在感染30 h采集病毒感染图像。结果显示,缺失orf3的重组病毒rDR13att-ΔORF3感染25 h和36 h时的Vero细胞数明显少于其他3株重组病毒感染相同时间时的细胞数(P < 0.05,图 6A、B);CPE观察发现以相同MOI感染同样时间时,缺失orf3的重组病毒rDR13att-ΔORF3的CPE比其他重组病毒更显著(图 7)。

|
| 图 6 重组病毒感染Vero细胞后不同时间的细胞计数 Figure 6 Vero cells count at different time points post infection by recombinant viruses 注:A:感染后25 h细胞计数;B:感染后36 h细胞计数. Note: A, B: The numbers of Vero cells at 25 and 36 hpi by recombinant viruses. |
|
|
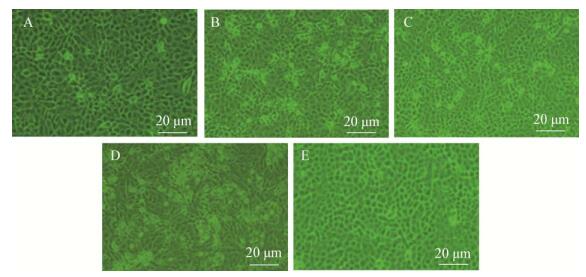
|
| 图 7 重组病毒感染Vero细胞30 h CPE形成 Figure 7 CPE formation at 30 h points post infection by recombinant viruses Note: A: rDR13att-ORF3wt; B: rDR13att-ORF3CV777; C: rDR13att-ORF3NY; D: rDR13att-∆ORF3; E: Mock. |
|
|
4株重组病毒以MOI为0.1感染Vero细胞,分别在感染12、24、36、48 h后用CCK-8试剂盒对Vero细胞活力进行测定。SPSS结果分析显示,重组病毒感染Vero细胞12 h时,各重组病毒感染的Vero细胞活力差异并不显著,而在感染24、36、48 h时,缺失orf3的重组病毒rDR13att-ΔORF3感染的Vero细胞活力显著低于其他3株重组病毒感染相同时间时的细胞活力(P < 0.05,图 8)。

|
| 图 8 重组病毒感染Vero细胞后不同时间的细胞活力 Figure 8 Vero cells viability at different time points post infection by recombinant viruses |
|
|
ORF3蛋白是目前发现的PEDV的唯一辅助性蛋白,其功能是PEDV的研究热点之一。但目前研究对于其是否有利于病毒增殖的结果不统一,如有研究证明此蛋白是离子通道蛋白[14],参与病毒增殖并对病毒增殖有促进作用;Beall等[15]利用基于体外连接的反向遗传学操作技术成功拯救了orf3基因缺失的重组PEDV(PC22A-∆orf3),同带有orf3基因的重组PEDV(PC22A)相比,PEDV(PC22A-∆orf3)形成的噬菌斑明显变小,其病毒滴度也略低于PEDV(PC22A),说明ORF3蛋白对PEDV体外增殖起重要作用。近期也有研究者通过构建稳定表达PEDV ORF3蛋白的Vero细胞系,显示ORF3蛋白可以促进PEDV增殖[16];但也有研究显示了与上不同的结果,如Chen等近期的研究结果显示orf3基因翻译的提前终止有利于PEDV适应Vero细胞,并可以提高其在Vero细胞上的复制能力[17];而Sun等[18]对一株非胰酶依赖PEDV 85-7的Vero细胞传代研究表明,orf3基因突变或翻译提前终止对PEDV的复制没有显著影响。Li等[13]利用反向遗传学系统构建了缺失orf3基因的重组PEDV,发现orf3基因缺失株和携带有全长orf3基因的重组病毒在Vero细胞上滴度相同,推测orf3基因不影响其在Vero细胞上的增殖。
PEDV反向遗传学技术为拯救相同遗传背景的毒株研究ORF3蛋白的功能提供了方便。本研究采用基于RNA同源重组的PEDV反向遗传学操作技术[13],以PEDV DR13弱毒株为基因骨架背景,拯救一系列携带有不同orf3基因的重组PEDV,同时拯救了orf3基因缺失的重组PEDV,研究ORF3蛋白对PEDV在Vero细胞上增殖的影响。免疫组化结果表明PEDV ORF3蛋白在Vero细胞中表达;一步生长曲线结果(图 5)显示虽然带有不同orf3基因的重组病毒感染相同时间的TCID50及出现CPE的量(图 7)不尽相同,在整个培养过程中,携带orf3基因的重组PEDV的滴度显著高于orf3基因缺失的重组PEDV的滴度,表明ORF3蛋白显著促进PEDV在Vero细胞上的增殖。本研究不仅是在完全相同遗传背景下和相同实验条件下比较了携带和不携带orf3基因的重组PEDV增殖能力的差异,而且设置了多株携带orf3基因的重组毒株作为参照,使研究结果更加科学和客观,这是与以往研究重要的不同之处。
在证明ORF3蛋白促进PEDV Vero细胞中增殖的基础上,通过对重组PEDV感染后25 h和36 h的活细胞计数发现,缺失orf3基因的重组病毒感染后的活细胞数比携带orf3基因的重组PEDV感染相同时间后的活细胞数要少(图 6),而且前者感染细胞后CPE出现的时间更早(图 7);通过对重组PEDV感染不同时间后测定细胞活力发现,感染24 h后缺失orf3基因的重组病毒感染后的细胞活力显著低于携带orf3基因的重组PEDV感染相同时间的细胞活力(图 8),该结果进一步证明带有orf3基因的重组病毒可以使更多细胞维持在生存状态。据此推断ORF3蛋白通过维持细胞活性、减缓或抑制细胞的凋亡/死亡以促进PEDV在Vero细胞上的增殖。Ye等[16]发现ORF3蛋白的表达可导致Vero细胞高尔基相关囊泡的增生,并伴随一些反式高尔基体囊的膨胀。ORF3在Vero细胞中的表达可延长细胞周期的S期,并诱导冠状病毒复制所必需的双层膜结构形成。这些研究表明ORF3蛋白的确可以与细胞相关蛋白相互作用,这些作用往往对PEDV的增殖是有利的。
总之,本研究通过拯救一系列携带不同orf3基因或orf3基因缺失的重组PEDV,证明了ORF3蛋白对于PEDV在Vero细胞中的增殖具有促进作用;同时提出ORF3蛋白的这种作用是通过延迟感染细胞的裂解死亡,为病毒增殖提供更加有利的条件。研究结果不仅丰富了对于PEDV ORF3生物功能的认识,也将为PEDV疫苗设计、临床防控及药物筛选提供理论基础。
致谢: 感谢荷兰乌德勒支大学兽医学院的Peter Rottier教授在试验设计和结果解释中给予的指导建议。| [1] |
Park SJ, Kim HK, Song DS, et al. Molecular characterization and phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field isolates in Korea[J]. Archives of Virology, 2011, 156(4): 577-585. DOI:10.1007/s00705-010-0892-9 |
| [2] |
Sun RQ, Cai RJ, Chen YQ, et al. Outbreak of porcine epidemic diarrhea in suckling piglets, China[J]. Emerging Infectious Diseases, 2012, 18(1): 161-163. DOI:10.3201/eid1801.111259 |
| [3] |
Shibata I, Tsuda T, Mori M, et al. Isolation of porcine epidemic diarrhea virus in porcine cell cultures and experimental infection of pigs of different ages[J]. Veterinary Microbiology, 2000, 72(3/4): 173-182. |
| [4] |
Takahashi K, Okada K, Ohshima K. An Outbreak of swine diarrhea of a new-type associated with coronavirus-like particles in Japan[J]. The Japanese Journal of Veterinary Science, 1983, 45(6): 829-832. DOI:10.1292/jvms1939.45.829 |
| [5] |
Cai BX. Infectious Diseases of Domestic Animal[M]. Beijing: China Agriculture Press, 2001, 213-214. 蔡宝祥. 家畜传染病学[M]. 北京: 中国农业出版社, 2001, 213-214. |
| [6] |
Zhang Z, Li L, Wang SS, et al. The identification and pathogenicity of porcine epidemic disease virus variant[J]. Chinese Journal of Veterinary Science, 2012, 32(10): 1423-1428. 张志, 李岚, 王赛赛, 等. 猪流行性腹泻新毒株的分离鉴定和致病性研究[J]. 中国兽医学报, 2012, 32(10): 1423-1428. |
| [7] |
Müller MA, van der Hoek L, Voss D, et al. Human coronavirus NL63 open reading frame 3 encodes a virion-incorporated N-glycosylated membrane protein[J]. Virology Journal, 2010, 7(1): 6. DOI:10.1186/1743-422X-7-6 |
| [8] |
Lu W, Zheng BJ, Xu K, et al. Severe acute respiratory syndrome-associated coronavirus 3a protein forms an ion channel and modulates virus release[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(33): 12540-12545. DOI:10.1073/pnas.0605402103 |
| [9] |
Kint J, Dickhout A, Kutter J, et al. Infectious bronchitis coronavirus inhibits STAT1 signaling and requires accessory proteins for resistance to type Ⅰ interferon activity[J]. Journal of Virology, 2015, 89(23): 12047-12057. DOI:10.1128/JVI.01057-15 |
| [10] |
Song DS, Yang JS, Oh JS, et al. Differentiation of a Vero cell adapted porcine epidemic diarrhea virus from Korean field strains by restriction fragment length polymorphism analysis of ORF3[J]. Vaccine, 2003, 21(17/18): 1833-1842. |
| [11] |
Park SJ, Moon HJ, Luo YZ, et al. Cloning and further sequence analysis of the ORF3 gene of wild- and attenuated-type porcine epidemic diarrhea viruses[J]. Virus Genes, 2008, 36(1): 95-104. DOI:10.1007/s11262-007-0164-2 |
| [12] |
Li RF, Qiao SL, Yang YY, et al. Phylogenetic analysis of porcine epidemic diarrhea virus (PEDV) field strains in central China based on the ORF3 gene and the main neutralization epitopes[J]. Archives of Virology, 2014, 159(5): 1057-1065. DOI:10.1007/s00705-013-1929-7 |
| [13] |
Li CH, Li Z, Zou Y, et al. Manipulation of the porcine epidemic diarrhea virus genome using targeted RNA recombination[J]. PLoS One, 2013, 8(8): e69997. DOI:10.1371/journal.pone.0069997 |
| [14] |
Wang K, Lu W, Chen JF, et al. PEDV ORF3 encodes an ion channel protein and regulates virus production[J]. FEBS Letters, 2012, 586(4): 384-391. DOI:10.1016/j.febslet.2012.01.005 |
| [15] |
Beall A, Yount B, Lin CM, et al. Characterization of a pathogenic full-length cDNA clone and transmission model for porcine epidemic diarrhea virus strain PC22A[J]. mBio, 2016, 7(1): e01451-15. |
| [16] |
Ye SY, Li ZH, Chen FZ, et al. Porcine epidemic diarrhea virus ORF3 gene prolongs S-phase, facilitates formation of vesicles and promotes the proliferation of attenuated PEDV[J]. Virus Genes, 2015, 51(3): 385-392. DOI:10.1007/s11262-015-1257-y |
| [17] |
Chen FZ, Zhu YX, Wu MZ, et al. Comparative genomic analysis of classical and variant virulent parental/attenuated strains of porcine epidemic diarrhea virus[J]. Viruses, 2015, 7(10): 5525-5538. DOI:10.3390/v7102891 |
| [18] |
Sun M, Ma JL, Yu Z, et al. Identification of two mutation sites in spike and envelope proteins mediating optimal cellular infection of porcine epidemic diarrhea virus from different pathways[J]. Veterinary Research, 2017, 48(1): 44. DOI:10.1186/s13567-017-0449-y |
 2018, Vol. 45
2018, Vol. 45