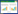扩展功能
文章信息
- 孔芳, 洪康进, 徐航, 赵世光, 王幼平
- KONG Fang, HONG Kang-Jin, XU Hang, ZHAO Shi-Guang, WANG You-Ping
- 基于啮食泡沫塑料黄粉虫肠道菌群中聚苯乙烯生物降解的探究
- Evidence of polystyrene biodegradation by gut microbiota of Styrofoam-feeding yellow mealworms (larvae of Tenebrio molitor Linnaeus)
- 微生物学通报, 2018, 45(7): 1438-1449
- Microbiology China, 2018, 45(7): 1438-1449
- DOI: 10.13344/j.microbiol.china.170719
-
文章历史
- 收稿日期: 2017-09-12
- 接受日期: 2018-01-25
- 网络首发日期(www.cnki.net): 2018-02-14
2. 扬州大学生物科学与技术学院 江苏 扬州 225009
2. College of Bioscience and Biotechnology, Yangzhou University, Yangzhou, Jiangsu 225009, China
石油基塑料的环境污染是世界性难题[1],据统计,2015年全球消耗塑料3亿t,其中应用最广的热塑性聚苯乙烯塑料占7.1%。聚苯乙烯(Polystyrene,PS)塑料是由苯乙烯单体聚合而成,有多个庞大苯基基团在分子链碳原子上,因此相对分子质量较高、耐腐蚀性好、稳定性强,普遍认为微生物无法降解聚苯乙烯类塑料[2]。传统处理废旧塑料的焚烧法、掩埋法均不能从根本上解决污染问题[3],而再加工受到加工次数的限制且应用范围较窄,为减缓塑料累积速度而研发的生物可降解塑料[4]对清除已形成的塑料垃圾毫无作用。通常高聚物的降解有光氧化、臭氧诱发、催化降解及生物降解等,其中生物降解是由生长在聚合物表面或内部的微生物引起,能耗低且不会造成二次污染,是绿色环保的降解方式。
黄粉虫(Tenebrio molitor Linnaeus)俗称面包虫,为全变态类昆虫,一个生长周期可分为卵、幼虫、蛹与成虫4个阶段,一般一个世代需要90-100 d[5-6]。黄粉虫幼虫目前用于动物饲料、食品加工、医药保健品及抗菌蛋白等,同时还可在环保应用中发挥作用,研究表明黄粉虫幼虫可富集重金属与微量元素于体内,并逐渐适应重金属污染的环境[7]。此外,黄粉虫幼虫能啮食降解塑料。沈叶红[8]从黄粉虫肠道中分离出8株细菌,并对黄粉虫降解塑料的机理进行了初步探究。Yang等发现以聚苯乙烯泡沫塑料为单一食源喂养黄粉虫幼虫,100只幼虫每天可以吃掉34-39 mg泡沫塑料,通过同位素α-13C或β-13C示踪,标记的PS塑料被降解矿化为13C标记的CO2与虫体脂肪,实验分离出PS降解细菌Exiguobacterium sp. YT2,该菌在60 d内可降解7.4%±0.4%的聚苯乙烯[9-10]。陈冠舟等[11]以高通量测序法探究啮食PS泡沫塑料黄粉虫肠道菌群结构,揭示了肠道细菌具有多样性,并且肠道细菌可能在黄粉虫生物降解塑料的过程中起主导作用。由于昆虫肠道细菌可分泌帮助昆虫肠道消化的酶,具有非常丰富的物种多样性及代谢途径多样性,因此从昆虫中分离降解菌是开发高分子材料生物降解的重要途径之一。本研究以啮食60 d聚苯乙烯的黄粉虫3龄幼虫为实验材料,通过采用多种培养基富集培养、聚苯乙烯+LB双层平板等方法,以期从肠道中分离出聚苯乙烯降解菌,并进行菌株形态学观察、生理生化实验及分子生物学分析,考察菌株对聚苯乙烯的降解特性,为聚苯乙烯塑料降解的研究提供良好的理论参考。
1 材料与方法 1.1 样品来源实验所用黄粉虫(Tenebrio molitor Linnaeus)幼虫于2016年10月购于山东无棣的绿色饲料养殖厂,幼虫虫体20-35 mm,在室温下饲养。
1.2 黄粉虫的饲养黄粉虫在室温25 ℃的实验室环境下饲养,挑取体态均匀的幼虫各300条分为2组,并记录黄粉虫的初始体重,实验组仅靠聚苯乙烯白色泡沫塑料啮食钻洞,对照组饲喂麸皮。
1.3 培养基及培养条件LB培养基(g/L):蛋白胨10.0,酵母膏5.0,NaCl 10.0,pH 7.0。
以聚苯乙烯为唯一碳源的基础培养基(g/L):(NH4)2SO4 1.0,K2HPO4 0.7,MgSO4·7H2O 0.7,KH2PO4 0.7,NH4NO3 1.0,MnSO4·H2O 0.001,NaCl 0.005,FeSO4·7H2O 0.002,聚苯乙烯膜片,pH 7.0。
查氏培养基(CA,g/L)[12]:NaNO3 3.0,K2HPO4 0.5,MgSO4·7H2O 0.5,KCl 0.5,FeSO4 0.01,蔗糖30.0,琼脂15.0,pH 7.0。
查氏酵母培养基(CYA,g/L):K2HPO4 1.0,查氏浓缩液10 mL,酵母提取物5.0,蔗糖30.0,琼脂15.0。
麦芽浸汁培养基(MEA,g/L):生麦芽20.0,蔗糖20.0,蛋白胨1.0,氯霉素0.1,琼脂15.0,pH调至6.4。
SAB缓冲液(pH 5.6,0.1 mol/L):将1.5 mL HAc稀释至100 mL,2.72 g NaAc·H2O稀释至200 mL,两溶液混合后调pH至5.6,4 ℃保存。
以上培养基如无特殊情况,1×105 Pa灭菌30 min。
1.4 主要试剂和仪器实验主要试剂为化学纯,国药集团药业股份有限公司;快速DNA提取检测试剂盒、Taq DNA聚合酶,天根生化科技(北京)有限公司。MyCycle PCR仪,美国Bio-Rad公司;紫外可见分光光度计,日本岛津公司;核酸电泳仪,北京六一生物科技有限公司;凝胶成像系统,英国Syngene公司;振荡培养箱,常州国华仪器有限公司;冷冻离心机,广州绿百草生物科技有限公司;生物制品冷冻干燥系统,北京松源华兴科技有限公司。
1.5 黄粉虫肠道微生物的分离与纯化按照文献[13]的方法,黄粉虫幼虫经过白色泡沫塑料60 d的饲喂处理,在超净工作台上用75%酒精对虫体消毒1 min,SAB缓冲液反复漂洗至白色肉体,无菌水清洗3次,然后在蜡盘中解剖取出肠道,加入200 μL无菌的0.9% NaCl溶液,用灭菌的研磨棒研磨至无可见颗粒,作为肠道微生物培养母液。
研磨物母液中加入无菌的0.9% NaCl溶液进行梯度稀释,取稀释倍数103、104、105的培养液200 μL涂布于CA培养基、CYA培养基与MEA培养基,30 ℃恒温培养,待菌落长出后,分别挑取菌落边缘处新长出的菌丝,及时转接至新鲜平板上培养,等菌落长至直径3 cm左右时转接至斜面,4 ℃保存备用。
1.6 黄粉虫幼虫粪便的收集与处理用无菌勺收集饲喂60 d的黄粉虫幼虫产生的粪便,加入50 mL聚苯乙烯(1 g)+LB液体培养基中,30 ℃、150 r/min振荡培养,每次按2% (质量体积比)接种量转接到新鲜培养基中,转接4次后取1 mL富集液,进行梯度稀释成10-1-10-5稀释液,取100 μL稀释液涂布平板,将平板上长出的形态不同的菌落编号并多次划线纯化,直至得到纯化单菌落,以确保菌株的纯度和聚苯乙烯降解的稳定性,将纯化的菌株保存斜面试管中于4 ℃,待进一步鉴定。
1.7 部分分离菌株的鉴定形态观察:挑取培养48-72 h的菌落涂片,使用革兰氏染色法将细菌染色并在油镜下观察菌体颜色,用扫描电镜观察细菌形态,其他生理生化试验参照沈萍等[12]方法。真菌进行菌丝、产孢结构以及孢子的形态特征观察。
分子生物学鉴定:肠道菌株基因组通过试剂盒提取。16S rRNA基因的扩增采用细菌通用引物27F (5′-CAGAGTTTGATCCTGGCT-3′)和1492R (5′-A GGAGGTGATCCAGCCGCA-3′)。肠道真菌菌株rRNA的ITS区域的扩增采用通用引物ITS1 (5′-TC CGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTC CGCTTATTGATATGC-3′)。
PCR反应体系(25.0 μL):Taq酶(5 U/μL) 0.15 μL,10×Buffer 2.5 μL,dNTPs (2.5 mmol/L) 2.0 μL,27F/1492R (10 μmol/L)各0.5 μL,模板DNA (100 ng/μL) 0.5 μL,灭菌ddH2O补足25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,55 ℃ 50 s,72 ℃ 1 min,32个循环;72 ℃ 10 min;4 ℃保存。PCR产物经1%琼脂糖凝胶电泳测其纯度,扩增产物经检测后送至生工生物工程(上海)股份有限公司进行测序。
将测序得到的序列通过NCBI网站(http://www.ncbi.nlm.nih.gov)进行同源序列搜索(BLAST search),匹配出同源序列。选取代表性菌株序列作进一步的分析,首先采用ClustalX 1.8将序列对齐,利用MEGA 6.0软件进行系统发育分析,并以自展法(Bootstrap)进行检测,共循环1 000次,Neighbor-Joining法构建系统发育树。根据系统发育树中组群关系对菌株进行分类,并结合菌株的形态观察结果确定菌株的分类地位。
1.8 菌株降解特性的研究 1.8.1 聚苯乙烯预处理将聚苯乙烯置于紫外灯下灭菌3 h,称取3 g聚苯乙烯溶于12 mL二氯甲烷配制成均匀溶液,在洁净的工作台上把溶液均匀涂于载玻片上成膜,然后置于真空干燥箱中除去二氯甲烷溶剂,制备成数张2.5 cm×2.0 cm、厚度0.1 mm的聚苯乙烯薄膜,将膜片用50%、75%与95%乙醇消毒,并用蒸馏水清洗3次,烘干称重并用紫外灭菌30 min备用。
1.8.2 聚苯乙烯膜片降解的测定将聚苯乙烯膜片(约25 mg)置入无碳源的液体培养基,每组3个平行,接入菌株于30 ℃、150 r/min振荡培养,设置空白对照,观察聚苯乙烯膜片的变化,定期取样。取出的膜片用蒸馏水洗涤,干燥后的膜片经喷金后采用扫描电子显微镜观察其表面形态结构;另取洗净干燥的膜片,进行水接触角、断裂伸长率以及拉伸强度的测定,按照GB/T528-2009标准测试样品的断裂延伸率和拉伸强度[14]。
1.8.3 聚苯乙烯颗粒降解的测定接种2% (体积比)的菌悬液至有5 g聚苯乙烯颗粒的摇瓶中,30 ℃、150 r/min振荡培养,以不接菌株的培养基为空白对照,每组3个平行,每5 d在灭菌的超净台迅速移取聚苯乙烯于灭菌的离心管中,清洗干净,烘干称重,计算60 d培养聚苯乙烯颗粒的失重率。
2 结果与分析 2.1 肠道细菌的分离筛选与鉴定 2.1.1 肠道细菌的形态学观察与鉴定以聚苯乙烯白色泡沫塑料饲喂黄粉虫幼虫,幼虫在泡沫中打洞,生长良好,经由幼虫肠道消化后白色泡沫变成土黄色条状粪便,将粪便富集,30 ℃、150 r/min振荡2 d,然后涂布于聚苯乙烯+LB的固体平板,根据菌落不同形态在有氧条件下进行分离纯化,获得7株好氧菌。将7株菌分别接种于LB和聚苯乙烯膜片组成的液体基础培养基中,对菌株进行初筛。经过10 d的培养,结果发现7株好氧菌在LB液体培养基中长势均良好,而与LB培养基相比,含聚苯乙烯的无碳源基础培养基中只有2株菌生长状况较好(菌株5、2),如图 1所示,这2株菌能以聚苯乙烯为唯一碳源生长,菌体浓度最高时2株菌的OD600分别为0.550±0.010和0.338±0.009,而其他菌株利用PS的能力较弱,在培养过程中菌体浓度几乎无变化。

|
| 图 1 7株菌在以PS膜片为唯一碳源的液体基础培养基中的生长曲线 Figure 1 Growth curves of strains 1-7 in liquid basic medium with PS films as the sole carbon source |
|
|
将初步筛选到的菌株5和2分别命名为PSI-1和PSI-2。将菌株在聚苯乙烯+LB的固体平板上培养3 d,菌落形态(图 2A、B)与革兰氏染色后的菌体形态(表 1)及电镜扫描如图 2C、D、E、F所示。

|
| 图 2 菌株PSI-1与PSI-2在PS+LB平板中菌落形态、革兰氏染色(100×油镜)与电镜图 Figure 2 Micrographs of PSI-1 and PSI-2 observed under the microscope and SEM 注:A和B分别为菌株PSI-1和PSI-2在PS+LB平板中的菌落形态;C:PSI-1 (G+);D:PSI-1的电镜图;E:PSI-2 (G-);F:PSI-2的电镜图. Note: A and B were colony morphology of strains PSI-1 and PSI-2 in PS +LB medium; C: PSI-1 (G+); D: Micrograph of PSI-1 by SEM; E: PSI-2 (G-); F: Micrograph of PSI-2 by SEM. |
|
|
| Strains | Colony features | Gram staining | Thallus morphology | Diameter after 3 d incubation period (mm) |
| PSI-1 | White, circle, moist and umbonate with an irregular margin, | Gram-positive and produced endospores | Streptococci, single rod-shaped or arrangement in filamentous chains | 4.0-6.0 |
| PSI-2 | Transparent, circle, smooth, moist with an entire margin | Gram-negative | Short rod-shaped, single or arrangement in pairs | 0.5-1.2 |
对2株菌的多项生理生化指标进行测定,如表 2所示,参照《伯杰氏细菌鉴定手册》与《常见细菌系统鉴定手册》等,可初步鉴定菌株PSI-1为芽胞杆菌属[15]、菌株PSI-2为肠杆菌。
| Items | PSI-1 | PSI-2 |
| Methyl red test | + | - |
| Indole test | + | - |
| Voges-Proskauer test | + | + |
| Glucose fermentation | + | + |
| Starch hydrolysis | + | - |
| Catalase test | + | + |
| Hydrogen sulfide test | - | - |
| Gelatin liquefaction test | + | - |
| Citrate test | - | - |
| Note: +: Positive; -: Negative. | ||
对菌株PSI-1与PSI-2的16S rRNA基因序列进行分析,PSI-1的片段长度为1 459 bp (GenBank登录号:MF928090),PSI-2的片段长度为1 515 bp (GenBank登录号:MF928091),将序列进行BLAST同源比对分析,挑出相似度99%以上的同源序列进行比对,构建系统发育进化树(图 3、4),发现菌株PSI-1与炭疽芽孢杆菌聚为同一分支中,菌株PSI-2与霍氏肠杆菌聚为同一分支中,二者自展值均是57,亲缘关系最近。根据上述形态学观察和生理生化鉴定以及进化树的对比结果,菌株PSI-1可鉴定为芽孢杆菌属的Bacillus anthracis Ames (AE016879),菌株PSI-2可鉴定为霍氏肠杆菌Enterobacter hormaechei。

|
| 图 3 菌株PSI-1基于16S rRNA基因序列的系统发育进化树 Figure 3 Phylogenetic tree of strain PSI-1 based on 16S rRNA gene sequence 注:利用MEGA 6.0软件中的Neighbor-Joining法构建系统发育树,括号中为菌株的登录号,节点上的数值是自展值(%). Note: The tree was reconstructed by the Neighbor-Joining method using the MEGA 6.0 software. Accession numbers of the bacterial isolates are shown in brackets. The numbers at the branch nodes are boot strap values (%). |
|
|
|
| 图 4 菌株PSI-2基于16S rRNA基因序列的系统发育进化树 Figure 4 Phylogenetic tree of strain PSI-2 based on 16S rRNA gene sequence |
|
|
从肠道提取液中分离到一株降解聚苯乙烯性能较好的真菌,命名为KHJ-1。将KHJ-1菌株分别点植于MEA、CYA与CA培养基中培养10 d,在不同培养基中的生长状况描述如表 3所示。菌株在MEA与CYA培养中菌丝生长速率最快(图 5),培养10 d后菌落直径可达80 mm左右,厚度约2 mm-3 mm,菌落颜色呈褐黑色,有辐射状沟纹,质地丝绒状,背面浅黄绿色,具霉味,菌丝发达,无渗出液。
| Index | MEA medium | CYA medium | CA medium |
| Surface color | Black | Black center with a white indusium in the edge | Brown-black |
| Color in the rear of the medium | Yellow-orange | Greenish-yellow | Colorless |
| Colony characteristics | Dry and wrinkled | Wrinkled | Wrinkle free |
| Speed of growth Colony diameter (mm) | Fast growing 85 mm in diameter | Fastest growing 90 mm in diameter | Slow-growing, 80 mm in diameter |
| Whole colony | Round | Round | Round |
| Margin | Irregular | Irregular | Irregular |
| Consistency | Adhere to the medium more tenaciously | Tenacious | Tenacious |
| Odor | Mouldy | Mouldy | Mouldy |

|
| 图 5 菌株KHJ-1在MEA、CYA与CA培养基上的生长状况 Figure 5 Developing conditions of KHJ-1 strain in different medium 注:A、B:在MEA培养基正面与反面;C、D:在CYA培养基正面与反面;E、F:在CA培养基正面与反面. Note: A, B: MEA medium; C, D: CYA medium; E, F: CA medium. |
|
|
KHJ-1的菌丝和分生孢子形态进行显微观察,可以看出菌株KHJ-1孢子囊球形黑色,在孢囊梗顶端形成,直径150 μm-250 μm,具有明显的壁,分生孢子梗发生于基质,孢梗茎(1 000-3 500) μm× (9-20) μm,无隔分枝状菌丝,菌丝特化形成假根,分生孢子呈球形(图 6),参照《真菌菌种鉴定手册》,菌株KHJ-1与曲霉科(Aspergillaceae)、曲霉属(Aspergillus)的性状一致。

|
| 图 6 KHJ-1菌株的菌丝体及孢子形态图 Figure 6 The morphologic hyphal and acervulus of endophyte KHJ-1 strain 注:A:菌株的菌丝形态;B:菌株的孢子形态. Note: A: Mycelial morphology of KHJ-1; B: Spore morphology of KHJ-1. |
|
|
KHJ-1菌株DNA扩增条带经琼脂糖凝胶电泳测定大小为570 bp左右,ITS-rRNA序列经NCBI上BLAST比对并申请GenBank登录号(MF928710)。菌株KHJ-1的ITS-rRNA序列与Aspergillus niger ATCC16888 (AY373852)序列相似性达100%。使用MEGA 6.0软件,以Neighbour-Joining方法构建进化树(图 7),遗传距离显示该菌株与黑曲霉遗传距离最近,自展值为96。综合形态学特征与ITS序列分析,将菌株KHJ-1鉴定为黑曲霉Aspergillus niger KHJ-1,该菌株已保藏于中国普通微生物菌种保藏管理中心,其保藏编号为CGMCC14629。

|
| 图 7 基于真菌KHJ-1的5.8S rRNA基因片段序列构建的系统发育树 Figure 7 Phylogenetic tree based on the 5.8S rRNA gene sequence of KHJ-1 注:括号中的序列号代表菌株的GenBank登录号;发育树节点的数值表示自展值(%). Note: Number in parenthesis represent the sequence's accession number in GenBank; Numbers at notes present bootstrap percentage. |
|
|
测定真菌KHJ-1对聚苯乙烯膜片的降解实验中,按2%接种量接入聚苯乙烯膜片+查氏液体培养基(实验组),设空白对照组。经14 d的培养,实验组培养基变浑浊,微生物菌体生长良好,对照组液体透明,实验组聚苯乙烯膜片上有大量腐蚀孔洞,孔洞大至肉眼可见(图 8),图 8B中最大椭圆孔洞为1.02 mm×0.669 mm。

|
| 图 8 SEM观察聚苯乙烯膜片表面 Figure 8 SEM observation of the surface of polystyrene film 注:A:空白对照;B:接种KHJ-1菌株14 d后的破损膜片. Note: A: Control; B: Film damaged after 14-day inoculation of strain KHJ-1. |
|
|
接触角是目前获得聚合物表面结构及其变化最有效、最灵敏的方法,聚苯乙烯膜片的疏水性可用接触角大小来反映,接触角越大,表面能越低,其疏水性越强[14]。测定空白对照组0 d膜片水接触角为85.02°±0.12°,疏水性很强;14 d后测定膜片水接触角缩至61.25°±0.16°,膜片接触角减小,亲水性增强。膜片的断裂伸长率由原来0 d的480.87%±4.15%降至95.25%±4.38%,拉伸强度由原来的240.5±3.30 MPa降至90.0±2.81 MPa,膜片力学性能大幅下降。膜片质地由初始的粗糙变得光滑,膜片边缘出现卷边、褶皱、易脆易破损等现象,而对照组的膜片几乎无变化。表明真菌微生物在膜片上生长并可有效降解聚苯乙烯。
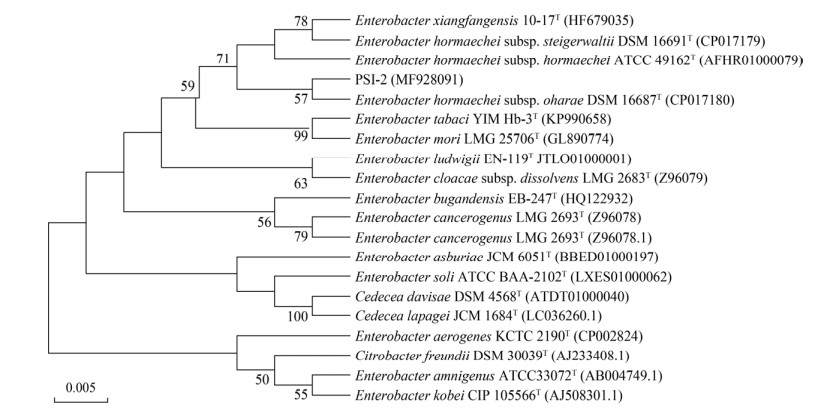
2.3.2 KHJ-1降解聚苯乙烯颗粒的测定将菌种KHJ-1接种若干瓶加有5 g聚苯乙烯颗粒的查氏液体培养基中,30 ℃、150 r/min振荡培养60 d,每5 d取样一次,洗涤聚苯乙烯颗粒并烘干至恒重,称量后计算颗粒的失重率,空白组与实验组各3个平行(图 9),在培养过程中菌株生长趋势增加,60 d细胞干重最大值为1.641±0.032 mg,从5、10、15、20 d时聚苯乙烯颗粒失重分别为5.8、25.8、37.6、54 mg,20 d后将菌种第一次重新转接新鲜培养基,导致25 d时PS颗粒重量变化出现了平缓,失重只有57 mg,与上次测量相差仅3 mg左右,菌株在20-25 d间也表现为生长停滞(图 9菱形标注),导致代谢缓慢;30 d时菌株迅速适应新环境,达到了对数生长期,PS失重达81.6 mg,与上次测量差值高达24.6 mg;培养40 d后第二次重新转接,降解又出现平缓,45 d测量与上次失重相差5.3 mg;50 d时菌株又重新适应新环境,60 d时PS失重高达214.8±0.004 mg,失重率为4.29%。结果表明菌株在迟滞期时颗粒失重也较慢,达到对数生长期时,PS失重也大幅增加,而空白组中颗粒实验前后几乎无变化,说明聚苯乙烯颗粒的降解是菌株作用的结果而非水解作用。
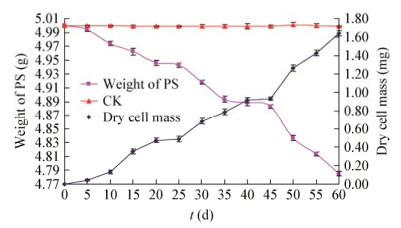
|
| 图 9 菌株生长对聚苯乙烯颗粒重量的影响 Figure 9 Effect of weight of polystyrene on growth of KHJ-1 |
|
|
塑料废物污染是世界性环境难题,严重威胁着生态环境,而聚苯乙烯又是其中最难降解的塑料之一。与处理塑料的传统方法相比,利用微生物降解途径对于生态环境的可持续发展更具现实意义。早期有研究报道不同国家和地区工作的研究人员发现在仓库与厨房中的具颚昆虫可以咀嚼和咬破装粮食的塑料袋[16-17]。根据对不同种昆虫(218个种)肠道菌群多样性研究,昆虫肠道中优势菌群属于Proteobacteria和Firmicutes两大门[18]。而陈冠舟等利用高通量测序探究黄粉虫肠道厌氧菌群结构发现,啮食PS组相对于纸片对照组中丰度最高的是Alcaligenes (相对丰度35.9%),因此可见啮食PS塑料对虫体正常肠道菌群结构造成影响[11]。Atiq等从埋放PS膜的土壤中分离出6种细菌,它们以PS作为唯一碳源在膜上粘附生长,通过检测胞外环境代谢物,发现只有Paenibacillus urinalis NA26、Bacillussp. NB6和Pseudomonas aeruginosa NB26 3种菌能从PS中提取一些碳,但塑料并未发生显著的化学变化[19]。沈叶红从黄粉虫肠道菌群中分离出8株好氧菌,分别是Stenotrophomonas、Serratia、Bacillus subtilis、Enterobactersp.、Bacterium、Staphylococcus、Stenotrophomonas maltophilia和Citrobacter,8株菌在PS膜上均有腐蚀斑[8],分离出的微生物菌种类别与文献报道的菌种存在较大的差别。Gilan等在好氧条件下分离的降解PS的菌种是Rhodococcus ruber C208,该菌降解率可达8%[20]。2014年Yang等首次以全面证据揭示了蜡虫(Plodia interpunctella,印度谷斑螟)肠道内存在有效降解聚乙烯(Polythene,PE)塑料的细菌,分离出2株细菌Bacillus spp. YP1和Enterobacter asburiae YT1,60 d液体培养PE膜失重率达10%,并在液体培养基中检测出大量水溶性的低分子量中间产物[21]。2015年Yang研究团队又发现,黄粉虫幼虫相对于蜡虫而言吃塑料更为厉害,并根据虫体粪便的化学组成证实聚苯乙烯长链已发生了解聚。Bombelli等在除去蜂巢内的寄生虫时偶然发现了蜡蛾幼虫,研究将100只蜡虫与英国超市的塑料袋接触,仅40 min袋子上就开始出现孔洞,12 h后塑料袋重量比初始减少了92 mg,而以前报道细菌生物降解某些塑料的速度为0.13 mg/d;为证实塑料降解并非仅由蜡虫咀嚼机制造成,将其中一些蜡虫捣碎后涂在PE塑料袋上,光谱分析表明PE化学键发生了断裂,蜡虫将PE转化成了乙二醇单体分子,证实蜡虫降解了PE高分子链[22]。本研究发现通过60 d连续饲喂聚苯乙烯泡沫塑料,黄粉虫幼虫肠道与粪便中富集了与PS降解相关的菌种,在有氧条件下通过分离筛选到2株细菌PSI-1、PSI-2与一株真菌KHJ-1,通过形态观察、生理生化及rRNA基因序列分析鉴定分别是Bacillus anthracis、Enterobacter hormaechei和Aspergillus niger,3株菌均能以聚苯乙烯为唯一碳源进行生长并参与塑料降解。在聚苯乙烯塑料降解特性研究中,我们选择了降解性较好的Aspergillus niger KHJ-1,14 d的培养发现PS膜片多处形成孔洞破损,水接触角与力学性能测定结果表明,当膜片上出现孔洞后,导致膜片受力不均,抗拉性能下降,疏水性减弱,亲水性增强,有利于菌体的粘附降解。推测降解过程中,菌株将PS高分子链氧化生成了–CHO、–COOH等亲水性基团[23]。在测定KHJ-1菌株对PS颗粒定量降解中,60 d测得PS颗粒失重214.8 mg/5 g,失重率为4.29%。作者认为失重率理论应更高些,由于菌体在PS降解过程中可能会附着在颗粒表面,导致颗粒外围附着有菌膜,从而使PS颗粒的称量结果之间的差值实际偏低,结果造成降解率计算偏低。
目前有关细菌降解PS等塑料已有较多报道,但降解能力大多不够理想,利用黑曲霉真菌降解PS的研究却很少。本研究分离出的Aspergillus niger KHJ-1相较于文献中报道的菌株而言,降解聚苯乙烯泡沬塑料的周期测定持续了60 d,周期虽漫长但重复性较好,尽管降解效率与文献报道存在一定的差距,未来的工作中可以通过诱变及降解优化等手段提高其降解效率。该菌株在聚苯乙烯生物降解方面极具应用潜能,丰富了聚苯乙烯降解菌株资源库,为深入研究聚苯乙烯的生物降解具有一定辅助作用。
| [1] |
Yoshida S, Hiraga K, Takehana T, et al. A bacterium that degrades and assimilates poly (ethylene terephthalate)[J]. Science, 2016, 351(6278): 1196-1199. DOI:10.1126/science.aad6359 |
| [2] |
Yang J, Song YL, Qin XY. Biodegradation of polyethylene[J]. Environmental Science, 2007, 28(5): 1165-1168. 杨军, 宋怡玲, 秦小燕. 聚乙烯塑料的生物降解研究[J]. 环境科学, 2007, 28(5): 1165-1168. |
| [3] |
Ioakeimidis C, Fotopoulou KN, Karapanagioti HK, et al. The degradation potential of PET bottles in the marine environment: An ATR-FTIR based approach[J]. Scientific Reports, 2016, 6: 23501. DOI:10.1038/srep23501 |
| [4] |
Lu CX, Liu L, Li JH, et al. Isolation and characterization of a microorganism degrading starch/polyethylene blends[J]. Chinese Journal of Applied & Environmental Biology, 2013, 19(4): 683-687. 陆辰霞, 刘龙, 李江华, 等. 淀粉填充聚乙烯类塑料降解微生物的筛选和降解特性[J]. 应用与环境生物学报, 2013, 19(4): 683-687. |
| [5] |
Bai YY, Cheng JA. Nutritive value and rearing methods of Tenebrio molitor in China[J]. Entomological Knowledge, 2003, 40(4): 317-322. 白耀宇, 程家安. 我国黄粉虫的营养价值和饲养方法[J]. 昆虫知识, 2003, 40(4): 317-322. DOI:10.7679/j.issn.2095-1353.2003.084 |
| [6] |
Ye XQ, Liu DH, Hu C. Some factors' effects on the solubility of protein from yellow mealworm (Tenebrio molitor L) larvae[J]. Journal of Zhejiang University (Science A), 2001, 2(4): 436-438. DOI:10.1631/jzus.2001.0436 |
| [7] |
van Ooik T, Rantala MJ, Saloniemi I. Diet-mediated effects of heavy metal pollution on growth and immune response in the geometrid moth Epirrita autumnata[J]. Environmental Pollution, 2007, 145(1): 348-354. DOI:10.1016/j.envpol.2006.03.008 |
| [8] |
Shen YH. Isolation of intestinal bacteria from T. molitor L and study on the phenomenon of plastic degradation[D]. Shanghai: Master's Thesis of East China Normal University, 2011 (in Chinese) 沈叶红. 黄粉虫肠道菌的分离和取食塑料现象的研究[D]. 上海: 华东师范大学硕士学位论文, 2011 http://cdmd.cnki.com.cn/Article/CDMD-10269-1014122466.htm |
| [9] |
Yang Y, Yang J, Wu WM, et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 1. Chemical and physical characterization and isotopic tests[J]. Environmental Science & Technology, 2015, 49(20): 12080-12086. |
| [10] |
Yang Y, Yang J, Wu WM, et al. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 2. Role of gut microorganisms[J]. Environmental Science & Technology, 2015, 49(20): 12087-12093. |
| [11] |
Chen GZ, Zhang BL, Ji MM, et al. Gut microbiota of polystyrene-eating mealworms analyzed by high-throughput sequencing[J]. Microbiology China, 2017, 44(9): 2011-2018. 陈冠舟, 张白鹭, 纪梦梦, 等. 高通量测序探究啮食聚苯乙烯泡沫塑料黄粉虫的肠道菌群结构[J]. 微生物学通报, 2017, 44(9): 2011-2018. |
| [12] |
Shen P, Chen XD. Microbiology Experiment[M]. 4th ed. Beijing: China Higher Education Press, 2007, 241. 沈萍, 陈向东. 微生物学实验[M]. 4版. 北京: 高等教育出版社, 2007, 241. |
| [13] |
Zhang Y, Shao MW, Zhang YL, et al. Inhibition of Amaranthus retroflexus by wasp gut fungal isolate Fusarium oxysporum MF06[J]. Acta Microbiologica Sinica, 2015, 55(3): 292-298. 张蕴, 邵明伟, 张应烙, 等. 马蜂肠道菌抑制反枝苋的活性筛选及菌株MF06的活性代谢产物[J]. 微生物学报, 2015, 55(3): 292-298. |
| [14] |
Wang XP, Chen ZF, Ni HG, et al. Surface properties of Hydroxy-terminated polystyrenes[J]. Chemical Journal of Chinese Universities, 2005, 26(9): 1752-1756. 王新平, 陈志方, 倪华钢, 等. 端羟基化聚苯乙烯的表面性质[J]. 高等学校化学学报, 2005, 26(9): 1752-1756. |
| [15] |
Buchanan RE, Gibbons NE. Bergey's Mannual of Determinative Bacteriology[M]. 8th ed. Beijing: Science Press, 1984, 274-280. 布坎南 RE, 吉本斯 NE. 伯杰氏细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984, 274-280. |
| [16] |
Gerhardt PD, Lindgren DL. Penetration of packaging films: film materials used for food packaging tested for resistance to some common stored-product insects[J]. California Agriculture, 1954, 8(6): 3-4. |
| [17] |
Riudavets J, Salas I, Pons MJ. Damage characteristics produced by insect pests in packaging film[J]. Journal of Stored Products Research, 2007, 43(4): 564-570. DOI:10.1016/j.jspr.2007.03.006 |
| [18] |
Yun JH, Roh SW, Whon TW, et al. Insect gut bacterial diversity determined by environmental habitat, diet, developmental stage, and phylogeny of host[J]. Applied and Environmental Microbiology, 2014, 80(17): 5254-5264. DOI:10.1128/AEM.01226-14 |
| [19] |
Atiq N, Ahmed S, Ali MI, et al. Isolation and identification of polystyrene biodegrading bacteria from soil[J]. African Journal of Microbiology Research, 2010, 4(14): 1537-1541. |
| [20] |
Gilan I, Hadar Y, Sivan A. Colonization, biofilm formation and biodegradation of polyethylene by a strain of Rhodococcus ruber[J]. Applied Microbiology and Biotechnology, 2004, 65(1): 97-104. |
| [21] |
Yang J, Yang Y, Wu WM, et al. Evidence of polyethylene biodegradation by bacterial strains from the guts of plastic-eating waxworms[J]. Environmental Science & Technology, 2014, 48(23): 13776-13784. |
| [22] |
Bombelli P, Howe CJ, Bertocchini F. Polyethylene bio-degradation by caterpillars of the wax moth Galleria mellonella[J]. Current Biology, 2017, 27(8): R292-R293. DOI:10.1016/j.cub.2017.02.060 |
| [23] |
Lu JJ. The analysis of Paenibacillus mucilaginosus KNP414 stress resistance comparative genome and transcriptome under nitrogen starvation condition[D]. Hangzhou: Master's Thesis of Zhejiang Sci-Tech University, 2014 (in Chinese) 卢景江. 胶质类芽孢杆菌KNP414抗逆比较基因组及氮饥饿的转录组分析[D]. 杭州: 浙江理工大学硕士学位论文, 2014 http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2551531 |
 2018, Vol. 45
2018, Vol. 45