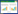扩展功能
文章信息
- 木尼热木·阿力木江, 楚敏, 唐琦勇, 顾美英, 朱静, 张伟, 张志东
- Muniremu·Alimujiang, CHU Min, TANG Qi-Yong, GU Mei-Ying, ZHU Jing, ZHANG Wei, ZHANG Zhi-Dong
- 辐射污染区盐爪爪根际可培养细菌群落组成及功能特性
- Community composition and functional characteristics of bacteria in the rhizosphere of Kalidium foliatum from the radiation polluted area
- 微生物学通报, 2018, 45(7): 1416-1425
- Microbiology China, 2018, 45(7): 1416-1425
- DOI: 10.13344/j.microbiol.china.170820
-
文章历史
- 收稿日期: 2017-10-12
- 接受日期: 2018-03-16
- 网络首发日期(www.cnki.net): 2018-05-14
2. 新疆农业科学院微生物应用研究所 新疆 乌鲁木齐 830091;
3. 新疆特殊环境微生物重点实验室 新疆 乌鲁木齐 830091
2. Institute of Microbiology, Xinjiang Academy of Agricultural Sciences, Urumqi, Xinjiang 830091, China;
3. Xinjiang Laboratory of Special Environmental Microbiology, Urumqi, Xinjiang 830091, China
核辐射污染可导致环境剧烈改变,显著改变土壤物理、化学等特性,对污染区域周边生态环境可产生巨大的扰动,进而对土壤中微生物群落组成和分布造成影响[1-2]。我国西北某区域存在着严重的放射性核辐射污染,造成了独一无二、不可复制的特殊辐射生境。相关研究表明,该区域并非生命的禁区,而是存在多种耐盐碱、耐干旱植物,孕育着丰富的微生物多样性[3]。盐爪爪[Kalidium foliatum (Pall.) Moq]为藜科多年生灌木,是典型的盐生植物,广泛分布在盐碱荒漠生境,辐射污染区多有分布。有研究表明,在盐爪爪生长过程中,其根际土壤的多种离子浓度显著提高,形成根际“离子岛”效应,特别是对Cl-和Na+具有较高的富集效果,能有效提高根际有效P和有效K的含量[4]。目前国内外关于盐爪爪的研究多集中在其形态解剖特点[5]、根系适盐特性[6]、盐分对种子萌发的影响[7]、耐盐分子机理及相关基因等方面[8-9],有关其根际微生物的研究鲜有报道。
植物根际微生物作为土壤-植物间物质交换活跃界面的重要成员,参与并担负着根际重要的生理过程,维系着根际生态平衡,是陆地上最重要的生态系统之一[10-11]。在生态学、生物多样性、系统分类和协同进化等研究上具有重要的理论意义,也在农业生产和生物资源的开发利用,以及污染土壤生物修复中有着重要的应用价值和利用前景,成为国内外微生物学研究的热点[12-13]。本研究所在区域位于我国西北辐射污染区某汇水区,由于地理气候原因,加之季节性洪水流经辐射污染区域的盐碱土壤,致使该汇水区地表 20 cm以上土壤含盐量可达2%以上,放射性核素水平是正常值的3-5倍。开展该区域盐爪爪根际微生物研究不仅有利于进一步揭示辐射污染区微生物多样性,也为解析根际微生物在盐爪爪盐适应性、根际“离子岛”效应形成过程中的作用提供基础。
本研究以辐射污染区盐爪爪根际细菌为研究对象,通过菌株分离、鉴定及抗逆性和功能特性分析,旨在初步解析辐射污染区盐爪爪根际细菌多样性,挖掘潜在的微生物资源和应用功能,为进一步开展相关研究奠定物质基础和理论依据。
1 材料与方法 1.1 材料和培养基 1.1.1 供试植物盐爪爪[Kalidium foliatum (Pall.) Moq]于2016年4月采自辐射污染区某汇水区。
1.1.2 培养基MM培养基(g/L):蛋白胨5.0,葡萄糖2.0,酵母膏3.0,牛肉膏1.5,氯化钠20.0,琼脂15.0,pH 7.2左右;P培养基(g/L):蛋白胨0.01,酵母粉0.05,葡萄糖0.001,KNO3 1.0,MgSO4 0.5,K2HPO4 0.5,Fe2SO4 0.01,NaCl 20.0,琼脂15.0,pH 7.2左右;CMKA培养基(g/L):Casin 0.5,Mannitol 1.5,KNO3 1.0,(NH4)2SO4 2.0,K2HPO4 0.5,CaCO3 0.5,NaCl 20.0,琼脂15.0,pH 7.0左右。其它培养基还包括TSA培养基、高氏一号培养基、R2A培养基、解磷基础培养基(NBRIP培养基)、解钾培养基、MKB培养基等,均购自青岛高科园海博生物技术有限公司;海生菌肉汤2216培养基购自美国BD公司。上述培养基在使用前,均另加2% (质量体积比) NaCl。
1.2 主要仪器电子天平、pH计,奥豪斯仪器(上海)有限公司;紫外分光光度计,SHIMADZU公司;智能生化培养箱,宁波东南仪器有限公司。
1.3 方法 1.3.1 根际土壤的收集盐爪爪样品采用垂直挖掘法,尽可能地保证根部的完整性。选择完整植株根部,采用抖落法去除非根际土壤,并在无菌条件下利用无菌细毛刷轻刷根部收集根际土壤样品,土样经充分混合后转移至无菌离心管中,于4 ℃保存备用[14-15]。
1.3.2 菌株的分离无菌条件下称取根际样品5.0 g,置于装有50 mL 2% NaCl溶液和无菌玻璃珠的三角瓶中,30 ℃、120 r/min振荡30 min,静置。吸取上述土壤悬液1 mL,经梯度稀释后,涂布至各类含有2% NaCl的分离平板上,于30 ℃恒温培养3-15 d,待菌落长出后,根据菌落的形态、大小及颜色初步筛选菌株,分离纯化后接至R2A培养基斜面上,4 ℃保存备用。
1.3.3 菌株的分子鉴定采用菌落克隆方法,利用细菌16S rRNA基因通用引物27F和1492R进行PCR扩增[2]。PCR产物经切胶纯化回收后,送往北京鼎国生物技术有限公司进行测序。所测得的序列经手工校对后,通过EzTaxon数据库(http://www.ezbiocloud.net/eztaxon/identify)进行比对,并调取相似性最高模式菌株序列,使用MEGA 5.0进行ClustalX多重比对,使用Neighbor-Joining法构建系统发育树[16],自举值(Bootstrap)为1 000,初步获得菌株的生物学分类地位。
1.3.4 菌株耐受性及功能测定菌株的pH、生长温度测定采用含有2% NaCl的1/10 TSA液体培养基进行[2];菌株的耐盐、耐重金属特性测定采用含有不同浓度NaCl和HgCl2、ZnCl2、CuCl2、PbCl2、CoCl2的1/10 TSA培养基进行[17];菌株的蛋白酶、脂肪酶、纤维素酶、淀粉酶等产酶特性研究分别采用加有2% (质量体积比)的脱脂奶粉、三丁酸甘油酯、羧甲基纤维素钠和可溶性淀粉的P培养基进行[18];菌株的植物促生特性采用定性分析方法进行[14]。
2 结果与分析 2.1 盐爪爪根际细菌的分离不同分离培养基培养3-15 d后,经菌落形态观察共挑取各类菌株452株。通过共同接种至含有2% NaCl的R2A培养基中,观察菌落形态和显微形态去重后,获得实验菌株267株。其中,采用贫营养培养基如P培养基、海生菌肉汤2216培养基、R2A培养基、CMKA培养基等共分离到菌株104株,占39.0%;植物促生等功能菌分离培养基分离到菌株74株,占27.7%;常规分离培养基分离到菌株89株,占33.3%,不同培养基来源菌株统计数情况如表 1所示。
| 培养基 Medium | 菌株数 Number of isolates | 所占比例 Ratio (%) |
| TSA培养基 Tryptic soy agar | 27 | 10.1 |
| MM培养基 MM medium | 26 | 9.7 |
| P培养基 P medium | 28 | 10.5 |
| 海生菌肉汤2216培养基 Marine broth 2216 | 16 | 6.0 |
| R2A培养基 R2A medium | 33 | 12.4 |
| CMKA培养基 CMKA medium | 27 | 10.1 |
| 高氏一号培养基 GAUZE’s Medium No.1 | 36 | 13.5 |
| 解钾培养基 Potassium-dissolving medium | 27 | 10.1 |
| MKB培养基 Modified King medium | 31 | 11.6 |
| NBRIP培养基 NBRIP medium | 16 | 6.0 |
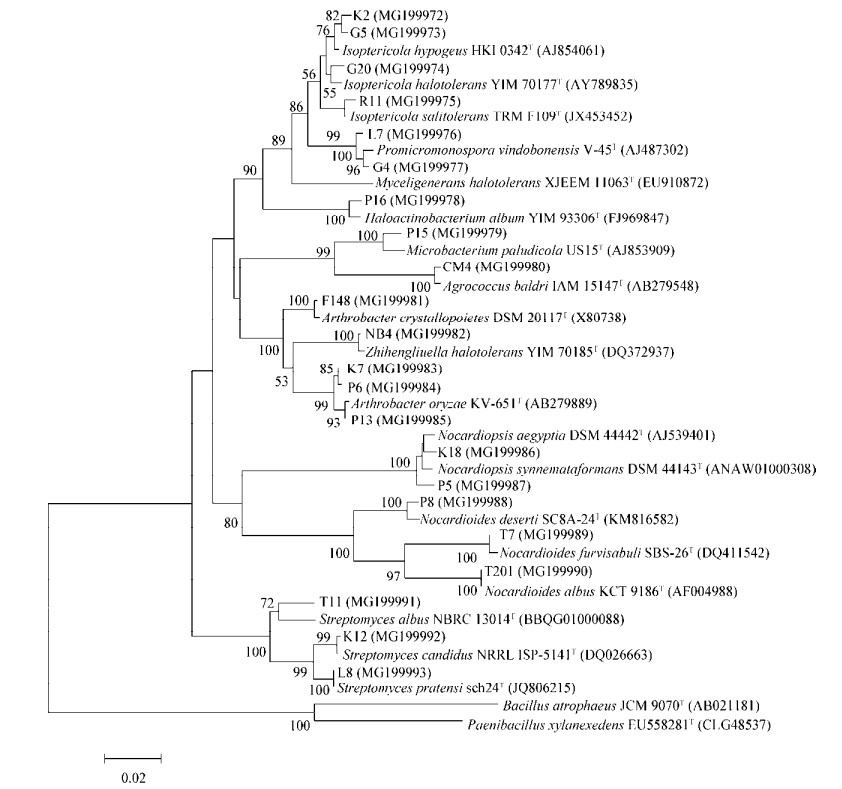
上述267株菌的16S rRNA基因序列经PCR扩增和测序后,所得序列提交NCBI数据库获得GenBank登录号为MG199972-MG200020,运用EzTaxon数据库(http://www.ezbiocloud.net/identify)进行了相似度比较,同时分别调取各菌株相似性最高模式菌株序列构建系统进化发育树(图 1-3)。通过比对及系统发育树可见,辐射区盐爪爪根际细菌多样性较丰富,所得267株菌分别归属于3个门20个属。其中,放线菌门(Actinobacteria)所含种属最丰富,涉及9个属,即白蚁菌属(Isoptericola)、原小单孢菌属(Promicromonospora)、嗜盐放线杆菌属(Haloactinobacterium)、微杆菌属(Microbacterium)、链霉菌属(Streptomyces)、诺卡氏土壤菌属(Nocardiopsis)、土壤球菌属(Agrococcus)、节杆菌属(Arthrobacter)、刘志恒菌属(Zhihengliuella);其次为变形杆菌门(Proteobacteria),涉及7个属,即盐单孢菌属(Halomonas)、硝酸盐还原菌(Nitratireductor)、中生根瘤菌属(Mesorhizobium)、叶杆菌属(Phyllobacterium)、副球菌(Paracoccus)、藤黄单胞菌属(Luteimonas)和德沃斯氏菌属(Devosia);厚壁菌门(Firmicutes)种属菌株涉及最少,仅为4个属,即盐芽孢杆菌属(Halobacillus)、芽孢杆菌(Bacillus)、太平洋海洋杆菌(Oceanobacillus)和缺陷短波单胞菌(Brevibacterium),但Bacillus、Halomonas、Nocardiopsis、Isoptericola属所占比例最高,分别占所测菌株的11.9%、11.6%、7.8%和6.3%。
|
| 图 1 基于放线菌门代表菌株的16S rRNA基因序列构建的系统进化树 Figure 1 Phylogenetic tree of isolates in phylum Actinobacteria and related type species based on 16S rRNA gene sequence |
|
|
|
| 图 2 基于厚壁菌门代表菌株的16S rRNA基因序列构建的系统进化树 Figure 2 Phylogenetic tree of isolates in phylum Firmicutes and related type species based on 16S rRNA gene sequences |
|
|

|
| 图 3 基于变形杆菌门代表菌株的16S rRNA基因序列构建的系统进化树 Figure 3 Phylogenetic tree of isolates in phylum Proteobacteria and related type species based on 16S rRNA gene sequence |
|
|
在完成测序的267个菌株中,7株菌与已知模式菌株序列相似性均小于98.5% (表 2),初步确定其为潜在新种,共涉及Micrococcales、Oceanospirillales、Bacillales、Xanthomonadales、Flavobacteriales等5个目的7个属,其中Micrococcales目潜在新种最多,有Isoptericola、Agrococcus和Promicromonospora共3个属;菌株M8与最近模式菌Halomonas cupida DSM 4740T相似性最低,仅为95.7%。初步表明辐射污染区盐爪爪根际存在着有待发掘的微生物潜在新类群(物种)资源。上述菌株的最终分类地位,有待进一步的细菌多相系统分类鉴定结果证明。
| 菌目 Order | 分离株 Isolates | 最近模式菌株 Closest type strains | 相似性 Similarity (%) |
| Micrococcales | CM10 | Isoptericola hypogeus HKI 0342T | 97.1 |
| Micrococcales | CM4 | Agrococcus baldri IAM 15147T | 98.1 |
| Micrococcales | L7 | Promicromonospora iranensis HM 792T | 98.4 |
| Oceanospirillales | M8 | Halomonas cupida DSM 4740T | 95.7 |
| Bacillales | Gao9 | Paenibacillus xylanexedens B22aT | 98.4 |
| Xanthomonadales | R10 | Luteimonas huabeiensis HB2T | 97.2 |
| Rhizobiales | CM7 | Nitratireductor aquibiodomus JCM 21793T | 95.9 |
| Flavobacteriales | MM18 | Sinomicrobium pectinilyticum 5DNS001T | 97.7 |
通过菌株筛选和分子鉴定结果选取了系统进化树中49株代表性菌株,进行了菌株的抗盐、抗碱、抗重金属等抗逆性研究。实验结果表明,盐爪爪根际细菌绝大部分具有较强的抗逆特性,其中74%的实验菌株具有耐受10% NaCl的生长能力,72%的菌株可在10 ℃生长,49%的菌株可在45 ℃生长,40%的菌株具有不同程度的重金属耐受特性,部分菌株如菌株T22具有极强的抗逆特性,在实验测定的各种逆境压力下均能生长,表 3为部分菌株的抗逆特性。
| Isolate | 10% NaCl | 10 ℃ | 45 ℃ | Hg2+ (200 mg/L) | Zn2+ (500 mg/L) | Cu2+ (200 mg/L) | Pb2+ (1 000 mg/L) | Co2+ (500 mg/L) | |
| P26 | ++ | ++ | ++ | + | + | + | + | - | |
| K18 | - | - | - | - | - | - | - | - | |
| L6 | + | + | ++ | - | + | + | + | + | |
| CM7 | ++ | + | - | + | + | - | + | - | |
| K12 | ++ | - | + | - | - | - | + | + | |
| K9 | ++ | - | + | - | + | - | + | + | |
| T22 | + | ++ | ++ | + | + | + | + | + | |
| P15 | - | + | + | + | + | + | + | - | |
| MM18 | + | + | - | ++ | + | + | + | - | |
| K27 | + | ++ | - | + | - | + | + | - | |
| R10 | + | + | - | ++ | + | + | + | + | |
| CM4 | + | + | - | + | + | - | - | - | |
| R11 | ++ | + | - | + | + | + | - | + | |
| 注:++:生长良好;+:生长;-:不生长. Note: ++: Good growth; +: Growth; -: No growth. | |||||||||
通过平板透明圈法或显色圈法对49株筛选获得菌株的淀粉酶、脂肪酶、蛋白酶和纤维素酶产生能力进行了分析。结果表明,实验菌株中47%的菌株具有淀粉酶活性,43%的菌株具有脂肪酶活性,43%的菌株具有蛋白酶活性,33%的菌株具有纤维素酶活性。通过解磷平板透明圈法检测菌株,结果显示24%的菌株具有解无机磷能力;吲哚-3-乙酸(Indole-3-acetic acid,IAA)定性反应显示,27%的菌株具有产IAA的能力,表 4为部分菌株产酶及植物促生特性的情况。
| 菌株 Isolates | 脂肪酶 Lipase | 蛋白酶 Protease | 纤维素酶 Cellulase | 淀粉酶 Amylase | 吲哚乙酸 IAA producing | 解磷 Phosphate-solubilizing | |
| P26 | + | - | - | - | + | - | |
| K18 | - | - | + | - | + | - | |
| L6 | - | - | - | - | + | - | |
| CM10 | + | - | + | - | - | - | |
| CM7 | + | + | - | + | - | + | |
| K12 | + | + | + | + | + | + | |
| K9 | + | + | - | - | - | - | |
| T22 | + | + | - | + | - | + | |
| P15 | + | + | - | + | + | - | |
| MM18 | + | - | - | + | + | - | |
| L1 | + | + | + | - | - | + | |
| K27 | - | - | - | - | + | - | |
| R10 | + | + | + | + | - | - | |
| 注:+:表示有活性;-:表示无活性. Note: +: Active; -: Inactive. | |||||||
我国辐射污染区存在着丰富的微生物多样性,蕴藏着大量未知微生物。前期相关研究表明,辐射污染区共涉及细菌域的19个门和6个潜在门或未分类门,总计726个已知属及数十个未分类属[3, 17];通过可培养方法,目前获得各类微生物2 000余株,涉及细菌域的76个属273个种,多数菌株分离自贫营养培养基[2]。本研究针对我国辐射污染区某汇水区辐射盐碱环境下典型耐盐植物——盐爪爪根际微生物进行了初步研究。通过可培养筛选,首次展现了盐爪爪根际丰富的微生物多样性,所分离的267株细菌均能在贫营养培养基R2A中良好生长,且39%的菌株分离自贫营养培养基,这些结果也进一步证明辐射污染区存在着大量可在贫营养条件下生长的微生物。菌株经分析确定,归属于细菌域的3个门20个属,其中放线菌门(Actinobacteria)所含种属最丰富;还获得了一批潜在的微生物新种,像Isoptericola、Promicromonospora、Haloactinobacterium、Agrococcus等都是此前尚未在辐射区分离获得的菌属。研究结果说明了辐射污染区存在着大量宝贵的微生物资源,有待进一步挖掘。
本研究发现,尽管盐爪爪根际存在着丰富的耐盐微生物,但其群落组成明显有别于目前已有盐生植物的相关报道[19-21]。如大庆盐碱土壤中9种植物根际土壤微生物群落结构中变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)为主要菌群[20];而对盐碱土壤翅碱蓬根际微生物群落的研究表明,Thioalkalispira、Marinilabiaceae、Salinimicrobium为胜利油田盐碱土壤中的优势菌属[21]。一般来说,由于根系分泌物以及脱落物的选择性,根际微生物群落组成和分布主要取决于植物种类(Plant-species-dependent)[22],不同种植物间根际微生物存在着较大的差异。更多研究表明,植物的生境也是影响根际微生物的主要因素之一,土壤样品的生态环境、土壤结构和pH、有机物组成、营养成分以及种植作物的耕作方式等均对根际微生物的群落分布存在影响,如肥沃的土壤真菌数量相对较多,而盐碱土壤中耐盐微生物种类较多[22-23]。
通过进一步研究发现,所获得的菌株70%以上具有较强的NaCl抗逆性,40%的菌株具有不同程度的重金属耐受特性,说明盐爪爪根际蕴藏着丰富的抗逆微生物。事实上,由于地理和气候原因,新疆地区盐湖、盐碱滩涂分布广泛,孕育着丰富的耐盐、嗜盐微生物资源,存在着大量微生物新种属。相关研究表明,由于盐碱区域的形成机理和地质环境不同,土壤微生物种类和数量存在着较大的差异。对新疆阿克苏盐矿的微生物多样性研究发现,分离菌株主要分布于厚壁菌门、放线菌门以及变形菌门3个门共计15个属,其中以厚壁菌门芽孢杆菌纲内各属种最多[18];对新疆硝尔库勒盐湖的放线菌进行分离后发现该区域分离株中近10%的菌株为潜在新种属[24]。本研究也进一步证实了新疆盐碱环境下存在着大量耐盐微生物资源。
同时,研究发现盐爪爪根际微生物存在着丰富多样的功能酶产生菌和植物促生菌,不仅显示了盐爪爪根际微生物的功能多样性,也为相关酶制剂的筛选和微生物菌肥的研制提供了丰富的科学材料。
| [1] |
Von Wehrden H, Fischer J, Brandt P, et al. Consequences of nuclear accidents for biodiversity and ecosystem services[J]. Conservation Letters, 2012, 5(2): 81-89. DOI:10.1111/j.1755-263X.2011.00217.x |
| [2] |
Gu MY, Zhang ZD, Wang W, et al. The effects of radiation pollution on the population diversities and metabolic characteristics of soil microorganisms[J]. Water, Air, & Soil Pollution, 2014, 225(9): 2133. |
| [3] |
Zhang ZD, Gu MY, Wang W, et al. Analysis of bacterial community in radiation polluted soils by high-throughput sequencing[J]. Microbiology China, 2016, 43(6): 1218-1226. 张志东, 顾美英, 王玮, 等. 基于高通量测序的辐射污染区细菌群落特征分析[J]. 微生物学通报, 2016, 43(6): 1218-1226. |
| [4] |
Yi LP, Ma J, Li Y. Soil salt and nutrient concentration in the rhizosphere of desert halophytes[J]. Acta Ecologica Sinica, 2007, 27(9): 3565-3571. 弋良朋, 马健, 李彦. 荒漠盐生植物根际土壤盐分和养分特征[J]. 生态学报, 2007, 27(9): 3565-3571. |
| [5] |
Zhang YC, Zhang JN. Studies on morphological structure of leaves of Suaeda salsa (L.) Pall in two different saline environments[J]. Journal of Ningxia University (Natural Science Edition), 2001, 22(1): 70-72, 76. 章英才, 张晋宁. 两种不同盐浓度环境中盐地碱蓬叶的形态结构特征研究[J]. 宁夏大学学报:自然科学版, 2001, 22(1): 70-72, 76. |
| [6] |
Gao RR, Zhao RH, Du XM, et al. Characteristics of root systems of two halophytes for adaptability to salinity[J]. Scientia Silvae Sinicae, 2010, 46(7): 176-182. 高瑞如, 赵瑞华, 杜新民, 等. 2种盐生植物根系的适盐特性[J]. 林业科学, 2010, 46(7): 176-182. DOI:10.11707/j.1001-7488.20100726 |
| [7] |
Li L, Zhang XM. Effect of temperature and salinity on germination of two Kalidium Species (Chenopodiaceae)[J]. Chinese Journal of Applied & Environmental Biology, 2007, 13(3): 317-321. 李利, 张希明. 温度和盐分对两种盐爪爪属植物种子萌发的影响[J]. 应用与环境生物学报, 2007, 13(3): 317-321. |
| [8] |
Jia J, Cai L, Zhang LG, et al. cDNA-AFLP analysis of genes related with Salt resistance in Kalidium foliatum[J]. Acta Botanica Boreali-Occidentalia Sinica, 2011, 31(2): 280-285. 贾晋, 蔡禄, 张鲁刚, 等. 盐爪爪耐盐相关基因的cDNA-AFLP分析[J]. 西北植物学报, 2011, 31(2): 280-285. |
| [9] |
Liu L, Zhang FC, Zeng YL. Subcellular localization of Na+/H+ antiporter and H+-PPase of Kalidium foliatum[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(3): 463-468. 刘琳, 张富春, 曾幼玲. 盐爪爪Na+/H+逆向转运蛋白和焦磷酸酶的亚细胞定位[J]. 西北植物学报, 2009, 29(3): 463-468. |
| [10] |
Chen ZY, Ma J, Lai HY, et al. Research advances in the mechanisms of plant root systems disturbance in rhizosphere micro-environment[J]. Chinese Journal of Ecology, 2017, 36(2): 524-529. 陈智裕, 马静, 赖华燕, 等. 植物根系对根际微环境扰动机制研究进展[J]. 生态学杂志, 2017, 36(2): 524-529. |
| [11] |
Barea JM, Pozo MJ, Azcón R, et al. Microbial co-operation in the rhizosphere[J]. Journal of Experimental Botany, 2005, 56(417): 1761-1778. DOI:10.1093/jxb/eri197 |
| [12] |
Correa-Galeote D, Bedmar EJ, Fernández-González AJ, et al. Bacterial communities in the rhizosphere of amilaceous maize (Zea mays L.) as assessed by pyrosequencing[J]. Frontiers in Plant Science, 2016, 7: 1016. |
| [13] |
Singh A, Sarma BK, Upadhyay RS, et al. Compatible rhizosphere microbes mediated alleviation of biotic stress in chickpea through enhanced antioxidant and phenylpropanoid activities[J]. Microbiological Research, 2013, 168(1): 33-40. DOI:10.1016/j.micres.2012.07.001 |
| [14] |
Yaqoob C, Awan HA, Maqbool A, et al. Microbial diversity of the rhizosphere of Kochia (Kochia indica) growing under saline conditions[J]. Pakistan Journal of Botany, 2013, 45(S1): 59-65. |
| [15] |
Yang Y, Liu BR. Distribution of soil nutrient and microbial biomass in rhizosphere versus nonrhizosphere area of different plant species in desertified steppe[J]. Acta Ecologica Sinica, 2015, 35(22): 7562-7570. 杨阳, 刘秉儒. 荒漠草原不同植物根际与非根际土壤养分及微生物量分布特征[J]. 生态学报, 2015, 35(22): 7562-7570. |
| [16] |
Kruys A, Wedin M. Phylogenetic relationships and an assessment of traditionally used taxonomic characters in the Sporormiaceae (Pleosporales, Dothideomycetes, Ascomycota), utilizing multi-gene phylogenies[J]. Systematics and Biodiversity, 2009, 7(4): 465-478. DOI:10.1017/S1477200009990119 |
| [17] |
Zhang ZD, Xie YQ, Wang W, et al. Isolation and character of radio-resistant black yeast-like fungus[J]. Microbiology China, 2012, 39(5): 724-731. 张志东, 谢玉清, 王玮, 等. 耐辐射黑色酵母状真菌的筛选和特性研究[J]. 微生物学通报, 2012, 39(5): 724-731. |
| [18] |
Zhang XC. Analysis of microbial diversity in salt mine of Aqsu[D]. Hangzhou: Master's Thesis of Zhejiang University, 2011 (in Chinese) 杨晓宸. 新疆阿克苏盐矿嗜盐(耐盐)微生物多样性研究[D]. 杭州: 浙江大学硕士学位论文, 2011 |
| [19] |
Wang C, Li HW, Xie YC, et al. Construction of screening system for cold tolerant Pseudomonas fluorescens for plant growth-promotion[J]. Microbiology China, 2016, 43(12): 2644-2656. 王超, 李宏伟, 谢越盛, 等. 耐低温荧光假单胞菌筛选体系建立及其植物促生作用评价[J]. 微生物学通报, 2016, 43(12): 2644-2656. |
| [20] |
Du YX, Xie BM, Cai HS, et al. Structural and functional diversity of rhizosphere microbial community of nine plant species in the Daqing Saline-alkali soil region[J]. Acta Ecologica Sinica, 2016, 36(3): 740-747. 杜滢鑫, 谢宝明, 蔡洪生, 等. 大庆盐碱地九种植物根际土壤微生物群落结构及功能多样性[J]. 生态学报, 2016, 36(3): 740-747. |
| [21] |
Li ZJ, Guo CC, Shi J, et al. Diversity of bacterial community in Suaeda roots rhizosphere growth in PAHs-contaminated saline soil estimated by high throughput sequencing method[J]. Microbiology China, 2017, 44(7): 1602-1612. 李志杰, 郭长城, 石杰, 等. 高通量测序解析多环芳烃污染盐碱土壤翅碱蓬根际微生物群落多样性[J]. 微生物学通报, 2017, 44(7): 1602-1612. |
| [22] |
Zhang H, Wang XM, Huang T, et al. Effect of NaCl stress on bacterial community diversity and core microbiome in rhizosphere and bulk soil of beach plum (Prunus maritima Marshall)[J]. Journal of Nanjing Forestry University (Natural Sciences Edition), 2017, 41(4): 49-54. 朱泓, 王小敏, 黄涛, 等. NaCl胁迫对滨梅根际细菌群落多样性及优势菌群的影响[J]. 南京林业大学学报:自然科学版, 2017, 41(4): 49-54. |
| [23] |
Aira M, Gómez-Brandón M, Lazcano C, et al. Plant genotype strongly modifies the structure and growth of maize rhizosphere microbial communities[J]. Soil Biology & Biochemistry, 2010, 42(12): 2276-2281. |
| [24] |
Chen ZJ, Guan TW, Zhang LL. The preliminary investigation of isolation methods for Actinobacteria of Xiaoerkule lake from Xinjiang[J]. Journal of Tarim University, 2012, 24(2): 50-55. 陈正军, 关统伟, 张利莉. 新疆硝尔库勒盐湖放线菌分离方法的初步研究[J]. 塔里木大学学报, 2012, 24(2): 50-55. |
 2018, Vol. 45
2018, Vol. 45