扩展功能
文章信息
- 罗宝龙, 魏军林, 黄丽丽, 张艳, 倪永清
- LUO Bao-Long, WEI Jun-Lin, HUANG Li-Li, ZHANG Yan, NI Yong-Qing
- 猪源产细菌素芽孢杆菌的筛选及抑菌特性
- Selection and antibacterial activity of bacteriocin-producing Bacilli from swine
- 微生物学通报, 2018, 45(6): 1342-1349
- Microbiology China, 2018, 45(6): 1342-1349
- DOI: 10.13344/j.microbiol.china.170721
-
文章历史
- 收稿日期: 2017-09-12
- 接受日期: 2017-11-02
- 网络首发日期(www.cnki.net): 2017-11-17
在自然状态的家畜养殖业环境中, 新生仔猪一般不会因为微生态菌群单一而发病, 但是集约化养殖的猪群生活在亚健康状态, 尤其消毒环境下出生的仔猪, 加上为提高母猪繁殖率而推行的仔猪早期断奶技术, 使初生仔猪和断奶幼崽对病原菌的抵抗力较弱, 外界环境的变化很容易引起猪群肠道内的微生物体系发生变化, 一旦有益菌不能形成优势则可能出现病原微生物的入侵而导致腹泻[1-2]。自从Stokstad等报道了低剂量抗生素具有促进动物生长的作用, 20世纪40年代以来抗生素不仅广泛用于动物疾病的预防, 而且作为生长促进剂用来提高动物的生产效率[3]。然而, 抗生素的滥用导致了微生物抗性基因的富集和扩散[4]。目前, 新型饲料添加剂的开发倍受重视, 例如产细菌素的益生菌制剂、有机酸、精油等, 其中细菌素是由细菌核糖体合成产生的一类对亲缘关系较近物种具有抑制活性的多肽或多肽前体, 具有无毒害、耐高温和无细菌耐受性等优点, 逐渐被应到用食品、饲料等行业[5]。例如, He等[6]发现仔猪颗粒饲料中单独添加产细菌素的枯草芽孢杆菌具有降低腹泻率、维持肠道代谢稳定等作用。Agazzi等[7]将乳酸菌Lactobacillus animalis SB310、Lactobacillus paracasei subsp. paracasei SB137和芽孢杆菌Bacillus coagulans SB117菌株添加到2-28日龄的荷斯坦牛犊饲料中, 改善了牛犊的肠道菌群, 提高了生长性能和生物特征参数。因此, 动物肠道微生物大多由具有一定稳定性的宿主特异性菌群构成[8]。研究也发现, 芽孢杆菌在不良环境中可形成抗极端环境的孢子, 相比目前使用较多的乳杆菌、乳球菌和双歧杆菌具有更大的生存优势和开发潜力, 特别是抑菌谱相对较宽的益生芽孢杆菌菌种资源的研发尤为重要[9-10]。
健康成年动物粪便中蕴藏着丰富的可维持菌群平衡的益生菌资源。本研究针对户外自然状态下散养的健康育肥猪粪便, 从中筛选多种芽孢杆菌及广谱抗菌的产细菌素芽孢杆菌优良菌株, 并对益生性能明显菌株的抗生素耐药性及其细菌素的稳定性进行检测, 以期为猪养殖业微生物饲料添加剂的研发奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株、主要试剂和仪器病原指示菌Staphylococcus aureus CICC21600、Escherichia coli EPEC O127:K63 CICC10411、Salmonella enterica subsp. enterica serovar Typhimurium CICC10420、Escherichia coli ETEC O78:K80 CICC10421、Escherichia coli EHEC O157:H7 CICC21530购自中国工业微生物菌种保藏管理中心。生物试剂和抗生素均购自北京博奥拓达科技有限公司; 用于PCR扩增的全套试剂及扩增引物购自TaKaRa公司; 生理生化试验所用试剂购自北京索莱宝科技有限公司。PCR仪购自德国BIOMETRA公司; 凝胶成像系统购自法国Vilber公司。
1.1.2 样品和培养基10份散养健康育肥猪粪便样品来源于石河子152团5连。用无菌药匙采集新鲜粪便装于灭菌保鲜盒, 置于4 ℃车载冰箱, 2 h内运回实验室进行处理。
LB培养基(g/L):胰蛋白胨10.0, 酵母浸粉5.0, NaCl 5.0。pH 6.5, 1×105 Pa灭菌20 min (固体加琼脂18.0 g/L)。
1.2 方法 1.2.1 菌株的分离纯化参考Lee等[11]的方法, 25 g样品溶于225 mL生理盐水, 振荡混匀, 85 ℃水浴30 min。采用梯度稀释液涂平板法在LB培养基上涂布, 37 ℃培养24 h。根据菌落颜色、大小、形态等表型差异进行初步筛选, 连续转接划线培养3次后, 挑单菌落接种至LB液体培养基中, 37 ℃、150 r/min振荡富集18 h, 5 600 r/min离心10 min, 弃掉上清液后加入新鲜培养基重悬, 补充25%的灭菌甘油冷冻保藏在-80 ℃。
1.2.2 革兰氏染色纯培养物进行革兰氏染色、孔雀绿芽孢染色, 镜检, 初步筛选得到疑似芽孢杆菌菌株。
1.2.3 产细菌素菌株的初筛将指示菌均匀涂布于相应的培养基上, 分别移取2 μL疑似菌株菌悬液点种, 并做标记。静置15 min后置于指示菌最适温度倒置培养18 h, 点种部位出现透明圈则说明有抑菌作用[12]。
1.2.4 产细菌素菌株的复筛初筛菌株在37 ℃、150 r/min振荡培养48 h, 8 000 r/min离心10 min收集上清液。复筛实验组包括:(1)调节上清液pH 6.5;(2)调节上清液过氧化氢酶浓度为5 μg/mL, 30 ℃水浴2 h; (3)调节上清液胰蛋白酶浓度为5 μg/mL, 30 ℃水浴2 h; (4)调节上清液胃蛋白酶浓度为5 μg/mL, 30 ℃水浴2 h; (5)调节上清液蛋白酶K浓度为5 μg/mL, 30 ℃水浴2 h。以LB液体培养菌悬液离心所得上清液做空白对照, 每组移取200 μL按牛津杯法进行抑菌实验, 每组处理3个平行, 记录结果[13]。
1.2.5 分离菌株16S rRNA基因的系统进化分析参考Justé等的方法提取产细菌素菌株DNA, 并采用细菌通用引物正向27F和反向1492R进行PCR扩增[14]。PCR产物由生工生物工程(上海)股份有限公司纯化后进行测序。将测序结果提交到GenBank数据库中, 序列相似性分析利用BLAST在线进行。从数据库获得相关属种的16S rRNA基因序列, 建立系统发育树。用ClustalX 1.83软件将序列进行排列[15], 用邻接法(Neighbor-Joining method)计算进化距离, 在MEGA 5.0[16]软件中采用P-distances法和Kimura-2-parameter双参数法建立系统发育树, 进化树分支的置信度采用Bootstrap法分析, 重复次数为1 000。
1.2.6 细菌素的热、酸碱稳定性测定将发酵上清液分别按以下处理进行细菌素粗蛋白液的热、酸碱稳定性测定:(1)分别在50、70、80、90、100、121 ℃处理30 min, 冷却至室温; (2)分别调节pH为3.0、5.0、7.0、9.0、11.0, 37 ℃温育24 h, 调回pH 6.5。采用牛津杯法进行抑菌试验, 指示菌为CICC10411。
1.2.7 药敏实验根据文献[17], 将筛选的产细菌素芽孢杆菌培养至对数期, 采用相差显微镜调整菌液浓度大约在(2.0-2.5)×108 CFU/mL, 移取200 μL, 用无菌棉签将菌液涂布于LB固体培养基。按照NCCLS 2010将杆菌肽(Bacitracin, BAT)、头孢噻肟(Cefotaxime, CTX)、红霉素(Erythromycin, ERM)、四环素(Tetracycline, TET)制成每片含药量分别为0.04 IU、30 μg、15 μg、30 μg的抗生素纸片(直径6 mm), 贴于平板上, 倒置培养18 h, 利用游标卡尺测定抑菌圈直径。每种纸片3个平行, 结果求平均值。
1.2.8 产细菌素菌株的生理生化鉴定按照东秀珠等[18]描述的方法进行。
2 结果与分析 2.1 菌株的分离依据菌落特征、细胞形态等从10份样品中初步分离得到116株纯培养物, 经革兰氏染色、芽孢染色得到82株疑似芽孢杆菌。大部分菌株菌落颜色为白色、灰白色, 少部分菌株呈现淡黄色、暗红色; 液体培养时培养基表面形成菌膜, 振荡后呈絮状悬浮。此外, 鉴定后属于同一种的不同菌株, 进化关系相近但其菌落形态有差异。图 1为筛选的6株产细菌素芽孢杆菌菌株的菌落特征。

|
| 图 1 基于16S rRNA基因序列的产细菌素芽孢杆菌系统发育树 Figure 1 Phylogenetic tree of bacteriocin-producing Bacillus based on 16S rRNA gene sequences |
|
|
初筛实验得到的15株菌至少对1种指示菌有明显的抑菌作用。考虑到细菌代谢过程中产生的过氧化氢、细菌素、有机酸或酸性末端物质均会不同程度地抑制其它微生物的生长, 因此通过调整pH和过氧化氢酶浓度来排除对菌株产细菌素实验结果的干扰判定, 通过3种蛋白酶对代谢液的处理, 初步证实抑菌物质的类蛋白质性质。复筛得到6株具有不同抑菌谱的产细菌素菌株(表 1), 其中DY7可以抑制5种指示菌, FX4和EY3对CICC10420没有抑制作用。菌株EY3、FX4对CICC21600的抑菌圈分别为13.26、18.42 mm。
| Items | BY2 | C4 | C7 | DY7 | EY3 | FX4 |
| CICC10411 | +++ | - | +++ | +++ | ++ | ++ |
| CICC10420 | ++ | - | - | + | - | - |
| CICC10421 | - | - | ++ | ++ | ++ | ++ |
| CICC21530 | - | - | +++ | +++ | ++ | ++ |
| CICC21600 | - | + | + | ++ | ++ | +++ |
| 胰蛋白酶 Trypsin |
- | - | + | - | - | - |
| 胃蛋白酶 Pepsin |
+ | - | + | - | - | - |
| 蛋白酶K Proteinase K |
- | - | - | - | - | - |
| 接触酶 Catalase |
+ | + | + | + | + | + |
| 淀粉水解 Hydrolysis of starch |
+ | + | + | + | + | + |
| 明胶液化 Gelatin liquefaction |
+ | + | + | + | + | + |
| 硝酸盐还原 Nitrate reduction |
+ | + | + | + | + | + |
| V-P test | + | + | + | + | + | + |
| 葡萄糖发酵(产酸) Glucose fermentation (produce acid) |
- | + | + | - | + | - |
| 葡萄糖发酵(产气) Glucose fermentation (produce gas) |
+ | + | + | + | + | + |
| 柠檬酸盐利用 Citrate utilization |
- | - | - | + | - | - |
| 菌落特征 Colony characteristics |
白色, | 灰色, | 白色, | 暗红色, | 白色, | 暗红色, |
| 边凸内凹, | 内凸中凹, | 内凸中凹, | 边缘褶皱, | 边凸内凹, | 边凸内凹, | |
| 不规则 | 不规则 | 不规则 | 不规则 | 圆形 | 不规则 | |
| 细胞特征 Cell characteristics |
杆状产芽孢, G+ |
杆状产芽孢, G+ |
杆状产芽孢, G+ |
杆状产芽孢, G+ |
杆状产芽孢, G+ |
杆状产芽孢, G+ |
| 注:-:阴性(8 mm); +:阳性(8-11 mm); ++:11-14 mm; +++: > 14 mm. Note:-:Negative (8 mm); +:Positive (8-11 mm); ++:11-14 mm; +++: > 14 mm. | ||||||
将6株产细菌素菌株所获得的16S rRNA基因序列提交到NCBI, 通过BLAST工具在GenBank数据库中与已发表的16S rRNA基因序列进行相似性比较, 选取相似性在98%以上的序列构建系统发育树, 由系统发育树可知6株产细菌素菌株均为芽孢杆菌属。菌株C7、C4与B. velezensis的16S rRNA基因序列相似性达到99%;EY3、BY2、FX4与已知种B. subtilis的相似性均达到99%以上; DY7与B. licheniformis的相似性达到100%, 结合形态特征和生理生化特征初步确定6株菌的分类学地位(图 1)。
2.4 细菌素稳定性不同温度、pH分别对DY7、FX4所产细菌素稳定性的影响分析见图 2、3。DY7和FX4的发酵上清液经过70 ℃处理30 min后, 抑菌活性分别下降了11.0%和18.1%;经过100 ℃处理30 min后, 抑菌活性仍有39.8%和32.5%;经过121 ℃处理后, 抑菌活性完全丧失。细菌素在pH 6.5时抑菌效果最好; 在pH 3.0-11.0范围内均有抑菌活性, 当pH为3.0时, 菌株DY7 (图 4)和FX4所产细菌素的抑菌活性分别为77.6%和84.6%;在pH为9.0时, 抑菌活性分别降低了29.0%和34.2%, 显示碱性环境对细菌素抑菌活性的影响比酸性大。
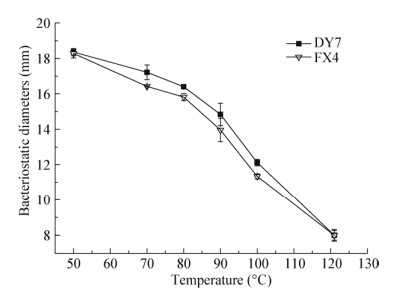
|
| 图 2 细菌素的热稳定性 Figure 2 The thermal stability of bacteriocin |
|
|

|
| 图 3 细菌素的酸碱稳定性 Figure 3 The pH stability of bacteriocin |
|
|

|
| 图 4 菌株DY7所产细菌素对CICC10411的抑菌活性 Figure 4 Antibacterial activity to CICC10411 of strain DY7 |
|
|
图 5统计显示, 所有6株产细菌素菌株均对CTX、ERM敏感; 除菌株EY3外均对BAT有耐药性; 菌株C4、C7、EY3对CTX、ERM、TET较敏感; 菌株BY2、DY7、FX4对TET具有耐受性。
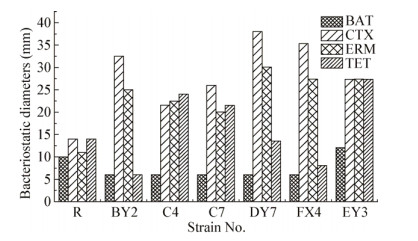
|
| 图 5 产细菌素菌株的耐药谱 Figure 5 Resistance spectrum of bacteriocin-producing strains Note:R:Resistance standard. |
|
|
产细菌素菌株生理生化结果见表 1, 结果表明6株芽孢杆菌属产细菌素菌株接触酶、淀粉水解、明胶液化、硝酸盐还原、V-P试验、葡萄糖产气实验均呈阳性; 柠檬酸盐利用实验只有菌株DY7呈阳性; BY2、DY7、FX4的葡萄糖产酸实验呈阴性。
3 讨论与结论目前, 由于抗生素在家禽、家畜养殖业的滥用和超级病原细菌的出现, 严重威胁人类健康。因此, 2006年欧盟禁止了抗生素作为生长促进剂在动物生产中的应用[19], 使得益生菌及其抗菌肽产品作为生物饲料添加剂成为科学研究开发的热门领域。益生菌及其代谢物细菌素应用于养殖业是基于其对病原微生物的营养竞争作用, 先入为主的排阻作用, 以及更显著的杀菌、拮抗作用[20]。同时, 开发益生菌作为饲料添加剂菌株本身的安全性至关重要, 包括抗生素耐药性、产毒素作用。与抗生素相比, 虽然细菌素具有较窄的抑菌谱, 但是目前的研究报道几乎没有发现靶细胞对细菌素具有耐受性。此外, Yeo等[17]的研究发现人源益生菌Lactobacillus rhamnosus GG在猪胃肠道的存活率和肠道上皮细胞粘附能力明显低于猪源益生菌。Mulder等[21]的研究表明初生的动物幼崽散养于自然环境更有利于肠道益生微生物的定殖, 因此有必要开展更广泛的宿主特异性菌株筛选, 不断拓展益生菌饲料研发和应用范围[22]。本研究筛选得到的菌株B. licheniformis DY7与B. subtilis FX4对常见的引起动物严重腹泻、败血症及局部化脓感染的革兰氏阴性(CICC10411、CICC10420、CICC10421、CICC21530)、阳性(CICC21600)致病微生物具有抑制作用, 而且B. licheniformis与B. subtilis已被列入微生物饲料添加剂范畴[10]。
细菌素对不同酸碱环境和热基质的稳定性拓宽了生物添加剂的应用范围。Miao等的研究中, 细菌素F1在pH 3.0、6.0和9.0条件下处理2 h, 细菌素的活性不受影响; 细菌素F1在60、80、100 ℃处理60 min和121 ℃处理20 min仍有抑菌活性[23]。本研究中B. licheniformis DY7与B. subtilis FX4菌株所产细菌素在pH 3.0-9.0处理24 h有抑菌活性, 相比细菌素F1酸碱稳定性更强; 在121 ℃处理30 min时抑菌活性丧失, 但100 ℃处理30 min仍有抑菌活性, 可以满足饲料发酵、添加剂的生产和加工工艺。
菌株对抗生素的敏感性被认为是最主要的安全特性[24]。Manhar等[25]报道了B.amyloliquefaciens AMS1对Ampicillin和Penicillin G具有耐受性。Hoa等[26]的研究发现Tetracyline对B. subtilis PY79没有抑制作用。然而, 目前研究发现由于各种因素影响, 微生物不能完全替代抗生素用于疾病治疗, 因此作为饲料添加剂的微生物具有一定的耐药性可增加其存活率[6, 27-28]。本研究中的4种抗生素根据作用机理分为两类:BAT、CTX抑制细胞壁的合成, ERM、TET抑制蛋白质合成[29]。2株高效产细菌素菌株均对BAT和TET有耐受性, 这将为2株微生物寄主的抗生素给药提供依据。菌株DY7和FX4的产细菌素特性和细菌素稳定性具备生物饲料添加剂基本特性, 符合饲料工业化生产工艺, 可以进一步研发。
| [1] |
Gaggìa F, Mattarelli P, Biavati B. Probiotics and prebiotics in animal feeding for safe food production[J]. International Journal of Food Microbiology, 2010, 141(S1): S15-S28. |
| [2] |
Yang FJ, Hou CL, Zeng XF, et al. The use of lactic acid bacteria as a probiotic in swine diets[J]. Pathogens, 2015, 4(1): 34-45. DOI:10.3390/pathogens4010034 |
| [3] |
Stokstad ELR, Jukes TH, Pierce J, et al. The multiple nature of the animal protein factor[J]. The Journal of Biological Chemistry, 1949, 180(2): 647-654. |
| [4] |
Berends BR, van den Bogaard AEJM, van Knapen F, et al. Veterinary public health:human health hazards associated with the administration of antimicrobials to slaughter animals.Part Ⅰ.An assessment of the risks of residues of tetracyclines in pork[J]. Veterinary Quarterly, 2001, 23(1): 2-10. DOI:10.1080/01652176.2001.9695068 |
| [5] |
Konisky J. Colicins and other bacteriocins with established modes of action[J]. Annual Review of Microbiology, 1982, 36: 125-144. DOI:10.1146/annurev.mi.36.100182.001013 |
| [6] |
He YY, Mao CX, Wen H, et al. Influence of ad libitum feeding of piglets with Bacillus subtilis fermented liquid feed on gut flora, luminal contents and health[J]. Scientific Reports, 2017, 7: 44553. DOI:10.1038/srep44553 |
| [7] |
Agazzi A, Tirloni E, Stella S, et al. Effects of species-specific probiotic addition to milk replacer on calf health and performance during the first month of life[J]. Annals of Animal Science, 2014, 14(1): 101-115. |
| [8] |
Callaway TR, Ricke SC. Direct-Fed Microbials and Prebiotics for Animals[M]. Berlin: Springer, 2011, 89-120.
|
| [9] |
Barbosa TM, Serra CR, La Ragione RM, et al. Screening for Bacillus isolates in the broiler gastrointestinal tract[J]. Applied and Environmental Microbiology, 2005, 71(2): 968-978. DOI:10.1128/AEM.71.2.968-978.2005 |
| [10] |
Cutting SM. Bacillus probiotics[J]. Food Microbiology, 2011, 28(2): 214-220. DOI:10.1016/j.fm.2010.03.007 |
| [11] |
Lee S, Lee J, Jin YI, et al. Probiotic characteristics of Bacillus strains isolated from Korean traditional soy sauce[J]. LWT-Food Science and Technology, 2017, 79: 518-524. DOI:10.1016/j.lwt.2016.08.040 |
| [12] |
Rojo-Bezares B, Sáenz Y, Poeta P, et al. Assessment of antibiotic susceptibility within lactic acid bacteria strains isolated from wine[J]. International Journal of Food Microbiology, 2006, 111(3): 234-240. DOI:10.1016/j.ijfoodmicro.2006.06.007 |
| [13] |
Jia LY. Screening and identification of the bacteriocin-like-producing bacteria and studying on the bacteriocin-like[D]. Shanxi: Doctoral Dissertation of Shanxi Agricultural University, 2014 (in Chinese) 贾丽艳. 产类细菌素菌株的筛选鉴定及类细菌素的研究[D]. 山西: 山西农业大学博士学位论文, 2014 |
| [14] |
Justé A, Thomma BPHJ, Lievens B. Recent advances in molecular techniques to study microbial communities in food-associated matrices and processes[J]. Food Microbiology, 2008, 25(6): 745-761. DOI:10.1016/j.fm.2008.04.009 |
| [15] |
Thompson JD, Gibson TJ, Plewniak F, et al. The CLUSTAL_X windows interface:flexible strategies for multiple sequence alignment aided by quality analysis tools[J]. Nucleic Acids Research, 1997, 25(24): 4876-4882. DOI:10.1093/nar/25.24.4876 |
| [16] |
Tamura K, Peterson D, Peterson N, et al. MEGA5:molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods[J]. Molecular Biology and Evolution, 2011, 28(10): 2731-2739. DOI:10.1093/molbev/msr121 |
| [17] |
Yeo S, Lee S, Park H, et al. Development of putative probiotics as feed additives:validation in a porcine-specific gastrointestinal tract model[J]. Applied Microbiology and Biotechnology, 2016, 100(23): 10043-10054. DOI:10.1007/s00253-016-7812-1 |
| [18] |
Dong XZ, Cai MY. Common Bacterial System Identification Manual[M]. Beijing: Science Press, 2001, 364-398. 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001, 364-398. |
| [19] |
Immerseel FV, Eeckhaut V, Moore RJ, et al. Beneficial microbial signals from alternative feed ingredients:a way to improve sustainability of broiler production?[J]. Microbial Biotechnology, 2017, 10(5): 1008-1011. DOI:10.1111/1751-7915.12794 |
| [20] |
Quigley EMM. Prebiotics and probiotics; modifying and mining the microbiota[J]. Pharmacological Research, 2010, 61(3): 213-218. DOI:10.1016/j.phrs.2010.01.004 |
| [21] |
Mulder IE, Schmidt B, Stokes CR, et al. Environmentally-acquired bacteria influence microbial diversity and natural innate immune responses at gut surfaces[J]. BMC Biology, 2009, 7: 79. DOI:10.1186/1741-7007-7-79 |
| [22] |
Yang X, Fang H, Shen C, et al. Research progress of bacteriocin and its application in animal feed[J]. Feed Research, 2017(6): 5-7, 16. 杨旭, 方华, 沈城, 等. 细菌素研究进展及其在动物饲料中的应用[J]. 饲料研究, 2017(6): 5-7, 16. |
| [23] |
Miao JY, Guo HX, Ou YW, et al. Purification and characterization of bacteriocin F1, a novel bacteriocin produced by Lactobacillus paracasei subsp.tolerans FX-6 from Tibetan kefir, a traditional fermented milk from Tibet, China[J]. Food Control, 2014, 42: 48-53. DOI:10.1016/j.foodcont.2014.01.041 |
| [24] |
Park MS, Ji GE. Development of probiotics and industrialization[J]. Food Science and Industry, 2014, 47: 19-28. |
| [25] |
Manhar AK, Saikia D, Bashir Y, et al. In vitro evaluation of celluloytic Bacillus amyloliquefaciens AMS1 isolated from traditional fermented soybean (Churpi) as an animal probiotic[J]. Research in Veterinary Science, 2015, 99: 149-156. DOI:10.1016/j.rvsc.2015.01.008 |
| [26] |
Hoa NT, Baccigalupi L, Huxham A, et al. Characterization of Bacillus species used for oral bacteriotherapy and bacterioprophylaxis of gastrointestinal disorders[J]. Applied and Environmental Microbiology, 2000, 66(12): 5241-5247. DOI:10.1128/AEM.66.12.5241-5247.2000 |
| [27] |
Parker EA, Roy T, D'Adamo CR, et al. Probiotics and gastrointestinal conditions:an overview of evidence from the cochrane collaboration[J]. Nutrition, 2018, 45: 125-134. DOI:10.1016/j.nut.2017.06.024 |
| [28] |
Cotter PD, Ross RP, Hill C. Bacteriocins — a viable alternative to antibiotics?[J]. Nature Reviews Microbiology, 2013, 11(2): 95-105. DOI:10.1038/nrmicro2937 |
| [29] |
Argyri AA, Zoumpopoulou G, Karatzas KAG, et al. Selection of potential probiotic lactic acid bacteria from fermented olives by in vitro tests[J]. Food Microbiology, 2013, 33(2): 282-291. DOI:10.1016/j.fm.2012.10.005 |
 2018, Vol. 45
2018, Vol. 45




