扩展功能
文章信息
- 王吴优, 田青, 程建国, 赵位, 邓磊, 罗燕
- WANG Wu-You, TIAN Qing, CHENG Jian-Guo, ZHAO Wei, DENG Lei, LUO Yan
- 林麝肺源致病性大肠杆菌感染BALB/c小鼠模型的建立及评价
- Establishment and evaluation of BALB/c mice challenge model with lung pathogenic Escherichia coli O78 of forest musk deer origin
- 微生物学通报, 2018, 45(6): 1333-1341
- Microbiology China, 2018, 45(6): 1333-1341
- DOI: 10.13344/j.microbiol.china.170685
-
文章历史
- 收稿日期: 2017-09-01
- 接受日期: 2017-12-15
- 网络首发日期(www.cnki.net): 2018-01-15
2. 四川养麝研究所 四川 都江堰 611830
2. Sichuan Institute of Musk Deer Breeding, Dujiangyan, Sichuan 611830, China
林麝肺炎及化脓性疾病是林麝规模化养殖常见疾病中发病率与死亡率最高的疾病之一, LPEC (Lung pathogenic Escherichia coli)是引起该种疾病的主要病原菌[1]。但由于缺少对肺炎、脓肿等疾病的有效防治手段, 极大地制约了林麝规模化养殖业的发展, 严重阻碍对濒危麝类动物的保护及麝香产量的提高[2]。林麝是国家一级濒危野生药用动物[3], 不宜进行动物回归实验, 这给林麝疾病的研究带来了困难。国内外有大量通过小鼠模型研究致病性大肠杆菌的报道, 但主要集中在肠道疾病[4-9], 虽然为建立小鼠模型提供了一定的参考, 但无法对LPEC引起的肺脏疾病有较好的解释。本研究通过对小鼠感染LPEC优势血清型O78建立模型, 进行生化指标测定、细菌定殖量观测以及病理组织学分析, 了解LPEC O78的毒力及致病性, 对LPEC O78的发病机制和病理生理等方面的深入研究有着重要的意义, 从而为该病的诊断和防控奠定了科学的理论依据。
1 材料与方法 1.1 材料 1.1.1 菌株和实验动物林麝LPEC O78 (GenBank登录号KU870315), 由四川农业大学温江校区动物检验实验室保存; 5周龄SPF级BALB/c小鼠108只, 体重22-24 g, 雌雄各半, 购自成都达硕实验动物有限公司。
1.1.2 主要试剂和仪器伊红-美兰琼脂(EMB)、LB培养基、五糖微量发酵管、蛋白胨水、甲基红、V-P、硫化氢、枸橼酸盐培养基等[10-11], 杭州微生物有限公司; 甲醛, 重庆茂业化学试剂有限公司; 细菌基因组提取试剂盒、DNA Marker (DL5000)等, 天根生化科技(北京)有限公司; 高速冷冻离心机, 德国艾本德公司; HD-F2600全自动生化测定仪, 济南华天恒达科技有限公司; PCR扩增仪、核酸电泳仪等, 美国伯乐公司。
1.2 方法 1.2.1 林麝LPEC O78菌液的制备林麝LPEC O78划线接种至EMB培养基上, 于37 ℃细菌培养箱中培养12 h, 挑取紫黑色带金属闪光的圆形单菌落, 接种于100 mL LB培养基中, 37 ℃、180 r/min振荡培养16 h。采用平板菌落计数法对菌液进行10倍系列稀释后涂板计数, 确定菌液浓度。
1.2.2 小鼠LD50的测定48只BALB/c小鼠饲喂3 d, 随机分为6个组, 5个实验组, 1个对照组, 每组8只, 雌雄各半。将已知浓度菌液倍比稀释为2.02×106- 2.02×1010 CFU/mL, 分别腹腔注射每个实验组, 每组每只小鼠注射量为0.1 mL/10 g体重, 对照组注射等量无菌PBS溶液。攻毒后, 连续7 d密切观察并记录小鼠的临床症状及死亡情况。利用Karber法对LD50值进行计算[12]。
1.2.3 林麝LPEC O78感染BALB/c小鼠模型的建立60只BALB/c小鼠饲喂3 d, 随机分为Ⅰ(对照)组(20只)和Ⅱ(实验)组(40只), 雌雄各半, 参照小鼠腹腔注射致病死亡结果以及LD50值, 选择合适浓度进行本次致病性感染实验。实验组和对照组小鼠按0.1 mL/10 g体重分别腹腔注射LPEC O78菌液及灭菌PBS溶液。于攻毒后12、24、48、72、96 h分别测定小鼠体重、各器官细菌含量, 并于24、36、48、60、72 h测定血液生化指标指数, 记录小鼠临床状态及死亡情况, 并采集濒死小鼠器官进行病理组织学观察。
1.2.4 小鼠体重及生存情况感染前及感染后每天记录小鼠的体重, 观察并记录小鼠死亡情况, 绘制小鼠体重变化曲线。
1.2.5 血液生化指标测定采血前禁食, 于攻毒后24、36、48、60、72 h随机选取3只实验组及2只对照组小鼠眼球采血, 倾斜放置于37 ℃环境中, 3 000 r/min离心15 min得到血清, 然后立刻采用HD-F2600全自动生化测定仪进行以下指标的测定:谷丙转氨酶(ALT, U/L)、谷草转氨酶(AST, U/L)、总蛋白(TP, g/L)、白蛋白(ALB, g/L)、磷(IP, mmol/L)、钙(Ca, mmol/L)、镁(Mg, mmol/L)、总胆红素(TBIL, µmol/L)、尿酸(URIC, µmol/L)、尿素(UREA, mmol/L)、血糖(GLU, mmol/L)、胆碱酯酶(CHE, U/L)和乳酸脱氢酶(LDH, U/L)。
1.2.6 细菌分离鉴定参照预实验结果, 攻毒后以小鼠出现精神萎靡、嗜睡、反应迟钝、被毛蓬乱为发病指标。将发病小鼠心、肝、脾、肺、肾及肠道接种于LB培养基上, 37 ℃培养18-24 h。挑取单菌落划线接种于EMB培养基, 37 ℃培养18-24 h, 挑取单菌落革兰氏染色镜检, 对细菌进行形态学观察。
将分离得到的菌株划线接种于LB平板培养16 h, 挑取适量单菌落分别接种于五糖微量发酵管(蔗糖、乳糖、葡萄糖、麦芽糖、甘露醇)、蛋白胨水、甲基红、V-P、硫化氢、枸橼酸盐培养基, 于37 ℃培养24-72 h, 并按照第8版《伯杰氏细菌鉴定手册》对生化实验结果进行判定[13]。
利用细菌基因组DNA提取试剂盒提取分离菌株的DNA为模板, 27F (5′-AGAGTTTGATCCTGG CTCAG-3′)和1492R (5′-TACGGTTACCTTGTTAC GACTT-3′)为引物进行16S rRNA基因扩增。PCR反应体系(50 µL):上、下游引物(10 μmol/L)各2 μL, 模板DNA 3 μL, 2×PCR mixture 25 μL, ddH2O 18 μL。PCR反应条件:94 ℃ 3 min; 94 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 30个循环; 72 ℃ 10 min。PCR产物经1%琼脂糖凝胶电泳, 观察结果。送生工生物工程(上海)股份有限公司进行测序, 并对得到的菌株序列结果进行同源性比对分析。
1.2.7 LPEC O78器官定殖量测定调整菌液浓度至3.6×108 CFU/mL, 按0.1 mL/10 g进行攻毒, 12、24、48、96、120 h随机选取3只实验组及2只对照组小鼠, 采集小鼠心、肝、脾、肺、肾以及肠道, 用灭菌PBS溶液漂洗, 除去血液和污物, 称量后研磨, 用无菌PBS溶液10倍系列稀释后铺板计数, 计算每克器官菌含量, 检测LPEC O78器官定殖量的变化。
1.2.8 病理学检查采集濒死小鼠器官, 包括脑、心、肝、脾、肺、肾、腺胃、气管环、胰腺和肠道, 观察并记录组织病变情况, 切取新鲜组织块, 置于4%中性甲醛溶液固定24-48 h, 常规方法制作病理组织切片(6 μm)。
1.3 统计处理数据处理与分析运用SPSS 22.0统计软件, 采用单因素方差分析(One way-ANOVA), 以P < 0.05表示差异显著。结果用“平均值±标准差”表示。
2 结果与分析 2.1 小鼠LD50实验攻毒后, 实验组小鼠均出现不同程度的食欲不振、精神沉郁、反应迟钝、被毛杂乱、粪便黏腻及眼角分泌物增多等临床症状。而对照组小鼠无异常临床表现, 剖检也未见病理变化。其中1组死亡数为0只, 2组死亡1只, 3组死亡4只, 4组死亡5只, 5组死亡8只, 通过计算得出林麝LPEC O78对BALB/c小鼠的LD50为3.6×108 CFU/mL。
2.2 小鼠体重变化实验组小鼠感染LPEC O78后出现精神萎靡、反应迟钝、被毛竖立、闭眼、眼角大量分泌物等临床特征, 并且体重于24 h之内急速下降, 下降约3.2 g左右。11 h时, 症状严重者出现死亡情况。24 h后小鼠体重逐渐回升, 但仍然低于对照组, 某些小鼠临床症状开始减轻。96 h后, 体重与对照组无明显差异, 且无小鼠死亡。对照组小鼠, 饮食欲健康, 体重变化不大, 如图 1所示。
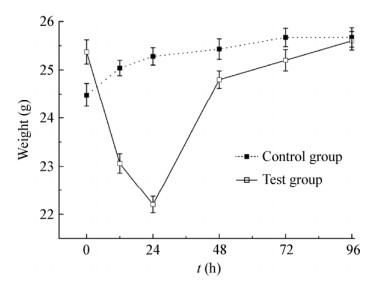
|
| 图 1 感染及对照小鼠体重变化曲线 Figure 1 The body weight change curves of infected and control mice |
|
|
如表 1所示, 小鼠血清中酶活性、蛋白质、电解质、血糖及蛋白质代谢物含量相较于Ⅰ(对照)组水平有明显升高(P < 0.05), 但尿酸含量变化不显著(P > 0.05)。Ⅱ(实验)组内, 谷丙转氨酶、谷草转氨酶活性、白蛋白、磷及尿素含量持续显著性升高(P < 0.05);乳酸脱氢酶和胆碱酯酶活性有显著性变化(P < 0.05), 于48 h达到最高; 总胆红素有显著性变化(P < 0.05), 于36 h达到最高; 血糖含量显著性降低(P < 0.05);总胆红素有显著性变化(P < 0.05), 于48 h达到最低; 钙含量有显著性变化(P < 0.05), 于36 h达到最低; 镁含量有显著性升高(P < 0.05), 但在60 h突然降低, 72 h突然升高。
| 项目 Items |
组别 Groups |
时间Time (h) | ||||
| 24 | 36 | 48 | 60 | 72 | ||
| 谷丙转氨酶 ALT (U/L) | Ⅰ | 28.09±1.23 | 29.99±1.29 | 29.07±1.77 | 30.94±1.67 | 30.17±1.44 |
| Ⅱ | 31.90±1.04# | 33.25±1.09# | 43.33±1.15*# | 54.53±1.41*# | 60.78±1.01*# | |
| 谷草转氨酶 AST (U/L) | Ⅰ | 101.29±0.87 | 102.45±1.16 | 113.25±0.91* | 118.46±1.31* | 117.59±1.19 |
| Ⅱ | 101.97±0.78 | 132.55±1.38*# | 134.28±0.93# | 193.44±1.14*# | 227.81±0.91*# | |
| 乳酸脱氢酶 LDH (U/L) | Ⅰ | 1 023.98±1.33 | 1 130.68±0.63* | 1 130.83±1.29 | 1 221.54±1.41* | 1 109.49±0.95* |
| Ⅱ | 1 374.20±1.04# | 1 490.43±1.37*# | 1 505.53±1.38*# | 1 371.30±0.47*# | 1 498.38±0.38*# | |
| 胆碱酯酶 CHE (U/L) | Ⅰ | 1 182.33±2.85 | 1 260.69±1.95* | 1 285.19±1.91* | 1 364.57±1.39* | 1 146.59±1.3* |
| Ⅱ | 1 283.11±1.64# | 1 361.43±2.11*# | 1 897.43±1.67*# | 1 465.82±2.09*# | 1 246.69±1.72*# | |
| 总蛋白 TP (g/L) | Ⅰ | 52.77±0.97 | 55.49±1.30* | 56.75±0.86 | 59.47±1.4* | 59.05±1.07 |
| Ⅱ | 61.00±1.27# | 55.64±1.21* | 45.59±1.27*# | 56.75±1.13* | 64.28±1.01*# | |
| 白蛋白 ALB (g/L) | Ⅰ | 17.52±1.10 | 16.73±1.12 | 17.66±1.18 | 15.92±0.98 | 16.75±1.11 |
| Ⅱ | 32.46±0.51# | 31.62±0.84# | 33.12±0.63*# | 36.04±0.74*# | 36.40±0.81# | |
| 血糖 GLU (mmol/L) | Ⅰ | 2.19±0.17 | 2.07±0.05 | 1.09±0.04* | 1.10±0.05 | 2.33±0.04* |
| Ⅱ | 4.41±0.03# | 4.67±0.07# | 2.26±0.05# | 2.06±0.09# | 1.24±0.03# | |
| 镁 Mg (mmol/L) | Ⅰ | 1.46±0.10 | 1.64±0.10 | 1.64±0.13 | 2.72±0.10* | 2.60±0.04 |
| Ⅱ | 5.66±0.07# | 5.86±0.03*# | 6.56±0.10*# | 5.78±0.06*# | 6.76±0.07*# | |
| 磷 IP (mmol/L) | Ⅰ | 4.86±0.06 | 3.02±0.06* | 4.33±0.07* | 4.15±0.09* | 4.37±0.10* |
| Ⅱ | 10.84±0.10# | 11.90±0.10*# | 11.35±0.07*# | 12.23±0.07*# | 12.36±0.07# | |
| 钙 Ca (mmol/L) | Ⅰ | 3.53±0.12 | 2.42±0.34* | 3.24±0.06* | 3.46±0.05 | 3.38±0.11 |
| Ⅱ | 10.02±0.11# | 9.01±0.10*# | 10.11±0.15*# | 10.87±0.63*# | 11.70±0.44*# | |
| 总胆红 TBI (µmol/L) | Ⅰ | 1.26±0.06 | 1.58±0.09* | 1.43±0.12* | 1.65±0.03* | 1.52±0.07 |
| Ⅱ | 1.66±0.12# | 3.76±0.11*# | 2.94±0.07*# | 1.63±0.05* | 1.54±0.05* | |
| 尿酸 URIC (µmol/L) | Ⅰ | 126.51±1.12 | 144.49±0.78* | 138.69±1.17* | 150.19±0.79* | 141.25±0.71* |
| Ⅱ | 126.44±0.93 | 144.48±0.77* | 138.90±0.62* | 150.30±1.11* | 140.99±0.06* | |
| 尿素 UREA (mmol/L) | Ⅰ | 5.22±0.06 | 7.03±0.09* | 8.53±0.13* | 7.93±0.11* | 8.37±0.57 |
| Ⅱ | 5.32±0.11 | 5.44±0.05# | 7.22±0.05*# | 7.93±0.09* | 9.07±0.07* | |
| 注:*:组内与前一时间点相比差异显著(P < 0.05);#:与对照组相比差异显著(P < 0.05). Note:*:Significant difference (P < 0.05) compared to the previous point in the same group; #:Significant difference (P < 0.05) compared to the control group. | ||||||
从6份病料中共分离出4株细菌, 在LB平板上形成表面光滑、灰白色、中等大小的圆形菌落, 在EMB琼脂板上形成紫黑色带金属闪光的圆形单菌落。经涂片、染色、镜检后可见两端钝圆、无芽孢的红色短杆菌。
4株菌对乳糖、葡萄糖、麦芽糖、甘露醇、蛋白胨水、甲基红为阳性; 对蔗糖、硫化氢、V-P、枸橼酸盐为阴性, 均符合大肠杆菌典型生化特征, 判定4株菌株均为大肠杆菌。
利用1%的琼脂糖凝胶电泳检测4株菌的16S rRNA基因扩增产物, 以DL5000为分子量标准, 如图 2所示, 4株菌分别可见1 400 bp左右的特异性条带。4株菌的基因序列与林麝LPEC O78 (GenBank登录号KU870315)基因序列一致性为100%。

|
| 图 2 分离菌株的16S rRNA基因电泳图 Figure 2 Electophesis of PCR products of 16S rRNA gene of isolated strains 注:M:DL5000分子质量标准; 1-4:分离菌株所扩增的特异性条带. Note:M:DL5000 DNA marker; 1-4:The specific band of isolated strains. |
|
|
对照组小鼠心、肝、脾、肺、肾以及肠道均无林麝LPEC O78感染。实验组小鼠心、肝、脾、肺、肾以及肠道均有林麝LPEC O78感染, 其中肝、肺、肠道组织中细菌含量在12 h即达到最高, 分别为7.4×105、3.1×105、2.6×105 CFU/g左右; 而心、脾、肾脏细菌含量在24 h达到最高, 分别为1.0×105、1.6×105、3.6×105 CFU/g左右。心、肝、肾及肠道在48 h细菌含量下降显著(P < 0.05), 肺脏在24 h细菌含量下降显著, 脾脏在24 h及72 h细菌含量分别显著上升及下降。96 h时脾脏及肾脏没有发现细菌生长, 如图 3所示。

|
| 图 3 感染组小鼠各器官组织中LPEC O78含量的变化 Figure 3 Changes of concentrations of LPEC O78 in each organ of infected mice 注:*:同一器官中, 与前一时间点相比差异显著(P < 0.05). Note:*:Significant difference (P < 0.05) compared to the previous point in the same organs. |
|
|
剖检发现, 实验组小鼠肺脏组织变小, 有轻微出血症状; 肝脏相较于对照组小鼠体积增大, 边缘偶见部分淤血; 小肠前端出血水肿。
组织病理学检查(图 4)发现:肝脏(图 4B、C)局部可见坏死灶, 中央静脉淤血, 局部肝血窦出血, 肝窦消失, 肝索结构紊乱, 肝细胞肿胀, 细胞核裂解消失, 肝细胞坏死, 结构不清; 肺脏(图 4E、F)肺泡代偿性扩增, 肺间隔增厚, 有少量淋巴细胞浸润, 局部肺泡萎缩变小; 肾脏(图 4H、I)肾小球肿胀, 数量减少, 肾小球囊腔消失; 十二指肠(图 4K、L)固有层充血、水肿, 结构疏松, 肠绒毛脱落, 上皮细胞掉入肠腔, 可见红细胞浸润; 空肠(图 4N、O)固有层血管轻度充血、水肿、疏松, 部分绒毛顶端上皮细胞脱落, 散在坏死灶, 灶中脱落坏死细胞增多。脑、气管、胰腺等无明显组织病理学变化。
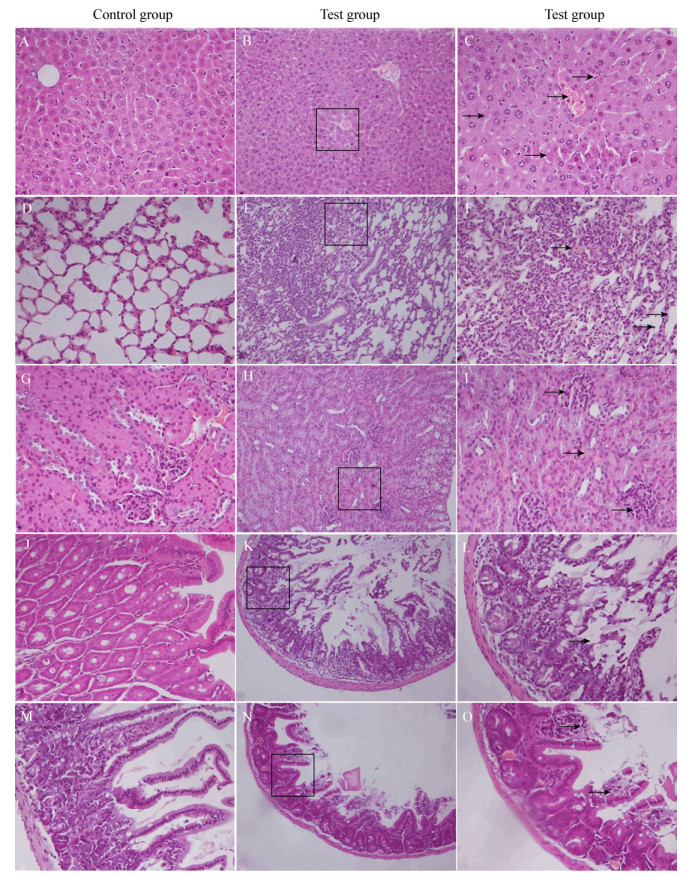
|
| 图 4 林麝LPEC O78人工感染BALB/c小鼠后主要脏器组织显微图片 Figure 4 Photomicrograph of different tissues of BALB/c mice in the control group and test group infected with LPEC O78 注:A、D、G、J、M分别为对照组肝、肺、肾、十二指肠、空肠的形态, 均为400×; B、E、H、K、N分别为实验组肝、肺、肾、十二指肠、空肠的形态, 均为200×; C、F、I、L、O分别为实验组肝、肺、肾、十二指肠、空肠的形态, 均为400×. Note:A, D, G, J and M represent the normal tissue of liver, lung, kidney, duodenum, jejunum in control group with magnification of 400×, respectively; B, E, H, K and N represent the pathological tissue of liver, lung, kidney, duodenum, jejunum in test group with magnification of 200×, respectively; C, F, I, L and O represent the pathological tissue of liver, lung, kidney, duodenum, jejunum in test group with magnification of 400×, respectively. |
|
|
动物疾病模型为全面深入认识疾病提供有效途径, 模型的建立应选择与研究对象的功能代谢及疾病特点等相似度较高的动物, 并且需避免在濒危动物上实验带来的风险。林麝是国家一级保护动物, 虽经过一定时期的人工驯化, 但仍具野性, 易受惊吓[14], 其特殊性使得必需选择合适的动物进行造模。小鼠体型小、性格温顺、价廉、易于获得、重复性好并且易于控制管理, 是理想的动物感染模型[15-16]; 也是构建大肠杆菌感染模型的首选动物[17]。LPEC O78是从患肺炎的林麝肺部分离, 首选滴鼻方式进行动物攻毒[18], 但在实验操作过程中小鼠对滴鼻的应激很大, 剂量又难以精确控制, 易造成小鼠死亡。而腹腔注射时剂量能够准确控制, 操作简便, 对实验小鼠的应激较小, 最后采用腹腔注射的方法进行动物攻毒实验。参照小鼠腹腔注射后的临床症状、致病死亡结果以及LD50值, 决定采用108数量级作为造模的感染剂量[19]。小鼠血液生化指标的测定以及组织病理学检查, 有助于判定机体代谢及器官损伤情况。本次实验还对感染小鼠的器官进行细菌分离鉴定及定殖量的时相性观测, 对明确小鼠感染模型是否成功建立具有积极意义[20]。
感染后3 h, 实验小鼠即出现与林麝患LPEC O78病情一致的临床症状, 表现为精神沉郁、被毛耸立, 随后出现呆立不动、食欲废绝以及腹泻、大便稀软[21]。11 h发现死亡病例, 至12 h各器官组织均有细菌定殖, 并且各器官细菌浓度除心脏和脾脏在24 h达到105数量级外, 其余器官12 h时就已达到此浓度, 对小鼠各脏器造成了一定的损伤, 这从血清生化指标中糖类、蛋白质代谢产物、酶活性、电解质水平都有明显上升中可以看出。Sankaran等[22]研究表明, 当病情加重时患细菌性肺炎的病人血糖水平会明显升高。高血糖状态不仅有利于病原菌在动物机体内生长繁殖, 而且其可抑制免疫细胞的吞噬作用[23], 使感染动物的抵抗力和免疫力降低, 诱发疾病导致感染动物致病甚至死亡。实验小鼠相对于对照组显著性升高的血糖水平, 可能是24 h内心、脾及肾脏细菌含量在升高, 肝、肺及肠道细菌含量维持较高浓度的原因之一。TP和ALB的变化可影响肝脏的合成功能。Summermatter等[24]研究发现, 当肝细胞受到损伤时血液中的LDH值会明显升高。ALT和AST是反映肝实质损害的重要指标, 这些都提示小鼠组织细胞受损, 脱水, 血液浓缩, 且剖检可见肝脏明显肿大。小鼠的各种临床症状结合细菌感染后器官受损情况, 解释了小鼠体重在12 h内迅速下降2.3 g左右, 之后下降稍缓, 24 h到达最低峰, 降低了3.1 g左右的明显变化。24 h内小鼠共死亡5只, 35 h时出现1只小鼠死亡, 截至48 h新增4例死亡, 细菌含量大、侵袭力强以及小鼠免疫力弱等因素都有可能导致这些结果的发生。24 h后, 心、肝、肾及肠道中细菌含量有显著性下降, 与机体免疫反应及吞噬细胞作用等因素有关。某些免疫力较强的小鼠, 精神状态较之前稍有缓解, 体重缓慢增加, 96 h已基本恢复正常水平, 且96 h肝脏及肾脏未发现LPEC O78的定殖, 其余器官定殖量下降, 提示小鼠器官功能逐渐恢复。
对实验组小鼠进行病理学剖解和组织病理学观察发现, 小鼠攻毒后能复制出与自然感染相同的临床症状和病理变化, 实验组小鼠的肺泡壁增厚, 扩张充血, 伴有中性粒细胞和淋巴细胞浸润, 该病理变化是由于细菌感染肺脏, 引起肺脏肺泡壁增厚, 炎性细胞聚集所致[25]。剖检肺脏也发现有出血及肿大。肝脏和肾脏有不同程度的淤血和充血, 肝脏中可见嗜中性粒细胞散在或小灶状浸润; 肠道上皮细胞坏死、脱落, 固有层充血、水肿、结构疏松。这与罗燕等[26]和Pilloux等[27]的报道基本一致, 也解释了细菌在各器官定殖中对组织细胞带来的伤害。早期取材组织的染色中, 心脏及脾脏组织未见明显异常。对照组小鼠无明显临床症状, 剖检也未见异常。
综上所述, 本研究初步建立了林麝肺源致病性大肠杆菌感染BALB/c小鼠模型, 并且了解了林麝LPEC O78引起机体血液生化指标的变化, 有助于认识林麝肺炎的发生发展规律, 为生化指标数据库的建立奠定了数据基础, 也为研究该病的发生机制、诊断以及防治奠定了科学的理论基础。通过对感染林麝LPEC O78的小鼠进行病理组织学的观察与研究, 丰富了LPEC的流行病学资料。
| [1] |
Luo Y, Wang P, Zhao HM, et al. Isolation and identification of lung pathogenic Escherichia coli from musk deer and PCR detection of the virulence genes[J]. Chinese Journal of Preventive Veterinary Medicine, 2012, 34(8): 615-618. 罗燕, 王朋, 赵洪明, 等. 林麝肺源致病性大肠杆菌分离鉴定及毒力基因PCR检测[J]. 中国预防兽医学报, 2012, 34(8): 615-618. |
| [2] |
Wang Y, Jiang HR, Xue WJ, et al. Advances in research of forest musk deer (Moschus berezovskii)[J]. Sichuan Journal of Zoology, 2006, 25(1): 195-200. 王淯, 姜海瑞, 薛文杰, 等. 林麝(Moschus berezovskii)研究概况和进展[J]. 四川动物, 2006, 25(1): 195-200. |
| [3] |
Jie H, Feng XL, Zhao GJ, et al. Research progress on musk secretion mechanism of forest musk deer[J]. China Journal of Chinese Materia Medica, 2014, 39(23): 4522-4525. 竭航, 封孝兰, 赵贵军, 等. 林麝泌香机制研究进展[J]. 中国中药杂志, 2014, 39(23): 4522-4525. |
| [4] |
Goswami K, Chen C, Xiaoli L, et al. Coculture of Escherichia coli O157:H7 with a nonpathogenic E.coli strain increases toxin production and virulence in a Germfree Mouse Model[J]. Infection and Immunity, 2015, 83(11): 4185-4193. DOI:10.1128/IAI.00663-15 |
| [5] |
Petersen AM, Schjrring S, Gerstrm SC, et al. Treatment of inflammatory bowel disease associated E.coli with ciprofloxacin and E.coli nissle in the streptomycin-treated mouse intestine[J]. PLoS One, 2011, 6(8): e22823. |
| [6] |
Witteveen E, Hoogland ICM, Wieske L, et al. Assessment of intensive care unit-acquired weakness in young and old mice:an E.coli septic peritonitis model[J]. Muscle & Nerve, 2016, 53(1): 127-133. |
| [7] |
Yang F, Wang N, Xu XZ, et al. Establishment of colonization model of Escherichia coli transformed with lux operon in mouse (Mus musculus) intestine[J]. Journal of Agricultural Biotechnology, 2014, 22(8): 925-932. 杨藩, 王宁, 徐西占, 等. 转lux基因簇大肠杆菌在小鼠肠道内定植模型的建立[J]. 农业生物技术学报, 2014, 22(8): 925-932. |
| [8] |
Mallick EM, McBee ME, Vanguri VK, et al. A novel murine infection model for Shiga toxin-producing Escherichia coli[J]. The Journal of Clinical Investigation, 2012, 122(11): 4012-4024. |
| [9] |
Boetius Hertz F, Lbner-Olesen A, Frimodt-Mller N. Antibiotic selection of Escherichia coli sequence type 131 in a mouse intestinal colonization model[J]. Antimicrobial Agents and Chemotherapy, 2014, 58(10): 6139-6144. |
| [10] |
Dai XZ, Liang XL, Qiu Q. Isolation and identification of bacteria from biofilm with culture medium of low nutrient concentration[J]. Microbiology China, 2010, 37(7): 951-955. 代先祝, 梁晓丽, 邱勤. 低营养浓度培养基分离培养生物膜中的细菌及其鉴定[J]. 微生物学通报, 2010, 37(7): 951-955. |
| [11] |
Dong XZ, Cai MY. Identification Manual of Common Bacterial Systems[M]. Beijing: Science Press, 2001, 370-391. 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001, 370-391. |
| [12] |
Xiong HM, Wei BQ, Wei RJ, et al. Calculation of median lethal dose (LD50) for Yersinia pestis by SPSS package[J]. Chinese Journal of Zoonoses, 2013, 29(11): 1127-1130. 熊浩明, 魏柏青, 魏荣杰, 等. 用SPSS软件计算鼠疫菌半数致死量(LD50)[J]. 中国人兽共患病学报, 2013, 29(11): 1127-1130. DOI:10.3969/cjz.j.issn.1002-2694.2013.11.020 |
| [13] |
Buchanan RE, Gibbons NR. Bergey's Manual of Determinative Bacteriology[M]. 8th ed. Baltimore: Williams & Wilkins, 1974.
|
| [14] |
Han ZS, Yang CS, Li QW, et al. Study on reprodution physiology and repoduction performance in musk deer (Moschus berezovskii)[J]. Journal of Northwest Sci-Tech University of Agriculture and Forestry (Natural Science Edition), 2003, 31(6): 103-106. 韩增胜, 杨长锁, 李青旺, 等. 林麝生殖生理和繁殖性能观察研究[J]. 西北农林科技大学学报:自然科学版, 2003, 31(6): 103-106. |
| [15] |
Liu Y, Sui LH, Zeng L, et al. Establishment of a mouse model of Escherichia coli O127 infection and real-time PCR detection of TGF-β1 expression[J]. Acta Laboratorium Animalis Scientia Sinica, 2013, 21(2): 13-16. 刘一, 隋丽华, 曾林, 等. BABL/c小鼠感染大肠杆菌O127模型的建立及TGF-β1因子的荧光定量检测[J]. 中国实验动物学报, 2013, 21(2): 13-16. |
| [16] |
von Kckritz-Blickwede M, Rohde M, Oehmcke S, et al. Immunological mechanisms underlying the genetic predisposition to severe Staphylococcus aureus infection in the mouse model[J]. The American Journal of Pathology, 2008, 173(6): 1657-1668. |
| [17] |
Cheng JP, Zou QM. The recent research of animal models of Escherichia coli O157:H7 infection[J]. Chinese Journal of Zoonoses, 2004, 20(11): 998-1000. 程建平, 邹全明. O157:H7大肠杆菌感染的动物模型研究近况[J]. 中国人兽共患病杂志, 2004, 20(11): 998-1000. DOI:10.3969/j.issn.1002-2694.2004.11.023 |
| [18] |
Liu XH, Xin DL, Hou AC, et al. Establishment of a mouse pneumonia model for Mycoplasma pncumoniae infection and alterations on the level of IFN-γ[J]. Chinese Journal of Zoonoses, 2004, 20(4): 284-287. 刘晓红, 辛德莉, 侯安存, 等. 小鼠肺炎支原体肺炎模型的建立及干扰素-γ的变化[J]. 中国人兽共患病杂志, 2004, 20(4): 284-287. |
| [19] |
Martins FS, Vieira AT, Elian SDA, et al. Inhibition of tissue inflammation and bacterial translocation as one of the protective mechanisms of Saccharomyces boulardii against Salmonella infection in mice[J]. Microbes and Infection, 2013, 15(4): 270-279. |
| [20] |
Renois F, Jacques J, Guillard T, et al. Preliminary investigation of a mice model of Klebsiella pneumoniae subsp.ozaenae induced pneumonia[J]. Microbes and Infection, 2011, 13(12/13)): 1045-1051. |
| [21] |
Li QB, Yan QG, Kang JP, et al. Isolation and identification of purulent bacteria from forest musk deer (Moschus berezovskii)[J]. Chinese Journal of Wildlife, 2012, 33(4): 211-213. 李秋波, 颜其贵, 康纪平, 等. 麝化脓病细菌性病原诊断鉴定[J]. 野生动物, 2012, 33(4): 211-213. |
| [22] |
Sankaran RT, Mattana J, Pollack S, et al. Laboratory abnormalities in patients with bacterial pneumonia[J]. Chest, 1997, 111(3): 595-600. DOI:10.1378/chest.111.3.595 |
| [23] |
Liang RZ, Li YX, Zhang ZH. Analysis of white blood cell, glucose and C-reaction protein changes in pneumonia[J]. Laboratory Medicine and Clinic, 2012, 9(1): 3-4. 梁瑞珍, 黎运西, 张智洪. 肺炎患者白细胞、血糖和C反应蛋白的变化分析[J]. 检验医学与临床, 2012, 9(1): 3-4. |
| [24] |
Summermatter S, Santos G, Pérez-Schindler J, et al. Skeletal muscle PGC-1α controls whole-body lactate homeostasis through estrogen-related receptor α-dependent activation of LDH B and repression of LDH A[J]. Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(21): 8738-8743. DOI:10.1073/pnas.1212976110 |
| [25] |
Salomonsen CM, Boye M, Hiby N, et al. Comparison of histological lesions in mink with acute hemorrhagic pneumonia associated with Pseudomonas aeruginosa or Escherichia coli[J]. Canadian Journal of Veterinary Research, 2013, 77(3): 199-204. |
| [26] |
Luo Y, Cheng JG, Wang JM, et al. Histopathological observations of forest musk deer died in pneumonia and suppurative diseases[J]. Progress in Veterinary Medicine, 2009, 30(11): 122-123. 罗燕, 程建国, 王建明, 等. 林麝肺炎及化脓性疾病的病理组织学观察[J]. 动物医学进展, 2009, 30(11): 122-123. DOI:10.3969/j.issn.1007-5038.2009.11.030 |
| [27] |
Pilloux L, Casson N, Sommer K, et al. Severe pneumonia due to Parachlamydia acanthamoebae following intranasal inoculation:a mice Model[J]. Microbes and Infection, 2015, 17(11/12): 755-760. |
 2018, Vol. 45
2018, Vol. 45




