扩展功能
文章信息
- 梁新冉, 李乃荟, 周新刚, 杨洋, 吴宇琪, 吴凤芝
- LIANG Xin-Ran, LI Nai-Hui, ZHOU Xin-Gang, YANG Yang, WU Yu-Qi, WU Feng-Zhi
- 番茄根内促生放线菌的分离鉴定及其促生效果
- Isolation and identification of tomato-associated endophytic actinomyces and their potential for plant growth promotion
- 微生物学通报, 2018, 45(6): 1314-1322
- Microbiology China, 2018, 45(6): 1314-1322
- DOI: 10.13344/j.microbiol.china.170645
-
文章历史
- 收稿日期: 2017-08-15
- 接受日期: 2017-12-07
- 网络首发日期(www.cnki.net): 2017-12-21
2. 哈尔滨工业大学建筑学院 黑龙江 哈尔滨 150001
2. School of Architecture, Harbin Institute of Technology, Harbin, Heilongjiang 150001, China
植物体内普遍存在一定数量的内生菌,在自然生态系统中寄主植物与内生菌是和谐共生的,这些内生菌可以提高寄主植物的抗逆性并促进其生长[1]。植物内生菌指的是可以在寄主植物的细胞内或细胞间隙中定殖,并且能与寄主植物共生的一类微生物[2]。目前关于植物内生菌的概念被广泛认可的是Hallann在1977年结合实践所提出[3],植物内生菌是指可以直接从植物体内获得或者经过表面消毒即可从植物组织中分离得到,而且不引起寄主明显病症的微生物。植物内生放线菌作为内生菌的重要类群,在植物中广泛存在,并且可能产生新型的活性产物[4]。这些内生放线菌其全部或者部分生活周期在植物组织内占据一定的生态位点,对寄主植物的健康生长起到至关重要的作用[5-6]。
与根围放线菌相比,植物内生放线菌可以在寄主植物体内独立分裂繁殖和传递,在植物体内占据稳定的生存空间,不易受环境条件的影响,具有独特的优势。同时,内生放线菌还会为寄主植物的生长营造一个适宜的生理环境[7]。目前,研究报道从植物根内分离得到促生放线菌对植物生长发育起到促进作用,如黄瓜[8]、柑橘[9]、苦菜[10]、番茄[11]等。Verma等[12]从表面消毒处理的印度苦楝树根组织内分离出3株具有促生作用的放线菌,而且均可以产生吲哚乙酸(IAA)和铁载体;Rungin等[13]从水稻根内分离出一株只产生铁载体的放线菌,也能很大程度上提高植物的生物质量、株高和根长。一般认为这些根内促生放线菌是通过产生某些次生代谢物质(如生长素)来促进植物生长[14],或者改变土壤中某些营养元素的形态,使其可以被植物同化吸收(如溶磷、铁载体),进而促进植物的生长发育。
本研究采用组织研磨培养法和放线菌分离培养基从表面消毒的番茄根内分离出菌株NEAU-D1,对该菌株产IAA、铁载体以及是否具有溶解难溶性磷酸盐的能力进行了测定,经过形态学观察和16S rRNA基因序列分析,菌株NEAU-D1被初步鉴定为链霉菌属。将菌株NEAU-D1接种于番茄和黄瓜盆栽试验中,进一步验证分析该菌株的促生效果,以便应用于后续的设施蔬菜多功能生物菌肥的研制与开发。
1 材料与方法 1.1 植物样品采集番茄植株采自黑龙江省双城市双城蔬菜实验基地,选取设施番茄连作地块上长势较好的结果期番茄植株用于内生放线菌的分离。
1.2 培养基(1) CPA分离培养基[15];(2)高氏一号培养基[16];(3) CAS检测培养基[17];(4) ISP3纯化培养基(g/L):燕麦片20.0 (煮沸30 min,使用四层无菌纱布过滤并将滤液加水补至1 L),KNO3 0.2,MgSO4 0.2,K2HPO4 0.5;(5) TSB培养基(g/L):大豆蛋白胨5.0,胰蛋白胨1.5,氯化钠5.0;(6) PKO液体培养基(g/L):葡萄糖10.0,硫酸铵0.5,MgSO4·7H2O 0.3,氯化钠0.3,氯化钾0.3,FeSO4·7H2O 0.036,MnSO4·4H2O 0.03,磷酸三钙2.0,磷酸铝2.0,磷酸锌2.0,磷酸铁2.0。
1.3 样品预处理带土采集番茄植株样品,去除番茄地上部组织,将根组织装入无菌袋后封口,贴上标签,带回实验室进行根内放线菌的分离。将取回的番茄样品室温干燥24 h,超声波处理15 min,用以去除表面泥土及附着的细菌。然后将超声后的样品用灭菌滤纸吸去表面水分。
1.4 表面消毒及检测将预处理后的样品切成5-10 mm左右的小段,进行7步表面消毒[18]:(1)用含放线菌酮(100 mg/L)和萘啶酮酸(20 mg/L)的水溶液处理1 min;(2)用无菌水冲洗3遍;(3)用5% NaClO冲洗5 min;(4)用2.5% Na2S2O3冲洗10 min;(5)用75%乙醇冲洗5 min;(6)无菌水冲洗3遍;(7) 10% NaHCO3冲洗10 min。将表面消毒后的样品放入烘箱100 ℃干燥15 min。同时取0.2 mL最后一遍清洗植物样品的水涂布于ISP3固体培养基上,28 ℃培养3-7 d,观察是否有菌长出,进行消毒效果检测。
1.5 内生放线菌的初步分离将经过表面消毒后的样品,每100 mg与1 mL无菌水混合,用研钵充分研磨,直至研磨成匀浆,4 ℃沉降10-20 min,取上清液涂布于放线菌分离培养基CPA (含有50 mg/L的放线菌酮和50 mg/L的萘啶酮酸)上,28 ℃培养7 d。挑取不同形态的放线菌菌落,经多次平板划线纯化后接种于高氏一号斜面培养基上,4 ℃保存备用。
1.6 菌株促生特性检测 1.6.1 菌株产IAA能力的测定菌株产IAA能力参照Glickmann和Dessaux[19]的方法进行测定,以空白培养基为对照,溶液变成粉红色表示有IAA产生。采用Salkowski比色法进一步测定菌株产生IAA的含量,IAA标准溶液(0、0.5、1.0、5.0、10.0、15.0、20.0、25.0 mg/L)与Salkowski试剂反应测出的标准曲线计算单位体积发酵液中IAA的含量。
1.6.2 菌株产铁载体能力测定菌株产铁载体能力测定参照陈绍兴[17]的方法,制作通用CAS检测平板。将具有产IAA能力的菌株接种于通用CAS检测平板上,28 ℃暗培养2-7 d。根据菌株是否在通用检测平板上产生明显的橙黄色的铁载体螯合圈,判断菌株是否具有产铁载体的能力。
1.6.3 菌株溶磷能力测定将具有高产IAA能力以及产铁载体能力的菌株分别接种于4种难溶性磷酸盐[20]的PKO液体培养基中,28 ℃、150 r/min振荡培养48 h,1 500 r/min离心2-3 min,取5 mL上清液与磷标准溶液(0、0.1、0.2、0.3、0.4、0.5 mg/L)均使用钼锑抗比色法定量测定其磷产量,从而测定菌株对4种难溶性磷酸盐(磷酸三钙、磷酸锌、磷酸铁、磷酸铝)的溶解能力。
1.7 菌株鉴定具有促生特性菌株的菌落形态及生理生化特征鉴定参照《伯杰细菌鉴定手册(第8版)》进行。16S rRNA基因序列测定参照曹鹏[18]的方法进行,将获得序列提交到NCBI的GenBank数据库,BLAST比对,与数据库中的已知序列进行同源性分析,运用MEGA 6.0软件生成N-J进化树。
1.8 菌株苗期盆栽的促生效果盆栽试验在东北农业大学设施工程中心人工气候室中进行,采取拌土法接种。将NEAU-D1菌株接种于液体发酵培养基中,28 ℃、125 r/min培养7 d,将菌液在10 000 r/min离心15 min,之后用无菌水重悬3次离心,并使用无菌水对菌液浓度进行调节[21],平板稀释涂布测定菌液浓度,以108 CFU/kg将培养的菌株均匀拌入无菌商品基质中,备用。取长势、大小一致的两叶一心的番茄和黄瓜幼苗栽种于装有200 g上述商品基质的花盆中,以等量无菌水处理的无菌商品基质作为对照,每个处理3次重复,每个重复10盆。于25 ℃的人工气候室中进行培养,每天浇灌等量的无菌水,待生长30 d后测定根长、株高、植株鲜重、植株干重。数据使用SAS 9.2进行了方差分析(ANOVA),采用最小显著差异法(Tukey)对不同处理间的差异进行比较。
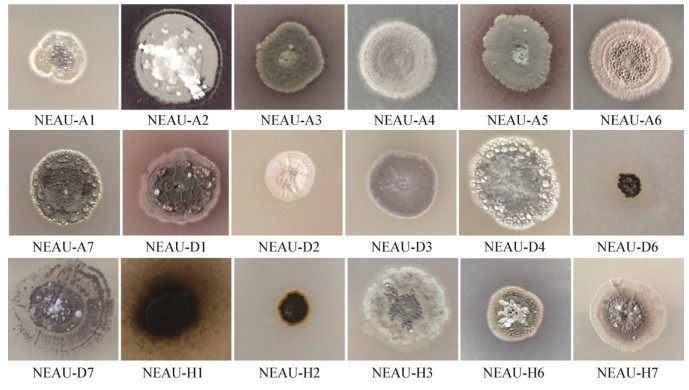
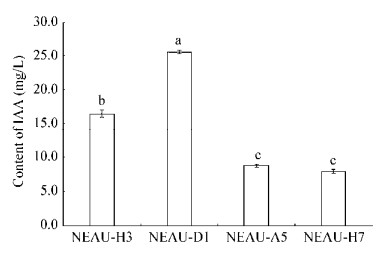
2 结果与分析 2.1 不同菌株产IAA能力分离获得的番茄根内放线菌共18株(图 1),其中4株菌能够产生IAA,分别命名为NEAU-H3、NEAU-D1、NEAU-A5和NEAU-H7。结果表明,NEAU-D1产生的IAA量高达25.56±0.24 mg/L,显著高于菌株NEAU-H3、NEAU-A5和NEAU-H7 (图 2)。因此,对该菌株进行后续研究。
|
| 图 1 18株内生放线菌的菌落形态 Figure 1 Colony morphology of 18 endophytic actinomycete strains |
|
|
|
| 图 2 不同菌株产IAA的能力 Figure 2 Estimation of IAA production of different strains 注:每个处理3次重复;柱状图上不同小写字母代表在0.05水平上差异显著。 Note: Experiments were repeated three times. Columns with different letters indicate significant differences at P < 0.05. |
|
|
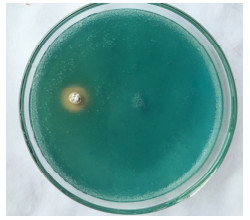
将菌株NEAU-D1接种到通用CAS检测培养基上,在培养48 h后菌株周围出现明显橙黄色晕圈(图 3),根据其橙黄色晕圈的大小可以判定其产铁载体的能力大小,说明该菌株具有产铁载体的能力。
|
| 图 3 菌株NEAU-D1产铁载体的CAS检测 Figure 3 CAS assay of the siderophore-producing of strain NEAU-D1 |
|
|
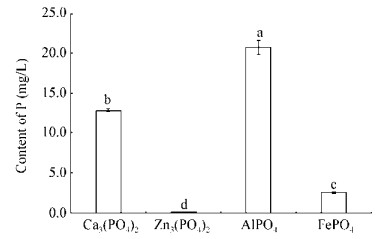
在液体摇瓶中菌株NEAU-D1可以溶解难溶性的磷酸盐——磷酸三钙[Ca3(PO4)2]、磷酸铁(FePO4)、磷酸铝(AlPO4)、磷酸锌[Zn3(PO4)2],其中菌株NEAU-D1对溶解磷酸铝的能力显著高于磷酸三钙、磷酸铁和磷酸锌,溶解磷酸铝的能力达20.76±0.90 mg/L;其次是磷酸三钙,溶解能力达12.90±0.19 mg/L显著高于其溶解磷酸铁和磷酸锌的量;菌株NEAU-D1对磷酸铁的溶解能力达2.56±0.09 mg/L,显著高于溶解磷酸锌的能力;该菌株对磷酸锌的溶解能力较弱,为0.15±0.01 mg/L (图 4)。
|
| 图 4 菌株NEAU-D1对难溶磷酸盐的溶解效果 Figure 4 Solubilization effects of NEAU-D1 strain on insoluble phosphates in liquid medium 注:每个处理3次重复;柱状图上不同小写字母代表在0.05水平上差异显著。 Note: Experiments were repeated three times. Columns with different letters indicate significant differences at P < 0.05. |
|
|
对所分离菌株的促生特性测定表明,菌株NEAU-D1具有产IAA和铁载体的能力,能溶解4种难溶性的磷酸盐,具有一定的研究价值。对菌株NEAU-D1进行革兰氏染色、过氧化氢酶、硝酸盐还原等表型特性检测(表 1),菌株NEAU-D1在ISP3培养基上菌落形成凸起,不透明,产生色素,菌落边缘带有不规则的灰色。
| 项目 Items | 结果 Results |
| 革兰氏染色 Gram stain | + |
| 好氧性试验 Aerobic test | + |
| V-P试验 V-P test | - |
| 甲基红(M.R.)反应 Methylred reaction | + |
| 淀粉水解 Starch hydrolysis | - |
| 明胶液化 Glutinhydrolyzation | - |
| 硝酸盐还原 Nitratereduced nitrite | - |
| 可溶性色素 Soluble pigment | + |
| 注:+:阳性;-:阴性. Note: +: Positive; -: Negative. |
|
由图 5可知,菌株NEAU-D1与Streptomyces violaceolatus DSM 40438和Streptomyces humiferus DSM 43030在同一分支,且其他相似性较高的菌株也都属于链霉菌属。因此菌株NEAU-D1很可能属于Streptomyces。菌株NEAU-D1的16S rRNA基因序列测序结果在GenBank中登录号为MF578943。

|
| 图 5 菌株NEAU-D1与其他相似典型菌株构建的系统发育树 Figure 5 Neighbour-Joining phylogenetic tree based on 16S rRNA gene sequences of strain NEAU-D1 and the similarity type species 注:发育树节点的数值表示Bootstrap值;标尺0.001表示序列差异的分支长度;括号内数值为GenBank数据库的登录号. Note: Numbers at note present bootstrap percentages; Bar 0.001 nucleotide divergence; Those in parentheses are GenBank accession numbers. |
|
|
结合促生特性试验,将菌株NEAU-D1作用于盆栽促生试验中,接种菌株NEAU-D1的番茄和黄瓜幼苗均表现出一定的促生作用。菌株NEAU-D1处理的番茄根长、株高、全株鲜重、全株干重比对照增加9%、23%、47%和92%,差异显著(图 6,表 2)。菌株NEAU-D1处理的黄瓜根长、株高、全株鲜重、全株干重比对照增加43%、47%、134%和58% (图 6,表 3)。

|
| 图 6 菌株NEAU-D1处理番茄和黄瓜的盆栽促生效果 Figure 6 Plant growth-promoting effect of strains NEAU-D1 on tomato and cucumber 注:A和B为菌株NEAU-D1对番茄的盆栽促生效果;C和D为菌株NEAU-D1对黄瓜的盆栽促生效果. CK为对照(未接种菌株NEAU-D1处理). Note: A and B: Plant growth-promoting effect of strains NEAU-D1 on tomato; C and D: Plant growth-promoting effect of strains NEAU-D1 on cucumber. CK: Uninoculated strain NEAU-D1. |
|
|
| 处理 Treatment |
NEAU-D1 | CK | 增加率 Increasing ratio (%) |
| 根长 Root height (cm) |
12.01±0.33 a | 10.99±0.34 b | 9 |
| 株高 Shoot height (cm) |
30.43±0.68 a | 24.71±0.28 b | 23 |
| 全株鲜重 Fresh weight (g) |
5.28±0.22 a | 3.58±0.18 b | 47 |
| 全株干重 Dry weight (g) |
0.92±0.07 a | 0.48±0.03 b | 92 |
| 注: CK:未接菌空白培养基对照.表中数据表示平均值±标准偏差.同列数据后不同小写字母表示处理间在0.05水平差异显著. Note: CK: Seedling substrate inoculated with PDA medium. Values are means±standard error. Different letters in one column represent significant difference at 0.05 level. The same as follows. |
|||
| 处理 Treatment |
NEAU-D1 | CK | 增加率 Increasing ratio (%) |
| 根长 Root height (cm) |
15.93±1.31 a | 11.16±0.60 b | 43 |
| 株高 Shoot height (cm) |
19.36±0.49 a | 13.21±0.74 b | 47 |
| 全株鲜重 Fresh weight (g) |
14.76±0.59 a | 6.31±0.64 b | 134 |
| 全株干重Dry weight (g) | 1.31±0.04 a | 0.83±0.03 b | 58 |
本研究从设施番茄连作土壤上生长的番茄根内分离出18株放线菌,对其进行促生特性测定,筛选出了菌株NEAU-D1,能够显著促进番茄苗期高生长和生物量积累。菌株NEAU-D1产IAA的量为25.56 mg/L,高于Qin等[22-23]从植物组织中分离的内生链霉菌KLBMP 5084所产生的IAA量(8.24 mg/L),以及Verma等[12]从印度苦楝树根内分离出的3株链霉菌所产生的IAA的量(9.22–13.73 mg/L)。菌株NEAU-D1不仅可以分泌大量的IAA,而且产生铁载体的能力同样很强。微生物分泌的铁载体可以给自身提供可利用的铁源,同样产生的过量的铁载体而造成相对高铁浓度的小生境,有利于其他利用同源铁载体的植物生长[24]。此外,该菌株对不同的难溶磷源具有不同程度的溶解能力,具有较广的“溶磷谱”,尤其对磷酸铝和磷酸三钙具有较强的溶解能力。土壤难溶磷矿物50%以上以磷酸钙的形态存在,其次为磷酸铁、磷酸铝[25],因此菌株NEAU-D1在活化土壤难溶性磷酸钙、磷酸铝中发挥重要作用。在菌株NEAU-D1处理的番茄和黄瓜的苗期盆栽试验中,菌株NEAU-D1处理的植株表现出显著的促生长作用。植株根长、株高以及干鲜重增长显著,且叶色浓绿,叶片大。菌株NEAU-D1对番茄和黄瓜幼苗的促生作用表明其具有重要的应用潜力。
国内外大量研究表明,具有促进植物生长作用的微生物,其作用机理为通过分泌植物激素、溶磷、产生铁载体等途径促进植物生长[26],与寄主互作的结构密切相关。本研究仅对菌株NEAU-D1在番茄和黄瓜幼苗生长的影响上进行了测定,其相关促生作用机制有待进一步研究。将菌株重新引入复杂的自然生境,是否能适应并有效定殖及促生作用也需要进一步探讨。
综上所述,菌株NEAU-D1在IAA产生、合成铁载体及溶解多种磷矿物方面都表现出较好的特性,对番茄和黄瓜幼苗的促生作用明显,筛选出的菌株NEAU-D1有望应用于设施蔬菜多功能生物肥料的开发。下一步将开展该菌株作为微生物肥料的研发,并进行大田促生试验研究。当然,这些菌株的促生机理尚待进一步研究。
4 结论本研究从设施番茄连作的地块上生长的番茄根内分离筛选获得一株对番茄和黄瓜均具有促生作用的菌株NEAU-D1。在苗期盆栽试验中,菌株NEAU-D1处理的幼苗其株高、根长和植株干鲜重均具有显著优势,且多项苗期生长指标均表现出稳定的促生作用。具有产IAA、溶多种磷矿物和产铁载体的能力,结合形态、生理生化特征和16S rRNA基因序列分析,初步鉴定菌株NEAU-D1为链霉菌属放线菌(Streptomyces sp.)。
| [1] |
Schulz B, Boyle C. What are endophytes?[A]//Schulz BJE, Boyle CJC, Sieber TN. Microbial Root Endophytes[M]. Berlin Heidelberg: Springer, 2006: 1-13
|
| [2] |
Stone JK, Bacon CW, White JF Jr. An overview of endophytic microbes: endophytism defined[A]//Bacon CW, White JF Jr. Microbial Endophytes[M]. New York: Marcel Dekker, 2000, 3-29
|
| [3] |
Okazaki T. Studies on Actinomycetes isolated from plant leaves[J]. Annual Report of Sankyo Research Laboratories, 1995, 47: 97-106. |
| [4] |
Qin S, Xing K, Jiang JH, et al. Biodiversity, bioactive natural products and biotechnological potential of plant-associated endophytic actinobacteria[J]. Applied Microbiology and Biotechnology, 2011, 89(3): 457-473. DOI:10.1007/s00253-010-2923-6 |
| [5] |
Sturz AV, Christie BR, Nowak J. Bacterial endophytes: potential role in developing sustainable systems of crop production[J]. Critical Reviews in Plant Sciences, 2000, 19(1): 1-30. DOI:10.1080/07352680091139169 |
| [6] |
Lodewyckx C, Vangronsveld J, Porteous F, et al. Endophytic bacteria and their potential applications[J]. Critical Reviews in Plant Sciences, 2002, 21(6): 583-606. DOI:10.1080/0735-260291044377 |
| [7] |
Kunoh H. Endophytic actinomycetes: attractive biocontrol agents[J]. Journal of General Plant Pathology, 2002, 68(3): 249-252. DOI:10.1007/PL00013084 |
| [8] |
Shimizu M, Yazawa S, Ushijima Y. A promising strain of endophytic Streptomyces sp. for biological control of cucumber anthracnose[J]. Journal of General Plant Pathology, 2009, 75(1): 27-36. DOI:10.1007/s10327-008-0138-9 |
| [9] |
Shutsrirung A, Chromkaew Y, Pathom-Aree W, et al. Diversity of endophytic actinomycetes in mandarin grown in northern Thailand, their phytohormone production potential and plant growth promoting activity[J]. Soil Science and Plant Nutrition, 2013, 59(3): 322-330. DOI:10.1080/00380768.2013.776935 |
| [10] |
Ma Z, Hui L, Liu C, et al. Streptosporangium sonchi sp. nov. two novel actinobacteria isolated from a root of common sowthistle (Sonchus oleraceus L.) and a millipede (Kronopolites svenhedind Verhoeff)[J]. Antonie van Leeuwenhoek, 2015, 107(6): 1491-1499. DOI:10.1007/s10482-015-0443-1 |
| [11] |
Cao P, Liu CX, Sun PY, et al. An endophytic Streptomyces sp. strain DHV3-2 from diseased root as a potential biocontrol agent against Verticillium dahliae and growth elicitor in tomato (Solanum lycopersicum)[J]. Antonie van Leeuwenhoek, 2016, 109(12): 1573-1582. DOI:10.1007/s10482-016-0758-6 |
| [12] |
Verma VC, Singh SK, Prakash S. Bio-control and plant growth promotion potential of siderophore producing endophytic Streptomyces from Azadirachta indica A. Juss[J]. Journal of Basic Microbiology, 2011, 51(5): 550-556. DOI:10.1002/jobm.v51.5 |
| [13] |
Rungin S, Indananda C, Suttiviriya P, et al. Plant growth enhancing effects by a siderophore-producing endophytic streptomycete isolated from a Thai jasmine rice plant (Oryza sativa L. cv. KDML105)[J]. Antonie van Leeuwenhoek, 2012, 102(3): 463-472. DOI:10.1007/s10482-012-9778-z |
| [14] |
Ma Y, Prasad MNV, Rajkumar M, et al. Plant growth promoting rhizobacteria and endophytes accelerate phytoremediation of metalliferous soils[J]. Biotechnology Advances, 2011, 29(2): 248-258. DOI:10.1016/j.biotechadv.2010.12.001 |
| [15] |
Guan XJ. Effect of biocontrol stain NEAU-Da4 on the endophytic actinobacteria of the soybean and identification of specific actinobacteria[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2016 (in Chinese) 关雪娇. 生防菌NEAU-Da4对大豆内生放线菌的影响及特异放线菌鉴定[D]. 哈尔滨: 东北农业大学硕士学位论文, 2016 |
| [16] |
Shen P, Fan XR, Li GW. Microbiology Experiment[M]. 3rd ed. Beijing: Higher Education Press, 1999, 69-82. 沈萍, 范秀容, 李广武. 微生物学实验[M]. 3版. 北京: 高等教育出版社, 1999, 69-82. |
| [17] |
Chen SX. Analysis of the biosynthesis conditions and characteristics of siderophores from Pseudomonas sp. SPF-1[D]. Wuhan: Master's Thesis of Wuhan University, 2005 (in Chinese) 陈绍兴. 假单胞菌SPF-1产铁载体条件及其铁载体性质研究[D]. 武汉: 武汉大学硕士学位论文, 2005 |
| [18] |
Cao P. Isolation and identification of a strain of tomato endophytic Actinomycetes against Verticillium dahlia[D]. Harbin: Master's Thesis of Northeast Agricultural University, 2016 (in Chinese) 曹鹏. 一株抗黄萎病的番茄内生放线菌的分离、筛选和鉴定[D]. 哈尔滨: 东北农业大学硕士学位论文, 2016 |
| [19] |
Glickmann E, Dessaux Y. A critical examination of the specificity of the salkowski reagent for indolic compounds produced by phytopathogenic bacteria[J]. Applied and Environmental Microbiology, 1995, 61(2): 793-796. |
| [20] |
Yang H, Fan BQ, Gong MB, et al. Isolation and identification of a novel phosphatedissolving strain P21[J]. Acta Microbiologica Sinica, 2008, 48(1): 51-56. 杨慧, 范丙全, 龚明波, 等. 一株新的溶磷草生欧文氏菌的分离、鉴定及其溶磷效果的初步研究[J]. 微生物学报, 2008, 48(1): 51-56. |
| [21] |
Passari AK, Mishra VK, Gupta VK, et al. In vitro and in vivo plant growth promoting activities and DNA fingerprinting of antagonistic endophytic actinomycetes associates with medicinal plants[J]. PLoS One, 2015, 10(9): e0139468. DOI:10.1371/journal.pone.0139468 |
| [22] |
Qin S, Zhang YJ, Yuan B, et al. Isolation of ACC deaminase-producing habitat-adapted symbiotic bacteria associated with halophyte Limonium sinense (Girard) Kuntze and evaluating their plant growth-promoting activity under salt stress[J]. Plant Soil, 2014, 374(1/2): 753-766. |
| [23] |
Qin S, Feng WW, Wang TT, et al. Plant growth-promoting effect and genomic analysis of the beneficial endophyte Streptomyces sp. KLBMP 5084 isolated from halophyte Limonium sinense[J]. Plant Soil, 2017, 416(1/2): 117-132. |
| [24] |
Zhao X, Chen SX, Xie ZX, et al. Isolation, identification and over-siderophores production of Pseudomonas fluorescens sp-f[J]. Acta Microbiologica Sinica, 2006, 46(5): 691-695. 赵翔, 陈绍兴, 谢志雄, 等. 高产铁载体荧光假单胞菌Pseudomonas fluorescens sp-f的筛选鉴定及其铁载体特性研究[J]. 微生物学报, 2006, 46(5): 691-695. |
| [25] |
Yuan KN. The Soil Chemistry of Plant Nutrition Elements[M]. Beijing: Science Press, 1983. 袁可能. 植物营养元素的土壤化学[M]. 北京: 科学出版社, 1983. |
| [26] |
Guo F, Jiang XG, Huang BL, et al. Inoculation of growth-promoting rhizobacteria on seedlings of Pinus massoniana[J]. Guangxi Forestry Science, 2013, 42(1): 71-76. 郭飞, 蒋雪刚, 黄宝灵, 等. 促生菌接种马尾松育苗试验[J]. 广西林业科学, 2013, 42(1): 71-76. |
 2018, Vol. 45
2018, Vol. 45




