扩展功能
文章信息
- 葛安辉, 方萍, 熊超, 张丽梅, 贺纪正
- GE An-Hui, FANG Ping, XIONG Chao, ZHANG Li-Mei, HE Ji-Zheng
- 联合固氮菌叶面接种剂的优化及其在玉米叶际的定殖
- Optimization of liquid inoculant of a nitrogen-fixing bacterium and its colonization on maize phyllosphere
- 微生物学通报, 2017, 45(6): 1303-1313
- Microbiology China, 2017, 45(6): 1303-1313
- DOI: 10.13344/j.microbiol.china.170623
-
文章历史
- 收稿日期: 2017-08-08
- 接受日期: 2017-12-01
- 网络首发日期(www.cnki.net): 2017-12-26
2. 浙江大学环境与资源学院 浙江 杭州 310058;
3. 中国科学院大学 北京 100049
2. College of Environmental & Resource Science of Zhejiang University, Hangzhou, Zhejiang 310058, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
氮素是陆地生态系统中最重要且限制作物生长的元素之一[1]。近20多年来,伴随着产量的提高,我国农业氮肥年投入比1990年增加了44%,达2 362万t[2],但我国主要粮食作物的氮肥平均利用率只有约28%-41%[3],每年因挥发、淋洗、径流等原因造成的氮肥流失量约占施用量的40%以上[4]。过量的氮肥投入不仅造成土壤酸化和水体富营养化,还会产生氮氧化物加剧全球变暖,造成一系列的生态环境问题[3, 5-7]。为此,国家"十三五"规划制定了氮肥总量调控并推进绿色发展的目标,以期能够提高氮肥利用率并避免造成环境污染。
自然状况下,大气氮素可以通过氮沉降和生物固氮作用进入陆地生态系统[8],其中生物固氮占自然氮输入的97%[9]。根据固氮微生物与植物的关系,生物固氮可分为共生固氮、自生固氮和联合固氮,后二者统称非共生固氮(Non-symbiotic nitrogen fixation)。与共生固氮菌具有宿主专一性相比,非共生固氮菌的宿主范围较广,在自然生态系统中广泛存在,且能够与小麦、玉米等禾本科植物联合固氮,对生态系统的氮素供应起着重要作用[10]。此外,非共生固氮菌还可以通过分泌生长激素、促进溶磷和秸秆降解、增强抗病性和抗逆境等间接作用促进植物生长[11],一直作为重要的根际促生菌被应用于农业生产。但固氮菌接种剂接种到土壤后,由于受土著微生物的竞争、土壤抑制物质和环境条件的变化等影响,接种的固氮菌很难找到合适的生态位,使得接种效果并不稳定,难以推广使用[12-13]。
叶际是植物叶片表面组成的生境,也泛指叶、茎、花、果等植物的地上部,是微生物包括细菌、真菌、酵母和原生动物等栖居的重要场所[14-16],其中细菌丰度最高可达106-107 cells/(cm2·leaf)[15]。据估计,地球上叶片表面积大约是地球表面积的2倍[17],由于叶际生境巨大,定殖在叶际的微生物对宿主植物抵御病害、生长促进和固氮,甚至生态系统氮输入等方面均有重要影响[18-19]。已有研究表明,叶附生固氮微生物是热带雨林中有效氮的重要来源,对于全球氮循环有重要意义[20-22]。同时,相比于土壤环境,叶际生境相对简单[15],将固氮菌接种剂接种到叶际,使其在叶际定殖以提高植物固氮效率,这将是固氮菌剂推广应用的一个新思路。研究适宜固氮菌生长和叶际定殖的接种剂或添加剂,及其在叶际上的生长定殖将为固氮菌剂在叶际的应用提供参考信息。
作为具有粘附和保水性能但无生物毒性的化合物,羧甲基纤维素(CMC)和甘油(Gly)常被用于接种剂中以增强其使用效果[23-24],作为液体接种剂的添加剂有望促进菌体在叶面的附着和定殖。因此,本研究以实验室前期筛选到的一株有较高固氮酶活性的菌株W12为研究对象,考察了不同浓度羧甲基纤维素(CMC)和甘油(Gly)对菌株W12生长曲线和固氮酶活性的影响。在此基础上,选择对菌株W12生长无影响但能促进固氮活性的添加剂浓度制成液体接种剂,并考察了不同贮藏方式下接种剂有效活菌数随时间的变化。在此基础上,研究了温室和野外条件下叶面喷施接种剂后菌株W12在玉米叶际的定殖情况和接种剂对宿主植物的促进生长效应,以探索固氮菌叶际接种的可行性。
1 材料与方法 1.1 供试菌株及培养条件供试菌株为分离自棉花根际的变栖克雷伯氏菌(Klebsiella variicola)菌株W12,-80 ℃长期保存,使用前于改良的Döbereiner低氮培养基[25]上活化后挑取单菌落。该培养基不加蛋白胨为无氮培养基,加0.2 g/L蛋白胨为低氮培养基,在该低氮固体培养基上培养24 h后,菌株W12形成直径约2 mm大的半透明菌落,在无氮培养基上需48 h左右形成类似大小的菌落。为方便快速制备接种剂和进行回收计数,本研究均采用低氮培养基进行培养。
1.2 主要试剂和仪器PBS磷酸缓冲液(g/L):KH2PO4 0.27,Na2HPO4 1.42,NaCl 8.0,KCl 0.2,调节pH至7.2。PCR仪,Eppendorf公司;紫外可见分光光度计,北京普析通用仪器有限责任公司;气相色谱仪,Agilent Technologies有限公司;连续流动分析仪,SEAL公司;凯氏定氮仪,北京三品科创仪器有限公司。
1.3 菌株W12的16S rRNA和nifH基因的扩增和测序分别以细菌通用引物27F/1492R和固氮菌nifH基因特异引物IGK3/DVV对菌株W12的16S rRNA和nifH基因进行PCR扩增[26-27]。16S rRNA基因的PCR条件为:94 ℃ 10 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 1.5 min,35个循环;72 ℃ 10 min。nifH基因的PCR条件为:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 5 min。PCR扩增产物经琼脂糖凝胶电泳后进行切胶回收纯化,纯化后送去测序。将测序结果进行BLAST分析,选取部分相似性较高的序列用MEGA 7.0进行多重比较分析并通过邻近法(Neighbor-Joining method)建立系统发育树,自展值为1 000。
1.4 液体接种剂的配方优化为提高液体接种剂的叶面粘附能力,选取2种具有粘附性和表面活性的物质作为添加剂。将含0.1%、0.3%、0.5%羧甲基纤维素(CMC)和含1%、2%、3%甘油的低氮培养液分装到50 mL离心管中,每管10 mL,同时设置不含添加剂和含添加剂不接种的对照组,每组3个重复。按2%接种量接种活化的菌液,接种后于30 ℃条件下恒温静置培养[25] (之前的研究表明该菌株在静置条件下比摇床培养生长更好),分别在6、12、24、36、48和72 h后用分光光度计在400 nm波长下测量光密度值(OD400),以未接种的不同浓度CMC或甘油处理的低氮培养液为空白参比。
乙炔还原法测定固氮酶活性。将含0.1%、0.3%、0.5% CMC和含1%、2%、3%甘油的低氮培养液分装于250 mL厌氧瓶中,每瓶20 mL,设置空白对照组,每组3个重复。按2%接种量接种活化的菌液,在30 ℃培养48 h后将瓶塞换成不透气的橡胶塞,从瓶内抽出20 mL气体,再注入20 mL乙炔。继续培养48 h后,从培养瓶中抽取气样,用气相色谱仪进行检测,记录乙烯峰面积,根据乙烯峰面积与乙烯浓度的标准曲线计算乙烯的浓度。
1.5 接种剂的贮藏方式和有效时间基于1.4的实验结果,选择对菌株W12生长没有抑制作用且固氮酶活性较高的添加剂浓度,将不含添加剂的培养液接种菌株W12培养48 h后6 000 r/min离心20 min,收集菌体并悬浮于含添加剂的PBS缓冲液中制成接种剂,浓缩体积为原来的一半,并设置不含添加剂的接种剂对照。对接种剂进行不同贮藏方式和有效时间的试验:(1) 25 ℃条件下保存不含添加剂的接种剂;(2) 4 ℃条件下保存不含添加剂的接种剂;(3) 4 ℃条件下保存含0.3% CMC的接种剂;(4) 4 ℃条件下保存含2%甘油的接种剂。分别在0、7、15、30、60、90 d对保存的液体接种剂进行稀释涂平板计数。每个处理设置3组重复。
1.6 玉米盆栽试验和叶际固氮菌回收用于玉米盆栽试验的土壤分别采自河南许昌和湖南祁阳,对应的土壤类型为潮土(Fluvo-aquic soil)和酸性红壤(Red soil)。土壤基本性质是:潮土pH为7.18,氨态氮和硝态氮浓度分别为5.51 mg/kg和27.14 mg/kg;红壤的pH为4.43,氨态氮和硝态氮浓度分别为7.33 mg/kg和44.44 mg/kg。盆栽试验过程:称取每盆土干重约2 kg,播种后保持盆栽内足够的水分,每隔一段时间测定其株高。盆栽不施底肥且玉米生长期内不施肥。分别在三叶期和大喇叭口期将接种剂以无菌PBS缓冲液稀释10倍后对玉米叶面进行喷施,并添加CMC或甘油使稀释后的接种剂与原接种剂含有相同的添加剂浓度。设置5个处理:(1)不接菌;(2)喷含0.3% CMC的接种剂;(3)喷含2%甘油的接种剂;(4)只喷含0.3% CMC的PBS溶液;(5)只喷含2%甘油的PBS溶液。每个处理设置3盆重复。玉米生长130 d后,采集叶片和少量茎部组织,剪碎混匀后每盆选取约5 g置于100 mL灭菌的PBS缓冲液中,200 r/min条件下振摇5 min,然后超声波振荡5 min,使微生物与叶片充分分离[18, 28],并在低氮培养基上进行稀释涂平板计数。
1.7 大田玉米试验为全面考察固氮菌叶面接种在大田的试验效果,在位于河南许昌的潮土上进行田间接种试验。试验始于2016年春,设置了5个处理,分别为:(1)不施氮肥(CK);(2)当地习惯用肥(N);(3)当地习惯用肥量减20%氮量(80% N);(4)当地习惯用肥量减20%氮量并喷固氮菌接种剂基质(含2%甘油的生理盐水溶液) (80% N+Gly);(5)当地习惯用肥量减20%氮量并喷固氮菌接种剂(80% N+W12)。试验小区的大小为24 m2,每个处理设置3个重复小区,小区处理随机排列。分别在玉米四叶期和大喇叭口期时将接种剂用生理盐水稀释10倍后对玉米叶面进行喷施。在第1次喷施1、30、70 d后采集植株中部的叶片,按照1.6中的方法用低氮培养基回收固氮菌。在玉米收获时用凯氏定氮法测定玉米叶片、茎和籽粒的含氮量,并计算玉米产量。将获得的数据使用SPSS 18.0进行统计分析,显著性差异通过单因素方差分析获得,图表制作使用Origin Pro8.0。
2 结果与分析 2.1 菌株系统发育分析对菌株W12 16S rRNA基因及nifH基因测序和聚类分析显示(图 1),该菌株与变栖克雷伯氏菌(Klebsiella variicola)的16S rRNA基因序列相似性达99%,与nifH基因相似性达97%,可以确定该菌株为变栖克雷伯氏菌。变栖克雷伯氏菌为2004年定义的新种,属于肠杆菌科(Enterobacteriaceae)克雷伯氏菌属(Klebsiella),具有固氮能力,在植物组织中大量存在[29]。我们之前的研究也表明,该菌株对环境因子的适应性较强,并具有较高的生长速率和固氮酶活性[25]。

|
| 图 1 基于16S rRNA基因(A)和nifH基因(B)构建的菌株系统发育树 Figure 1 Phylogenetic trees of strain W12 based on 16S rRNA gene (A) and nifH gene (B) 注:括号内的序号为菌株GenBank登录号; 分支点上的数字为自展值,即1 000次重复抽样聚到一起的百分比,低于50的未显示; 标尺代表系统发育树分支距离单位. Note: Numbers in brackets represent GenBank accession numbers; The number of the nodes means the bootstrap value, representing the percentage of occurrence in 1 000 replications, the value lower than 50 has been deleted; The scale bar means branch distance unit of phylogenetic tree. |
|
|
添加不同浓度CMC和甘油培养条件下,菌株W12的生长曲线如图 2A所示,在低氮培养液中,含添加剂的菌株W12生长曲线与对照组类似,在很短的时间内进入对数生长期,且稳定期持续时间较长。在生长稳定期后(24 h后)添加CMC的处理中菌体OD400值较对照相比有增加的趋势,而添加2%和3%甘油的处理组与对照相比OD400值有一定程度降低,但总体来说差异不显著,表明添加CMC和甘油对菌株W12的生长无明显促进或抑制作用。

|
| 图 2 添加剂对菌株W12生长曲线(A)和固氮酶活性(B)的影响 Figure 2 Impacts of CMC and glycerol addition on the growth curve (A) and nitrogenase activity (B) of strain W12 in liquid media |
|
|
添加不同浓度CMC和甘油培养后,菌株W12的平均固氮酶活性分别提高了3.7倍和24.2倍。除0.1% CMC处理组外,其他处理组与对照组都有显著性差异,且添加甘油处理组的平均固氮酶活性达61 083 nmol C2H4/mL菌液,显著高于CMC的处理组(9 264 nmol C2H4/mL) (P < 0.05),表现出极高的促进效果(图 2B)。综合以上2个因素,分别选择0.3% CMC和2.0%甘油作为最终的添加剂浓度用于后续试验。
2.2.2 接种剂贮藏时间的检验液体培养的菌液经离心浓缩制备成接种剂后,贮存于不同温度条件下,分别在0、7、15、30、60、90 d以低氮培养基进行活菌计数,结果如图 3所示。接种剂经过90 d的贮藏后,4种保存方式剩余的活菌数都大量减少。在4 ℃条件下保存的3个处理组剩余活菌数都高于1.0×108 CFU/mL,而25 ℃条件下约为1.7×107 CFU/mL。同时,4 ℃和4 ℃添加2%甘油处理组剩余活菌数显著高于4 ℃添加0.3% CMC处理组(P < 0.05)。因此贮藏温度是影响接种剂剩余活菌数的主要因素,低温(4 ℃)或添加2.0%甘油后低温贮藏可以最大限度地延长接种剂有效期。

|
| 图 3 不同贮藏方式下固氮菌接种剂的保存期限 Figure 3 The shelf life of inoculant stored at different conditions |
|
|
以潮土和酸性红壤对玉米进行盆栽种植,并在三叶期和大喇叭口期进行接种剂喷施,在距离最后一次喷施40 d (玉米生长130 d)后,利用低氮培养基对叶际微生物进行平板稀释计数,结果如图 4所示。在低氮培养基上培养1-2 d后,菌株W12能形成表面光滑有凸起的圆形菌落,半透明,直径约2-5 mm,在平板上回收到的其他细菌菌落直径小于1 mm且呈乳白色,根据此特征可将菌株W12与其他叶际微生物区分。从图 4A可知,菌株W12能够在叶际成功定殖,在玉米生长至130 d时仍能检测到相当数量的菌落,且数量远远高于其他处理组和对照组,达到4.3×105 CFU/g叶片,而未接种菌株W12的处理组在低氮培养基上也能回收到少量和菌株W12具有相似特征的菌落。接种菌株W12的处理中回收到的W12类似菌约占所有可培养固氮菌的31.41%,成为叶际的优势固氮菌种;而未接种的处理组,W12类似菌只占玉米叶际可培养固氮菌的2.49%。接种剂喷施后,处理组的株高与对照组相比虽然有增加的趋势,但是统计性检验不显著。

|
| 图 4 菌株W12在盆栽玉米叶际的定殖密度(A)与所占比例(B) Figure 4 The amount of W12-similar bacteria recovered from maize leaves (A) and its proportion among all culturable bacteria (B) on the phyllosphere in pot experiment |
|
|
在河南许昌潮土上进行大田试验结果表明,在接种剂喷施次日,喷施固氮菌处理的玉米叶片回收到的W12类似菌密度可达6.8×106 CFU/g叶片;在30 d后,其密度下降至8.2×104 CFU/g叶片,显著低于喷施初始时的密度(图 5A)。接种剂喷施70 d后,低氮培养基上回收到的W12类似菌和其他菌显著高于喷施30 d后回收到的数量,分别为1.7×105 CFU/g叶片和1.4×106 CFU/g叶片(图 5B)。无论是30 d还是70 d,喷施固氮菌处理中回收到的W12类似菌显著高于无W12菌剂喷施的处理,在未喷施W12处理中分别为1.9×103 CFU/g叶片和5.5×104 CFU/g叶片,而同一采样时期不同处理回收到的其他菌数量之间没有显著差异(图 5B)。
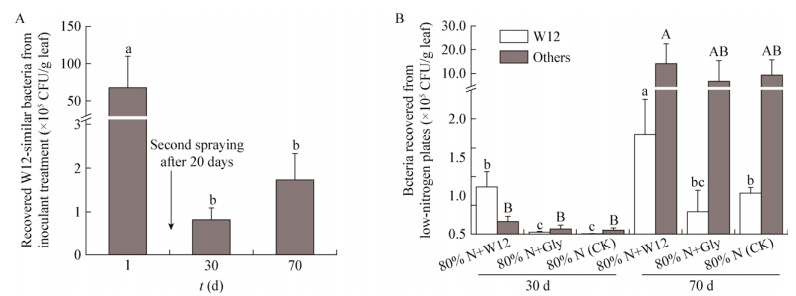
|
| 图 5 大田喷施接种剂不同时间后W12在叶际的定殖数量 Figure 5 The amount of W12-similar bacteria recovered from maize phyllosphere after application in field |
|
|
对玉米收获时产量和植株不同部位含氮量的测定结果表明,常规施肥的处理产量达12.4 t/hm2,稍高于其他减氮和未施氮的处理(11.0-11.6 t/hm2),但不同处理产量的差异不显著(图 6A)。由图 6B可知,接种W12的处理中玉米籽粒和茎部的含氮量分别为6.0 g/kg和16.0 g/kg,显著高于其他减氮处理(80% N和80% N+Gly);叶片的含氮量为5.5 g/kg,与其他处理相比虽然有所增加,但是未达到显著性水平。同时,接种W12的处理与常规施肥的处理相比,籽粒含氮量之间没有显著性差异,而茎部和叶片的含氮量高于常规施肥的处理。

|
| 图 6 大田玉米产量(A)与植株不同部位含氮量(B) Figure 6 The grain yield (A) and nitrogen content (B) in different parts of maize in field |
|
|
接种剂是具有生物活性的制剂,为了保持足够的接种浓度,常需要选择合适的添加剂为细菌提供适宜的微环境和物理防护[13]。添加剂通常可以提高接种剂的粘度、稳定性、表面活性、功效和分散性[13]。羧甲基纤维素(CMC)是一种非离子型的水溶性纤维素,较易获得且价格较低,常被用作添加剂和粘附剂[13, 30]。甘油因具有粘性和吸水性,能够保护细胞免于干燥,常用于接种剂中以延长保存时间[13, 23, 31]。因此,我们选择CMC和甘油作为固氮菌的备选添加剂,实验结果表明这2种添加剂都可以显著提高菌株W12的固氮酶活性。
乙炔还原法是测量微生物固氮酶活性常用的方法,其测得的结果是一种累积效应。一方面,添加剂可能会刺激固氮基因的表达,使得固氮酶数量增加;另一方面,活细胞数量的积累同样可以增加固氮酶的数量。一般认为,固氮微生物能够利用添加的碳源,从而提高其固氮酶活性[32-33]。CMC和甘油也是一种碳源,但本文中所用添加剂对菌株W12固氮酶活性提高的原因仍然需要进一步的实验验证。类似地,Aeron等[34]在接种剂中添加CMC,结果表明CMC能提高接种植物的固氮酶活性并且增加植物的结瘤数量,说明CMC具有生物刺激作用;Elegba等[35]利用CMC作为粘合剂也得出了类似的结论。Gibson等[36]通过在不同培养基中培养根瘤菌(Rhizobium sp.)菌株32H1,发现添加甘油可以使其固氮酶活性持续更长的时间。这些结论与本文的研究结果说明CMC和甘油可以作为添加剂用于接种剂中以提高接种剂的使用功效,但CMC和甘油促进固氮菌酶活的分子机制还不清楚,将来需要从基因表达水平层面深入研究。
3.2 液体接种剂的贮藏条件接种剂在不同条件下的保存实验结果显示,温度是影响接种剂剩余活菌数的主要因素,4 ℃低温条件下更有利于接种剂的贮藏,这与许多研究结果相一致[37-39]。《农用微生物菌剂》质量标准(GB20287-2006)中要求液体接种剂的有效活菌数不低于2.0×108 CFU/mL,保质期不少于3个月[40]。本研究中不添加甘油或添加2%甘油处理组在4 ℃保存90 d后,活菌数仍达(4.0-6.0)×108 CFU/mL接种剂,符合国家标准。此外,在4 ℃条件下,在接种剂中加2.0%甘油和不含甘油的对照处理活菌数无显著差异,而添加0.3% CMC处理组在前30天内能使接种剂的剩余活菌数保持在较高的水平,显著高于其他3个处理组和对照组,但随着保存时间的延长,该处理中剩余活菌数低于4 ℃对照和加2.0%甘油的处理,说明添加CMC不利于接种剂长期保存,加甘油与否对接种剂保存也无特别影响。
接种剂的贮藏时间是接种剂实际应用的主要挑战之一[13]。目前,液体接种剂的保存方法主要有低温和添加剂等,提高接种剂中微生物浓度也可以延长其有效时间[13]。例如,Singleton等[41]通过添加甘油等制备液体接种剂,提高了根瘤菌的生长速率和接种剂的贮藏时间。此外,接种剂在运输和使用过程中环境条件变化剧烈,容易造成有效活菌数的减少,因此,液体接种剂的运输条件(如温度条件)需要更多的关注[13]。
3.3 菌株W12在叶际的定殖和应用效果为了验证固氮菌接种剂在叶际的定殖能力和应用效果,我们分别进行了盆栽和大田试验。在叶面喷施接种后,盆栽和大田玉米叶际回收到的W12类似菌在所有可培养固氮菌中分别占31.4%和15.1%,已经成为玉米叶际固氮菌的优势种。表明菌株W12经过一段时间后在叶际成功定殖。未接种的对照处理组叶际回收到的W12类似菌数量显著低于接种处理组,但仍然存在一定数量,可能是在接种剂喷施过程中造成污染或由于环境因素的作用而使菌株W12移到了未接种的玉米植株上。此外,虽然从叶际分离的W12类似菌具有与菌株W12相同的培养特征,但不能完全肯定其就是菌株W12,因此W12菌株特异性引物和检测方法的建立,是下一步需要进行的工作。
接种剂处理后的大田玉米籽粒和茎部的含氮量显著高于其他减氮处理,表明接种剂能够提高植物的氮素营养供应,但是玉米产量增加的统计性效应不显著,这与许多其他的接种剂试验结果类似。张英等[42]的研究表明,对小白菜接种联合固氮菌后,小白菜的产量有增加的趋势,但多数生长指标与对照组相比并未达到显著性差异;方萍等[43]应用固氮螺菌(Azosprillum brasilense) NO40在水稻上进行接种试验,接种后水稻株高、秸秆干重及叶绿素含量等都有增加,但水稻的增产效果未达到显著水平。这可能主要由于土壤条件的异质性、环境条件的变化、土著微生物的竞争以及土壤氮素水平、氧气含量等因素影响了菌株的接种效果[12-13],尤其土壤结合态氮的含量增加会显著抑制固氮菌酶活,使细菌固氮能力降低[12]。目前农田氮肥投入普遍存在过量现象[44],以至于固氮菌的促生效果不明显。我们在大田中进行的试验结果也发现,由于前期投入的肥料过多,即使一季不施氮肥(CK处理)或进行减氮处理(80% N),对作物的产量影响都不大,因此,对固氮菌剂的应用效果评估仍需要进行长期观测。同时,叶际也可能存在大量其他固氮微生物对氮素固定和促进植物生长产生作用,因此将来需要结合运用同位素示踪和微生物分子生态学技术手段,区分接种剂和叶际土著固氮菌对植物氮素输入的相对贡献,以综合考察固氮菌剂叶面应用推广的可行性,并探讨促进其应用效果的技术和方法。
致谢: 衷心感谢河南农业大学李培培老师、吴传发同学等在潮土大田试验布置和管理中给予的帮助和支持。| [1] |
Berthrong ST, Yeager CM, Gallegos-Graves L, et al. Nitrogen fertilization has a stronger effect on soil nitrogen-fixing bacterial communities than elevated atmospheric CO2[J]. Applied and Environmental Microbiology, 2014, 80(10): 3103-3112. DOI:10.1128/AEM.04034-13 |
| [2] |
National Bureau of Statistics of China. National data[DB/OL]. [2017-06-08]. http://data.stats.gov.cn/easyquery.htm?cn=C01 (in Chinese) 中华人民共和国国家统计局. 国家数据[DB/OL]. [2017-06-08]. http://data.stats.gov.cn/easyquery.htm?cn=C01 |
| [3] |
Zhu ZL, Chen DL. Nitrogen fertilizer use in China–contributions to food production, impacts on the environment and best management strategies[J]. Nutrient Cycling in Agroecosystems, 2002, 63(2/3): 117-127. DOI:10.1023/A:1021107026067 |
| [4] |
Huang GQ, Wang XX, Qian HY, et al. Negative impact of inorganic fertilizes application on agricultural environment and its countermeasures[J]. Ecology and Environment, 2004, 13(4): 656-660. 黄国勤, 王兴祥, 钱海燕, 等. 施用化肥对农业生态环境的负面影响及对策[J]. 生态环境, 2004, 13(4): 656-660. |
| [5] |
Guo JH, Liu XJ, Zhang Y, et al. Significant acidification in major Chinese croplands[J]. Science, 2010, 327(5968): 1008-1010. DOI:10.1126/science.1182570 |
| [6] |
Erisman JW, Bleeker A, Galloway J, et al. Reduced nitrogen in ecology and the environment[J]. Environmental Pollution, 2007, 150(1): 140-149. DOI:10.1016/j.envpol.2007.06.033 |
| [7] |
Hu HW, Chen DL, He JZ. Microbial regulation of terrestrial nitrous oxide formation: understanding the biological pathways for prediction of emission rates[J]. FEMS Microbiology Reviews, 2015, 39(5): 729-749. DOI:10.1093/femsre/fuv021 |
| [8] |
Cusack DF, Silver W, McDowell WH. Biological nitrogen fixation in two tropical forests: ecosystem-level patterns and effects of nitrogen fertilization[J]. Ecosystems, 2009, 12(8): 1299-1315. DOI:10.1007/s10021-009-9290-0 |
| [9] |
Galloway JN, Townsend AR, Erisman JW, et al. Transformation of the nitrogen cycle: recent trends, questions, and potential solutions[J]. Science, 2008, 320(5878): 889-892. DOI:10.1126/science.1136674 |
| [10] |
Saikia SP, Jain V. Biological nitrogen fixation with non-legumes: an achievable target or a dogma?[J]. Current Science, 2007, 92(3): 317-322. |
| [11] |
Kennedy IR, Choudhury ATMA, Kecskés ML. Non-symbiotic bacterial diazotrophs in crop-farming systems: can their potential for plant growth promotion be better exploited?[J]. Soil Biology and Biochemistry, 2004, 36(8): 1229-1244. DOI:10.1016/j.soilbio.2004.04.006 |
| [12] |
Zhang LM, Fang P, Zhu RQ. Recent advances in research and application of associated nitrogen-fixation with graminaceous plants[J]. Chinese Journal of Applied Ecology, 2004, 15(9): 1650-1654. 张丽梅, 方萍, 朱日清. 禾本科植物联合固氮研究及其应用现状展望[J]. 应用生态学报, 2004, 15(9): 1650-1654. |
| [13] |
Bashan Y, De-Bashan LE, Prabhu SR, et al. Advances in plant growth-promoting bacterial inoculant technology: formulations and practical perspectives (1998-2013)[J]. Plant and Soil, 2014, 378(1/2): 1-33. |
| [14] |
Vacher C, Hampe A, Porté AJ, et al. The phyllosphere: microbial jungle at the plant–climate interface[J]. Annual Review of Ecology, Evolution, and Systematics, 2016, 47: 1-24. DOI:10.1146/annurev-ecolsys-121415-032238 |
| [15] |
Lindow SE, Brandl MT. Microbiology of the phyllosphere[J]. Applied and Environmental Microbiology, 2003, 69(4): 1875-1883. DOI:10.1128/AEM.69.4.1875-1883.2003 |
| [16] |
Pan JG, Hu Q, Qi HY, et al. Advance in the research of phyllospheric microorganism[J]. Acta Ecologica Sinica, 2011, 31(2): 583-592. 潘建刚, 呼庆, 齐鸿雁, 等. 叶际微生物研究进展[J]. 生态学报, 2011, 31(2): 583-592. |
| [17] |
Vorholt JA. Microbial life in the phyllosphere[J]. Nature Reviews Microbiology, 2012, 10(12): 828-840. DOI:10.1038/nrmicro2910 |
| [18] |
Rico L, Ogaya R, Terradas J, et al. Community structures of N2-fixing bacteria associated with the phyllosphere of a Holm oak forest and their response to drought[J]. Plant Biology, 2014, 16(3): 586-593. DOI:10.1111/plb.2014.16.issue-3 |
| [19] |
Knief C, Ramette A, Frances L, et al. Site and plant species are important determinants of the Methylobacterium community composition in the plant phyllosphere[J]. The ISME Journal, 2010, 4(6): 719-728. DOI:10.1038/ismej.2010.9 |
| [20] |
Fürnkranz M, Wanek W, Richter A, et al. Nitrogen fixation by phyllosphere bacteria associated with higher plants and their colonizing epiphytes of a tropical lowland rainforest of Costa Rica[J]. The ISME Journal, 2008, 2(5): 561-570. DOI:10.1038/ismej.2008.14 |
| [21] |
Wanek W, Pörtl K. Phyllosphere nitrogen relations: reciprocal transfer of nitrogen between epiphyllous liverworts and host plants in the understorey of a lowland tropical wet forest in Costa Rica[J]. New Phytologist, 2005, 166(2): 577-588. DOI:10.1111/j.1469-8137.2005.01319.x |
| [22] |
Abril AB, Torres PA, Bucher EH. The importance of phyllosphere microbial populations in nitrogen cycling in the Chaco semi-arid woodland[J]. Journal of Tropical Ecology, 2005, 21(1): 103-107. DOI:10.1017/S0266467404001981 |
| [23] |
Manikandan R, Saravanakumar D, Rajendran L, et al. Standardization of liquid formulation of Pseudomonas fluorescens Pf1 for its efficacy against Fusarium wilt of tomato[J]. Biological Control, 2010, 54(2): 83-89. DOI:10.1016/j.biocontrol.2010.04.004 |
| [24] |
Viji G, Uddin W, Romaine CP. Suppression of gray leaf spot (blast) of perennial ryegrass turf by Pseudomonas aeruginosa from spent mushroom substrate[J]. Biological Control, 2003, 26(3): 233-243. DOI:10.1016/S1049-9644(02)00170-6 |
| [25] |
Zhang LM. Selection and identification of an associative nitrogen-fixing bacterium strain with high efficiency and investigation of its physiological characteristics and of its inoculation effects[D]. Hangzhou: Master's Thesis of Zhejiang University, 2002 (in Chinese) 张丽梅. 高效联合固氮菌的筛选、鉴定及其生理生化特征和接种效应研究[D]. 杭州: 浙江大学硕士学位论文, 2002 |
| [26] |
Suzuki MT, Giovannoni SJ. Bias caused by template annealing in the amplification of mixtures of 16S rRNA genes by PCR[J]. Applied and Environmental Microbiology, 1996, 62(2): 625-630. |
| [27] |
Gaby JC, Buckley DH. A comprehensive evaluation of PCR primers to amplify the nifH gene of nitrogenase[J]. PLoS One, 2012, 7(7): e4214. |
| [28] |
Zhou Y, Qiao XW, Wang J, et al. Extraction methods of microorganisms from phyllosphere[J]. Bulletin of Botanical Research, 2006, 26(2): 233-237. 周育, 乔雄梧, 王静, 等. 植物叶际微生物提取方法研究[J]. 植物研究, 2006, 26(2): 233-237. |
| [29] |
Rosenblueth M, Martínez L, Silva J, et al. Klebsiella variicola, a novel species with clinical and plant-associated isolates[J]. Systematic and Applied Microbiology, 2004, 27(1): 27-35. DOI:10.1078/0723-2020-00261 |
| [30] |
Jha CK, Saraf M. Evaluation of multispecies plant-growth- promoting consortia for the growth promotion of Jatropha curcas L.[J]. Journal of Plant Growth Regulatio, 2012, 31(4): 588-598. DOI:10.1007/s00344-012-9269-5 |
| [31] |
Taurian T, Anzuay MS, Angelini JG, et al. Phosphate-solubilizing peanut associated bacteria: screening for plant growth-promoting activities[J]. Plant and Soil, 2010, 329(1/2): 421-431. |
| [32] |
Gupta V, Roper MM. Protection of free-living nitrogen-fixing bacteria within the soil matrix[J]. Soil and Tillage Research, 2010, 109(1): 50-54. DOI:10.1016/j.still.2010.04.002 |
| [33] |
Bandyopadhyay A, Stöckel J, Min HT, et al. High rates of photobiological H2 production by a cyanobacterium under aerobic conditions[J]. Nature Communications, 2010, 1: 139. DOI:10.1038/ncomms1139 |
| [34] |
Aeron A, Khare E, Arora NK, et al. Practical use of CMC-amended rhizobial inoculant for Mucuna pruriens cultivation to enhance the growth and protection against Macrophomina phaseolina[J]. The Journal of General and Applied Microbiology, 2012, 58(2): 121-127. DOI:10.2323/jgam.58.121 |
| [35] |
Elegba MS, Rennie RJ. Effect of different inoculant adhesive agents on rhizobial survival, nodulation, and nitrogenase (acetylene-reducing) activity of soybeans (Glycine max (L.) Merrill)[J]. Canadian Journal of Soil Science, 1984, 64(4): 631-636. DOI:10.4141/cjss84-063 |
| [36] |
Gibson AH, Scowcroft WR, Child JJ, et al. Nitrogenase activity in cultured Rhizobium sp. strain 32H1: nutritional and physical considerations[J]. Archives of Microbiology, 1976, 108(1): 45-54. DOI:10.1007/BF00425092 |
| [37] |
Lei XY. Study on the preparation technology of active lyophilized agent of Lactobacillus[D]. Chongqing: Master's Thesis of Southwest University, 2013 (in Chinese) 雷欣宇. 乳酸菌活性干燥菌剂制备工艺的研究[D]. 重庆: 西南大学硕士学位论文, 2013 |
| [38] |
Deaker R, Roughley RJ, Kennedy IR. Legume seed inoculation technology—a review[J]. Soil Biology and Biochemistry, 2004, 36(8): 1275-1288. DOI:10.1016/j.soilbio.2004.04.009 |
| [39] |
Sivasakthivelan P, Saranraj P. Azospirillum and its formulations: a review[J]. International Journal of Microbiological Research, 2013, 4(3): 275-287. |
| [40] |
General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of China. GB 20287-2006 Microbial inoculants in agriculture[S]. Beijing: Standards Press of China, 2006 (in Chinese) 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB 20287-2006农用微生物菌剂[S]. 北京: 中国标准出版社, 2006 |
| [41] |
Singleton P, Keyser H, Sande E. Development and evaluation of liquid inoculants[A]//Herridge D. Inoculants and Nitrogen Fixation of Legumes in Vietnam[M]. Canberra: Australian Centre for International Agricultural Research, 2002: 52-66
|
| [42] |
Zhang Y, Fang H, Chen L, et al. Effects of associated rhizosphere nitrogen-fixing bacteria on pakchoi (Brassica campestris ssp. chinensis L.) and lettuce (Lactuca sativa L.)[J]. Acta Agriculturae Shanghai, 2000, 16(4): 70-73. 张英, 方华, 陈磊, 等. 联合固氮菌对小白菜和莴苣的使用效果[J]. 上海农业学报, 2000, 16(4): 70-73. |
| [43] |
Fang P, Zhang LM, Jia XM, et al. Effects of inoculation with tropical rice associative N2-fixing bacteria Azospirillum brasilense NO40 in the red paddy soil[J]. Journal of Zhejiang University (Agriculture & Life Sciences), 2001, 27(1): 33-36. 方萍, 张丽梅, 贾小明, 等. 固氮螺菌(Azosprillum brasilense) NO40在红壤性水稻土上的接种效应[J]. 浙江大学学报:农业与生命科学版, 2001, 27(1): 33-36. |
| [44] |
Lassaletta L, Billen G, Grizzetti B, et al. 50 year trends in nitrogen use efficiency of world cropping systems: the relationship between yield and nitrogen input to cropland[J]. Environmental Research Letters, 2014, 9(10): 105011. DOI:10.1088/1748-9326/9/10/105011 |
 2017, Vol. 45
2017, Vol. 45




