扩展功能
文章信息
- 孟振祥, 李袁飞, 孙若琳, 金巍, 成艳芬, 朱伟云
- MENG Zhen-Xiang, LI Yuan-Fei, SUN Ruo-Lin, JIN Wei, CHENG Yan-Fen, ZHU Wei-Yun
- 三硝酸丙三酯对厌氧真菌和甲烷菌代谢产物、纤维水解酶活性及菌群丰度的影响
- Effects of nitroglycerin on the metabolic profile, fibrolytic enzyme activities and microbial abundance of anaerobic fungi and methanogens
- 微生物学通报, 2018, 45(6): 1295-1302
- Microbiology China, 2018, 45(6): 1295-1302
- DOI: 10.13344/j.microbiol.china.170710
-
文章历史
- 收稿日期: 2017-09-08
- 接受日期: 2017-12-27
- 网络首发日期(www.cnki.net): 2018-01-25
瘤胃甲烷的生成不仅是反刍动物摄入饲料能量的损失,还是重要的温室气体来源。因此,瘤胃甲烷减排一直是反刍动物营养研究领域的热点。近年来,小分子硝酸酯化合物的瘤胃甲烷抑制能力受到广泛关注。硝酸酯化合物主要是通过氧化甲烷菌的甲基辅酶M还原酶的活性中心,从而特异性地抑制甲烷菌的甲烷生成能力[1]。
系列研究表明硝酸酯化合物具有良好的瘤胃甲烷抑制效果[2-5],但这些研究主要关注了硝酸酯化合物对瘤胃甲烷菌、细菌和原虫的影响,鲜有研究关注这些化合物对瘤胃内主要纤维降解菌——厌氧真菌的影响。厌氧真菌是最先定殖到植物纤维组织上的瘤胃微生物之一,通过分泌一系列的纤维水解酶,结合其独特的假根系统,能够高效地降解植物细胞壁成分[6-9]。此外,厌氧真菌的主要代谢产物包括甲酸、乙酸、乙醇、乳酸、二氧化碳和氢气[10],其中甲酸、氢气和二氧化碳均是大部分甲烷菌合成甲烷的底物[11]。因此,厌氧真菌在瘤胃纤维降解和甲烷生成过程中起着重要作用。
本文利用厌氧真菌和甲烷菌共培养体系,简单模拟瘤胃内纤维降解甲烷生成的过程,这一系统能够为体外研究厌氧真菌和甲烷菌的代谢特点提供较贴近瘤胃内环境。因此,本文利用这一系统研究了NG对厌氧真菌和甲烷菌代谢产物、主要的纤维水解酶活性及菌群丰度的影响,为探讨硝酸酯化合物对厌氧真菌和瘤胃纤维降解的影响提供依据。
1 材料与方法 1.1 菌种来源厌氧真菌和甲烷菌均来源于南京农业大学消化道微生物研究室。厌氧真菌纯培养菌株是Piromyces sp. F1;厌氧真菌和甲烷菌共培养菌株是Piromyces sp. F1+Methanobrevibacter sp.。
1.2 主要试剂和仪器NG购于北京益民药业有限公司;偏磷酸、巴豆酸、磷酸二氢钾、磷酸和乙醇购于国药集团化学试剂有限公司;甲醇购于德国默克公司;3, 5-二硝基水杨酸购于上海麦克林生化科技有限公司;羧甲基纤维素钠、木聚糖和柠檬酸购于西格玛奥德里奇(上海)贸易有限公司;PBS缓冲液、十六烷基三甲基溴化铵(Cetyltrimethyl ammonium bromide, CTAB)、酚-氯仿-异戊醇和Tris-HCl缓冲液购于上海索莱宝生物科技有限公司;SYBR GREEN/ROX qPCR荧光定量试剂盒购于宝生物工程(大连)有限公司;所用引物均由上海英骏生物技术有限公司合成。气压转换仪,英国IGER公司;安捷伦高效气相色谱仪7890B、安捷伦高效液相色谱仪、气体所用色谱柱Porapak Q packing & MolSieve 5A packing及乳酸和甲酸所用色谱反相柱ZorbaxSB-Aq,安捷伦科技(中国)有限公司;乙酸和乙醇所用色谱柱FUSED SILICA,美国Supelco公司;Ecoscan 5 pH计,新加坡Eutech公司;FastPrep®-24 Instrument细胞壁破碎仪,美国MP Biomedicals公司;ABI 7500 Real-time PCR仪,赛默飞世尔科技(中国)有限公司。
1.3 培养基和试验设计培养基的配制参照朱伟云等[12]描述的方法。采用160 mL血清瓶和100 mL的发酵体系。每个发酵瓶含培养基95 mL,接种5 mL培养3 d的菌液(每毫升菌液中厌氧真菌ITS1基因拷贝数为0.5×106-1.0×106),底物添加量为1% (质量体积比,1 mm的粉碎稻草秸杆)。接种结束后,用气压转换仪平衡发酵瓶内气压,使初始气压为0,39 ℃下静置发酵96 h。
采用双因素四水平(2×4)试验设计,厌氧真菌纯培养及与甲烷菌共培养时均分别添加0.0、6.6、13.2和19.8 μmol/L NG。
1.4 总产气量总产气量的测定参照Theodorou等[13]的方法,用气压转换仪定时测定发酵瓶内产气量和甲烷。
1.5 发酵产物分析氢气和甲烷的测定参照Jin等[14]的方法,采用安捷伦高效气相色谱仪测定。汽化室温度为200 ℃,色谱柱(Porapak Q packing & MolSieve 5A packing)为毛细管柱,柱温80 ℃;TCD检测器:200 ℃;载气为N2。
发酵结束时利用Ecoscan 5 pH计测定发酵液pH,采集发酵液,–20 ℃保存备用。
乙酸和乙醇的测定参照Jin等[14]的方法,采用安捷伦高效气相色谱仪7890B测定。样品经偏磷酸酸化,内标为巴豆酸。汽化室温度为220 ℃;色谱柱为FUSED SILICA毛细管柱,柱温40 ℃,4 min;40-110 ℃,40 ℃/min;110 ℃,2 min;110-150 ℃,40 ℃/min;150 ℃,5 min梯度升温。氢离子火焰检测器FID:250 ℃,载气为N2。
乳酸和甲酸的测定参照李袁飞等[15]的方法,采用安捷伦高效液相色谱仪测定。色谱柱为反相柱ZorbaxSB-Aq。流动相KH2PO4溶液(20 mmol/L,pH 2.7,利用H3PO4调节)与甲醇的比例为99:1 (体积比)。紫外检测波长215 nm,柱温30 ℃。
厌氧真菌木聚糖酶和羧甲基纤维素酶活性检测参照Jin等[16]的3, 5-二硝基水杨酸法。反应体系含有10 mg可溶性木聚糖或羧甲基纤维素钠,1.8 mL柠檬酸-磷酸氢二钠缓冲液和0.2 mL经过稀释的发酵液上清液。在pH 6.0和50 ℃条件下,每分钟每毫升酶液释放1 μmol还原性糖为1个酶活单位[U/(min·mL)]。
1.6 DNA提取和Real-time PCRDNA提取参照Jin等[14]的方法,取发酵液1.5 mL,4 ℃、12 000×g离心10 min,利用PBS缓冲液(0.01 mol/L)清洗沉淀2次。沉淀加入1 mL CTAB,利用细胞壁破碎仪破碎细胞壁。酚-氯仿-异戊醇提取DNA,乙醇沉淀DNA。DNA最终溶于50 μmol/L Tris-HCl缓冲液。
甲烷菌和厌氧真菌定量的引物和方法参照Jin等[14]。构建20 μL反应体系:SYBR GREEN 10 μL,ROX Ⅱ 0.4 μL,正、反向引物(表 1,10 μmol/L)各0.4 μL,DNA模板2.0 μL,双蒸水6.8 μL。使用ABI 7500 Real-time PCR仪进行定量分析。荧光定量PCR反应条件:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 30 s;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,40个循环。
数据经Excel 2010初步整理后采用SPSS 20.0软件中的General linear model (Multivariate)进行分析,分析主效应和交互作用的影响,P < 0.05表示差异显著。
2 结果与分析 2.1 NG对总产气量、氢气、甲烷及pH值的影响如图 1所示,在共培养组中,添加6.6 μmol/L NG显著降低了总产气量和甲烷产量,导致氢气积累(P < 0.05),但pH未有显著变化(P > 0.05);在纯培养组中,添加6.6 μmol/L NG没有显著影响总产气量和氢气产量以及pH (P > 0.05);随着NG剂量的增加,共培养和纯培养组的总产气量和氢气产量均呈降低趋势,而pH值呈升高趋势;发酵体系和剂量水平的交互作用对总产气量有显著影响(P < 0.05),对氢气产量和pH无显著影响(P > 0.05)。

|
| 图 1 NG对气体产量和pH值的影响 Figure 1 The effect of NG on the production of gas and pH value 注:气体包括总产气量(A)、氢气(B)和甲烷(C). *:P < 0.05. Note: The production of gas includes total gas (A), hydrogen (B) and methane (C). *: P < 0.05. |
|
|
如图 2所示,在共培养组中,6.6 μmol/L NG显著降低了乙酸产量(P < 0.05),导致甲酸积累(P < 0.05),但对乙醇和乳酸产量没有显著影响(P > 0.05)。在纯培养组,6.6 μmol/L NG显著降低了甲酸、乙酸和乙醇产量(P < 0.05),但对乳酸产量没有显著影响(P > 0.05)。随着NG剂量的增加,共培养和纯培养组的甲酸、乙酸、乙醇和乳酸产量均呈下降趋势。发酵体系和剂量水平的交互作用对甲酸、乙酸和乙醇产量具有显著影响(P < 0.05),但对乳酸产量没有显著影响(P > 0.05)。
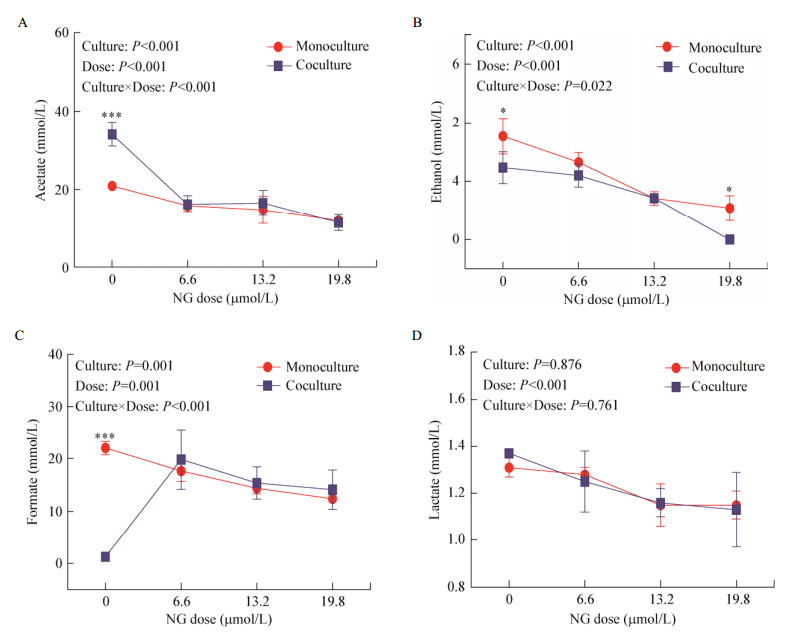
|
| 图 2 NG对有机酸和乙醇浓度的影响 Figure 2 The effect of NG on concentration of the organic acids and ethanol 注:A:乙酸;B:乙醇;C:甲酸;D:乳酸. *:P < 0.05;***:P < 0.001. Note: A: Acetate; B: Ethanol; C: Formate; D: lactate. *: P < 0.05; ***: P < 0.001. |
|
|
如图 3所示,在共培养和纯培养中,6.6 μmol/L NG均降低了木聚糖酶和羧甲基纤维素酶酶活性(P < 0.05)。随着NG剂量的增加,共培养和纯培养中的木聚糖酶和羧甲基纤维素酶酶活性均呈下降趋势(P < 0.05)。发酵体系和剂量水平的交互作用对木聚糖酶和羧甲基纤维素酶酶活性具有显著影响(P < 0.05)。

|
| 图 3 NG对酶活性的影响 Figure 3 The effect of NG on the activities of enzymes 注:A:木聚糖酶;B:羧甲基纤维素酶. *:P < 0.05;**:P < 0.01;***:P < 0.001. Note: A: Xylanase; B: CMCase. *: P < 0.05; **: P < 0.01; ***: P < 0.001. |
|
|
如图 4所示,在共培养中,6.6 μmol/L NG没有显著降低厌氧真菌和甲烷菌的丰度(P > 0.05)。在纯培养中,6.6 μmol/L NG也没有显著降低厌氧真菌的丰度(P > 0.05)。随着NG剂量的增加,在共培养和纯培养中,厌氧真菌和甲烷菌丰度均呈下降趋势。发酵体系和剂量水平的交互作用对厌氧真菌的丰度有显著影响(P < 0.05)。

|
| 图 4 NG对厌氧真菌(A)和甲烷菌(B)丰度的影响 Figure 4 The effect of NG on the abundances of anaerobic fungus (A) and methanogens (B) 注:*:P < 0.05;***:P < 0.001. Note: *: P < 0.05; ***: P < 0.001. |
|
|
在瘤胃中,厌氧真菌和甲烷菌之间存在着种间氢转移[19]。种间氢转移提高了这2种微生物的能量利用效率,同时使这2种微生物形成稳定的共生体系[16, 20]。在瘤胃这个复杂的生态系统中,无法排除细菌和原虫的干扰,不利于直接研究厌氧真菌和甲烷菌的生理活性和功能。然而,厌氧真菌和甲烷菌的体外共培养体系能够简单模拟瘤胃内主要的纤维降解产甲烷过程,使直接研究这2种微生物的生理活性和功能成为可能。因此,本文利用这一共培养体系研究了新型甲烷菌抑制剂NG对甲烷菌活性的抑制能力,同时评估了其对厌氧真菌活性的潜在影响。结果表明,NG能够抑制甲烷菌的活性。当共培养体系中的甲烷菌活性被抑制后,厌氧真菌的代谢变化与先前关于厌氧真菌与甲烷菌共培养的研究结果类似。Jin等[16]研究发现当用抗生素去除厌氧真菌和甲烷菌共培养体系中的甲烷菌后,总产气量、乙酸产量、木聚糖酶和羧甲基纤维素酶酶活性显著降低。Li等[21-22]对厌氧真菌纯培养和共培养代谢葡萄糖和木糖的研究也有相似的结果。共培养中的甲烷菌被抑制后,厌氧真菌产生的氢气和甲酸不能被利用合成甲烷,大量氢气积累,导致氢气反馈抑制厌氧真菌氢体内的乙酸和氢气代谢通路[23]。厌氧真菌的氢体是合成ATP的场所[10],氢体内的代谢被抑制,厌氧真菌能量生成减少,进而导致分泌的纤维水解酶减少,活性降低。
6.6 μmol/L NG的添加成功抑制了共培养中甲烷的生成,但也抑制了厌氧真菌的活性。Jin等[14]利用瘤胃体外模拟发酵研究NG对瘤胃发酵和微生物区系的影响发现,NG显著降低了甲烷生成量和甲烷菌丰度,但未显著影响细菌、原虫和厌氧真菌的丰度。本文结果可能与厌氧真菌纯菌对NG的抵抗较弱有关。
随着添加剂量的升高,NG对厌氧真菌的抑制作用增强。硝酸酯化合物的硝酸酯官能团具有较强的氧化性,能够将甲烷菌MCR活性中心的Ni(Ⅰ)氧化为Ni(Ⅱ)而使其失活[1],因此较高浓度NG可能会超出厌氧真菌的氧化还原修复能力而使菌体受到损伤。同时硝酸酯官能团能够被还原成亚硝酸盐,而亚硝酸盐对厌氧真菌可能也具有抑制作用,但具体机制仍需进一步研究。
综上所述,NG能够抑制甲烷菌的活性,但对厌氧真菌也有抑制作用,这种抑制作用随着剂量的升高而增强。
| [1] |
Duin EC, Wagner T, Shima S, et al. Mode of action uncovered for the specific reduction of methane emissions from ruminants by the small molecule 3-nitrooxypropanol[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(22): 6172-6177. DOI:10.1073/pnas.1600298113 |
| [2] |
Romero-Perez A, Okine EK, Guan LL, et al. Effects of 3-nitrooxypropanol on methane production using the rumen simulation technique (Rusitec)[J]. Animal Feed Science & Technology, 2015, 209: 98-109. |
| [3] |
Romero-Perez A, Okine EK, McGinn SM, et al. The potential of 3-nitrooxypropanol to lower enteric methane emissions from beef cattle[J]. Journal of Animal Science, 2014, 92(10): 4682-4693. DOI:10.2527/jas.2014-7573 |
| [4] |
Reynolds CK, Humphries DJ, Kirton P, et al. Effects of 3-nitrooxypropanol on methane emission, digestion, and energy and nitrogen balance of lactating dairy cows[J]. Journal of Dairy Science, 2014, 97(6): 3777-3789. DOI:10.3168/jds.2013-7397 |
| [5] |
Haisan J, Sun Y, Guan LL, et al. The effects of feeding 3-nitrooxypropanol on methane emissions and productivity of Holstein cows in mid lactation[J]. Journal of Dairy Science, 2014, 97(5): 3110-3119. DOI:10.3168/jds.2013-7834 |
| [6] |
Borneman WS, Hartley RD, Morrison WH, et al. Feruloyl and p-coumaroyl esterase from anaerobic fungi in relation to plant cell wall degradation[J]. Applied Microbiology & Biotechnology, 1990, 33(3): 345-351. |
| [7] |
Joblin KN, Naylor GE, Williams AG. Effect of Methanobrevibacter smithii on xylanolytic activity of anaerobic ruminal fungi[J]. Applied & Environmental Microbiology, 1990, 56(8): 2287-2295. |
| [8] |
Matsui H, Ushida K, Kojima Y. Fiber-digesting extracellular enzyme profiles of fungal lsolates Neocallimastix sp. P1 grown on five different carbohydrates[J]. Nihon Chikusan Gakkaiho, 1992, 63(8): 809-813. DOI:10.2508/chikusan.63.809 |
| [9] |
Gordon GLR, Phillips MW. Extracellular pectin lyase produced by Neocallimastix sp. LM1, a rumen anaerobic fungus[J]. Letters in Applied Microbiology, 1992, 15(3): 113-115. DOI:10.1111/j.1472-765X.1992.tb00740.x |
| [10] |
Boxma B, Voncken F, Jannink S, et al. The anaerobic chytridiomycete fungus Piromyces sp. E2 produces ethanol via pyruvate: formate lyase and an alcohol dehydrogenase E[J]. Molecular Microbiology, 2004, 51(5): 1389-1399. DOI:10.1046/j.1365-2958.2003.03912.x |
| [11] |
Tapio I, Snelling TJ, Strozzi F, et al. The ruminal microbiome associated with methane emissions from ruminant livestock[J]. Journal of Animal Science & Biotechnology, 2017, 8: 7. |
| [12] |
Zhu WY, Mao SY, Wang QJ, et al. Study on the screening of anaerobic fungi by in vitro fermentation[J]. Journal of Nanjing Agricultural University, 2001, 24(3): 44-48. 朱伟云, 毛胜勇, 王全军, 等. 厌氧真菌体外发酵筛选技术的研究[J]. 南京农业大学学报, 2001, 24(3): 44-48. |
| [13] |
Theodorou MK, Williams BA, Dhanoa MS, et al. A simple gas production method using a pressure transducer to determine the fermentation kinetics of ruminant feeds[J]. Animal Feed Science & Technology, 1994, 48(3/4): 185-197. |
| [14] |
Jin W, Meng ZX, Wang J, et al. Effect of nitrooxy compounds with different molecular structures on the rumen methanogenesis, metabolic profile, and methanogenic community[J]. Current Microbiology, 2017, 74(8): 891-898. DOI:10.1007/s00284-017-1261-7 |
| [15] |
Li YF, Sun MZ, Cheng YF, et al. Effects of associated methanogen on organic acid profile of glucose metabolism by anaerobic fungus revealed using high performance liquid chromatography[J]. Chinese Journal of Animal Nutrition, 2017, 29(4): 1198-1204. 李袁飞, 孙美洲, 成艳芬, 等. 高效液相色谱法测定瘤胃甲烷菌共存对厌氧真菌代谢葡萄糖产有机酸特性的影响[J]. 动物营养学报, 2017, 29(4): 1198-1204. |
| [16] |
Jin W, Cheng YF, Mao SY, et al. Isolation of natural cultures of anaerobic fungi and indigenously associated methanogens from herbivores and their bioconversion of lignocellulosic materials to methane[J]. Bioresource Technology, 2011, 102(17): 7925-7931. DOI:10.1016/j.biortech.2011.06.026 |
| [17] |
Jeyanathan J, Kirs M, Ronimus RS, et al. Methanogen community structure in the rumens of farmed sheep, cattle and red deer fed different diets[J]. FEMS Microbiology Ecology, 2011, 76(2): 311-326. DOI:10.1111/fem.2011.76.issue-2 |
| [18] |
Denman SE, McSweeney CS. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J]. FEMS Microbiology Ecology, 2006, 58(3): 572-582. DOI:10.1111/fem.2006.58.issue-3 |
| [19] |
Tapio I, Snelling TJ, Strozzi F, et al. The ruminal microbiome associated with methane emissions from ruminant livestock[J]. Journal of Animal Science and Biotechnology, 2017, 8: 7. DOI:10.1186/s40104-017-0141-0 |
| [20] |
Cheng YF, Edwards JE, Allison GG, et al. Diversity and activity of enriched ruminal cultures of anaerobic fungi and methanogens grown together on lignocellulose in consecutive batch culture[J]. Bioresource Technology, 2009, 100(20): 4821-4828. DOI:10.1016/j.biortech.2009.04.031 |
| [21] |
Li YF, Jin W, Cheng YF, et al. Effect of the associated methanogen Methanobrevibacter thaueri on the dynamic profile of end and intermediate metabolites of anaerobic fungus Piromyces sp.F1[J]. Current Microbiology, 2016, 73(3): 434-441. DOI:10.1007/s00284-016-1078-9 |
| [22] |
Li YF, Jin W, Mu CL, et al. Indigenously associated methanogens intensified the metabolism in hydrogenosomes of anaerobic fungi with xylose as substrate[J]. Journal of Basic Microbiology, 2017, 57(11): 933-940. DOI:10.1002/jobm.v57.11 |
| [23] |
Cheng YF, Jin W, Mao SY, et al. Production of citrate by anaerobic fungi in the presence of co-culture methanogens as revealed by 1H NMR spectrometry[J]. Asian-Australasian Journal of Animal Sciences, 2013, 26(10): 1416-1423. |
 2018, Vol. 45
2018, Vol. 45




