扩展功能
文章信息
- 徐雅梦, 姜晓冰, 于涛, 王海磊, 石磊
- XU Ya-Meng, JIANG Xiao-Bing, YU Tao, WANG Hai-Lei, SHI Lei
- MdrL外排泵在单核细胞增生李斯特菌对苯扎氯铵耐受中的作用
- Role of efflux pump MdrL in tolerance to benzalkonium chloride in Listeria monocytogenes
- 微生物学通报, 2018, 45(6): 1273-1282
- Microbiology China, 2018, 45(6): 1273-1282
- DOI: 10.13344/j.microbiol.china.170689
-
文章历史
- 收稿日期: 2017-09-02
- 接受日期: 2017-12-28
- 网络首发日期(www.cnki.net): 2018-01-09
2. 新乡学院生命科学技术学院 河南 新乡 453000;
3. 暨南大学食品安全与营养研究院 广东 广州 510632
2. College of Life Sciences and Technology, Xinxiang University, Xinxiang, Henan 453000, China;
3. Institute of Food Safety and Nutrition, Jinan University, Guangzhou, Guangdong 510632, China
季铵盐类化合物(Quaternary ammonium compounds,QACs)消毒剂,特别是苯扎氯铵(Benzalkonium chloride,BC)被广泛应用于食品工业领域[1]。QACs是一类阳离子表面活性剂,可吸附于微生物表面形成微团,并逐步渗入细胞膜的类脂层,从而改变细胞的通透性,使细胞内容物外渗,进而导致微生物死亡[2]。由于QACs遇水易起泡,因此此类消毒剂在使用后一般不进行专门清洗;加之QACs的降解速度较慢,可能会造成其在环境中的残留,从而增加QACs耐受菌株出现的可能性[2-3]。
单核细胞增生李斯特菌(Listeria monocytogenes,Lm)是一种重要的食源性致病菌。Lm能在低温、高盐、长时间干燥以及酸等多种不利环境条件下生存和繁殖,导致食品在加工和保藏过程中易受其污染。通过摄入污染的食品可引起李斯特菌病(Listeriosis)的散发和暴发流行[4]。由于Lm能在食品加工环境中存活数月乃至数年之久,QACs在食品工业的广泛使用可能会促进Lm耐受菌株的出现。许多文献已经报道了从食品及食品相关环境中分离的Lm菌株对BC的敏感性下降[1, 5-7]。
外排泵在细菌中广泛存在,属于膜转运蛋白。研究表明,一些外排泵可以将消毒剂、抗生素、重金属等作为底物排出体外,使菌体内的药物浓度始终维持在较低水平,从而导致细菌产生耐药性[5, 8]。目前,研究者普遍认为外排泵是介导Lm对BC产生耐受的主要机制[9]。Tamburro等[10]的研究发现,在BC刺激下,mdrL基因的表达量明显升高,推测MdrL外排泵可能与Lm对BC的耐受有关。
本研究以Lm标准菌株EGD-e为研究对象,利用同源重组技术构建mdrL基因缺失突变株,通过检测野生株和突变株在BC胁迫下的生理行为和细胞表面形态等,调查MdrL外排泵在Lm对BC耐受中的作用,为阐明Lm对BC的耐受机制奠定理论基础。
1 材料与方法 1.1 菌株和质粒Lm标准菌株EGD-e和质粒pERL3由华中师范大学罗勤教授惠赠;大肠杆菌DH5α、DH10B购自北京博迈德基因技术有限公司;穿梭质粒pMAD由本实验室保存。
1.2 主要试剂和仪器苯扎氯铵,上海阿拉丁生化科技股份有限公司;利血平和溴化乙锭(Ethidium bromide,EB),美国Sigma-Aldrich公司;细菌基因组DNA提取试剂盒和质粒小提试剂盒,北京天根生化科技有限公司;胶回收试剂盒、PCR产物纯化试剂盒、T4 DNA连接酶、限制性内切酶,Thermo Fisher Scientific公司;Taq DNA聚合酶和dNTPs,宝生物工程(大连)有限公司;引物由上海捷瑞生物工程有限公司合成。
电热恒温培养箱,北京科伟永兴仪器有限公司;气浴恒温振荡器,金坛天竟实验仪器厂;基因扩增仪,北京东胜创新生物科技有限公司;电泳仪,北京市六一仪器厂;离心机,上海安亭科学仪器厂;凝胶成像分析系统、电转仪,美国Bio-Rad公司;实时荧光定量PCR仪,瑞士Roche公司;微生物全自动生长曲线分析仪,芬兰Oy Growth Curves Ab Ltd.;透射电镜,日本HITACHI公司。
1.3 培养基脑心浸液培养基(Brain heart infusion,BHI),北京陆桥生物技术有限公司;LB培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0。
1.4 方法 1.4.1 mdrL基因缺失菌株和回复突变株的构建与分子鉴定以EGD-e基因组DNA为模板,分别用mdrL-A/mdrL-B和mdrL-C/mdrL-D两对引物扩增mdrL基因的上、下游同源臂,引物序列见表 1。利用重叠延伸PCR (Splicing by overlap extension,SOE-PCR)技术[11]融合上下游同源臂,融合片段经切胶回收后与穿梭质粒pMAD[12]分别用限制性内切酶BamH Ⅰ和EcoR Ⅰ同步双酶切。酶切产物经纯化后进行连接反应,将构建好的重组质粒pMAD-ΔmdrL转化至大肠杆菌DH5α中,将阳性转化株送至北京博迈德基因技术有限公司进行测序。
| 引物 Primers |
序列 Sequences (5'→3') |
退火温度 Annealing temperature (℃) |
长度 Sizes (bp) |
| mdrL-A | CGGGATCCGTCCCTTGGTTCTGGCAT | 48 | 500 |
| mdrL-B | AATACAACTACACTTCCCTTTCCGGAAAGGGAAGTGTAGTTGTATT | 48 | |
| mdrL-C | GGAAAGGGAAGTGTAGTTGTATTCCAGCACATTTTACCTTACAAC | 48 | 735 |
| mdrL-D | CGGAATTCTCCAATCATAAAGTTTCGTCAG | 48 | |
| mdrLJC1 | TGTAAAGCAGCAGGAGTG | 50 | 2 617/1 471 |
| mdrLJC2 | AAACGACGCTAATAACCAT | 50 | |
| MP7-2 | CCCTCGAGTATCATACAATAGCACCTCTG | 50 | 1 389 |
| MP8-2 | CCGTCGACCCAGGTTACTCAGTCTCTTG | 50 | |
| 注:斜体部分序列表示保护碱基;下划线部分序列表示酶切位点. Note: Italicized nucleotides are protective bases; Nucleotides underlined are restriction recognition sites. |
|||
采用青霉素G法制备EGD-e感受态细胞[13]。取4 μL测序正确的重组质粒pMAD-ΔmdrL与40 μL感受态细胞混匀、电击,立刻加入500 μL BHI培养基于30 ℃、150 r/min培养3 h。将菌液均匀涂布于含红霉素(5 μg/mL)、IPTG和X-Gal的BHI平板上,30 ℃培养48 h。挑取蓝色单菌落于含红霉素(5 μg/mL)的BHI液体培养基,39 ℃、150 r/min培养24 h。稀释菌液选择合适梯度的稀释液涂布于含红霉素(5 μg/mL)、IPTG和X-Gal的BHI平板上,39 ℃、150 r/min培养48 h。挑取蓝色单菌落于BHI液体培养基,30 ℃、150 r/min培养24 h。将菌液转接至新鲜的BHI,39 ℃培养。稀释涂布,39 ℃培养48 h。挑取白色单菌落用引物mdrLJC1/mdrLJC2进行PCR扩增检测缺失条带,最终获得ΔmdrL突变株。
PCR扩增含有启动子区域的mdrL基因,PCR反应体系(50 μL):5×PS buffer 10 μL,2.5 mmol/L dNTPs 4 μL,10 μmol/L上、下游引物各3 μL,Prime STAR HS DNA polymerase 0.5 μL,DNA 1.5 μL,超纯水补足50 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 40 s,48 ℃ 15 s,72 ℃ 90 s,30个循环;72 ℃ 7 min。PCR扩增产物经Sal Ⅰ和Xho Ⅰ双酶切后与质粒pERL3连接,转化至大肠杆菌DH10B中,在含有红霉素(300 μg/mL)的LB平板上培养,通过菌液PCR和质粒双酶切验证筛选出含有重组质粒pERL3-mdrL的阳性克隆,将阳性转化株送至北京博迈德基因技术有限公司进行测序。将测序正确的重组质粒pERL3-mdrL电转至ΔmdrL感受态细胞中,筛选得到回复突变株CΔmdrL。同时将质粒pERL3电转至ΔmdrL作为对照菌株(ΔmdrL-pERL3)。
1.4.2 药物敏感性试验按照美国临床实验室标准协会(Clinical and laboratory standards institute,CLSI)推荐的琼脂稀释法测定菌株对BC的最小抑菌浓度(Minimum inhibitory concentration,MIC)[14]。每个样品重复3次。
1.4.3 生长曲线测定利用微生物全自动生长曲线分析仪测定野生株EGD-e和突变株ΔmdrL在不同刺激下的生长曲线。每株菌分别挑取5个单克隆接种至BHI液体培养基中,37 ℃、150 r/min培养过夜。过夜培养物按1:100分别接种至新鲜的BHI、BHI+BC (2 μg/mL)、BHI+利血平(20 μg/mL[5])和BHI+BC (2 μg/mL)+利血平(20 μg/mL)中,然后取300 μL菌液转移至100孔的检测板中,37 ℃培养48 h,每隔15 min测定菌液的OD600值。利用DMFit软件(英国食品研究所研发)拟合生长曲线[15],并计算细菌生长的迟滞期(Lag phase duration,LPD)、平均最大生长率(Mean maximum growth rate,MMGR)以及平均最大光密度值(Mean maximum optical density,MMOD)。
1.4.4 平板法检测菌株对BC的耐受性挑取野生株EGD-e和突变株ΔmdrL接种于BHI液体培养基,37 ℃、150 r/min培养至OD600约为0.6。将菌液做10倍梯度稀释,首先选取合适的稀释度用于菌落计数,然后再选取6个连续的稀释度(10-2-10-7),从每个稀释度的菌液中吸取1 μL分别点接至含有不同浓度BC (0、2、4 μg/mL)的BHI平板上,37 ℃培养24 h。
1.4.5 致死曲线测定野生株EGD-e和突变株ΔmdrL在37 ℃、150 r/min培养至OD600约为0.6。分别取3 mL菌液4 000×g离心5 min弃上清后再加入3 mL含有16 μg/mL BC的BHI液体培养基,重悬菌体。分别在加入BC后0、10、20和30 min时,取100 μL菌液做梯度稀释,取合适的稀释度涂布于BHI平板,37 ℃培养24 h。对BHI平板进行菌落计数并计算存活率。每个样品重复3次。
1.4.6 EB积累和外排试验野生株EGD-e和突变株ΔmdrL接种至3 mL BHI液体培养基中,37 ℃、150 r/min培养至对数中期,离心(4 000×g,5 min)收集细胞;PBS洗涤2次;PBS悬浮细胞至OD600约为0.3,该菌悬液分别用于EB积累和外排试验。
EB的积累:向菌悬液中加入EB (终浓度为8 μg/mL),置于实时荧光定量PCR仪,选择激发波533 nm,发射波572 nm,37 ℃循环60次,每个循环的第51-60 s采集信号[16]。EB的外排:向菌悬液中加入EB (8 μg/mL),孵育60 min。离心收集细胞,PBS悬浮至OD600约为0.3。将菌液分为两组,一组不做任何处理,另一组的菌液中加入1.8 mg/mL的葡萄糖[17]。每个样品重复3次。EB外排试验的结果以相对荧光值的方式表示,即每个时间点的荧光值与最大荧光值的比值。
1.4.7 细胞形态观察将处于对数期的野生株和突变株用戊二醛(10%)进行固定,室温放置2 h;离心收集细胞,用无菌水洗涤2次;加入1 mL无菌水悬浮细胞。取5 μL菌液置于铜网上,孵育2 min;然后滴加5 μL磷钨酸染色15 s,彻底晾干后上透射电镜观察。
1.4.8 数据分析利用Origin 8.5软件对所得的实验数据进行双尾t检验分析。
2 结果与分析 2.1 外排抑制剂利血平对EGD-e生长的影响在含有利血平的BHI培养基中,EGD-e仍能生长(图 1A)。在含有BC的BHI培养基中,EGD-e的LPD变长;而在此基础上加入利血平后,EGD-e的生长完全受到抑制(图 1B)。结果表明,外排泵在Lm对BC耐受中起至关重要的作用。

|
| 图 1 野生株EGD-e在利血平作用下的生长曲线 Figure 1 Growth curves of wild-type strain EGD-e in the presence of reserpine |
|
|
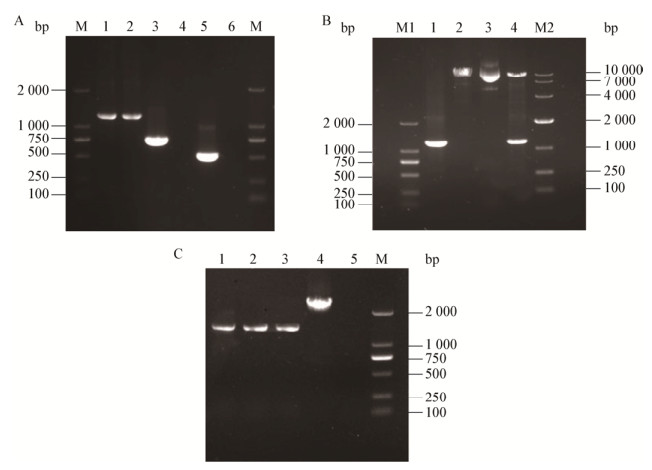
通过SOE-PCR得到1 235 bp的上、下游同源臂融合片段,与预期结果一致(图 2A)。重组质粒pMAD-ΔmdrL经双酶切验证正确后电转至EGD-e感受态中(图 2B)。筛选得到的阳性菌株用检测引物只能扩增出1 471 bp的片段(图 2C)。测序结果表明已缺失mdrL基因获得ΔmdrL突变株。
|
| 图 2 mdrL基因缺失株的构建 Figure 2 Construction of the deletion mutant strain ΔmdrL 注:A:M:DL2000 marker;1、2:SOE-PCR扩增产物;3:mdrL下游同源臂;5:mdrL上游同源臂;4、6:阴性对照. B:M1:DL2000 marker;M2:DL10000 marker;1:融合片段;2:pMAD双酶切产物;3:pMAD质粒;4:pMAD-ΔmdrL双酶切产物. C:M:DL2000 marker;1、2:阳性克隆;3:ΔmdrL阳性对照;4:mdrL阳性对照;5:阴性对照. Note: A: M: DL2000 marker; 1, 2: Amplification of SOE-PCR; 3: Homologous arms down-stream of mdrL; 5: Homologous arms up-stream of mdrL; 4, 6: Negative control. B: M1: DL2000 marker; M2: DL10000 marker; 1: Amplification of SOE-PCR; 2: Double digested pMAD; 3: pMAD plasmid 4: Double digested pMAD-ΔmdrL. C: M: DL2000 marker; 1, 2: Positive clone; 3: Positive control of ΔmdrL; 4: Positive control of mdrL; 5: Negative control. |
|
|
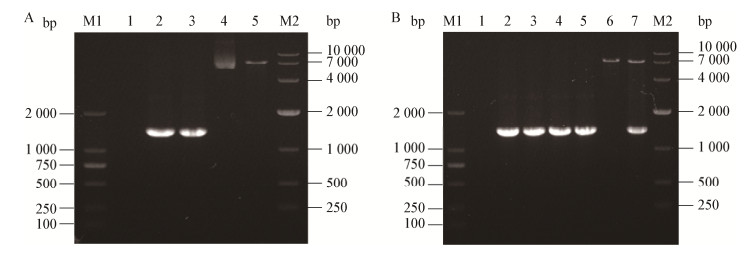
按照1.4.1的方法构建回复突变株,通过PCR扩增得到含启动子的mdrL基因,与预期结果一致(图 3A)。通过菌液PCR和质粒双酶切验证筛选出含有重组质粒pERL3-mdrL的阳性克隆(图 3B);测序结果显示,阳性克隆的序列与野生株EGD-e的完全一致,将重组质粒pERL3-mdrL电转至ΔmdrL感受态细胞中,筛选得到回复突变株CΔmdrL。同时将质粒pERL3电转至ΔmdrL作为对照菌株(ΔmdrL-pERL3)。
|
| 图 3 mdrL基因回复突变株的构建 Figure 3 Construction of the complemented strain CΔmdrL 注:M1:DL2000 marker;M2:DL10000 marker;A:1:阴性对照;2、3:mdrL(含启动子);4:pERL3质粒;5:pERL3双酶切产物;B:1:阴性对照;2:阳性对照;3-5:阳性克隆;6:pERL3-mdrL双酶切产物. Note: M1: DL2000 marker; M2: DL10000 marker; A: 1: Negative control; 2, 3: mdrL (containing promoter mdrL gene); 4: pERL3 plasmid; 5: Double digested pERL3; B: 1: Negative control; 2: Positive control; 3-5: Positive clone; 6: Double digested pERL3-mdrL. |
|
|
野生株EGD-e和突变株ΔmdrL对BC的MIC值均为6 μg/mL。mdrL的缺失并不影响菌株对BC的MIC值,这与我们预期的结果不同,可能是由于琼脂稀释法的灵敏度低,不足以反映野生株和突变株在表型上的差异。
2.5 生长曲线分析野生株EGD-e和突变株ΔmdrL在BHI培养基中的生长情况没有明显差异(图 4A)。然而加入BC后,ΔmdrL的LPD明显变长,为EGD-e的1.56倍;而ΔmdrL的MMGR和MMOD则分别降低为EGD-e的62%和80% (图 4B,表 2)。以上结果表明mdrL基因与Lm在BC胁迫下的生长有关。将mdrL基因回补后,菌株在BC存在下的生长恢复至野生株的水平(图 4B);对照菌株ΔmdrL-pERL3的生长曲线与突变株相似(图 4)。这些结果表明突变株在BC胁迫下的生长缺陷只与mdrL基因的敲除有关,排除极性效应的影响。

|
| 图 4 野生株EGD-e和突变株ΔmdrL在BC作用下的生长曲线 Figure 4 Growth curves for wild-type strain EGD-e and mutant strain ΔmdrL in the presence of BC |
|
|
| 菌株 Strain |
迟滞期 LPD (h) |
平均最大生长率 MMGR (Units/h) |
平均最大光密度值 MMOD (Units) |
|||||
| BHI | BC | BHI | BC | BHI | BC | |||
| EGD-e | 3.240±0.096 | 18.740±0.063 | 0.342±0.015 | 0.259±0.007 | 1.150±0.010 | 0.990±0.018 | ||
| ΔmdrL | 3.410±0.131 | 29.300±0.042** | 0.242±0.011 | 0.161±0.004* | 1.040±0.016 | 0.790±0.024**** | ||
| 注:*:与野生株EGD-e相比的差异显著性(*:P < 0.05;**:P < 0.01;****:P < 0.0001). Note:Significantly varied values compared to the corresponding value of the wild-type strain EGD-e are indicated by asterisks (*: P < 0.05; **: P < 0.01; ****: P < 0.0001). |
||||||||
经检测,野生株EGD-e和突变株ΔmdrL的初始菌液的菌落总数分别为2.41×1011 CFU/mL和1.94×1011 CFU/mL,两者数值相近。由图 5可知,在BHI平板上,野生株和突变株均能正常生长;BC的浓度为2 μg/mL时,野生株和突变株的生长没有表现出明显差异;BC的浓度提高至4 μg/mL时,野生株和突变株的生长显现出明显的差异(稀释倍数大于104时肉眼无法观察到突变株的生长)。

|
| 图 5 平板法检测野生株EGD-e和突变株ΔmdrL对BC的敏感性 Figure 5 Determination of BC susceptibility of wild-type strain EGD-e and mutant strain ΔmdrL using the plate-based assay |
|
|
致死浓度BC (16 μg/mL)作用下,野生株EGD-e和突变株ΔmdrL的存活率表现出明显差异(图 6)。BC作用30 min后,野生株和突变株的平均存活率分别为1.96%和0.006 5%。与野生株相比,突变株在BC刺激下的存活能力显著降低。

|
| 图 6 野生株EGD-e和突变株ΔmdrL在BC (16 μg/mL)作用下的致死曲线 Figure 6 Kill curves of wild-type strain EGD-e and mutant strain ΔmdrL exposed to 16 μg/mL of BC |
|
|
野生株EGD-e和突变株ΔmdrL对EB的积累无明显差异(图 7A)。不加葡萄糖时,野生株EGD-e和突变株ΔmdrL对EB的外排不明显;葡萄糖的加入提高了菌株对EB的外排能力,并且野生株EGD-e和突变株ΔmdrL对EB的外排能力几乎一致(图 7B)。结果表明,MdrL外排泵与EGD-e对EB的积累和外排无关。

|
| 图 7 EB积累和外排 Figure 7 Accumulation and efflux of EB |
|
|
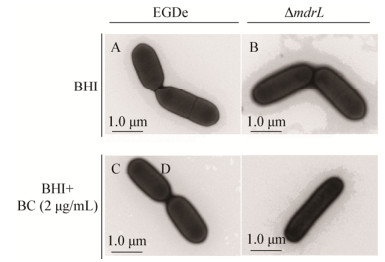
由图 8可知,无BC刺激时,野生株EGD-e与突变株ΔmdrL的形态无明显差异(图 8A、B)。加入BC后,野生株EGD-e的细胞形态无明显变化(图 8C);而突变株ΔmdrL的细胞明显变细长(图 8D)。
|
| 图 8 细胞形态观察结果 Figure 8 Electron micrographs of the cell morphology |
|
|
外排泵属于膜转运蛋白,在细菌中广泛存在。除了参与细胞的正常物质运输和代谢,外排泵还能够去除细菌细胞和胞膜中的有害物质,帮助细菌抵御外界不良环境的影响。研究表明,一些外排泵可以把抗生素、消毒剂、重金属等作为底物排出菌体外使细菌产生耐药性[5, 8]。目前,研究者普遍认为外排泵是介导Lm对BC耐受的主要机制[9]。许多文献报道,加入外排抑制剂利血平(利血平是一种具有降血压活性的小分子生物碱,对革兰氏阳性菌的外排系统具有较好的抑制作用)后,Lm对BC的MIC值会出现不同程度的下降[5, 18-19]。在本研究中,利血平的存在能够完全抑制EGD-e在亚致死浓度BC胁迫下的生长,表明外排泵在Lm对BC的耐受中起重要作用。
Tamburro等[10]研究发现,在BC刺激下mdrL基因的表达量明显增高,表明MdrL外排泵可能与Lm对BC的耐受有关。由mdrL基因编码的多重耐药外排泵MdrL属于细菌外排系统中常见的主要易化子超家族(Major facilitator superfamily,MFS),是一种自足型多药外排转运蛋白[20]。为了明确MdrL外排泵在Lm对BC耐受中的作用,本研究利用同源重组技术构建EGD-e的mdrL基因缺失菌株ΔmdrL。药敏结果显示,mdrL基因缺失前后菌株EGD-e对BC的MIC值没有变化。我们推测这可能是由于琼脂稀释法的灵敏度不足以反映野生株和突变株在表型上的差异。因此,本研究又通过其它技术手段检测野生株EGD-e和突变株ΔmdrL在BC刺激下的生长情况。由生长曲线结果可知,在亚致死浓度BC (2 μg/mL)作用下,与野生株相比,突变株的LPD明显变长,MMGR和MMOD均降低,表明mdrL基因与Lm在BC胁迫下的生长有关。回复突变株在BC存在下的生长恢复至野生株的水平,表明本研究中构建的突变株为非极性突变,即突变株在BC存在下的生长缺陷是由于mdrL基因的缺失所致,与极性效应无关。平板法的结果显示,BC的浓度为4 μg/mL时,野生株EGD-e和突变株ΔmdrL的生长显现出明显的差异。在致死浓度BC作用下,与野生株相比,突变株的存活率降低2个log值。此外,本研究还利用透射电镜观察BC刺激前后野生株EGD-e和突变株ΔmdrL的细胞形态。加入BC后,突变株ΔmdrL的细胞明显变细长。以上这些结果表明MdrL外排泵介导Lm对BC的耐受。值得注意的是,敲除mdrL后,Lm菌株在BC刺激下的生长并没有完全受到抑制,这表明除了MdrL外排泵,可能还有其他外排泵与BC的耐受有关。
Mata等[21]利用同源重组技术构建LO28的mdrL基因插入失活突变株,并命名为LOMT1。与野生株LO28相比,突变株LOMT1对EB的积累量增加,同时对EB的外排能力明显降低,表明EB是MdrL外排泵的底物,mdrL基因的缺失影响菌株对EB的外排能力。而本研究的结果显示,野生株EGD-e和突变株ΔmdrL对EB的积累和外排无明显差异,表明MdrL与EB的外排无关,这与先前的报道[21]截然不同。本研究与Mata等[21]的研究存在两个不同点:(1)所用菌株不同。Mata等[21]以LO28为研究对象,而本研究则使用EGD-e;(2)构建突变体的方法不同。Mata等[21]构建了mdrL基因插入失活突变体,而本研究则通过缺失mdrL基因中一段序列来构建敲除突变体,实现读码框内敲除(In-frame deletion)。这两点可能是导致本研究与前人研究结果不同的原因。
本研究以Lm标准菌株EGD-e为研究对象,通过构建mdrL基因缺失突变株和回复突变株调查MdrL外排泵在Lm对BC耐受中的作用。生长曲线、平板法、致死曲线以及透射电镜的结果表明,MdrL外排泵介导Lm对BC的耐受。EB积累和外排试验结果表明,MdrL与Lm对EB的外排无关。
| [1] |
Sagrario O, Pilar L, Victoria L, et al. Antibiotic susceptibility in benzalkonium chloride-resistant and -susceptible Listeria monocytogenes strains[J]. Foodborne Pathogens and Disease, 2014, 11(7): 517-519. DOI:10.1089/fpd.2013.1724 |
| [2] |
Gerba CP, Müller V. Quaternary ammonium biocides: efficacy in application[J]. Applied and Environmental Microbiology, 2015, 81(2): 464-469. DOI:10.1128/AEM.02633-14 |
| [3] |
Hegstad K, Langsrud S, Lunestad BT, et al. Does the wide use of quaternary ammonium compounds enhance the selection and spread of antimicrobial resistance and thus threaten our health?[J]. Microbial Drug Resistance, 2010, 16(2): 91-104. DOI:10.1089/mdr.2009.0120 |
| [4] |
Arslan F, Meynet E, Sunbul M, et al. The clinical features, diagnosis, treatment, and prognosis of neuroinvasive listeriosis: a multinational study[J]. European Journal of Clinical Microbiology & Infectious Diseases, 2015, 34(6): 1213-1221. |
| [5] |
Xu DY, Li YL, Zahid MSH, et al. Benzalkonium chloride and heavy-metal tolerance in Listeria monocytogenes from retail foods[J]. International Journal of Food Microbiology, 2014, 190: 24-30. DOI:10.1016/j.ijfoodmicro.2014.08.017 |
| [6] |
Martínez-Suárez JV, Ortiz S, López-Alonso V. Potential impact of the resistance to quaternary ammonium disinfectants on the persistence of Listeria monocytogenes in food processing environments[J]. Frontiers in Microbiology, 2016, 7: 638. |
| [7] |
Bisbiroulas P, Psylou M, Iliopoulou I, et al. Adaptational changes in cellular phospholipids and fatty acid composition of the food pathogen Listeria monocytogenes as a stress response to disinfectant sanitizer benzalkonium chloride[J]. Letters in Applied Microbiology, 2011, 52(3): 275-280. DOI:10.1111/lam.2011.52.issue-3 |
| [8] |
Guérin F, Galimand M, Tuambilangana F, et al. Overexpression of the novel MATE fluoroquinolone efflux pump FepA in Listeria monocytogenes is driven by inactivation of its local repressor FepR[J]. PLoS One, 2014, 9(9): e106340. DOI:10.1371/journal.pone.0106340 |
| [9] |
Jiang XB, Yu T, Liang Y, et al. Efflux pump-mediated benzalkonium chloride resistance in Listeria monocytogenes isolated from retail food[J]. International Journal of Food Microbiology, 2016, 217: 141-145. DOI:10.1016/j.ijfoodmicro.2015.10.022 |
| [10] |
Tamburro M, Ripabelli G, Vitullo M, et al. Gene expression in Listeria monocytogenes exposed to sublethal concentration of benzalkonium chloride[J]. Comparative Immunology, Microbiology and Infectious Diseases, 2015, 40: 31-39. DOI:10.1016/j.cimid.2015.03.004 |
| [11] |
Zhao C, Zhao J, Wang W, et al. Expression of MLAA34-HSP70 fusion gene constructed by SOE-PCR[J]. Pakistan Journal of Pharmaceutical Sciences, 2017, 30(3(Special)): 1125-1127. |
| [12] |
Arnaud M, Chastanet A, Débarbouillé M. New vector for efficient allelic replacement in naturally nontransformable, low-GC-content, gram-positive bacteria[J]. Applied and Environmental Microbiology, 2004, 70(11): 6887-6891. DOI:10.1128/AEM.70.11.6887-6891.2004 |
| [13] |
Guo L, Chen GW, Xie MM, et al. Construction and biological activity of a strain of Listeria monocytogenes deleted for positive regulatory factor a gene (prfA)[J]. Food Science, 2017, 38(10): 12-17. 郭亮, 陈国薇, 谢曼曼, 等. 单增李斯特菌prfA基因缺失菌株的构建及其生物学特性鉴定[J]. 食品科学, 2017, 38(10): 12-17. DOI:10.7506/spkx1002-6630-201710003 |
| [14] |
CLSI. Performance standards for antimicrobial susceptibility testing[R]. CLSI Document M100-S21, Wayne, PA: Clinical and Laboratory Standards Institute, 2012
|
| [15] |
Zhang PP, Liu Y, Fang C, et al. Comparison of growth models of Listeria monocytogenes in chilled pork[J]. Acta Microbiologica Sinica, 2011, 51(12): 1625-1631. 张培培, 刘媛, 方春, 等. 单增李斯特菌在冷鲜猪肉中的生长预测模型比较[J]. 微生物学报, 2011, 51(12): 1625-1631. |
| [16] |
Paix o L, Rodrigues L, Couto I, et al. Fluorometric determination of ethidium bromide efflux kinetics in Escherichia coli[J]. Journal of Biological Engineering, 2009, 3: 18. DOI:10.1186/1754-1611-3-18 |
| [17] |
Aase B, Sundheim G, Langsrud S, et al. Occurrence of and a possible mechanism for resistance to a quaternary ammonium compound in Listeria monocytogenes[J]. International Journal of Food Microbiology, 2000, 62(1/2): 57-63. |
| [18] |
Elhanafi D, Dutta V, Kathariou S. Genetic characterization of plasmid-associated benzalkonium chloride resistance determinants in a Listeria monocytogenes strain from the 1998-1999 outbreak[J]. Applied and Environmental Microbiology, 2010, 76(24): 8231-8238. DOI:10.1128/AEM.02056-10 |
| [19] |
Rakic-Martinez M, Drevets DA, Dutta V, et al. Listeria monocytogenes strains selected on ciprofloxacin or the disinfectant benzalkonium chloride exhibit reduced susceptibility to ciprofloxacin, gentamicin, benzalkonium chloride, and other toxic compounds[J]. Applied and Environmental Microbiology, 2011, 77(24): 8714-8721. DOI:10.1128/AEM.05941-11 |
| [20] |
Piddock LJV. Multidrug-resistance efflux pumps? not just for resistance[J]. Nature Reviews Microbiology, 2006, 4(8): 629-636. DOI:10.1038/nrmicro1464 |
| [21] |
Mata MT, Baquero F, Pérez-Díaz JC. A multidrug efflux transporter in Listeria monocytogenes[J]. FEMS Microbiology Letters, 2000, 187(2): 185-188. DOI:10.1111/fml.2000.187.issue-2 |
 2018, Vol. 45
2018, Vol. 45




