扩展功能
文章信息
- 董冰雪, 夏敏, 蔡心清, 李鹏, 押玉柯, 毛润乾
- DONG Bing-Xue, XIA Min, CAI Xin-Qing, LI Peng, YA Yu-Ke, MAO Run-Qian
- 宏基因组来源耐Mn2+、热稳定细菌漆酶的分子克隆及酶学特性
- Molecular cloning and enzyme characterization of a metagenome- derived bacterial laccase with Mn2+ tolerance and thermostability
- 微生物学通报, 2018, 45(6): 1190-1199
- Microbiology China, 2018, 45(6): 1190-1199
- DOI: 10.13344/j.microbiol.china.170649
-
文章历史
- 收稿日期: 2017-08-17
- 接受日期: 2018-02-12
- 网络首发日期(www.cnki.net): 2018-03-23
2. 南阳师范学院生命科学与技术学院 河南 南阳 473061;
3. 中山大学生命科学学院 广东 广州 510275
2. School of Life Science and Technology, Nanyang Normal University, Nanyang, Henan 473061, China;
3. School of Life Sciences, Sun Yat-Sen University, Guangzhou, Guangdong 510275, China
木质纤维素是地球上含量最高、分布最广的可再生资源,可用作制浆、造纸、化工、纤维素乙醇等工业原料[1-3];具有成本低且“不与粮争地”的优点[2]。为了能更好地利用木质纤维素,木质素降解成为备受关注的热点[4-5]。漆酶和锰过氧化物酶(Manganese peroxidase,Mnp)是木质素降解的主要酶[6-8],二者之间存在协同效应[9-10]。Mnp的活性发挥依赖于Mn2+,然而绝大多数漆酶的活性都受到Mn2+的抑制[11-16]。现实生产中造纸、生物乙醇和染料等工业的反应往往在高温下进行,普通的酶很难适应。因此寻找耐热、耐受Mn2+的漆酶是提高复合酶系降解木质素能力、拓宽漆酶工业应用领域的重要途径。
目前工业生产中只有真菌漆酶得到了应用[17],真菌漆酶的工业化应用往往需要高效重组表达,然而真核基因的克隆、翻译及翻译后加工都制约了其高效表达[18],细菌基因的表达则容易得多。过去认为漆酶仅存在于植物与真菌中,近年来,Alexandre等[19]通过对蛋白质数据库及细菌基因组进行同质性分析,发现漆酶可能广泛存在于原核生物中。尤其令人感兴趣的是细菌漆酶具有Cu2+抗性[20]、不需糖基化、热稳定性强[21]、耐高浓度盐[22]及酶的反应pH值范围广[23]等优点而更适合工业应用[24]。
虽然漆酶可能广泛存在于原核生物中,但目前已经发现的具有类似漆酶活性的细菌并不多[25-29]。宏基因组技术的产生为从不同自然生境的未培养微生物中寻找新的漆酶基因资源提供了有力的技术手段[30]。Ausec等利用宏基因组技术得到一种耐高浓度氯化钠的漆酶,然而该酶不耐热[31]。Ye等利用宏基因组手段从红树林分离到一种碱性漆酶,但该酶活性受Mn2+抑制且热稳定性差[32]。从宏基因组文库筛选耐Mn2+、耐高温的细菌漆酶尚未见报道。本文以许昌市某污水河造纸厂废水排入口处污泥为样品构建宏基因组文库,以期筛选出耐Mn2+且性质稳定的细菌漆酶,低成本表达后组成高效复合酶系,为木质纤维素预处理奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒大肠杆菌DH5α、BL21(DE3)pLysS为本实验室保存;Mnp/GS115[33]和CIPmt5/GS115[34]用于表达Mnp和突变灰盖鬼伞过氧化物酶(Coprinus cinereus Peroxidase,CIP) CIPmt5,来自前期工作。表达载体pET-28a由本实验室保存,克隆载体pUC118BamH I/BAP购自TaKaRa公司。
1.1.2 主要试剂和仪器限制性内切酶、高保真酶PrimeSTAR Max Premix和连接酶购自TaKaRa公司;DNA凝胶回收试剂盒、质粒提取试剂盒购自天根生化科技有限公司;土壤基因组快速提取试剂盒Fast DNA Spin Kit For Soil购自MP Biomedicals公司;蛋白纯化离心柱Ni-NTA Spin Columns购自QIAGEN公司;蛋白提取试剂BugBuster Protein Extraction Reagent购自Novagen公司;2, 2′-连氮-双-(3-乙基苯并噻唑-6-酸) [2, 2ʹ-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid),ABTS]、丁香醛连氮(Syringaldazine,SGZ)、2, 6-二甲氧苯酚(2, 6-Dimethoxyphenol,2, 6-DMP)、儿茶酚和愈创木酚购自Sigma公司;木质素来自南阳天冠集团;其他试剂均为进口分析纯。离心机购自力新仪器(上海)有限公司;NanoDrop 2000微量紫外分光光度计购自Thermo Scientific公司;PCR仪、iMark酶标仪、电泳仪和凝胶成像系统购自Bio-Rad公司。
1.2 土壤样品DNA提取取许昌市某污水河造纸厂废水排入口处污泥作为实验样品,基因组DNA的提取使用土壤基因组快速提取试剂盒,参照商家提供的使用说明书进行操作。
1.3 基因组文库的构建及漆酶活性基因筛选基因组DNA用BamH I部分酶切后回收2.5−7.5 kb的片段,连接到pUC118BamH I/BAP载体上,电击转化大肠杆菌DH5α,构建污水河污泥样品的宏基因组文库。复制文库到每孔含500 μL LB培养基(添加50 μg/mL Amp、0.25 mmol/L IPTG和1 mmol/L CuSO4)的深孔96孔板37 ℃培养过夜。4 000 r/min离心5 min取细胞,加入蛋白提取试剂,参照说明书裂解细胞。4 000 r/min离心5 min取上清,加入1 mmol/L CuSO4、5 mmol/L MnSO4和1 mmol/L愈创木酚,挑取反应后变成棕红色的克隆,再使用ABTS和SGZ进行复筛。选取能使ABTS变蓝绿色、SGZ变粉紫色的克隆检测并送Invitrogen公司测序。
1.4 漆酶ORF的确定、序列分析及系统发育树构建将测序结果输入NCBI数据库,使用ORF finder工具对测序结果进行分析,寻找可能的漆酶开放阅读框。根据ORF的大小将该基因命名为lac1542,编码蛋白Lac1542,所在质粒命名为pUC118- lac1542。利用ClustalW软件对Lac1542进行同源性分析并使用MEGA 4.0软件构建系统发育树。
1.5 漆酶基因的克隆及在大肠杆菌中的表达条件优化以pUC118-lac1542为模板,设计如下引物进行PCR扩增:Lac1542F (5′-CCGGAATTCATGACACT TGAAAAATTTGTGGAT-3′)和Lac1542R (5′- GCTCTAGATCAGTTATGGGGATCAGTTATAT-3′) (下划线部分代表酶切位点,斜体部分代表保护碱基)。反应体系(15 μL):模板1 ng,2×PrimeSTAR Max Premix 7.5 μL,10 pmol/μL上、下游引物各1 μL,添加无菌双蒸水至总体积15 μL。扩增条件:95 ℃ 5 min;98 ℃ 10 s,58 ℃ 10 s,72 ℃ 15 s,30个循环;72 ℃ 5 min。PCR产物用EcoR I/Xba I双酶切后回收连接在用同样的酶处理过的pET-28a上,电击转化大肠杆菌BL21(DE3)pLysS。挑转化子检测后命名为Lac1542/BL21并接种至LB液体培养基培养至OD600为0.6,分别添加终浓度为0.1−4.0 mmol/L的IPTG和0.1−1.5 mmol/L的CuSO4,不同温度(20、25、30、37 ℃)下200 r/min培养8 h诱导目的蛋白表达。
1.6 重组漆酶纯化、分子量大小估算及蛋白浓度测定在4 ℃、8 000 r/min离心10 min取细胞超声波破碎(400 W,工作3 s,间隔5 s,工作时间10 min),根据蛋白纯化试剂盒使用说明书纯化蛋白。SDS-PAGE凝胶电泳检测酶的纯度并估算分子量。NanoDrop 2000微量紫外分光光度计280 nm下测定酶蛋白的浓度[ε=8.849×104 L/(mol·cm)]。
1.7 酶活性的测定漆酶活性测定采用ABTS法[35],25 ℃预热含0.5 mmol/L ABTS的缓冲液(pH 4.0),加入适量的酶启动反应。用iMark酶标仪在405 nm下测量光吸收值变化,以1 min内氧化1μmol ABTS所需要的酶量定义为1个单位(U) [ε=3.6×104 L/(mol·cm)],Mnp和CIP活性测定参考前期工作[33-34]。
1.8 酶学特性研究 1.8.1 pH对酶反应的影响最适反应pH测定采用柠檬酸-磷酸缓冲液(pH 3.0−8.0),200 μL反应体系含390 ng纯化的Lac1542,其它条件同1.7。pH稳定性测定取纯化后的Lac1542,先置于上述缓冲液内冰上保温2 h,再调至最适pH,75 ℃测定剩余酶活,以未处理的酶作对照,每个反应至少3个重复。
1.8.2 温度对酶反应的影响最适反应温度测定设置温度范围30−90 ℃,每5 ℃为一个梯度。以pH 4.0的醋酸钠(NaAc)作为缓冲液,其它条件同最适pH测定。温度稳定性测定取纯化后的Lac1542,先置于不同温度下保温2 h,冰上冷却,再按最适条件测定剩余酶活,每个反应至少3个重复。
1.8.3 动力学参数的测定以不同浓度的ABTS、2, 6-DMP、SGZ、儿茶酚和愈创木酚为底物,以pH 4.0的NaAc为缓冲液,反应温度设为75 ℃;相应波长下测量吸光值的变化(2, 6-DMP、儿茶酚和愈创木酚使用波长450 nm;SGZ使用540 nm),计算出各浓度下不同底物对应的酶活,每个反应至少3个重复。动力学参数(Km和kcat)采用GraphPad prism 6软件中的米氏方程计算、拟合。
1.8.4 金属离子对酶反应的影响将适量的酶和不同的金属离子在pH 4.0的NaAc缓冲液中4 ℃预处理15 min,加入1 mmol/L CuSO4和0.5 mmol/L ABTS起始反应,在最适条件下测酶活,以未加金属离子的反应作为对照,计算出相对活性,每个反应至少3个重复。
1.9 木质素降解的协同效应 1.9.1 Mnp和CIPmt5粗酶液的获得 1.9.2 木质素含量的测定参考文献[33]。
1.9.3 Lac1542降解木质素以50 mmol/L丁二酸钠(pH 5.5)为缓冲液,4 mL反应体系含50 g/L木质素、1 mmol/L CuSO4、0.025 mmol/L ABTS、25 mmol/L MnSO4、2 U Lac1542,30 ℃反应8 h,测剩余木质素的含量,每个实验3个重复。
1.9.4 Mnp降解木质素以50 mmol/L丁二酸钠(pH 5.5)为缓冲液,4 mL体系含木质素50 g/L、25 μL的30% H2O2、25 mmol/L MnSO4、16 U Mnp,30 ℃反应8 h后测剩余木质素的含量,每个实验3个重复。
1.9.5 Lac1542和Mnp复合酶降解木质素将Lac1542和Mnp组成复合酶降解木质素经响应面优化,最佳的反应条件:反应体系4 mL,含15 μL的Lac1542 (1.8 U)、6.84 μL的Mnp (12 U)、30%双氧水20 μL,其它条件同1.9.3。
1.9.6 CIPmt5和Mnp复合酶降解木质素固定总酶量为12 U,将Mnp和CIPmt5以不同的比例混合(1:4、2:3、1:1、3:2、4:1)用于降解木质素,其余条件同1.9.4。
1.9.7 Lac1542、CIPmt5和Mnp复合酶降解木质素Lac1542用量分别为15 μL和30 μL (1.8 U和3.6 U),添加0.025 mmol/L ABTS和1 mmol/L CuSO4,其余条件同1.9.6。
1.10 核酸序列登录号所报道序列已经提交至GenBank (登录号MF579951)。
2 结果与分析 2.1 宏基因组文库的构建和漆酶基因的筛选所构建的宏基因组文库得到的库容量约10 700个克隆。随机选取20个克隆提质粒进行酶切检测,片段插入率为100%;插入片段平均大小为4.5 kb,大小范围从2.5−8.0 kb,包含约48 Mb的土壤微生物DNA信息。酶切结果显示所建文库的DNA插入片段高度多样化。经过初筛和复筛从文库中得到一个具有漆酶活性的克隆。
2.2 Lac1542序列分析测序分析显示4.2 kb的插入片段中存在一个完整的编码漆酶基因的开放阅读框。该基因全长1 542 bp,编码513个氨基酸组成的多肽,所编码的蛋白属于含铜多酚氧化酶家族,命名为Lac1542。NCBI数据库序列比对显示该蛋白在氨基酸水平上与施氏假单胞菌漆酶(AND62506.1)和枯草芽孢杆菌多铜氧化酶(WP_042977959.1B)有99%相似性;与真菌漆酶相似性低:酿酒酵母S288C漆酶(NP_116612.1) 20%、裂殖酵母972h漆酶(NP_594494.1) 22%、灵芝漆酶(ACR24357.1) 22%。系统发育树构建结果显示Lac1542与施氏假单胞菌漆酶亲缘关系最近,聚在同一分支(图 1),证明得到的是细菌漆酶。

|
|
图 1 Lac1542 (uncultured bacterium MF579951)和近似相关蛋白系统发育分析
Figure 1 Phylogenetic analysis of Lac1542 (uncultured bacterium MF579951) and closely related proteins
注:分支点上的数字表示构建系统树时1 000次计算形成该节点的百分比;括号内为GenBank登录号;标尺长度代表进化距离. Note: The bootstrap values (%) presented at the branches were calculated from 1 000 replications; Numbers in parentheses are GenBank accession numbers; The scale bar represents sequence divergence. |
|
|
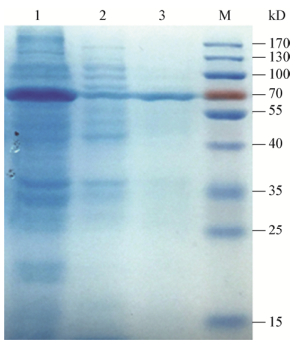
培养Lac1542/BL21至OD600达0.6时添加0.25 mmol/L IPTG、1 mmol/L CuSO4,30 ℃、200 r/min培养8 h诱导目的蛋白表达效果最佳。对诱导后的细胞进行超声波破壁,SDS-PAGE电泳结果显示蛋白以可溶性表达为主;纯化后得到了单一条带,分子量约为70 kD,与理论分析值相符(图 2)。重组蛋白对ABTS的比酶活为99.64 U/mg,还对SGZ、儿茶酚、愈创木酚和2, 6-DMP几种经典的漆酶底物显示了活性(表 1)。这些结果说明Lac1542是一个具有高酶活、底物范围广、可溶性表达的细菌漆酶,在工业生产中具有潜在的应用价值。
|
| 图 2 纯化后重组Lac1542的SDS-PAGE分析 Figure 2 SDS-PAGE analysis of purified recombinant Lac1542 注:M:蛋白分子量标准;1:细胞裂解上清;2:细胞裂解沉淀;3:纯化后的Lac1542. Note:M: Standard protein molecular mass markers (sizes in kilodaltons are indicated on the right); 1: Recombinant Lac1542 from supernatant of E. coli BL21(DE3)plysS cell lysates; 2: Recombinant Lac1542 from precipitation of E. coli BL21(DE3) plysS cell lysates; 3: Recombinant Lac1542 purified by Ni-NTA Spin column. |
|
|
| Substrate | Km (μmol/L) |
kcat (s-1) |
kcat/Km (L/(s·μmol)) |
Activity (U/mg) |
| ABTS | 194.9±3.219 | 100.4±3.27 | 0.516 | 99.64 |
| 2, 6-DMP | 407 7±11.32 | 0.112 6±0.017 | 3.00×10–5 | 0.061 |
| SGZ | 474 4±52.76 | 0.901 7±0.902 | 1.90×10–4 | 0.150 |
| Catechol | 620 2±76.73 | 0.644 5±0.021 | 1.04×10–4 | 0.549 |
| Guaiacol | 139 5±22.46 | 0.014 3±0.001 | 1.03×10–5 | 0.014 |
以ABTS为底物,重组Lac1542的最适pH为4.0,在pH 3.5−4.5保持有80%以上活性。此外,酶在pH 3.0−6.5范围内活性稳定,pH 6.5时处理2 h后残余酶活仍接近60% (图 3)。可以看出Lac1542是一种在较广范围pH内有活性且比较稳定的酶。

|
| 图 3 pH对Lac1542活性和稳定性的影响 Figure 3 Effect of pH on activity and stability of Lac1542 using ABTS as substrate |
|
|
以ABTS为底物,重组Lac1542的最适反应温度为75 ℃,90 ℃时仍保留70%活性。在70 ℃以下酶活性稳定,保温2 h仍有80%以上活性,75 ℃保温2 h酶活仍剩余50% (图 4)。可见该酶是一个非常耐热的漆酶,适合制浆、造纸、染料等工业上废水处理。

|
| 图 4 温度对Lac1542活性和稳定性的影响 Figure 4 Effect of temperature on activity and stability of Lac1542 using ABTS as substrate |
|
|
酶的动力学参数kcat/Km(催化效率)通常被当作衡量酶对底物专一性强弱的一个指标。催化效率最高的ABTS被认为是漆酶的最佳底物,其余最佳底物的顺序依次为:SGZ > 儿茶酚 > 2, 6-DMP > 愈创木酚(表 1)。
2.4.4 金属离子对酶活的影响以ABTS为底物研究了不同金属离子对漆酶活性的影响。结果显示,K+、Na+、Ca2+、Mg2+、Fe2+和Fe3+对酶都起抑制作用;10 mmol/L以下的NH4+对酶有激活作用;Mn2+和Cu2+在100 mmol/L时仍能促进酶的活性(表 2)。这对于以后该酶和依赖Mn2+的Mnp组成复合酶系进行木质素降解时有着不可比拟的优势。
| Metal ions | Metal salts | Metal ions concentration (mmol/L) | ||
| 1 | 10 | 100 | ||
| Control | None | 100.00 | 100.00 | 100.00 |
| Cu2+ | CuSO4 | 100.00 | 137.80 | 139.53 |
| Fe3+ | FeCl3 | 83.66 | 80.09 | − |
| Na+ | NaCl | 98.43 | 67.77 | 11.75 |
| Fe2+ | FeSO4 | 5.59 | 15.36 | 30.24 |
| Mg2+ | MgCl2 | 88.43 | 61.63 | 9.05 |
| Ca2+ | CaCl2 | 90.52 | 57.96 | 9.93 |
| K+ | KCl | 87.07 | 70.67 | 13.78 |
| Mn2+ | MnSO4 | 120.42 | 115.59 | 111.98 |
| NH4+ | (NH4)2SO4 | 118.65 | 112.19 | 94.48 |
| 注:−:未检测. Note: −: No detection. |
||||
单一的酶降解木质素效率都不高,2 U的Lac1542仅降解18.7%的木质素;16 U的Mnp可降解木质素22.4%;将Lac1542和Mnp组成复合酶系,通过响应面优化1.8 U Lac1542和12 U Mnp即可提高木质素降解率至47.8% (图 5A)。固定总的过氧化物酶量为12 U,将Mnp和CIPmt5以不同比例混合降解木质素效率都高于单独的16 U Mnp,其中以1:1混合的情况下降解率最高,可达48.9%。将3种酶组成复合酶系,漆酶1.8 U、CIPmt5和Mnp比例为2:3时组成的复合酶系对木质素的降解效果最好,达到71.5% (图 5B),说明3种酶组成的复合酶系可更有效地降解木质素。

|
| 图 5 酶降解木质素能力 Figure 5 lignin degradation ability using enzymes 注:A:漆酶Lac1542、锰过氧化物酶及其复合酶降解木质素能力;B:灰盖鬼伞过氧化物酶、锰过氧化物酶复合酶系及漆酶Lac1542、灰盖鬼伞过氧化物酶和锰过氧化物酶复合酶系降解木质素能力. Note: A: Lignin degradation using laccase Lac1542, Mnp, and Lac1542/Mnp complex enzyme respectively; B: Lignin degradation using complex enzyme containing CIP/Mnp, CIP/Mnp/Lac1542 respectively. |
|
|
漆酶因底物谱广、绿色环保、不需要昂贵的辅因子而在制浆、造纸、化妆品、生物传感器、有机污染物生物修复等领域得到了广泛的研究与应用[36]。在工业中使用的真菌漆酶反应pH偏酸,在中性至碱性往往失去活性,以ABTS为底物最适pH一般为2.5左右[15, 37];本实验筛选得到的Lac1542以ABTS为底物最适pH为4.0,以SGZ和愈创木酚为底物最适pH为8.0,反应pH范围广,比真菌漆酶更有优势。Lac1542最显著的特点是高浓度Mn2+仍然可以促进酶的活性。目前仅查到3篇关于Mn2+促进漆酶活性的报道。Kalyani等[36]报道1 mmol/L的Mn2+对红色亚栖热菌漆酶活性有促进作用,汪春蕾[38]报道5 mmol/L的Mn2+对枯草芽孢杆菌WD23芽孢漆酶有一定激活作用,但两篇文献均未涉及更高浓度Mn2+对酶活性的影响;Arias等[39]报道20 mmol/L Mn2+可以促进蓝色链霉菌CECT 3335漆酶活性,超过40 mmol/L则会产生抑制。Lac1542在100 mmol/L Mn2+存在时活性仍然不受抑制,这对于和Mnp组成复合酶系处理多种污染物有着天然的优势。Lac1542的第2个显著特点是反应温度高、热稳定性强。真菌漆酶的最适反应温度一般在30–60 ℃,嗜热菌来源的漆酶最适反应温度在50–60 ℃[40]。芽孢杆菌属来源的漆酶具有高的最适反应温度,Martins等报道了枯草芽孢杆菌的芽孢漆酶CotA最适反应温度为75 ℃,热稳定性强[28],和Lac1542相似;Koschorreck等报道了地衣芽孢杆菌的漆酶最适反应温度为85 ℃,70 ℃处理1 h酶活剩余43%[29],而Lac1542在70 ℃处理2 h酶活剩余80%以上。Lac1542第3个显著特点就是30 ℃诱导表达时以可溶性表达为主,浓缩、纯化简单,非常有利于工业应用。Martins等的枯草芽孢杆菌漆酶在大肠杆菌中以包涵体表达为主[28];Koschorreck等研究地衣芽孢杆菌漆酶原核表达时发现诱导温度超过18 ℃就会形成无活性的包涵体[29]。虽然Martins的枯草芽孢杆菌CotA在最适反应温度和耐热性上和Lac1542近似,但是以ABTS、SGZ和愈创木酚为底物时最适反应pH都低于Lac1542,CotA的包涵体表达方式使得它在工业应用前景上不如Lac1542。
为了验证耐Mn2+的Lac1542组成的复合酶系的功能,分别对Lac1542、Mnp、CIPmt5以及由其组成的复合酶系进行了木质素降解能力的检测。单一的细菌漆酶Lac1542处理木质素降解率仅有18.7%,远低于前期工作中云芝漆酶的降解能力[33],可能跟细菌漆酶氧化还原电势低有关,也可能跟反应温度有关。虽然提高温度后细菌漆酶降解木质素能力可能会有所提高,考虑到要组成复合酶系并且降低能耗,此处仍然选择了在30 ℃反应。CIPmt5本身不是木质素降解酶,和Mnp不同比例混合组成的复合酶系降解能力均高于Mnp;当加入低浓度Lac1542 (1.8 U)时,明显促进木质素降解,CIPmt5和Mnp的最适比例为2:3最合适;当加入较高浓度Lac1524 (3.6 U)且CIPmt5和Mnp比例大于1时反而会抑制木质素降解。多酶反应体系中高的Lac1542含量并不能促进木质素的降解,说明漆酶浓度低时3种酶之间存在着某种协同,漆酶浓度高时3种酶之间存在某种抑制效应,具体原因还有待于进一步研究。
| [1] |
de Gonzalo G, Colpa DI, Habib MHM, et al. Bacterial enzymes involved in lignin degradation[J]. Journal of Biotechnology, 2016, 236: 110-119. DOI:10.1016/j.jbiotec.2016.08.011 |
| [2] |
Mathews SL, Pawlak J, Grunden AM. Bacterial biodegradation and bioconversion of industrial lignocellulosic streams[J]. Applied Microbiology and Biotechnology, 2015, 99(7): 2939-2954. DOI:10.1007/s00253-015-6471-y |
| [3] |
Ćilerdžić J, Stajić M, Vukojević J. Activity of Mn-oxidizing peroxidases of Ganoderma lucidum depending on cultivation conditions[J]. BioResources, 2016, 11(1): 95-104. |
| [4] |
Davidi L, Mora sa S, Artzi L, et al. Toward combined delignification and saccharification of wheat straw by a laccase-containing designer cellulosome[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(39): 10854-10859. DOI:10.1073/pnas.1608012113 |
| [5] |
Cui YH, Wang Q, Gou GJ, et al. Advances in catalytic degradation liquefaction of lignin[J]. Materials Review, 2017, 31(5): 112-116, 133. 崔玉虎, 王奇, 苟光俊, 等. 木质素催化降解液化的研究进展[J]. 材料导报, 2017, 31(5): 112-116, 133. DOI:10.11896/j.issn.1005-023X.2017.05.018 |
| [6] |
Paliwal R, Uniyal S, Rai JPN. Evaluating the potential of immobilized bacterial consortium for black liquor biodegradation[J]. Environmental Science and Pollution Research, 2015, 22(9): 6842-6853. DOI:10.1007/s11356-014-3872-x |
| [7] |
Johannson M, Denekamp M, Asiegbu FO. Production and isozyme pattern of extracellular laccase in the S and P intersterility groups of the root pathogen Heterobasidion annosum[J]. Mycological Research, 1999, 103(3): 365-371. DOI:10.1017/S0953756298007436 |
| [8] |
Masarin F, Norambuena M, Ramires HOR, et al. Manganese peroxidase and biomimetic systems applied to in vitro lignin degradation in Eucalyptus grandis milled wood and kraft pulps[J]. Journal of Chemical Technology and Biotechnology, 2016, 91(5): 1422-1430. DOI:10.1002/jctb.2016.91.issue-5 |
| [9] |
Aarti C, Arasu MV, Agastian P. Lignin degradation: a microbial approach[J]. South Indian Journal of Biological Sciences, 2015, 1(3): 119-127. DOI:10.22205/sijbs/2015/v1/i3/100405 |
| [10] |
Galliano H, Gas G, Seris JL, et al. Lignin degradation by Rigidoporus lignosus involves synergistic action of two oxidizing enzymes: Mn peroxidase and laccase[J]. Enzyme and Microbial Technology, 1991, 13(6): 478-482. DOI:10.1016/0141-0229(91)90005-U |
| [11] |
Li TL. Properties of spore laccase from Bacillus subtilis WN02 and its use in dye decolorrization[D]. Harbin: Master's Thesis of Northeast Forestry University, 2010 (in Chinese) 李泰仑. 枯草芽孢杆菌WN02芽孢漆酶的性质及染料脱色研究[D]. 哈尔滨: 东北林业大学硕士学位论文, 2010 |
| [12] |
Jiang S. Characterization and dye decolorrization ability of Clostriridium prazmowski spore laccase[D]. Harbin: Master's Thesis of Northeast Forestry University, 2012 (in Chinese) 蒋帅. 梭状芽孢杆菌产漆酶的酶学性质及对染料脱色的研究[D]. 哈尔滨: 东北林业大学硕士学位论文, 2012 |
| [13] |
Li J. Produce laccase bacteria strain screening and its application[D]. Harbin: Master's Thesis of Northeast Forestry University, 2013 (in Chinese) 栗君. 产漆酶细菌菌株的筛选及其应用[D]. 哈尔滨: 东北林业大学硕士学位论文, 2013 |
| [14] |
Shi XW, Liu Q, Ma JS, et al. An acid-stable bacterial laccase identified from the endophyte Pantoea ananatis Sd-1 genome exhibiting lignin degradation and dye decolorization abilities[J]. Biotechnology Letters, 2015, 37(11): 2279-2288. DOI:10.1007/s10529-015-1914-1 |
| [15] |
Ai MQ, Wang FF, Huang F. Purification and characterization of a thermostable laccase from Trametes trogii and its ability in modification of Kraft lignin[J]. Journal of Microbiology and Biotechnology, 2015, 25(8): 1361-1370. DOI:10.4014/jmb.1502.02022 |
| [16] |
Zhu XF, Ding T. Effect of metal irons on activity of two laccases[J]. Chemical Research, 2003, 14(3): 50-51, 54. 朱显峰, 丁涛. 常见金属离子对漆酶酶活的影响[J]. 化学研究, 2003, 14(3): 50-51, 54. |
| [17] |
Xu F, Damhus T, Danielsen S, et al. Catalytic applications of laccase[A]//Schmid RD, Urlacher VB. Modern Biooxidation[M]. Weinheim: Wiley-VCH, 2007: 43-75
|
| [18] |
Koschorreck K, Schmid RD, Urlacher VB. Improving the functional expression of a Bacillus licheniformis laccase by random and site-directed mutagenesis[J]. BMC Biotechnology, 2009, 9: 12. DOI:10.1186/1472-6750-9-12 |
| [19] |
Alexandre G, Zhulin IB. Laccases are widespread in bacteria[J]. Trends in Biotechnology, 2000, 18(2): 41-42. DOI:10.1016/S0167-7799(99)01406-7 |
| [20] |
Hullo MF, Moszer I, Danchin A, et al. CotA of Bacillus subtilis is a copper-dependent laccase[J]. Journal of Bacteriology, 2001, 183(18): 5426-5430. DOI:10.1128/JB.183.18.5426-5430.2001 |
| [21] |
Suzuki T, Endo K, Ito M, et al. A thermostable laccase from Streptomyces lavendulae REN-7: purification, characterization, nucleotide sequence, and expression[J]. Bioscience, Biotechnology, and Biochemistry, 2003, 67(10): 2167-2175. DOI:10.1271/bbb.67.2167 |
| [22] |
Brander S, Mikkelsen JD, Kepp KP. Characterization of an alkali- and halide- resistant laccase expressed in E. coli: CotA from Bacillus clausii[J]. PLoS One, 2014, 9(6): e99402. DOI:10.1371/journal.pone.0099402 |
| [23] |
Ruijssenaars HJ, Hartmans S. A cloned Bacillus halodurans multicopper oxidase exhibiting alkaline laccase activity[J]. Applied Microbiology and Biotechnology, 2004, 65(2): 177-182. |
| [24] |
Zhao M, Wei XD, Wang CL, et al. Research progress of bacterial laccase[J]. Transactions of China Pulp and Paper, 2008, 23(3): 107-114. 赵敏, 魏兴东, 汪春蕾, 等. 细菌漆酶的研究进展[J]. 中国造纸学报, 2008, 23(3): 107-114. |
| [25] |
Sharma P, Goel R, Capalash N. Bacterial laccases[J]. World Journal of Microbiology and Biotechnology, 2007, 23(6): 823-832. DOI:10.1007/s11274-006-9305-3 |
| [26] |
Singh G, Capalash N, Goal R, et al. A pH-stable laccase from alkali-tolerant γ-proteobacterium JB: purification, characterization and indigo carmine degradation[J]. Enzyme and Microbial Technology, 2007, 41(6/7): 794-799. |
| [27] |
Wang CL, Cui DZ, Lu L, et al. Cloning and characterization of CotA laccase from Bacillus subtilis WD23 decoloring dyes[J]. Annals of Microbiology, 2016, 66(1): 461-467. DOI:10.1007/s13213-015-1128-8 |
| [28] |
Martins LO, Soares CM, Pereira MM, et al. Molecular and biochemical characterization of a highly stable bacterial laccase that occurs as a structural component of the Bacillus subtilis endospore coat[J]. The Journal of Biological Chemistry, 2002, 277(21): 18849-18859. DOI:10.1074/jbc.M200827200 |
| [29] |
Koschorreck K, Richter SM, Ene AB, et al. Cloning and characterization of a new laccase from Bacillus licheniformis catalyzing dimerization of phenolic acids[J]. Applied Microbiology and Biotechnology, 2008, 79(2): 217-224. DOI:10.1007/s00253-008-1417-2 |
| [30] |
Handelsman J, Rondon MR, Brady SF, et al. Molecular biological access to the chemistry of unknown soil microbes: a new frontier for natural products[J]. Chemistry and Biology, 1998, 5(10): R245-R249. DOI:10.1016/S1074-5521(98)90108-9 |
| [31] |
Ausec L, Berini F, Casciello C, et al. The first acidobacterial laccase-like multicopper oxidase revealed by metagenomics shows high salt and thermo-tolerance[J]. Applied Microbiology and Biotechnology, 2017, 101(15): 6261-6276. DOI:10.1007/s00253-017-8345-y |
| [32] |
Ye M, Li G, Liang WQ, et al. Molecular cloning and characterization of a novel metagenome-derived multicopper oxidase with alkaline laccase activity and highly soluble expression[J]. Applied Microbiology and Biotechnology, 2010, 87(3): 1023-1031. DOI:10.1007/s00253-010-2507-5 |
| [33] |
Dong BX. Synthesis, site-specific mutagenesis, expression in Pichia pastoris of ligninolytic enzymes from the white rot fungi and their degradability to lignocellusic stuff used for paper industry[D]. Guangzhou: Doctoral Dissertation of Sun Yat-Sen University, 2008 (in Chinese) 董冰雪. 白腐真菌木质素降解酶的合成、定点突变、毕赤酵母表达以及它们对造纸工业中木质纤维原料降解的研究[D]. 广州: 中山大学博士学位论文, 2008 |
| [34] |
Zhang L, Zhang W, Fang JT, et al. Directed evolution of Coprinus cinereus peroxidase to improve the decolorization of textile wastewaters[J]. Microbiology China, 2017, 44(4): 774-782. 张磊, 张伟, 方金涛, 等. 定向进化提高灰盖鬼伞过氧化物酶染织废水脱色效率[J]. 微生物学通报, 2017, 44(4): 774-782. |
| [35] |
Galai S, Korri-Youssoufi H, Marzouki MN. Characterization of yellow bacterial laccase SmLac/role of redox mediators in azo dye decolorization[J]. Journal of Chemical Technology and Biotechnology, 2014, 89(11): 1741-1750. DOI:10.1002/jctb.2014.89.issue-11 |
| [36] |
Kalyani DC, Munk L, Mikkelsen JD, et al. Molecular and biochemical characterization of a new thermostable bacterial laccase from Meiothermus ruber DSM 1279[J]. RSC Advances, 2016, 6(5): 3910-3918. DOI:10.1039/C5RA24374B |
| [37] |
Han MJ, Choi HT, Song HG. Purification and characterization of laccase from the white rot fungus Trametes versicolor[J]. Journal of Microbiology, 2005, 43(6): 555-560. |
| [38] |
Wang CL. Clone and heterologous expression of CotA gene of spore coat protein pocessing bacterial laccase activity[D]. Harbin: Doctoral Dissertation of Northeast Forestry University, 2010 (in Chinese) 汪春蕾. 具细菌漆酶活性的芽孢外壁蛋白CotA基因克隆及异源表达研究[D]. 哈尔滨: 东北林业大学博士学位论文, 2010 |
| [39] |
Arias ME, Arenas M, Rodríguez J, et al. Kraft pulp biobleaching and mediated oxidation of a nonphenolic substrate by laccase from Streptomyces cyaneus CECT 3335[J]. Applied and Environmental Microbiology, 2003, 69(4): 1953-1958. DOI:10.1128/AEM.69.4.1953-1958.2003 |
| [40] |
Chefetz B, Chen Y, Hadar Y. Purification and characterization of laccase from Chaetomium thermophilium and its role in humification[J]. Applied and Environmental Microbiology, 1998, 64(9): 3175-3179. |
 2018, Vol. 45
2018, Vol. 45




