扩展功能
文章信息
- 郑家敏, 梁燕辉, 朱凡, 叶秀云, 林娟
- ZHENG Jia-Min, LIANG Yan-Hui, ZHU Fan, YE Xiu-Yun, LIN Juan
- 几丁质酶基因的克隆表达及酶学性质
- Cloning, expression and characterization of the chitinase gene from Vibrio sp. GR52
- 微生物学通报, 2018, 45(5): 1027-1034
- Microbiology China, 2018, 45(5): 1027-1034
- DOI: 10.13344/j.microbiol.china.170571
-
文章历史
- 收稿日期: 2017-07-22
- 接受日期: 2017-10-25
- 网络首发日期(www.cnki.net): 2017-11-07
几丁质(Chitin)是由N-乙酰-D-氨基葡萄糖通过β-l, 4-糖苷键连接而成的线性多糖[1]。几丁质是自然界中蕴藏量仅次于纤维素的有机物,主要存在于真菌细胞壁、虾壳、蟹壳、甲壳动物的外壳和肠道中,全世界每年能合成100亿t左右几丁质[2-4]。几丁质物理性质稳定,难溶于水、碱、稀酸和一般有机溶剂,仅能溶于浓盐酸、磷酸等无机强酸中并伴随着严重的降解,因此很难被有效利用[5]。随着海洋生物资源的不断开发利用和寡糖生理活性研究的深入,几丁质寡糖的应用价值逐渐被揭示。研究表明,几丁质降解产物及其衍生物具有调节人体pH、增强免疫、降低血糖血脂、抗菌消炎、抑制肿瘤生长、改善土壤微生物、诱导植物抗病等生物活性[6-14]。几丁质酶作为降解几丁质的工具酶,具有作用条件温和、高效、环保、酶解副反应少、产物安全性高等优点,将逐步取代传统的酸降解法[15]。因此,几丁质酶的开发应用引起了国内外研究者的广泛关注。
几丁质酶来源广泛,在细菌、真菌、放线菌、病毒和动植物中均被发现[2],目前研究最深入的是微生物几丁质酶。虽然产几丁质酶的微生物种类丰富,但应用到工业生产的菌株仅粘质沙雷氏菌(Serratia marcescens)、链霉菌(Streptomyces)和木霉(Trichoderma)等少数几类微生物。目前已报道的产几丁质酶菌株酶活力普遍较低,同时几丁质酶对虾壳、蟹壳、污水等废弃物中的金属离子比较敏感。不同来源的几丁质酶,其酶学性质有所差异,在分子量、最适反应pH和温度、金属离子的作用等方面也各不相同。本文采用基因工程方法克隆几丁质酶基因,构建重组工程菌BL21(DE3)/pET22b- chiGR52-1,诱导表达重组酶rchiGR52-1并进行分离纯化和酶学性质研究,以期为几丁质酶的开发应用奠定基础。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒弧菌GR52菌株从广西北海红树林底泥中筛选获得;基因克隆宿主菌Escherichia coli Top10为本实验室保存菌株;表达宿主菌Escherichia coli BL21(DE3)购于Novagen有限公司;质粒pET-22b(+)购自北京全式金(TRANS)有限公司。
1.1.2 主要试剂和仪器及培养基Pfu DNA polymerase,北京全式金(TRANS)有限公司;质粒提取试剂盒,OMEGA公司;限制性内切酶、T4 DNA连接酶、蛋白Marker,Thermo Fisher Scientific公司;IPTG (Isopropyl β-D- Thiogalactoside),Amresco公司。
梯度热循环PCR仪,德国Eppendorf公司;凝胶成像仪,上海培清科技有限公司;电泳仪和电泳槽,日本ATTO公司;高压蒸汽灭菌锅,SHENAN公司;超净工作台,苏州安泰空气技术有限公司;隔水式恒温培养箱,上海一恒科技有限公司;可见分光光度计,上海精密科学仪器有限公司;高速冷冻离心机,日本HITACHI公司。
LB培养基参照文献[3]配制。
1.2 实验方法 1.2.1 基因克隆设计引物chiGR52-1-F (5′-CATGGATCCGGCA CCTTCAGCTCCGTCAATCGATC-3′)和chiGR52- 1-R (5′-TCGAAGCTTAGGCGTCTGGCACTCGGC CG-3′),以弧菌GR52菌株DNA为模板,PCR扩增chiGR52-1基因。PCR反应体系(50 µL):2×Pfu PCR Master 25 µL,chiGR52-1-F (20 µmol/L) 1.5 µL,chiGR52-1-R (20 µmol/L) 1.5 µL,基因组DNA (20 ng/µL) 3 µL,ddH2O 19 µL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,58.5 ℃ 30 s,72 ℃ 2.5 min,30个循环;72 ℃ 10 min;10 ℃保存。将PCR产物进行琼脂糖凝胶电泳验证,回收目的片段。
1.2.2 表达载体构建将chiGR52-1基因和质粒pET-22b(+)用BamHⅠ和Hind Ⅲ双酶切,回收的目的基因片段和酶切质粒用T4 DNA连接酶连接,构建重组表达质粒pET-22b-chiGR52-1,转化至感受态细胞Escherichia coli Top10,挑选阳性克隆子送至Invitrogen公司测序,将序列正确的重组质粒转化至感受态细胞Escherichia coli BL21(DE3)。
1.2.3 序列分析采用Expasy中ProtParam (http://web.expasy.org/cgi-bin/protparam/protparam)预测几丁质酶chiGR52-1基因的蛋白质分子量以及等电点等;采用SignalP 4.1 (http://www.cbs.dtu.dk/services/SignalP/)预测蛋白质信号肽以及剪切位点,为目的蛋白表达提供一定基础条件;利用SWISS-MODEL (http://swissmodel.expasy.org/)在线对几丁质酶进行同源建模。
1.2.4 重组酶rchiGR52-1的诱导表达将构建的大肠杆菌工程菌接种到LB液体培养基(含100 mg/L Amp)中,37 ℃、200 r/min振荡培养。菌液OD600达到0.5-0.8时,加入IPTG (终浓度为1 mmol/L)进行诱导,以未添加IPTG诱导作为对照组。将菌液4 ℃、13 000 r/min离心5 min,收集上清液并测定几丁质酶活力。
1.2.5 重组酶rchiGR52-1的酶活力检测采用DNS (3, 5-二硝基水杨酸)法测定还原糖含量[16]。取0.1 mL酶液与0.9 mL的0.5%胶体几丁质底物,于50 ℃水浴反应30 min后,加入1.5 mL DNS并煮沸5 min显色;同时以灭活酶液组作为空白对照。6 000 r/min离心5 min,取上清液于540 nm测定吸光值,根据N-乙酰-D-氨基葡萄糖标准曲线计算还原糖含量。酶活力单位定义为:在该反应条件下,1 min催化底物产生1 μmol N-乙酰-D-氨基葡萄糖所需的酶量定义为1个酶活力单位(U)。
1.2.6 重组酶rchiGR52-1的分离纯化利用中空纤维柱对诱导上清液进行初步浓缩;通过Ni-NTA亲和层析对重组酶rchiGR52-1进行分离纯化,SDS-PAGE检测纯度。
1.2.7 重组酶rchiGR52-1的比活力测定采用考马斯亮蓝染色(Bradford)法测定纯化重组酶的蛋白含量[17-18];在最适反应条件下测定重组酶活力,计算比活力(酶活力/蛋白含量)。
1.2.8 重组酶rchiGR52-1的酶学性质研究(1) 最适反应pH和pH稳定性研究:在50 ℃条件下,分别测定在不同pH缓冲溶液配制的胶体几丁质底物中的重组酶rchiGR52-1酶活力,以测得的最高酶活力值为100%计算相对酶活力,确定最适反应pH;将重组酶rchiGR52-1置于不同pH缓冲液中37 ℃条件下保温1 h,在最适pH和温度下测定酶活力,以未处理组的酶活力为100%计算各pH下几丁质酶的残余酶活百分比。
(2) 最适反应温度和热稳定性研究:在最适pH条件下,分别测定在不同温度(30、40、50、60、70 ℃)下的重组酶rchiGR52-1酶活力,以测得的最高酶活力为100%计算相对酶活力,确定最适反应温度;将重组酶rchiGR52-1分别置于不同温度中保温不同时间(2、5、8、15、30、45、60 min),并在最适pH和温度下测定酶活力,以未处理组的酶活力为100%,计算各温度条件下几丁质酶的残余酶活百分比。
(3) 不同金属离子及化学试剂对酶活力的影响:在最适反应条件下,比较浓度为1 mmol/L和5 mmol/L的16种金属离子(Na+、K+、Li+、Ag+、Mn2+、Ca2+、Co2+、Cu2+、Mg2+、Ni2+、Fe2+、Hg2+、Zn2+、Pb2+、Cr3+、Fe3+)和3种化学试剂[EDTA (乙二胺四乙酸)、SDS (十二烷基硫酸钠)、β-巯基乙醇]对重组酶rchiGR52-1酶活力的影响,以相同条件下未加金属离子和化学试剂的酶促反应为对照。
(4) 重组酶rchiGR52-1的Km值和Vmax值测定:配制不同浓度(0.5、1.0、1.5、2.0、2.5、5.0 g/L)的胶体几丁质底物,在最适反应条件下测定酶活力,重复3次,计算酶促反应速度,利用双倒数法求得Km值和Vmax值[19]。
(5) 酶底物特异性研究:分别配制0.5% (质量体积比)的胶体几丁质、细粉几丁质、虾壳粉、壳聚糖、羧甲基纤维素钠(CMC-Na)底物,在最适条件下测定重组酶rchiGR52-1酶活力,确定该重组酶对不同底物的作用特异性。
2 结果与分析 2.1 几丁质酶全长基因调取及序列分析以弧菌GR52菌株基因组DNA为模板,设计全长特异性引物进行PCR扩增得到一条2 500 bp左右的片段(图 1)。将该片段测序获得的序列利用Vector NTⅠ进行分析,寻找开放阅读框,在NCBI数据库中进行蛋白序列比对,确认该序列为完整的几丁质酶全长基因,记为chiGR52-1。
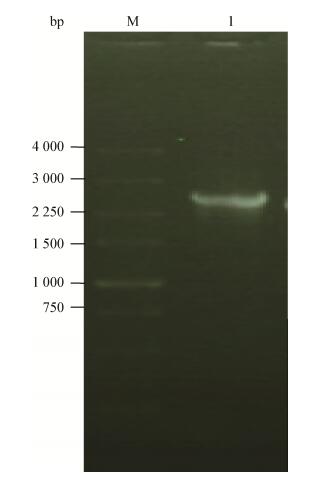
|
| 图 1 几丁质酶基因chiGR52-1的PCR扩增电泳图 Figure 1 PCR products of chitinase gene chiGR52-1 注:M:5 000 bp DNA Marker;1:PCR扩增产物. Note: M: 5 000 bp DNA Marker; 1: PCR products. |
|
|
几丁质酶基因chiGR52-1全长2 553 bp,编码850个氨基酸和1个终止密码子,经预测,等电点为4.39,分子量为87.22 kD。将核酸序列翻译成氨基酸序列,采用NCBI中的BLASTp功能,与数据库中的蛋白序列进行比对。在数据库中,最相似的蛋白是Chitinase [Vibrio fluvialis] WP044365306.1和WP032080440.1,一致性均只有80%,因此,chiGR52-1蛋白是一个比较新颖的蛋白。SignalP4.1在线预测结果表明该蛋白有强信号肽,信号肽切割位点在第26和27个氨基酸之间。SWISS-MODEL在线对几丁质酶chiGR52-1进行同源模建,以3arr.1作为模型,对全长850个氨基酸的几丁质酶chiGR52-1第27-593个氨基酸进行结构模拟,得到一个蛋白质结构(图 2A),一致性为79.79%。一般来说,当2个蛋白质序列一致性大于50%,其结构上的相似性能够达到90%;当2个蛋白质序列一致性低于30%时,二者结构上的相似性就较低[20]。通过Saves服务器(http://services.mbi.ucla.edu/SAVES/)和ProSA[21](https//prosa.services.came.sbg.ac.at/prosa.php)对模拟的结构进行了多种参数的检验,ERRAT、ProSA、Verify-3D值分别为95.471、-11.04、99.82%,表明该蛋白结构是合理的。通过Pymol软件分析蛋白的静电势分布情况(图 2B),图中红色部分表示负电,蓝色部分表示正电。
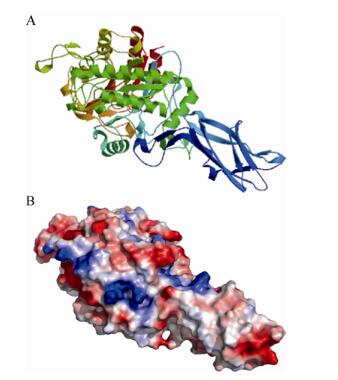
|
| 图 2 几丁质酶chiGR52-1蛋白三维结构图(A)和表面电势图(B) Figure 2 Three-dimensional structure (A) and surface (B) of chiGR52-1 |
|
|
重组工程菌BL21(DE3)/pET22b-chiGR52-1经IPTG诱导分泌重组酶rchiGR52-1。诱导结束后,离心收集上清液测定几丁质酶活力并进行SDS- PAGE检测(图 3)。结果发现经过IPTG诱导的发酵上清液在90 kD处出现一条明显的蛋白条带,与预测的理论分子量大小(87.22 kD)一致,说明重组几丁质酶基因chiGR52-1在大肠杆菌中诱导表达成功。

|
| 图 3 SDS-PAGE分析纯化重组酶rchiGR52-1 Figure 3 SDS-PAGE analysis of purified recombinant rchiGR52-1 注:M:Protein marker;1:纯化重组酶;2:经IPTG诱导发酵上清液;3:未经IPTG诱导发酵上清液. Note: M: Protein marker; 1: The purified rchiGR52-1; 2: Fermentation with IPTG; 3: Fermentation without IPTG. |
|
|
将诱导和未经诱导的发酵上清液经过中空纤维柱初步浓缩、镍柱纯化后得到单一条带(图 3泳道1),表明重组酶rchiGR52-1已获得纯化。在最适反应条件下测定重组酶rchiGR52-1比活力为4.33 U/mg。
2.3 重组酶rchiGR52-1的性质分析 2.3.1 最适反应pH和pH稳定性将rchiGR52-1置于不同pH缓冲液中测定酶活力,结果表明该重组酶的最适反应pH为6.0;当pH < 3.0或pH > 11.0时,酶活力基本为0 (图 4A)。将rchiGR52-1置于不同pH缓冲液中37 ℃保温1 h并测定残余酶活力,结果表明该酶在pH 5.0-10.0范围内稳定性较好,能保持86%以上的相对酶活力;在pH低于4.0条件下该酶完全失活(图 4B)。

|
| 图 4 重组酶rchiGR52-1最适反应pH (A)和pH稳定性(B) Figure 4 Effect of pH on activity (A) and stability (B) of rchiGR52-1 |
|
|
将rchiGR52-1置于不同温度中测定酶活力,结果表明该重组酶的最适反应温度为50 ℃ (图 5A)。将rchiGR52-1置于不同温度中保温1 h并在最适反应条件下测定残余酶活力,结果表明该酶在45 ℃以下稳定性较好,在50 ℃保温1 h能保持60%以上的相对酶活力,超过50 ℃酶快速失活(图 5B)。

|
| 图 5 重组酶rchiGR52-1最适反应温度(A)和热稳定性(B) Figure 5 Effect of temperature on activity (A) and stability (B) of rchiGR52-1 |
|
|
测定16种不同金属离子及化学试剂在1 mmol/L和5 mmol/L浓度下对重组酶rchiGR52-1酶活力的影响(表 1)。结果表明:在1 mmol/L浓度下,Mn2+、Co2+、Li+、Hg2+、Ag+、SDS对该酶具有不同程度的抑制作用,其中Hg2+对该酶有强烈的抑制作用,残余酶活只有1.2%,Cu2+和Ca2+对该酶则有27.8%和31.5%的促进作用;在5 mmol/L浓度下,Mn2+、Co2+、Li+、SDS、Fe2+、Ag+、Hg2+对该酶有明显的抑制作用,其中Hg2+对该酶的抑制作用为100%,Ni2+对该酶具有一定的促进作用,其他离子和化学试剂对该酶没有明显的影响。
| 试剂 Additives |
浓度 Concentration (mmol/L) |
相对酶活 Relative activity (%) |
浓度 Concentration (mmol/L) |
相对酶活 Relative activity (%) |
| Control | - | 100.0±0.0 | - | 100.0±0.0 |
| Na+ | 1 | 110.5±4.2 | 5 | 110.4±1.0 |
| Mn2+ | 1 | 76.7±2.8 | 5 | 56.8±5.1 |
| Cu2+ | 1 | 127.8±3.4 | 5 | 107.2±1.0 |
| Ni2+ | 1 | 100.8±1.0 | 5 | 124.7±3.4 |
| Mg2+ | 1 | 97.2±5.2 | 5 | 83.8±4.2 |
| Gr3+ | 1 | 102.7±2.8 | 5 | 104.8±0.2 |
| Co2+ | 1 | 83.5±1.0 | 5 | 62.3±3.4 |
| Li+ | 1 | 60.9±1.2 | 5 | 49.5±5.0 |
| Ca2+ | 1 | 131.5±2.7 | 5 | 111.8±2.2 |
| Fe2+ | 1 | 104.6±3.6 | 5 | 67.5±6.5 |
| Fe3+ | 1 | 110.4±6.8 | 5 | 102.3±7.6 |
| Hg2+ | 1 | 1.2±1.4 | 5 | 0.0±0.0 |
| Ag+ | 1 | 87.6±6.1 | 5 | 70.8±6.7 |
| Zn2+ | 1 | 93.1±4.5 | 5 | 88.2±4.6 |
| K+ | 1 | 95.5±4.6 | 5 | 94.8±4.0 |
| Pb2+ | 1 | 96.5±0.9 | 5 | 96.1±3.5 |
| SDS | 1 | 79.1±5.5 | 5 | 40.2±4.0 |
| EDTA | 1 | 93.7±4.5 | 5 | 84.7±4.7 |
| β-巯基乙醇 β-Mercaptoethanol |
1 | 103.1±4.2 | 5 | 95.6±1.4 |
| Note: -: Without treatment. | ||||
采用Linewaeaver-Burk作图法,测得重组酶rchiGR52-1的Vmax为0.19 μmol/(mL·min),Km为0.85 mg/mL,kcat为7.02 s-1 (表 2)。
以0.5% (质量体积比)胶体几丁质、细粉几丁质、虾壳粉、壳聚糖、羧甲基纤维素钠(CMC-Na)为底物,测定重组酶在不同底物下的酶活力,以底物为胶体几丁质的酶活力为100%计算其他底物的相对酶活力。结果如表 3所示,重组酶rchiGR52-1对胶体几丁质有很高的酶活力,对细粉几丁质只有10.9%的酶活力,对虾壳粉有微弱的酶活力,对壳聚糖和羧甲基纤维素钠没有酶活力。可见,重组几丁质酶rchiGR52-1只能特异性地降解几丁质,不能降解壳聚糖、纤维素等几丁质结构类似物。推测其底物作用方法与纤维素酶不同,只能特异地与几丁质结合。
| 底物 Substrate |
相对酶活力 Relative activity (%) |
| 胶体几丁质Colloidal chitin | 100.0±2.6 |
| 细粉几丁质Powdery chitin | 10.9±0.2 |
| 虾壳粉Shrimp shell meal | 3.8±1.4 |
| 壳聚糖Chitosan | No detected |
| 羧甲基纤维素钠CMC-Na | No detected |
以弧菌GR52基因组DNA为模板,克隆几丁质酶基因chiGR52-1全长,构建工程菌——大肠杆菌BL21(DE3)/pET22b(+)-chiGR52-1进行诱导表达,对重组酶rchiGR52-1进行分离纯化和酶学性质研究。
重组酶的最适反应pH为6.0,最适反应温度为50 ℃,在pH 5.0-10.0、45 ℃以下稳定性较好;低浓度(1 mmol/L)下Cu2+、Ca2+对该酶具有一定促进的作用,而高浓度(5 mmol/L)下Ni2+则具有促进作用;在1 mmol/L和5 mmol/L浓度下,Mn2+、Co2+、Li+、Hg+、Ag+和SDS对该酶都具有抑制作用,其中Hg+对该酶的抑制作用为100%。酶促反应参数Km、Vmax、kcat分别为0.85 mg/mL、0.19 μmol/(mL·min)和7.02 s-1,底物特异性分析表明该重组酶能特异性降解几丁质。吕梦圆等[4]采用重组大肠杆菌表达几丁质酶LICHI18A,以胶体几丁质作为底物的催化动力学参数Km、Vmax分别为2.913 mg/mL、2.836 μmol/(min·mg),kcat为0.024 s-1 (表 2)。相比之下,本文构建表达的重组几丁质酶rchiGR52-1具有较好的底物亲和力和较高的催化效率。
陶勇[3]和Konagaya等[22]的研究结果表明革兰氏阴性细菌来源几丁质酶的最适反应温度为35-45 ℃,最适反应pH分别为4.6和5.0,在pH 5.0-7.0范围内较为稳定;革兰氏阳性细菌来源几丁质酶的最适反应温度为40 ℃,最适反应pH为5.0,在pH 5.0-8.0范围内较为稳定。吕梦圆等[14]研究表明,重组几丁质酶在大肠杆菌中表达的最适反应温度和pH分别为37 ℃和3.8,在35 ℃以下热稳定性较好。Huo等[23]从Aeromonas veronii B565中克隆到一条产几丁质酶基因并成功表达,重组酶的最适反应温度和pH分别为40 ℃和6.0,在50 ℃下保温1 h剩余酶活力仅为20%,在pH 5.0-6.0范围内稳定性较好。相比之下,本文构建表达的重组几丁质酶rchiGR52-1,具有较高的最适反应温度(50 ℃)和良好的热稳定性(在50 ℃下保温1 h仍能保持60%以上的相对酶活力),并具有宽广的pH作用范围(pH 5.0-10.0),而且专一性强,这可能与蛋白表面电势有关,为拓宽几丁质酶的应用奠定了良好的基础。Hao等[24]研究表明,几丁质酶CHI Ⅰ和CHI Ⅱ蛋白结构稳定,表面具有较多的碱性氨基酸,可以吸收负电荷,对其稳定性起到了重要的作用。
| [1] |
Hao ZK, Cai YJ, Liao XR, et al. Optimization of nutrition factors on chitinase production from a newly isolated Chitiolyticbacter meiyuanensis SYBC-H1[J]. Brazilian Journal of Microbiology, 2012, 43(1): 177-186. DOI:10.1590/S1517-83822012000100019 |
| [2] |
Wang ZW, Liu ZM. Advance in study and application on chitinase produced by microbes[J]. Letters in Biotechnology, 2006, 17(3): 439-442. 王治伟, 刘志敏. 微生物几丁质酶研究进展[J]. 生物技术通讯, 2006, 17(3): 439-442. |
| [3] |
Tao Y. Identification of a chitinase-producing bacterial strain, characterization, gene cloning and expression of the chitinase[D]. Chengdu: Doctoral Dissertation of Sichuan University, 2006 (in Chinese) 陶勇. 一株产几丁质酶细菌的鉴定、酶的性质及其基因的克隆与表达[D]. 成都: 四川大学博士学位论文, 2006 |
| [4] |
Lv MY, Shi JX, Xia X, et al. Enzymatic properties of chitinase from recombinant Escherichia coli with different substrates and analysis of hydrolysates[J]. Food and Fermentation Industries, 2015, 41(3): 26-32. 吕梦圆, 石佳仙, 夏祥, 等. 大肠杆菌表达几丁质酶对不同底物的酶学性质及其降解产物分析[J]. 食品与发酵工业, 2015, 41(3): 26-32. |
| [5] |
Zhang YT. High-yield expression, characterization and application in aquaculture of two chitinolytic enzymes from an Aeromonas veronii strain B565[D]. Beijing: Master's Thesis of Chinese Academy of Agricultural Sciences, 2012 (in Chinese) 张宇婷. 来源于维氏气单胞菌B565的两个几丁质降解酶基因的高效表达、性质研究及水产养殖应用[D]. 北京: 中国农业科学院硕士学位论文, 2012 |
| [6] |
Ubhayasekera W, Karlsson M. Bacterial and fungal chitinase chiJ orthologs evolve under different selective constraints following horizontal gene transfer[J]. BMC Research Notes, 2012, 5: 581. DOI:10.1186/1756-0500-5-581 |
| [7] |
Zhang HB, Liu MY, Tian YJ, et al. Comparative characterization of chitinases from silkworm (Bombyx mori) and bollworm (Helicoverpa armigera)[J]. Cell Biochemistry and Biophysics, 2011, 61(2): 267-275. DOI:10.1007/s12013-011-9196-2 |
| [8] |
Langner T, G hre V. Fungal chitinases: function, regulation, and potential roles in plant/pathogen interactions[J]. Current Genetics, 2016, 62(2): 243-254. DOI:10.1007/s00294-015-0530-x |
| [9] |
Anuradha V, Revathi K. Antifungal potentiality of marine microbial chitinases isolated from crustacean shells[J]. Journal of Pure and Applied Microbiology, 2011, 5(1): 87-96. |
| [10] |
Zhang XB. Effects of chitosan oligosaccharide on the expression of IL-1β and TNF-α in macrophages[D]. Hangzhou: Master's Thesis of Zhejiang University, 2002 (in Chinese) 张小边. 壳寡糖对巨噬细胞IL-1β、TNF-α基因表达的影响[D]. 杭州: 浙江大学硕士学位论文, 2002 |
| [11] |
Yang MD, Qu ZH, Li YR, et al. The application of chitin, chitosan and its derivatives in food industry[J]. Food Science, 2001, 1(5): 97-99. 杨铭铎, 曲志华, 李元瑞, 等. 几丁质/几丁聚糖及其衍生物在食品中的应用[J]. 食品科学, 2001, 1(5): 97-99. |
| [12] |
Song GM. Construction on chitinase produced by recombinant Bacillus subtilis[D]. Wuxi: Master's Thesis of Jiangnan University, 2008 (in Chinese) 宋光明. 产几丁质酶重组枯草芽孢杆菌的构建[D]. 无锡: 江南大学硕士学位论文, 2008 |
| [13] |
Yao YP, Wang JM, Zhang ZG, et al. Role of N-acetyl-chito-oligosaccharides in plant diseases biological control of Trichoderma spp.[J]. Journal of Shanxi Agricultural Sciences, 2013, 41(2): 194-196. 姚艳平, 王建明, 张作刚, 等. 几丁寡糖在木霉菌生物防治中的作用[J]. 山西农业科学, 2013, 41(2): 194-196. |
| [14] |
Lv MY, Lv YL, Xia X, et al. Expression and inclusion body renaturation of recombinant chitinase in E. coli and its enzymology properties[J]. Science and Technology of Food Industry, 2015, 36(22): 168-172. 吕梦圆, 吕永玲, 夏祥, 等. 大肠杆菌重组几丁质酶的表达、包涵体复性及酶学性质研究[J]. 食品工业科技, 2015, 36(22): 168-172. |
| [15] |
Li J, Zeng ZW, Ouyang SW. Characters, gene expression regulation and applications of microbial chitinases[J]. Microbiology, 2001, 28(4): 84-87. 李君, 曾中文, 欧阳石文. 微生物几丁质酶的特性、基因表达调控及应用[J]. 微生物学通报, 2001, 28(4): 84-87. |
| [16] |
Liu D, Cai J, Xie CC, et al. Purification and partial characterization of a 36-kDa chitinase from Bacillus thuringiensis subsp. colmeri, and its biocontrol potential[J]. Enzyme and Microbial Technology, 2010, 46(3/4): 252-256. |
| [17] |
Li J, Zhang YT, Zeng W, et al. Determination of total protein content applications Coomassie brilliant blue[J]. Chinese Journal of Biologicals, 2000, 13(2): 118-120. 李娟, 张耀庭, 曾伟, 等. 应用考马斯亮蓝法测定总蛋白含量[J]. 中国生物制品学杂志, 2000, 13(2): 118-120. |
| [18] |
Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [19] |
Dixon M, Webb EC. Enzymes[M]. 3rd ed. New York: Academic Press, 1979.
|
| [20] |
Spezio M, Wilson DB, Karplus PA. Crystal structure of the catalytic domain of a thermophilic endocellulase[J]. Biochemistry, 1993, 32(38): 9906-9916. DOI:10.1021/bi00089a006 |
| [21] |
Sippl MJ. Recognition of errors in three-dimensional structures of proteins[J]. Proteins: Structure, Function, and Bioinformatics, 1993, 17(4): 355-362. DOI:10.1002/(ISSN)1097-0134 |
| [22] |
Konagaya Y, Tsuchiya C, Sugita H. Purification and characterization of chitinases from Clostridium sp. E-16 isolated from the intestinal tract of the South American sea lion (Otaria flavescens)[J]. Letters in Applied Microbiology, 2006, 43(2): 187-193. DOI:10.1111/lam.2006.43.issue-2 |
| [23] |
Huo FM, Ran C, Yang YL, et al. Gene cloning, expression and characterization of an exo-chitinase with high β-glucanase activity from Aeromonas veronii B565[J]. Acta Microbiologica Sinica, 2016, 56(5): 787-803. |
| [24] |
Hao ZK, Wu HG, Yang ML, et al. Cloning, expression and 3D structure prediction of chitinase from Chitinolyticbacter meiyuanensis SYBC-H1[J]. International Journal of Molecular Sciences, 2016, 17(6): 825. DOI:10.3390/ijms17060825 |
 2018, Vol. 45
2018, Vol. 45




