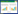扩展功能
文章信息
- 赵漫, 李冰, 马燕天, 何世耀, 牟晓真, 吴兰
- ZHAO Man, LI Bing, MA Yan-Tian, HE Shi-Yao, MOU Xiao-Zhen, WU Lan
- 应用环境微生物治理淡水湖泊微囊藻毒素污染的研究进展
- Advances in the application of environmental microbes to control microcystins in freshwater lake
- 微生物学通报, 2018, 45(4): 893-899
- Microbiology China, 2018, 45(4): 893-899
- DOI: 10.13344/j.microbiol.china.170709
-
文章历史
- 收稿日期: 2017-09-08
- 接受日期: 2017-12-20
- 网络首发日期(www.cnki.net): 2018-01-08
随着全球气候变暖和湖泊富营养化程度的加剧,世界范围内湖泊生态系统中有害蓝藻水华的发生频率和分布范围不断增加[1]。当淡水湖泊中大量的蓝细菌(称为"蓝绿藻")积聚在一起时,就会形成有害蓝藻水华(Cyanobacterial harmful algal blooms,CyanoHABs),进而产生各种次生有毒代谢物——藻毒素。微囊藻毒素(Microcystins,MCs)是全球淡水系统中最为常见、毒性最强的藻毒素,它不仅影响植物的生长和动物的新陈代谢,并且具有生物富集作用,能够对人类健康造成严重危害,是目前藻毒素毒性机理研究的重点。
许多学者提出了MCs污染治理的物理和化学方法,如活性炭的吸附法,氯化剂、臭氧、高锰酸钾、过氧化氢等化学氧化法等[2-5]。但是这些方法普遍存在高成本、低效率和容易造成二次污染等局限性。微生物在淡水湖泊生态系统的生物地球化学循环过程中起着不可替代的作用[6]。MCs的微生物降解本身就是自然环境中MCs降解的主要途径之一,这种途径安全高效具有巨大的应用潜力,因此开发以微生物介导的去除MCs的新技术迫在眉睫。此外,大力减少氮磷营养盐进入湖泊来控制富营养化,从源头出发控制淡水湖泊中蓝藻水华的形成也是根本举措之一[7-8]。
本文主要总结了微生物群落对淡水湖泊中MCs的响应研究进展,并介绍了目前应用微生物响应MCs的研究缺陷,以增强我们对MCs微生物响应机制的认识,为降低MCs生物学风险以及保证水生环境的安全提供指导。
1 藻毒素的产生及其严重危害 1.1 淡水湖泊中的蓝藻水华以及藻毒素的产生淡水湖泊在维持生态平衡和调节气候方面具有重要作用,且是周边工农业生产和生活用水的主要来源,因此维持并且改善淡水湖泊生态环境至关重要。然而近些年来,由于气候变化、土地滥用以及工农业污染等原因,淡水湖泊生态系统成为全球变化速度最快的生态系统之一[9],产生了严重的富营养化问题。由富营养化引起的蓝藻暴发会导致湖泊透明度降低、缺氧,且蓝藻能与其他生物竞争养分资源,从而破坏湖泊中的生态平衡[10-11]。同时,有些蓝藻种类能产生次级代谢产物藻毒素,当蓝藻生长或者死亡时,都会释放大量的藻毒素到湖泊中,进而造成各种生物的死亡[12]。
1.2 不同藻毒素的化学结构和毒性藻毒素包含了许多不同的种类,其中微囊藻毒素(MCs)是研究最多的一种藻毒素。MCs是一类具有肝毒性的环肽家族,MCs的环状结构为(-D-Ala-X-D-MeAsp-Y-Adda-D-Glu-Mdha) (图 1[13]),其中Adda是一种特殊的β-氨基酸(3-氨基-9-甲氧基-10-苯基-2, 3, 8-三甲基-4, 6-二烯酸),是构成MCs毒性的必需基团[15],而X和Y通常为可变的氨基酸,X可以为L-氨基酸、亮氨酸(L)、精氨酸(R)、酪氨酸(Y)、色氨酸(W)或苯丙氨酸(F),而Y可以为L-氨基酸、精氨酸(R)、丙氨酸(A)或甲硫氨酸(M)。由于这两种氨基酸可变,以及其他氨基酸的甲基化/去甲基化,使MCs容易生成各种异构体,至今已经确定了100多种MCs的变体[16]。在所有MCs变体中,MC-LR是毒性最强且研究最多的一种,其次是MC-RR和MC-YR这两种变体[14, 17]。

|
| 图 1 在R1(2)和R2(4)两个位点含两个可变的L-氨基酸的微囊藻毒素环状结构 Figure 1 Cyclic chemical structure of MCs with two variable L-amino acids at sites R1(2) and R2(4) 注:(1) D-Ala:D-丙氨酸;(3) D-iso-MeAsp:D-赤-β-甲基天冬氨酸(Masp);(5):Adda;(6) D-iso-Glu:D-异谷氨酸;(7) Mdha:N-脱氢丙氨酸[14]. Note: (1) D-Ala: D-Alanine; (3) D-iso-MeAsp: D-erythro-β-methyl-aspartic acid; (5): Adda; (6) D-iso-Glu: D-Glutamic acid; (7) Mdha: N-methyl-dehydroalanine [14]. |
|
|
MCs对细胞蛋白磷酸酶PP1和PP2的活性具有抑制作用,可以在水生生物体内积累[18-19],抑制水生生物(包括浮游植物,巨型水生植物,无脊椎动物和脊椎动物)的生长[20-21],降低生物的繁殖力[21],最终引起水生生物的大量死亡[22],从而使得淡水环境进一步恶化,导致淡水生态系统的失衡[21, 23-24]。因此认为MCs能对淡水坏境中的动植物产生一定的生态压力,对淡水生态环境具有直接的破坏作用。
不仅如此,有关MCs对人类健康的毒性效应的报道也有很多,MCs的主要靶器官是肝脏,国际癌症研究机构(IARC)将MC-LR定义为可能使人类致癌的物质(2B级)[15]。有研究报道了人类由MCs引起的原发性肝癌事件,并且仍在增加[25]。此外,由MCs引起的人类中毒甚至死亡的事件时有发生,最严重的事件发生在1996年的巴西,131名患者在血液透析过程中受到MCs污染而引发急性肝衰竭,其中76名患者死亡[23, 26]。由于MCs对人类健康构成严重威胁,因此世界卫生组织(WHO)在1998年已经确定了饮用水中MC-LR的含量不超过1 μg/L的指标[27],而人类对水产品中MC-LR的耐受值(TDI)为每天0.04 μg/kg[28]。
2 微囊藻毒素的自然分解以及微生物的响应机制由于MCs的毒性会对生态环境和人体健康产生严重的影响,所以MCs污染控制一直以来都是人们研究的热点。目前已经报道了许多MCs降解的物理和化学方法,但是由于这些方法存在各种局限性,所以很少被人们应用于实际的污染控制中。因此,我们迫切需要发展一种简便易行、行之有效且环境友好的方法来控制或治理MCs污染。MCs的生物降解在自然湖泊中是一种常见的现象,而微生物在MCs降解过程中起着至关重要的作用。
2.1 微生物降解微囊藻毒素的过程研究在自然水生环境中,MCs一般有4种去向,分别是稀释、吸收、生物积累和降解[29],稀释、吸收和生物积累只能减少水体中藻毒素的浓度水平,不能消除其毒性,而降解可以使MCs完全失活。降解过程可以细分为非生物分解(如光分解)和生物分解(如:细菌、真菌分解)[30]。大量研究表明在湖泊水体和沉积物中部分MCs能够被生物分解[30-34]。现如今,科研工作者已经鉴定出各种能降解MCs的生物,包括原核生物(如细菌)以及真核生物。MCs含有较为稳定的环状结构,使它对许多自然因素包括高温、极端pH、光照以及常见的水解酶等都有抗性[35-36],这就表明在能降解MCs的生物体内必然含有特殊的酶以及降解途径来介导MCs的降解过程[7]。
早在1994年,Jones等分离出了能利用MC-LR作为氮源和唯一碳源的鞘氨醇单胞菌MJ-PV (ACM-3962)[37]。进一步研究表明,该菌中mlr基因簇负责MC-LR的降解,而且细胞内至少3种水解酶参与了MC-LR的降解过程,即MlrA、MlrB和MlrC。MlrA通过水解Arg-Adda肽键催化MC-LR的开环,从而导致MC-LR分子毒性的显著降低;然后线性MC-LR依次由MlrB和MlrC这两种酶水解产生一个四肽和Adda[38]。但是也有研究表明,MlrC也可以将线性MC-LR直接分解为Adda[39-40]。因此在研究MCs微生物降解菌的过程中,大部分学者都致力于通过研究微生物中是否存在mlr基因簇从而来判断微生物是否有降解MCs的能力。
然而Mou及其他学者研究发现一些MCs降解菌中不存在mlr基因簇却依然能够降解MCs,这说明在这些MCs降解菌中,存在不同的降解机理[7, 41-42]。其中通过宏基因组分析发现嗜甲基菌目在MCs降解过程中所占比例最高,而其不含有mlr序列,进一步研究发现其内含有由谷胱甘肽酶(GST)介导的异形物质代谢途径在MCs降解的过程中显著表达,可能参与了MCs的降解过程[7]。
2.2 湖泊水体微生物群落对微囊藻毒素的响应机制尽管国内外学者对湖泊水体MCs降解微生物已有一些研究,且分离和表征了部分MCs降解菌。然而单独去研究MCs降解菌不能说明淡水湖泊中MCs的实际降解情况,而淡水湖泊中微生物群落组成非常复杂。研究表明在不同营养浓度和水文条件的湖泊中,微生物群落组成和功能也不同[43-46],因此,有必要运用不同的技术手段对不同湖泊水体中微生物群落对MCs的响应情况进行研究。
Christoffersen等[32]通过16S rRNA基因PCR-DGGE技术对丹麦一条富营养化湖泊的研究中发现土著细菌群落能够快速降低水体中的MCs含量,使得初始浓度为10-136 μg/L的MCs经过大约8 d处理后殆尽。同时伴随着MCs的下降,细菌群落的丰度升高,湖水中溶解有机碳(DOC)和颗粒有机碳(POC)含量也降低,这说明湖水中可能存在多样性较高的寡营养微生物种群参与了MCs降解。
近年来随着科学技术的进步,人们更加详尽地了解了淡水湖泊中微生物群落对MCs的响应情况。Mou等[7]通过宏基因组以及流式细胞分析等方法研究了经常发生有害蓝藻水华的伊利湖,发现在加有MC-LR的湖水中,细菌群落(包括高代谢活性细菌和低代谢活性细菌)丰度显著增大,同时MC-LR浓度显著降低,处理24 h后湖水中MC-LR几乎完全消失。进一步研究发现在添加有MC-LR的湖水中细菌群落显著不同于对照组,主要表现为嗜甲基菌目(不含有mlr基因簇)在添加MC-LR后丰度显著提高(由对照组9.6%提高到53.2%)。另外,该研究发现鞘脂单胞菌目在MCs处理过程中不及嗜甲基菌目重要,这与之前研究认为鞘脂单胞菌目在MCs降解过程中占主体地位的结果不同。
以上这些研究提示微生物群落在响应MCs的同时,其本身也会受到MCs的影响,通过微生物群落的多样性发生的变化来调控MCs降解菌的大量产生进而达到湖泊水体MCs的减少。
3 微生物在藻毒素污染控制技术中的潜在应用微生物在治理水体MCs污染以及缓解暴露于MCs下的植物毒性方面都具有潜在的应用价值。近年来人们通过模拟实验已经证明,利用微生物可以高效地控制MCs污染。
Li等[47]在使用掺杂有假单胞菌属An18 (Pseudomonas sp. An18,一种MCs降解菌)和壳聚糖的当地土壤处理发生有害蓝藻水华的太湖的研究中发现,大约90%的溶解性MCs和总MCs被降解,包括了30%的MC-LR和70%的MC-RR。此研究中大量的MCs被降解主要是由于MCs降解菌嵌入到土壤中,从而增强MCs的微生物降解作用。有研究发现根瘤菌能够降解MCs,利用根瘤菌耐MCs的特性,将它与受MCs污染的蚕豆共培养,发现蚕豆的干重、结瘤、固氮以及氨同化循环酶发生改变,结果表明耐MCs的根瘤菌既能保护蚕豆免受MCs毒性的影响,又能使蚕豆的氮含量显著增多[48]。
以上这些研究主要是利用降解菌对MCs的降解才达到降低MCs污染风险的目的,然而近年来,有研究发现有些微生物对能够产生MCs的蓝藻的生长有抑制作用,使得微生物种群既能去除蓝藻又可以减少MCs的大量产生,从而能有效控制MCs污染。例如有研究[49]利用杀优洛菌素链霉菌JXJ-0089 (Streptomyces eurocidicus JXJ-0089,一种放线菌)对形成有害蓝藻水华的蓝藻细胞的生长抑制特性,将其与有害蓝藻水华蓝藻藻株共培养,发现这类细菌在除藻的同时能显著抑制藻细胞内MC-LR释放到细胞外,从而能有效控制有害蓝藻水华及MCs污染。
4 小结和展望利用微生物来处理水体中的MCs由于具有各种优势而广受关注,现如今,随着科学技术的发展与进步,国内外在微生物群落对MCs的响应方面已经有了很大的进展。但是要将微生物治理MCs污染技术应用于实践,还需要在如下方面获得突破:
(1) MCs降解菌的遗传和分子基础尚不完善。目前已经确定了一种细菌mlr基因簇介导的MCs降解途径,但是随后的一系列研究表明,由mlr基因簇编码的每种酶的特定角色以及降解途径的中间体和产物还不是很清楚[50]。而不含mlr基因簇的细菌也可以降解MCs,因此,MCs降解菌的遗传和分子基础还需要进一步探索研究。
(2) 微生物群落对MCs的响应机制和过程需要进一步明确。微生物群落对MCs的响应机制仍处于探索阶段,由于微生物群落在响应MCs的同时会受到包括生物在内的多种因素的影响,且在响应MCs的同时又反过来会受到MCs本身的调控,因此如何在确定的微生物种群(包括能降解MCs的微生物或者对MCs产生菌有抑制作用的微生物种群)的情况下结合最优条件,将微生物群落应用于淡水湖泊中MCs的污染治理,仍然需要科研工作者的进一步努力。
(3) 利用微生物将MCs转化为可利用资源是一个新的应用前景。将MCs作为底物,结合其他技术,探索利用微生物对MCs的分子响应机制,使其在被去除的同时能够产生人类所需的资源,从而实现MCs的高效利用,这将是众多学者重点突破及努力发展的方向。
| [1] |
Paerl HW, Otten TG. Blooms bite the hand that feeds them[J]. Science, 2013, 342(6157): 433-434. DOI:10.1126/science.1245276 |
| [2] |
Campinas M, Rosa MJ. Removal of microcystins by PAC/UF[J]. Separation and Purification Technology, 2010, 71(1): 114-120. DOI:10.1016/j.seppur.2009.11.010 |
| [3] |
Fan JJ, Daly R, Hobson P, et al. Impact of potassium permanganate on cyanobacterial cell integrity and toxin release and degradation[J]. Chemosphere, 2013, 92(5): 529-534. DOI:10.1016/j.chemosphere.2013.03.022 |
| [4] |
Rodríguez E, Onstad GD, Kull TPJ, et al. Oxidative elimination of cyanotoxins: comparison of ozone, chlorine, chlorine dioxide and permanganate[J]. Water Research, 2007, 41(15): 3381-3393. DOI:10.1016/j.watres.2007.03.033 |
| [5] |
Ding J, Shi HL, Timmons T, et al. Release and removal of microcystins from Microcystis during oxidative, physical, and UV-based disinfection[J]. Journal of Environmental Engineering, 2010, 136(1): 2-11. |
| [6] |
Hayden CJ, Beman JM. Microbial diversity and community structure along a lake elevation gradient in Yosemite National Park, California, USA[J]. Environmental Microbiology, 2016, 18(6): 1782-1791. DOI:10.1111/1462-2920.12938 |
| [7] |
Mou XZ, Lu XX, Jacob J, et al. Metagenomic identification of bacterioplankton taxa and pathways involved in microcystin degradation in Lake Erie[J]. PLoS One, 2013, 8(4): e61890. DOI:10.1371/journal.pone.0061890 |
| [8] |
Paerl HW, Xu H, McCarthy MJ, et al. Controlling harmful cyanobacterial blooms in a hyper-eutrophic lake (Lake Taihu, China): the need for a dual nutrient (N & P) management strategy[J]. Water Research, 2011, 45(5): 1973-1983. DOI:10.1016/j.watres.2010.09.018 |
| [9] |
Carpenter SR, Stanley EH, Zanden MJV. State of the world's freshwater ecosystems: physical, chemical, and biological changes[J]. Annual Review of Environment and Resources, 2011, 36: 75-99. DOI:10.1146/annurev-environ-021810-094524 |
| [10] |
Timmermann K, Norkko J, Janas U, et al. Modelling macrofaunal biomass in relation to hypoxia and nutrient loading[J]. Journal of Marine Systems, 2012, 105-108: 60-69. DOI:10.1016/j.jmarsys.2012.06.001 |
| [11] |
Suikkanen S, Fistarol GO, Granéli E. Allelopathic effects of the Baltic cyanobacteria Nodularia spumdigena, Aphanizomenon flos-aquae and Anabaena lemmermannii on algal monocultures[J]. Journal of Experimental Marine Biology and Ecology, 2004, 308(1): 85-101. DOI:10.1016/j.jembe.2004.02.012 |
| [12] |
Wood R. Acute animal and human poisonings from cyanotoxin exposure—a review of the literature[J]. Environment International, 2016, 91: 276-282. DOI:10.1016/j.envint.2016.02.026 |
| [13] |
Stotts RR, Namikoshi M, Haschek WM, et al. Structural modifications imparting reduced toxicity in microcystins from Microcystis spp[J]. Toxicon, 1993, 31(6): 783-789. DOI:10.1016/0041-0101(93)90384-U |
| [14] |
Tsao S, Wei DJ, Chang YT, et al. Aerobic biodegradation of microcystin-LR by an indigenous bacterial mixed culture isolated in Taiwan[J]. International Biodeterioration & Biodegradation, 2017, 124: 101-108. |
| [15] |
Puddick J, Prinsep MR, Wood SA, et al. High levels of structural diversity observed in microcystins from Microcystis CAWBG11 and characterization of six new microcystin congeners[J]. Marine Drugs, 2014, 12(11): 5372-5395. DOI:10.3390/md12115372 |
| [16] |
Sivonen K, Jones G. Cyanobacterial toxins[A]//Chorus I, Bartram J. Toxic Cyanobacteria in Water: A Guide to Their Public Health Consequences, Monitoring and Management[M]. London, New York: SPON Press, 1999: 43-112
|
| [17] |
Merel S, Walker D, Chicana R, et al. State of knowledge and concerns on cyanobacterial blooms and cyanotoxins[J]. Environment International, 2013, 59: 303-327. DOI:10.1016/j.envint.2013.06.013 |
| [18] |
Sotton B, Guillard J, Anneville O, et al. Trophic transfer of microcystins through the lake pelagic food web: evidence for the role of zooplankton as a vector in fish contamination[J]. Science of the Total Environment, 2014, 466/467: 152-163. DOI:10.1016/j.scitotenv.2013.07.020 |
| [19] |
Gibble CM, Peacock MB, Kudela RM. Evidence of freshwater algal toxins in marine shellfish: implications for human and aquatic health[J]. Harmful Algae, 2016, 59: 59-66. DOI:10.1016/j.hal.2016.09.007 |
| [20] |
Wiegand C, Pflugmacher S. Ecotoxicological effects of selected cyanobacterial secondary metabolites a short review[J]. Toxicology and Applied Pharmacology, 2005, 203(3): 201-218. DOI:10.1016/j.taap.2004.11.002 |
| [21] |
Ferrão-Filho ADS, Kozlowsky-Suzuki B. Cyanotoxins: bioaccumulation and effects on aquatic animals[J]. Marine Drugs, 2011, 9(12): 2729-2772. DOI:10.3390/md9122729 |
| [22] |
Paskerová H, Hilscherová K, Bláha L. Oxidative stress and detoxification biomarker responses in aquatic freshwater vertebrates exposed to microcystins and cyanobacterial biomass[J]. Environmental Science and Pollution Research, 2012, 19(6): 2024-2037. DOI:10.1007/s11356-012-0960-7 |
| [23] |
Carmichael WW, Azevedo SM, An JS, et al. Human fatalities from cyanobacteria: chemical and biological evidence for cyanotoxins[J]. Environmental Health Perspectives, 2001, 109(7): 663-668. DOI:10.1289/ehp.01109663 |
| [24] |
Yang CY. Studies on the ecophysiological effects of microcystins against microbes[D]. Wuhan: Doctoral Dissertation of Chinese Academy of Sciences, 2007 (in Chinese) 杨翠云. 微囊藻毒素对微生物的生理生态学效应[D]. 武汉: 中国科学院博士学位论文, 2007 |
| [25] |
Mohamed ZA, Deyab MA, Abou-Dobara MI, et al. Occurrence of cyanobacteria and microcystin toxins in raw and treated waters of the Nile River, Egypt: implication for water treatment and human health[J]. Environmental Science and Pollution Research, 2015, 22(15): 11716-11727. DOI:10.1007/s11356-015-4420-z |
| [26] |
Yuan MC, Carmichael WW, Hilborn ED. Microcystin analysis in human sera and liver from human fatalities in Caruaru, Brazil 1996[J]. Toxicon, 2006, 48(6): 627-640. DOI:10.1016/j.toxicon.2006.07.031 |
| [27] |
World Health Organization. Guidelines for drinking-water quality. vol. 2, Health criteria and other supporting information -addendum[R]. Geneva: World Health Organization, 1998
|
| [28] |
Falconer I, Bartram J, Chorus I, et al. Safe levels and safe practices[A]//Chorus I, Bartram J. Toxic Cyanobacteria in Water[M]. Boca Raton: CRC Press, 1999: 155-178
|
| [29] |
Gągała I, Mankiewicz-Boczek J. The natural degradation of microcystins (cyanobacterial hepatotoxins) in fresh water—the future of modern treatment systems and water quality improvement[J]. Polish Journal of Environmental Studies, 2012, 21(5): 1125-1139. |
| [30] |
Chen XG, Yang X, Yang LL, et al. An effective pathway for the removal of microcystinLR via anoxic biodegradation in lake sediments[J]. Water Research, 2010, 44(6): 1884-1892. DOI:10.1016/j.watres.2009.11.025 |
| [31] |
Cousins IT, Bealing DJ, James HA, et al. Biodegradation of microcystin-LR by indigenous mixed bacterial populations[J]. Water Research, 1996, 30(2): 481-485. DOI:10.1016/0043-1354(95)00189-1 |
| [32] |
Christoffersen K, Lyck S, Winding A. Microbial activity and bacterial community structure during degradation of microcystins[J]. Aquatic Microbial Ecology, 2002, 27(2): 125-136. |
| [33] |
Li JM, Li J, Shi G, et al. Discerning biodegradation and adsorption of microcystin-LR in a shallow semi-enclosed bay and bacterial community shifts in response to associated process[J]. Ecotoxicology and Environmental Safety, 2016, 132: 123-131. DOI:10.1016/j.ecoenv.2016.05.033 |
| [34] |
Hu F. Biodegradation of microcystin-LR by indigenous microorganism and their community structure in sediment of Chaohu Lake[D]. Wuhan: Master's Thesis of Wuhan University of Technology, 2011 (in Chinese) 胡帆. 巢湖沉积物中土著微生物对MC-LR的降解及其群落结构变化[D]. 武汉: 武汉理工大学硕士学位论文, 2011 |
| [35] |
Tsuji K, Naito S, Kondo F, et al. Stability of microcystins from cyanobacteria: effect of light on decomposition and isomerization[J]. Environmental Science & Technology, 1994, 28(1): 173-177. |
| [36] |
Rastogi RP, Sinha RP, Incharoensakdi A. The cyanotoxin-microcystins: current overview[J]. Reviews in Environmental Science and Bio/Technology, 2014, 13(2): 215-249. DOI:10.1007/s11157-014-9334-6 |
| [37] |
Jones GJ, Orr PT. Release and degradation of microcystin following algicide treatment of a Microcystis aeruginosa bloom in a recreational lake, as determined by HPLC and protein phosphatase inhibition assay[J]. Water Research, 1994, 28(4): 871-876. DOI:10.1016/0043-1354(94)90093-0 |
| [38] |
Bourne DG, Jones GJ, Blakeley RL, et al. Enzymatic pathway for the bacterial degradation of the cyanobacterial cyclic peptide toxin microcystin LR[J]. Applied and Environmental Microbiology, 1996, 62(11): 4086-4094. |
| [39] |
Dziga D, Wasylewski M, Szetela A, et al. Verification of the role of MlrC in microcystin biodegradation by studies using a heterologously expressed enzyme[J]. Chemical Research in Toxicology, 2012, 25(6): 1192-1194. DOI:10.1021/tx300174e |
| [40] |
Shimizu K, Maseda H, Okano K, et al. Enzymatic pathway for biodegrading microcystin LR in Sphingopyxis sp. C-1[J]. Journal of Bioscience and Bioengineering, 2012, 114(6): 630-634. DOI:10.1016/j.jbiosc.2012.07.004 |
| [41] |
Manage PM, Edwards C, Singh BK, et al. Isolation and identification of novel microcystin-degrading bacteria[J]. Applied and Environmental Microbiology, 2009, 75(21): 6924-6928. DOI:10.1128/AEM.01928-09 |
| [42] |
Lezcano M, Morón-López J, Agha R, et al. Presence or absence of mlr genes and nutrient concentrations co-determine the microcystin biodegradation efficiency of a natural bacterial community[J]. Toxins, 2016, 8(11): 318. DOI:10.3390/toxins8110318 |
| [43] |
Kou WB, Zhang J, Lu XX, et al. Identification of bacterial communities in sediments of Poyang Lake, the largest freshwater lake in China[J]. SpringerPlus, 2016, 5(1): 401. DOI:10.1186/s40064-016-2026-7 |
| [44] |
Newton RJ, Jones SE, Eiler A, et al. A guide to the natural history of freshwater lake bacteria[J]. Microbiology and Molecular Biology Reviews, 2011, 75(1): 14-49. DOI:10.1128/MMBR.00028-10 |
| [45] |
Salcher MM, Pernthaler J, Posch T. Seasonal bloom dynamics and ecophysiology of the freshwater sister clade of SAR11 bacteria 'that rule the waves'(LD12)[J]. The ISME Journal, 2011, 5(8): 1242-1252. DOI:10.1038/ismej.2011.8 |
| [46] |
Wilhelm SW, LeCleir GR, Bullerjahn GS, et al. Seasonal changes in microbial community structure and activity imply winter production is linked to summer hypoxia in a large lake[J]. FEMS Microbiology Ecology, 2014, 87(2): 475-485. DOI:10.1111/1574-6941.12238 |
| [47] |
Li H, Pan G. Simultaneous removal of harmful algal blooms and microcystins using microorganism-and chitosan-modified local soil[J]. Environmental Science & Technology, 2015, 49(10): 6249-6256. |
| [48] |
Lahrouni M, Oufdou K, El KF, et al. Microcystin-tolerant Rhizobium protects plants and improves nitrogen assimilation in Viciafaba irrigated with microcystin-containing waters[J]. Environmental Science and Pollution Research, 2016, 23(10): 10037-10049. DOI:10.1007/s11356-016-6223-2 |
| [49] |
Zhang BH, Ding ZG, Li HQ, et al. Algicidal activity of Streptomyces eurocidicus JXJ-0089 metabolites and their effects on Microcystis physiology[J]. Applied and Environmental Microbiology, 2016, 82(17): 5132-5143. DOI:10.1128/AEM.01198-16 |
| [50] |
Yan H, Wang HS, Liu XL, et al. Advances in the pathway and molecular mechanism for the biodegradation of microcystins[J]. Environmental Science, 2014, 35(3): 1205-1214. 闫海, 王华生, 刘晓璐, 等. 微囊藻毒素微生物降解途径与分子机制研究进展[J]. 环境科学, 2014, 35(3): 1205-1214. |
 2018, Vol. 45
2018, Vol. 45