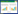扩展功能
文章信息
- 王慧敏, 姚倩倩, 李月月, 蔡溯林, 孙明珠, 顾向阳
- WANG Hui-Min, YAO Qian-Qian, LI Yue-Yue, CAI Su-Lin, SUN Ming-Zhu, GU Xiang-Yang
- 渗透压冲击下中度嗜盐菌Halomonas sp. Y四氢嘧啶类相容性溶质的合成与释放
- Synthesis and release of ectoines in a moderate halophile Halomonas sp. Y subjected to osmotic shocks
- 微生物学通报, 2018, 45(4): 744-752
- Microbiology China, 2018, 45(4): 744-752
- DOI: 10.13344/j.microbiol.china.170343
-
文章历史
- 收稿日期: 2017-05-05
- 接受日期: 2017-08-16
- 网络首发日期(www.cnki.net): 2017-08-31
相容性溶质机制是嗜盐微生物抵御高渗透压逆境胁迫而生存的主要策略,所谓相容性溶质就是嗜盐微生物合成的能够平衡细胞渗透压,并且能与细胞内体系相容而不影响其它生物大分子功能的小分子有机化合物[1]。文献报道的相容性溶质主要有甜菜碱类、四氢嘧啶类、多元醇类、糖类和氨基酸类等,其中四氢嘧啶类物质(包括四氢嘧啶和羟基四氢嘧啶)是中度嗜盐菌胞内合成的最常见的相容性溶质[2]。近年来的体外试验研究发现四氢嘧啶类物质还可用作保护剂缓解高温、冷冻、干燥、辐射、变性剂等对蛋白质、核酸、细胞膜甚至完整细胞结构造成的有害作用,具有优异和长效的皮肤保湿效果,并可缓解紫外线照射引起的皮肤细胞损害;对神经系统退行性疾病如阿尔兹海默氏症、帕金森病等有一定的疗效[3]。目前四氢嘧啶已经应用于酶制剂、生物医药及护肤品等相关领域,因此,其合成方法及商业化生产越来越受到国内外研究者的关注。
四氢嘧啶的化学合成尚无成功的报道,目前只有依赖中度嗜盐菌进行商业化生产。早期采用生物发酵后从菌体中直接提取的方法[4],产物的提取和纯化工艺复杂,制备成本较高。1998年Sauer等利用某些中度嗜盐菌可在高渗透压条件下合成四氢嘧啶而低渗透压下释放至胞外的功能,成功开发出细菌泌乳工艺,其特点是发酵培养的菌体可以反复使用,产物可多次回收,四氢嘧啶的合成量得到大幅提高,因而具有巨大的应用潜力[5-8]。目前国际上报道的适合于细菌泌乳工艺的菌株主要有Halomonas elongata、Brevibacterium sp. JCM 6894、Halomonas boliviensis、Chromohalobacter salexigens DSM304等,单位质量细胞中四氢嘧啶的合成量达0.1−0.2 g/g[5-8],国内分离的优良菌株尚不多见[9-10],也未见商业化生产的报道。本研究的目的在于分离、筛选以四氢嘧啶类化合物为主要相容性溶质的中度嗜盐菌,研究渗透压冲击对四氢嘧啶合成和释放的影响,为四氢嘧啶的生物合成积累菌种资源。
1 材料与方法 1.1 培养基乳酸培养基(g/L):乳酸5.0,NaCl 100.0,(NH4)2 SO4 0.5,MgSO4·7H2O 0.25,K2HPO4 0.25,pH 7.0。
保存培养基(g/L):蛋白胨10.0,酵母粉5.0,NaCl 100.0,琼脂20.0,pH 7.0。
1.2 主要试剂和仪器四氢嘧啶和羟基四氢嘧啶标准品购自Sigma公司;Taq DNA聚合酶、dNTPs、PCR引物及PCR缓冲液等试剂均购自南京金斯瑞生物技术有限公司。PCR扩增仪,美国赛默飞世尔科技有限公司;高效液相色谱仪,日本岛津公司;高分辨质谱仪,美国沃特世公司。
1.3 中度嗜盐菌的分离筛选试验菌株分离自江苏省连云港市某盐池土样。将盐池土样于100 g/L的无菌盐水中进行梯度稀释并涂布于乳酸培养基平板,35 ℃培养1周,从平板上挑取单菌落,经划线纯化得到2株中度嗜盐菌Y和J。预备试验中发现菌株Y能同时合成四氢嘧啶和羟基四氢嘧啶2种相容性溶质,在低渗冲击(NaCl质量浓度为10 g/L)中表现出较好的分泌功能(65.3%),而菌株J只能合成四氢嘧啶,不能合成羟基四氢嘧啶且其分泌率较低(45.3%),因此选择菌株Y进行进一步研究。
1.4 细菌生理生化特性的测定及菌种鉴定菌株的细胞形态及生理生化特性测定参照文献[11]进行。菌株基因组DNA的提取及16S rRNA基因的扩增按照文献[12]进行,扩增产物送南京金斯瑞生物技术有限公司测序,测定所得序列提交到GenBank,通过EzTaxon网站与相关细菌模式菌株的16S rRNA基因序列进行比对,采用MEGA 6.0软件中的邻接法构建系统发育树。
1.5 盐度对分离菌株生长及四氢嘧啶合成的影响菌种经活化培养后,以10%接种量转接至新鲜的乳酸培养基中(50 mL/500 mL),各摇瓶培养基中NaCl的终浓度依次为10、30、50、100、150、200和250 g/L,所有摇瓶35 ℃、170 r/min振荡培养24 h后,分别吸取1 mL菌液8 000 r/min离心10 min沉淀菌体,用等体积的0.5 mol/L的NaOH溶液溶解菌体细胞,采用Folin酚试剂法[13]测定菌体蛋白的质量浓度,并换算成菌体干重(菌体干重/菌体蛋白比值为2.04,由预备试验测定);另取1 mL菌液,离心沉淀菌体后去上清液,加入等体积的80%乙醇溶液静置过夜,再次离心取上清液于50 ℃烘干,加入1 mL超纯水溶解提取物,用0.45 μm微孔滤膜过滤后按照文献[14]的方法进行四氢嘧啶类物质的定量分析和质谱鉴定。HPLC检测条件如下:流动相为95% (体积比)、pH 7.0、50 mmol/L的磷酸缓冲液加5% (体积比)甲醇,流速0.8 mL/min,柱温40 ℃,检测波长为210 nm,进样体积为20 μL。
1.6 渗透压冲击下四氢嘧啶的合成与释放分离菌株以10%接种量接种至50 mL乳酸培养基中,35 ℃、170 r/min振荡培养24 h,8 000 r/min离心10 min收集菌体,重新悬浮于等体积的NaCl质量浓度分别为0、2.5、5.0、10.0、20.0、30.0 g/L的低渗溶液中并置摇床振荡培养,定时取样1 mL离心沉淀菌体,上清液用于测定释放的四氢嘧啶含量,低渗冲击30 min后将菌液再次离心沉淀菌体,然后用45 mL高渗培养基重新悬浮后置摇床振荡培养,定时取样测定胞内四氢嘧啶的合成量。
1.7 细菌泌乳法制备四氢嘧啶分离菌株在NaCl质量浓度为100 g/L的乳酸培养基中35 ℃、170 r/min摇瓶培养24 h,取200 mL发酵液于8 000 r/min离心10 min收集菌体,悬浮于50 mL质量浓度为10 g/L的NaCl溶液中振荡培养20 min,释放四氢嘧啶。再次离心收集菌体并重新悬浮于50 mL NaCl质量浓度为100 g/L的高渗培养基中诱导四氢嘧啶合成。之后按照上述方法反复交替进行低渗-高渗冲击,每次低渗冲击后取样测定释放的四氢嘧啶含量,高渗冲击后取样测定合成的四氢嘧啶含量。
2 结果与分析 2.1 菌株Y的分离与鉴定采用NaCl质量浓度为100 g/L的乳酸培养基从盐池土中分离到一株中度嗜盐菌Y,该菌株在乳酸培养基上形成乳白色圆形菌落,菌落呈半球状隆起,表面光滑、湿润。菌株Y为革兰氏阴性的杆状细菌,不产芽孢,能运动。菌株Y对淀粉水解试验、明胶液化试验、酯酶试验、蛋白酶试验和吲哚试验的结果均呈阴性,过氧化氢酶试验、苯丙氨酸脱氢酶试验、脲酶试验、产硫化氢试验和乙酰甲基甲醇试验结果均呈阳性。菌株Y可利用乳酸、乙酸、丙酸、正丁酸、正戊酸等有机酸,以及葡萄糖、纤维二糖、果糖、蔗糖、麦芽糖等糖类物质为唯一碳源生长,但不能利用淀粉、乳糖、半乳糖、木糖、核糖、鼠李糖、阿拉伯糖为唯一碳源生长。厌氧条件下菌株Y不发酵葡萄糖、蔗糖、麦芽糖、纤维二糖等糖类碳源,也不能以硝酸盐或亚硝酸盐为电子受体进行生长,说明菌株Y为严格好氧的细菌。
以细菌通用引物27F (5′-AGAGTTTGATCCT GGCTCAG-3′)与1492R (5′-GGTTACCTTGTTAC GACTT-3′)扩增菌株Y的16S rRNA基因,对扩增产物测序后得到序列长度为1 400 bp的片段(GenBank登录号为KY977527),通过EzTaxon网站与相关细菌模式菌株的16S rRNA基因序列进行比对发现,该菌株同Halomonas aquamarina和Halomonas meridiana的相似性最高达99.1%,可以归至相同的属,但在系统发育树(图 1)中与上述2个菌株并不处于同一分支,而是形成一个独立的分支,可见菌株Y在进化关系上又不同于上述2个种。根据菌株Y的生理生化特性和16S rRNA基因序列比对结果,将菌株Y鉴定为盐单胞菌属的一个种,并命名为盐单胞菌(Halomonas sp.) Y。
|
| 图 1 菌株Y基于16S rRNA基因序列相似性构建的系统发育树 Figure 1 Phylogenetic tree of strain Y based on the 16S rRNA gene sequences 注:进化树各分支点的数字为自展值,括号中为菌株的16S rRNA基因序列号,标尺表示每个位点0.005次碱基替换. Note: Bootstrap values are shown in branching points. GenBank accession numbers of 16S rRNA gene sequence are given in parentheses. The bar represents 0.005 substitutions per site. |
|
|
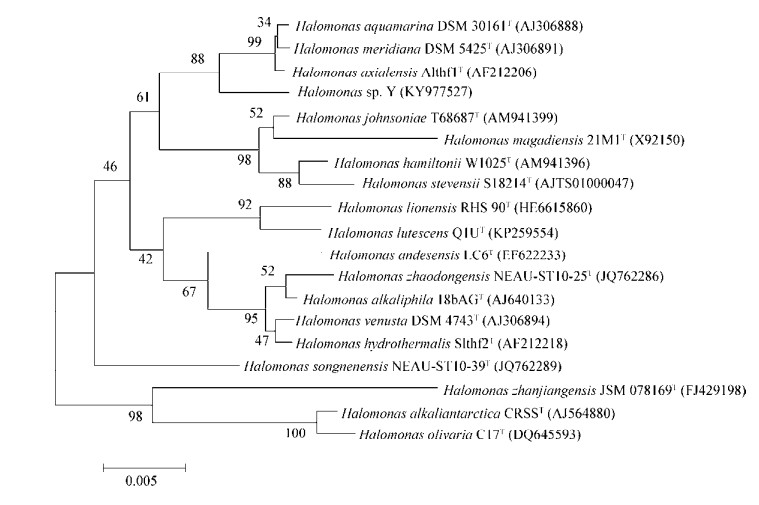
菌株Y可以适应10−250 g/L的NaCl质量浓度并以乳酸为唯一碳源生长(图 2),最适生长的NaCl质量浓度为100 g/L,高于或低于该浓度时菌株Y的生长速率逐渐下降。在NaCl质量浓度为100 g/L的乳酸培养基中菌株Y的生长速率最高,对数期代时为4.5 h。
|
| 图 2 盐浓度对菌株Y生长及四氢嘧啶合成的影响 Figure 2 Effects of salinity on the growth of and ectoine synthesis in strain Y |
|
|
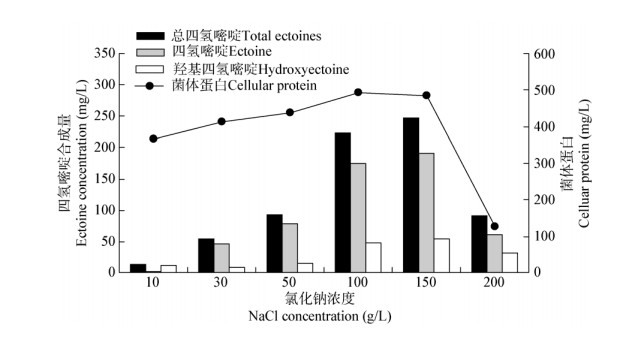
采用80%的乙醇溶液提取菌株Y胞内的相容性溶质并用高效液相色谱仪检测,在HPLC图谱中3.61 min和4.04 min处各有一个峰,出峰时间分别与羟基四氢嘧啶和四氢嘧啶标准品相同(图 3),质谱检测结果显示,提取液中存在2种物质,其中丰度较高物质的化学式及其分子质量与四氢嘧啶标准品一致,而丰度较低物质的化学式及其分子质量同羟基四氢嘧啶标准品一致(图 4),证明菌株Y细胞提取液中的相容性物质确为四氢嘧啶和羟基四氢嘧啶。HPLC定量分析结果显示,菌株Y合成的相容性溶质以四氢嘧啶为主(67.2%−85.3%),羟基四氢嘧啶积累量相对较低,仅占14.7%−32.8%。盐浓度对菌体四氢嘧啶的合成量有很大影响,当培养基中NaCl浓度为150 g/L时,总四氢嘧啶的合成量最高,达246.6 mg/L,低于或者高于该盐浓度时四氢嘧啶的合成量均呈显著下降趋势(图 2)。从耐盐的浓度范围和相容性溶质合成量来看,菌株Y是一株以四氢嘧啶为主要相容性溶质的中度嗜盐菌。
|
| 图 3 菌株Y细胞提取液中四氢嘧啶类相容性溶质的HPLC图谱 Figure 3 HPLC spectrum of ectoines in the extract of Y cells |
|
|
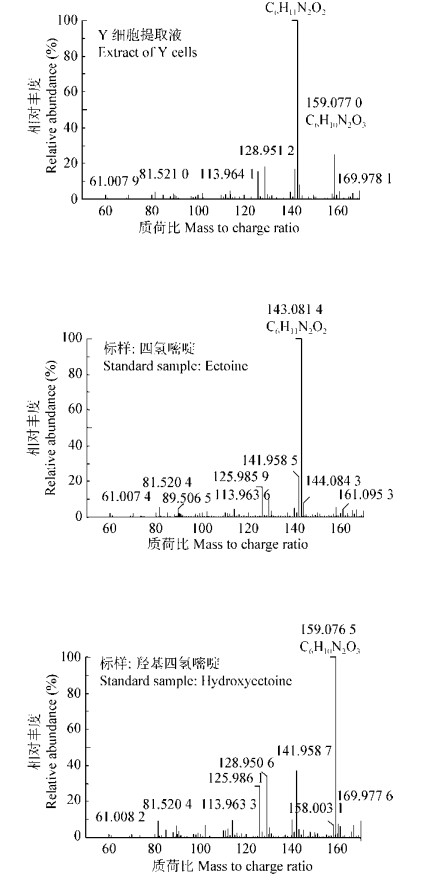
|
| 图 4 四氢嘧啶类标样及Y细胞提取液中相容性溶质的质谱图 Figure 4 MS spectrograms for standard ectoines and compatible solutes in the extract of Y cells |
|
|
为了研究细菌泌乳法制备四氢嘧啶的可行性,首先以最适生长的高渗培养基(NaCl质量浓度为100 g/L)中培养的菌体为材料,研究了低渗溶液对菌株Y胞内四氢嘧啶释放的影响。从图 5可以看出,在低渗溶液中菌株Y胞内四氢嘧啶的释放速率极大,低渗冲击5 min后即可达到最大的释放率,延长低渗冲击的时间后释放率不再有明显变化。四氢嘧啶的释放率与低渗溶液中盐浓度呈负相关关系,当冲击液中NaCl质量浓度由0 g/L逐步提高至30 g/L时,四氢嘧啶的释放率由93.8%大幅下降至40.7%。
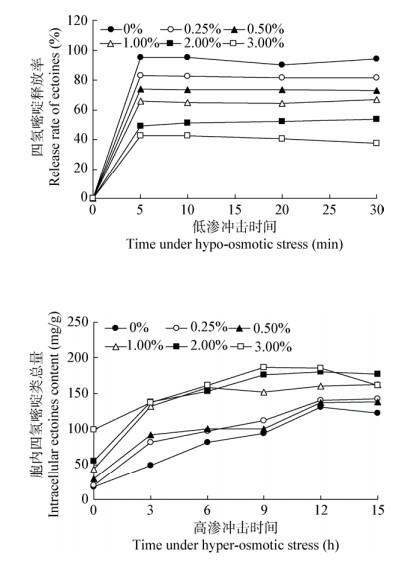
|
| 图 5 渗透压冲击下Y细胞中四氢嘧啶的释放与重新合成 Figure 5 Release and resynthesis of ectoines in Y cells under hypo/hyper-osmotic stress |
|
|
低渗冲击30 min后离心收集菌体,再转移至高渗培养基(NaCl浓度为100 g/L)中进一步考察其重新合成四氢嘧啶的能力。结果显示:经0−5 g/L NaCl溶液冲击的Y菌体转移至高渗培养基中后,四氢嘧啶的合成量较低(126.4−141.7 mg/g),且恢复合成的速率较慢,达到最大合成量所需的时间长达12 h,说明NaCl浓度为0−5 g/L的低渗冲击对Y菌体的代谢活性已经产生不利影响;10、20和30 g/L的NaCl溶液冲击对Y菌体的活性影响较小,转移至高渗培养基中后四氢嘧啶恢复合成的速率明显加快,且其最大合成量分别上升至158.3、178.1和186.3 mg/g (图 5)。但是,Y菌体经20−30 g/L的盐溶液低渗冲击时四氢嘧啶的释放率偏低(57.1%−40.7%),再次低渗冲击的情况下并不能释放更多的四氢嘧啶产物,因此也不满足细菌泌乳工艺的要求。相对而言,经10 g/L的盐溶液低渗冲击的菌体转入高渗培养基中后虽然四氢嘧啶的合成量不是最高,但胞内四氢嘧啶的释放率较高(65.3%),再次低渗冲击的情况下反而可以释放和收获更多的四氢嘧啶类产物,因此适合于细菌泌乳工艺的要求。在本试验中菌体质量浓度为1 002 mg/L的条件下,经质量浓度为10 g/L的NaCl溶液低渗冲击后释放的四氢嘧啶量可达142.2 mg/L。
2.4 细菌泌乳法制备四氢嘧啶类相容性溶质将摇瓶培养的Y菌体浓缩4倍后采用细菌泌乳工艺制备四氢嘧啶,共进行11轮低渗/高渗冲击,冲击周期为12 h。结果显示,菌株Y的确能耐受连续多次的高渗/低渗冲击,并保持持续地合成与释放其胞内四氢嘧啶的能力(图 6)。在11轮渗透压冲击循环中,菌株Y对四氢嘧啶的合成量与释放量仅有小幅波动,其每轮冲击的平均合成量为543.8±86.8 mg/L,平均释放量为515.5±58.6 mg/L,释放量占胞内四氢嘧啶类总量的64.5%。四氢嘧啶类的总合成量为6.0 g/L,总释放量为5.7 g/L,合成效率为1.03 g/(L·d)。在每轮的高渗/低渗冲击中底物的消耗量为4 g/L,细菌泌乳工艺中四氢嘧啶对底物的转化率为128.9 mg/g。
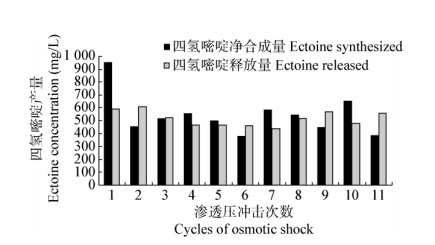
|
| 图 6 渗透压冲击下Y细胞中四氢嘧啶的释放与重新合成 Figure 6 Release and resynthesis of ectoines in Y cells under hypo/hyper-osmotic stress |
|
|
本文报道的盐单胞菌Y最适生长的NaCl浓度较高,单位质量细胞中总四氢嘧啶的合成量达223.4 mg/g,其中四氢嘧啶和羟基四氢嘧啶分别为175.5 mg/g和47.9 mg/g,是一株较高产四氢嘧啶类相容性溶质的中度嗜盐菌。采用细菌泌乳工艺制备四氢嘧啶,经11轮渗透压冲击,四氢嘧啶总合成量为6.0 g/L,总释放量为5.7 g/L,平均释放率为64.5%,底物转化率达128.9 mg/g,底物转化率同常规分批培养相比提高了2.7倍,朗亚军等采用细菌泌乳法制备羟基四氢嘧啶时也得到了类似的结果[10]。
中度嗜盐菌在合成四氢嘧啶的同时副产羟基四氢嘧啶是较为普遍的现象[3, 7-8, 15-17],盐单胞菌Y也具有这个特点,它在摇瓶分批培养条件下合成的四氢嘧啶类相容性溶质中四氢嘧啶占67.2%−85.3%,羟基四氢嘧啶积累量相对较低,仅占14.7%−32.8%。不过在连续冲击的条件下,其合成并释放的四氢嘧啶类物质中四氢嘧啶的比例高达99.6%以上,羟基四氢嘧啶的比例则不到0.4%,这对下游工艺中四氢嘧啶的提取、纯化是十分有利的,同时说明细菌泌乳工艺不利于羟基四氢嘧啶的合成,这一现象在文献中尚未见报道。细菌泌乳工艺不利于羟基四氢嘧啶合成的原因可以从2个方面解释:(1)羟基四氢嘧啶合成是在四氢嘧啶的基础上经羟基化反应而得,最后一步羟基化反应相对滞后[16]。据报道,当此类菌体生长到稳定期,继续延长培养时间会有四氢嘧啶含量下降而羟基四氢嘧啶上升的现象[17];(2)四氢嘧啶和羟基四氢嘧啶虽然作用相似,但后者对于嗜盐菌耐受或抵抗更高盐浓度作用更为显著,通常在盐浓度超过最适生长的浓度而菌体生长较慢时有较高的积累[18],而本试验在最适生长的盐浓度下进行,盐单胞菌Y优先合成四氢嘧啶可以避免浪费能量。
应当指出的是,虽然分批培养中盐单胞菌Y在NaCl质量浓度为150 g/L的条件下四氢嘧啶的产量最高,但在细菌泌乳工艺中我们没有采用该培养基,而是选择了生长速率最快、NaCl浓度为100 g/L的高渗培养基来诱导四氢嘧啶的合成,其原因是盐浓度为150 g/L时培养的细胞,经低渗冲击后转回到高渗培养基中,其四氢嘧啶再合成的速率较慢,最终合成量也有明显下降,导致后续低渗冲击中释放的四氢嘧啶产量并无显著增加。
总的来说,盐单胞菌Y能以乳酸为唯一碳源生长,营养要求较为简单,无需以蛋白胨或酵母粉的形式补充生长因子即可满足其生长的需要;另外,在菌体细胞培养过程中随着乳酸被逐步利用,培养基可维持中性至微碱性的pH环境,不会出现pH下降,有利于菌体生长及四氢嘧啶合成产量的稳定,因而在四氢嘧啶的生物合成领域具有更好的应用潜力。
| [1] |
Horikoshi K, Antranikian G, Bull AT, et al. Halophilic bacteria[M]. Boca Raton: CRC Press, 2011, 255-308.
|
| [2] |
Zhao BS, Yang LF, Wang L, et al. Study progress on compatible solutes in moderately halophilic bacteria[J]. Acta Microbiologica Sinica, 2007, 47(5): 937-941. 赵百锁, 杨礼富, 王磊, 等. 中度嗜盐菌相容性溶质机制的研究进展[J]. 微生物学报, 2007, 47(5): 937-941. |
| [3] |
Pastor JM, Salvador M, Argandona M, et al. Ectoines in cell stress protection: uses and biotechnological production[J]. Biotechnology Advances, 2010, 28(6): 782-801. DOI:10.1016/j.biotechadv.2010.06.005 |
| [4] |
Frings E, Sauer T, Galinski EA. Production of hydroxyectoine: high cell-density cultivation and osmotic downshock of Marinococcus strain M52[J]. Journal of Biotechnology, 1995, 43(1): 53-61. DOI:10.1016/0168-1656(95)00119-2 |
| [5] |
Sauer T, Galinski EA. Bacterial milking: a novel bioprocess for production of compatible solutes[J]. Biotechnology and Bioengineering, 1998, 57(3): 306-313. DOI:10.1002/(ISSN)1097-0290 |
| [6] |
Nagata S, Wang YQ, Oshima A, et al. Efficient cyclic system to yield ectoine using Brevibacterium sp. JCM 6894 subjected to osmotic downshock[J]. Biotechnology and Bioengineering, 2007, 99(4): 941-948. |
| [7] |
Van-Thuoc D, Guzmán H, Quillaguaman J, et al. High productivity of ectoines by Halomonas boliviensis using a combined two-step fed-batch culture and milking process[J]. Journal of Biotechnology, 2010, 147(1): 46-51. DOI:10.1016/j.jbiotec.2010.03.003 |
| [8] |
Fallet C, Rohe P, Franco-Lara E. Process optimization of the integrated synthesis and secretion of ectoine and hydroxyectoine under hyper/hypo-osmotic stress[J]. Biotechnology and Bioengineering, 2010, 107(1): 124-133. DOI:10.1002/bit.v107:1 |
| [9] |
He J, Wang T, Sun JQ, et al. Isolation and characteristics of a moderately halophilic bacterium accumulating ectoine as main compatible solute[J]. Acta Microbiologica Sinica, 2005, 45(6): 900-904. 何健, 汪婷, 孙纪全, 等. 以四氢嘧啶为主要相容性溶质的中度嗜盐菌I15的分离和特性研究[J]. 微生物学报, 2005, 45(6): 900-904. |
| [10] |
Lang YJ, Ren YN, Bai L, et al. Hydroxyectoine synthesis and release under osmotic shock in Cobetia marina CICC10367[J]. Acta Microbiologica Sinica, 2009, 49(12): 1590-1595. 朗亚军, 任亚南, 柏林, 等. Cobetia marina CICC10367渗透压冲击下羟基四氢嘧啶的合成及释放[J]. 微生物学报, 2009, 49(12): 1590-1595. DOI:10.3321/j.issn:0001-6209.2009.12.007 |
| [11] |
Dong XZ, Cai MY. Manual for Systematic Identification of Common Bacteria[M]. Beijing: Science Press, 2001, 364-398. 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001, 364-398. |
| [12] |
Marchesi JR, Sato T, Weightman A. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S rRNA[J]. Applied and Environmental Microbiology, 1998, 64(2): 795-799. |
| [13] |
Walker JM. The Protein Protocols Handbook[M]. New York: Humana Press, 2009, 17-23.
|
| [14] |
Wei YH, Yuan FW, Chen WC, et al. Production and characterization of ectoine by Marinococcus sp. ECT1 isolated from a high-salinity environment[J]. Journal of Bioscience and Bioengineering, 2011, 111(3): 336-342. DOI:10.1016/j.jbiosc.2010.11.009 |
| [15] |
Tao P, Liu H, Yu YJ, et al. Ectoine and 5-hydroxyectoine accumulation in the halophile Virgibacillus halodenitrificans PDB-F2 in response to salt stress[J]. Applied Microbiology and Biotechnology, 2016, 100(15): 6779-6789. DOI:10.1007/s00253-016-7549-x |
| [16] |
Bursy J, Pierik AJ, Pica N, et al. Osmotically induced synthesis of the compatible solute hydroxyectoine is mediated by an evolutionarily conserved ectoine hydroxylase[J]. Journal of Biological Chemistry, 2007, 282(43): 31147-31155. DOI:10.1074/jbc.M704023200 |
| [17] |
Seip B, Galinski EA, Kurz M. Natural and engineered hydroxyectoine production based on the Psedomonas stutzeri ectABCD-ask gene cluster[J]. Applied and Environmental Microbiology, 2011, 77(4): 1368-1374. DOI:10.1128/AEM.02124-10 |
| [18] |
Stöveken N, Pittelkow M, Sinner T, et al. A specialized Aspartokinase enhanced the biosynthesis of the osmoprotectants ectoine and hydroxyectoine in Pseudomonas stutzeri A1501[J]. Journal of Bacteriology, 2011, 193(17): 4456-4468. DOI:10.1128/JB.00345-11 |
 2018, Vol. 45
2018, Vol. 45