扩展功能
文章信息
- 史应武, 楚敏, 杨红梅, 高雁, 张涛, 曾军, 林青, 李玉国, 欧提库尔, 娄恺, 罗明
- SHI Ying-Wu, CHU Min, YANG Hong-Mei, GAO Yan, ZHANG Tao, ZENG Jun, LIN Qing, LI Yu-Guo, MAHEMUTI Outikuer, LOU Kai, LUO Ming
- 新疆棉花黄萎病株内生真菌荧光定量检测及时空动态分析
- Quantitative detection and spatiotemporal dynamic analysis of endophytic fungi in cotton infected by Verticillium Wilt using Real-time PCR
- 微生物学通报, 2018, 45(2): 376-385
- Microbiology China, 2018, 45(2): 376-385
- DOI: 10.13344/j.microbiol.china.170275
-
文章历史
- 收稿日期: 2017-04-05
- 接受日期: 2017-06-28
- 网络首发日期(www.cnki.net): 2017-08-08
2. 新疆特殊环境微生物实验室 新疆 乌鲁木齐 830091;
3. 新疆农业大学农学院 新疆 乌鲁木齐 830052
2. Xinjiang Laboratory of Special Environmental Microbiology, Urumqi, Xinjiang 830091, China;
3. College of Agronomy, Xinjiang Agricultural University, Urumqi, Xinjiang 830052, China
世界性严重棉花病害棉花黄萎病主要由大丽轮枝菌(Verticillium dahliae Kleb.)和黑白轮枝菌(Verticillium alboatrum Reinke & Berthold)引起,发生时会严重影响棉花的产量,至今尚无有效的防治方法[1-3]。新疆是我国最大的棉花生产基地,棉花黄萎病在全疆分布广、危害大,严重阻碍棉花的生产,目前缺乏有效的药剂防治措施和适宜新疆栽培的棉花抗病品种[4-5]。
近年来,植物内生菌成为研究的热点,利用内生菌防治植物病害已成为研究的重要方面。内生真菌(Endophytic fungi)是指在其生活史中某一段时期内或整个生命时期生活于植物组织内部,对其宿主不引起明显疾病的一类真菌[6]。内生真菌生活于棉花组织内部,能够促进棉花生长,有些能够抑制黄萎病菌生长[7-8]。内生真菌种类、定殖率和定殖量等因素直接影响真菌对宿主植物的效应。因此,棉花黄萎病株内生真菌定量分析对揭示棉花内生真菌影响黄萎病发生,以及微生态调控黄萎病具有重要意义。虽然我国棉花内生真菌的研究还处于起步阶段,但已涉及棉花内生真菌的分离鉴定[8]、群落结构分析[9]、生防潜力评价[10]以及黄萎病控病作用及机理[11-14]等方面。然而,关于棉花黄萎病植株内生真菌研究报道很少,仅见刘政[8]采用分离培养的方法对石河子重病田棉花黄萎病内生真菌的种类数量进行了研究,随着棉花生育时期的推进,在发病棉株根部轮枝孢属种群数量从蕾期开始逐渐上升外,其他类群真菌的数量也呈下降趋势;另外棉花黄萎病植株和棉花健康植株内生真菌种类数量存在一定差异。目前棉花黄萎病株内生真菌含量的研究鲜见报道。
植物内生真菌含量的研究以前多采用生化标记物,如葡萄糖胺、胞外漆酶和ATP作为检测植物内生真菌含量的指标,这些方法都存在着一些问题,如方法的重复性达不到要求或样品的非真菌成分中也含有标记物[15-19]。但目前还没有合适的定量分析方法。定量检测植物组织中内生真菌的传统方法中,免疫学和组织化学是最常用的一种方法。对于免疫学的方法,不但要求样品的量比较高,而且抗体和植物蛋白发生交联反应会影响检测结果;而利用组织化学方法检测棉花中的内生真菌,不但要求检测人员具有丰富的实践经验和熟练的操作技术,而且当植物组织内的菌丝含量少、分布稀疏时,很难将它们检测出来。现阶段植物内生真菌含量的研究多采用传统稀释平板法来完成目标微生物的分离计数、培养以及形态学鉴定等过程。然而由于传统稀释平板法自身缺陷所造成的局限性,导致其无法全面反映自然条件下微生物的生长状况,从而容易使研究结果产生偏差。利用PCR的方法定量检测样品用量小,一般取新鲜植物的组织少许即可进行,而且检测准确性更高[20-23]。
随着PCR技术的不断成熟和发展,实时荧光定量PCR (RT-qPCR)法已被应用于植物各组织中内生真菌的含量测定[24-28]。2010年,Tellenbach等[27]建立了RT-qPCR检测植物内生真菌的方法,并评价了这种实时荧光定量PCR方法在3种系统中的稳定性。结果显示该方法可以更为全面、实时地分析植物内生真菌含量的变化情况,是传统研究手段的必要补充。
近年来,新疆棉花黄萎病扩展速度加快,病菌致病性明显增强,发病提早,为害加重,生长中后期有大面积落叶成光秆的现象。北疆的棉花黄萎病重于南疆,南疆棉区棉花枯萎病菌的致病力相对较强。但有关基于实时荧光定量PCR的棉花内生真菌数量测定及其时空动态变化的研究目前尚未见报道。本研究采用实时荧光PCR技术,建立了棉花中内生真菌定量分析的方法,对来源于新疆主要棉花生态区棉花植株内生真菌总量进行调查,以期明确其内生真菌分布规律及其与黄萎病菌数量的关系。
1 材料与方法 1.1 材料 1.1.1 植物样品2015年从新疆北疆的石河子、乌苏、精河,南疆的库尔勒、阿拉尔、图木舒克,东疆的哈密选择棉田中黄萎病发病较均匀的田块作为取样点(表 1),分别在棉花的苗期、蕾期、花期和絮期,采用五点法取样,用小铲刀将棉株根部挖出,置于装有变色硅胶的保鲜袋中脱水处理,带回实验室置于4 ℃保存,用于内生真菌RT-qPCP检测。
| 样品编号 Sampling number |
样点 Sampling sites |
经度 Longitude |
纬度 Latitude |
苗期 Seeding stage (Date) |
蕾期 Bud stage (Date) |
花期 Flower stage (Date) |
絮期 Boll opening stage (Date) |
| HBZ | HM (Hongxing farm, Hami) | 93°16′15′′E | 42°54′52′′N | 5.20 | 6.26 | 8.20 | 9.20 |
| KBZ | KEL (33 Tuan Farm, Kuerle) | 87°7′53′′E | 40°27′56′′N | 5.22 | 6.28 | 7.30 | 8.31 |
| ABZ | ALE (Alaer, Akesu) | 81°10′57′′E | 40°20′8′′N | 5.26 | 6.29 | 7.31 | 9.60 |
| TBZ | TMS (44 Tuan, Tumushuke) | 79°7′43′′E | 39°55′12′′N | 5.27 | 6.30 | 8.10 | 9.70 |
| JBZ | JH (Daheyan town, Jinghe) | 82°24′38′′E | 44°34′55′′N | 6.20 | 7.30 | 8.30 | 9.80 |
| WBZ | WS (Huanggong town, Wusu) | 84°46′46′′E | 44°32′43′′N | 6.30 | 7.40 | 8.40 | 9.90 |
| SBZ | SHZ (Nongkesuo, Shihezi) | 86°2′52′′E | 44°20′6′′N | 6.30 | 7.40 | 8.40 | 9.90 |
从棉花中分离的内生真菌Alternaria sp. S1,在PDA培养基[29]上复壮后的纯培养物作为RT-qPCR检测的标准菌株。
1.2 主要试剂和仪器Ezup柱式植物基因组DNA试剂盒,OMEGA公司。显微镜,重庆奥特光学仪器有限公司;PCR仪,杭州博日科技有限公司;17高速离心机,美国赛默飞世尔科技公司;水平电泳仪,北京六一仪器厂;超纯水机,上海和泰仪器公司。
1.3 RT-qPCR法定量棉花内生真菌 1.3.1 反应体系的建立及优化纯化回收真菌Alternaria sp. S1 PCR产物,连接到pUCm-T载体,转化大肠杆菌,提取重组质粒,取已纯化的重组质粒2 μL,通过超微量分光光度计测定浓度,调整浓度后进行1-8次10倍连续梯度稀释,作为标准样品。应用真菌通用引物ITS86(F)和ITS4(R)[30]扩增菌株5.8S rDNA-ITS区段,探针Probe:5′-ACGCTCGYACAGGCATGCCC-3′。探针两端分别用FAM和BHQ1标记,探针和引物由上海闪晶分子生物科技有限公司合成。通过实时PCR仪进行荧光定量PCR扩增探针浓度的优化。其探针浓度优化后的体系为:模板(标准DNA/阴性对照) 5 μL/0 μL,ITS86(F)和ITS4(R) (10 μmol/L)各0.8 μL,FS Essential DNA Probes Master 10.0 μL,Probe 0.4 μL,ddH2O水补足20 μL。反应条件为:95 ℃ 10 min;95 ℃ 25 s,50 ℃ 120 s,72 ℃ 90 s,共45个循环。退火延伸时检测荧光信号。根据反应的Ct值、最高荧光值对引物反应浓度、最佳退火温度及扩增效率进行优化,以扩增Ct值在15-35之间,扩增效率接近100%为最佳反应。
1.3.2 标准曲线制作通过反应体系的建立及优化,确定标准DNA梯度浓度、引物浓度和最佳反应条件,在最佳(相同)反应条件下进行RT-qPCR扩增,同时设置不加模板的阴性对照,每个反应体系重复3次,由Roche LightCycle 480软件自动生成标准曲线和方程以建立Ct值与内生真菌浓度对数值之间的线性关系,其中y为扩增反应Ct值,x为内生真菌DNA起始浓度的Log10值。
1.3.3 组织基因组DNA提取随机选取各采样点10个重复的棉花根部组织,在液氮中充分研磨,称取30 mg左右粉末于1.5 mL无菌EP管中;按Ezup柱式植物基因组DNA抽提试剂盒提取各组织基因组总DNA。
1.3.4 RT-qPCR定量检测为准确测定和表示棉花组织中内生真菌的含量[ITS rDNA copies g/root fresh weight (FRW)],通过超微量分光光度计测定各组织基因组DNA浓度;分别以棉花根部组织总DNA为模板,在最佳扩增条件下对内生真菌含量进行RT-qPCR检测;检测完毕,将每个样品对应的Ct值带入标准曲线方程,计算各组织中内生真菌的含量(copies/g FRW)。
1.4 棉花黄萎病病原的RT-qPCR棉花黄萎病菌常规PCR体系和质粒标准品构建,以及荧光定量PCR反应条件优化和标准曲线建立参照文献[31]。以棉花根部组织总DNA为模板,进行RT-qPCR检测,每管3个重复,并设无棉花黄萎病菌的空白对照。
1.5 棉花黄萎病原与内生真菌的相互关系对采集的7个采样点棉花根部黄萎病菌和内生真菌定量检测。用皮尔逊相关系数(Pearson correlation coefficient,PCC)分析黄萎病病原菌与根部内生真菌的相互关系,将不同根部黄萎病病原菌数量和不同内生真菌在根中的含量构建成矩阵,以棉花根部黄萎病病原及其内生真菌为指标,以不同采样点棉花根为样本。PCC计算公式[22]如下:

|
所测数据采用SPSS 19.0软件进行数据统计分析,用Origin 8.5软件绘图。
2 结果与分析 2.1 标准曲线的制作标准真菌菌株Alternaria sp. S1的PCR产物浓度为51.60 ng/μL,进行7次10倍梯度稀释,浓度依次为5.16×100-5.16×10-6 ng/μL,并以5.16×10-1-5.16×10-6 ng/μL这6个标准浓度的DNA为模板进行PCR扩增,反应结束后由LightCycler®480系统软件自动生成反应曲线(图 1)和标准曲线(图 2)。

|
| 图 1 10倍梯度稀释阳性质粒的荧光定量PCR扩增曲线 Figure 1 RT-qPCR amplifacation curve of serial 10-fold dilutions of positive recombinant plasmids Note: RFU: Relative fluorescence units. |
|
|

|
| 图 2 棉花内生真菌TaqMan实时荧光定量标准曲线图 Figure 2 RT-qPCR standard curve of serial 10-fold dilutions of positive recombinant plasmids Note: Error: 0.017 8; Efficiency: 1.751; Slope: -3.817; YIntercept: 47.08; Link: 80, 330. |
|
|
扩增反应的扩增效率E=1.751,说明该反应体系和条件较理想;各浓度梯度间反应的相关性系数R2=0.996,说明标准差都在0.2范围内;截距为47.08。因此得出内生真菌的DNA起始浓度对数值与Ct值之间的线性方程为y=-3.817x+47.08。
2.2 不同生育时期棉花植株根部内生真菌数量变化趋势库尔勒和阿拉尔棉花样品中内生真菌数量变化趋势相似,随着棉花生长发育其根部内生真菌数量逐渐上升,棉花花铃期和吐絮期达到最大值,其中库尔勒棉花根部最大值达1.46×109 copies/g FRW。阿拉尔棉花根部内生真菌数量到蕾期才缓慢上升,花铃期达到最大值,为8.30×107 copies/g FRW,比库尔勒棉花明显低1/10,吐絮期逐渐下降(图 3)。但是,哈密棉花根部内生真菌数量在苗期最高,花铃期下降到最低后缓慢上升,吐絮期升到2.18×107 copies/g FRW。
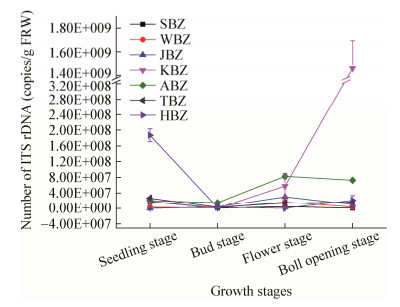
|
| 图 3 各生育时期的棉花黄萎病株内生真菌数量变化 Figure 3 Variation of numbers of endophytic fungi in cotton infected by Verticillium Wilt at different growth stages 注:SBZ、WBZ、JBZ、KBZ、ABZ、TBZ、HBZ分别表示石河子、乌苏、精河、库尔勒、阿拉尔、图木舒克和哈密棉花病株内生真菌. Note: SBZ, WBZ, JBZ, KBZ, ABZ, TBZ, HBZ show fungal endophyte in cotton affected Verticillium Wilt in Shihezi, Jinghe, Korla, Wusu, Alar, Tumu Shuker and Hami respectively. |
|
|
综合棉花全生育期(苗期、蕾期、花期、絮期),除哈密棉花根部内生真菌数量先降后升,阿拉尔棉花蕾期上升,花铃期达最大值,以及库尔勒棉花吐絮期达到最大值以外,其他内生真菌数量在各个生育期没有很大的变化。
2.3 不同采样地点棉花植株根部内生真菌数量变化趋势库尔勒棉花内生真菌数量最高,吐絮期达到1.46×109 copies/g FRW,其次为哈密,苗期为1.87×108 copies/g FRW;精河最少,苗期为1.85×104 copies/g FRW (图 4)。

|
| 图 4 各采样点棉花黄萎病株内生真菌数量差异 Figure 4 Variation of numbers of endophytic fungi in cotton infected by Verticillium Wilt at different sampling sites 注:SHZ、WS、JH、KEL、ALE、TMS、HM分别表示采样地点石河子、乌苏、精河、库尔勒、阿拉尔、图木舒克和哈密. Note: SHZ, WS, JH, KEL, ALE, TMS, HM show sampling locations in Shihezi, Wusu, Jinghe, Korla, Alar, Tumu Shuker and Hami respectively. |
|
|
从图 4可以看出,棉花根部内生真菌数量的空间变化趋势是南疆、东疆、北疆依次递减:南疆库尔勒和阿拉尔内生真菌数量较高,库尔勒吐絮期达到最大值,阿拉尔和图木舒克逐渐下降;哈密苗期又略上升,可见棉花植株内生真菌数量最大值出现在南疆(库尔勒花铃期)。
2.4 棉花内生真菌数量与黄萎病菌数量间的关系棉花不同样品根部黄萎病原菌数量及其内生真菌数量分布见表 2,内生真菌数量在精河苗期棉花根部分布数量最少,而内生真菌数量在库尔勒吐絮期棉花根部最高。苗期棉花黄萎病病原菌的含量在所测的7个样点中均较低。北疆棉花根部黄萎病病原菌数量峰值较多出现在花铃期,而南疆和东疆一般出现在棉花吐絮期。石河子、乌苏棉花黄萎病病原菌数量和内生真菌数量最高均出现在花铃期。样点库尔勒絮期棉花根部内生真菌数量在整个生育期最高,而同期黄萎病病原数量并非最高。
| 样点 Sampling sites |
苗期 Seeding stage |
蕾期 Bud stage |
花期 Flower stage |
絮期 Boll opening stage |
|||||||
| 病原菌 Verticillium dahliaein |
内生真菌 Endophytic fungi |
病原菌 Verticillium dahliaein |
内生真菌 Endophytic fungi |
病原菌 Verticillium dahliaein |
内生真菌 Endophytic fungi |
病原菌 Verticillium dahliaein |
内生真菌 Endophytic fungi |
||||
| SHZ | 118 | 17 326 616 | 177.0 | 627 542 | 131 006 | 4 540 521 | 21 710 | 614 781 | |||
| WS | 4 | 2 935 604 | 249 451.0 | 1 443 879 | 131 200 | 16 698 488 | 58 088 | 3 447 192 | |||
| JH | 4 | 18 500 | 14 302.0 | 4 348 181 | 23 376 | 30 139 710 | 28 527 | 10 287 043 | |||
| KEL | 9 | 18 796 212 | 515.2 | 918 211 | 2 402 | 57 691 687 | 1 114 | 1 459 998 886 | |||
| ALE | 473 | 20 131 747 | 38 758.0 | 15 012 374 | 33 127 | 83 006 573 | 5 767 615 | 72 612 236 | |||
| TMS | 87 | 26 775 231 | 806.9 | 2 948 364 | 83 470 | 13 912 315 | 853 060 | 16 474 234 | |||
| HM | 232 | 186 999 767 | 699.6 | 2 817 276 | 41 827 | 475 681 | 483 462 | 21 328 622 | |||
不同地点棉花根部内生真菌与黄萎病病原菌的PCC见表 3,北疆精河棉花内生真菌数量与黄萎病病原菌数量显著正相关,其PCC高达0.639。石河子和哈密棉花内生真菌与黄萎病病原菌呈负相关,其相关系数分别为-0.180和-0.275。其他地区内生真菌与黄萎病病原菌之间存在正相关,但相关性不显著,图木舒克棉花内生真菌与黄萎病病原菌的PCC仅为0.093。
| Sampling sites | PCC |
| SHZ | -0.180 |
| WS | 0.270 |
| JH | 0.639* |
| KEL | 0.096 |
| ALE | 0.475 |
| TMS | 0.093 |
| HM | -0.275 |
| 注:SHZ、WS、JH、KEL、ALE、TMS、HM分别表示采样地点石河子、乌苏、精河、库尔勒、阿拉尔、图木舒克和哈密.*:在P < 0.05水平上差异显著. Note: SHZ, WS, JH, KEL, ALE, TMS, HM show sampling locations in Shihezi, Wusu, Jinghe, Korla, Alar, Tumu Shuker and Hami respectively. *: Significant differences at P < 0.05. |
|
不同生育期棉花根部内生真菌与黄萎病病原菌的PCC见表 4,各生育时期棉花内生真菌数量与黄萎病病原菌数量呈负相关。其中苗期和蕾期棉花内生真菌与黄萎病病原菌相关度较高,其相关系数分别为-0.85和-0.78。其他内生真菌与黄萎病病原菌之间相关性较低,如吐絮期棉花内生真菌与黄萎病病原菌的PCC仅为-0.172。
| Growth stages | PCC |
| Seedling stage | -0.850 |
| Bud stage | -0.780 |
| Flower stage | -0.591 |
| Boll opening stage | -0.172 |
植物内生真菌具有促进植物生长和防治植物病虫害的作用,定量内生真菌是分析内生菌与作物病虫害相关性的关键。因此,一种快速、准确、灵敏的检测植物内生真菌方法非常有利于筛选具有抑菌能力的内生真菌。本研究建立了一种针对棉花植株根际土壤真菌和根部内生真菌的分子定量检测方法。该方法摆脱了传统的纯培养过程,与传统检测方法相比,具有高效、简单和快速等诸多优点。棉花内生真菌的精确定量分析有助于认识和丰富作物内生菌在时间和空间上的动态变化规律,阐明内生菌与黄萎病的关系。
采用RT-qPCR技术对新疆主要棉区棉花根中内生真菌含量的定量测定显示,被检测的根组织中均存在内生真菌,库尔勒和阿拉尔棉花样品中内生真菌数量变化均表现为随棉花生长发育其根部内生真菌数量逐渐上升,棉花花铃期和吐絮期达到最大值;其中库尔勒棉花吐絮期为最大值,而阿拉尔棉花表现为蕾期缓慢上升,花铃期达到最大值,吐絮期逐渐下降,这可能与棉花品种基因型有关。苏丹等[25]选取内生真菌特异性引物,利用PCR技术对黑麦草中内生真菌定量发现,不同植株之间内生真菌数量差异较大,而同株植物相同龄级分蘖之间内生真菌数量无显著差异,内生真菌数量不仅与植物种以及品种有关,也与植物的基因型密切相关。这为我们在不同生态区棉花内生真菌数量差异原因的推断提供了一个有力的证据。
总体上新疆主要棉区棉花全生育期内生真菌数量最大值出现在花铃期,说明棉花根组织中的内生真菌数量与棉花的生长发育是紧密相关、协同增长的,也可能是因为花铃期棉田小气候和棉花微环境有利于内生真菌的生长和繁殖。刘政[8]采用组织分离培养法研究石河子棉田不同时期黄萎病发病棉株根部内生真菌种群数量动态变化,发现随着棉花生育时期的推进,轮枝孢属种群数量从蕾期开始逐渐上升外,其他类群真菌的数量均呈下降趋势。进入初花期–结铃期轮枝孢属种群数量直线上升,到结铃期时分离频率最高达33.82%。这说明黄萎病棉株进入中后期,病原菌的侵入造成了内生真菌菌群和数量的锐减。出现这种内生真菌急剧下降的原因可能是因为黄萎病菌在棉花体内大量繁殖,造成空间竞争和营养条件的恶化,导致内生真菌不能较好地生长和繁殖。本文与刘政得到的研究结果不一致,作者推测与研究对象和研究方法有关。本研究选取新疆主要棉区不同生育时期的棉花样品,采用TaqMan实时荧光定量PCR方法开展研究,所得结果是棉花内生真菌的总体数量(基因拷贝数);而刘政选取石河子棉花样品,采用可培养的方法进行实验,得到的是基于组织块分离的内生菌的种类及其分离频率,这是造成结果不一致的主要原因。
虽然刘政对一个或局部棉区棉花进行了不同生育时期内生真菌数量动态进行了实验[8],然而有关棉花内生真菌在不同生态区的分布研究较少。Ek-Ramos等对美国得克萨斯州8个农场棉花内生菌的时空动态研究发现,内生真菌群落组成受棉株不同组织和发育时间的影响,而特异真菌类群随空间变化[32]。本文的研究结果显示新疆棉花根部内生真菌在空间上表现出明显的分布特征。总体而言,新疆棉花根部内生真菌数量南疆高于北疆,尤以南疆库尔勒和阿拉尔内生真菌数量方面表现更明显,同时不同地点伴有此起彼伏的显著特征,如库尔勒吐絮期达到最大值,阿拉尔和图木舒克逐渐下降。新疆棉花根部内生真菌数量南疆高于北疆,这种差异可能是由于南疆土壤、气候及棉花品种更有利于内生真菌的生长和繁殖所致。
本研究初步探讨了黄萎病发病棉株内生真菌数量与棉花黄萎病菌数量的相关关系。肖蕊等[31]建立了土壤中棉花黄萎病菌的SYBR Green Ⅰ荧光定量PCR检测方法,实现了田间土壤棉花黄萎病菌的简便、快速、定量的早期检测,为棉花黄萎病发生危害的风险预测和制定病害综合防治措施提供理论依据。本文采用肖蕊等的定量方法对新疆棉花黄萎病菌进行了定量,利用皮尔逊相关系数分析了黄萎病病原菌与根部内生真菌的相互关系。新疆棉花内生真菌数量与黄萎病病原菌数量有一定的关系,但总体上这种关系在棉花生育时期和棉花主要生态区并没有表现出十分明显的规律性,但两者间在棉花不同生态区主要表现为正相关,而在不同发育时期表现为负相关。棉花不同生育时期内生真菌数量与黄萎病病原菌数量呈较高的负相关性可能是因为随着棉花生育时期的推进,黄萎病病原菌在棉花体内大量繁殖,造成空间竞争和营养条件恶化,导致内生真菌不能很好地生长和繁殖。有关新疆棉花内生真菌与黄萎病的关系具有复杂性,其原因需要进一步研究。
| [1] |
Lin L, Zhang X, Deng S. Research advances in cotton Verticillium Wilt[J]. Cotton Science, 2014, 26(3): 260-267. 林玲, 张昕, 邓晟. 棉花黄萎病研究进展[J]. 棉花学报, 2014, 26(3): 260-267. |
| [2] |
Jian GL, Zou YF, Ma C. Causes and countermeasures of cotton Verticillium Wilt[J]. China Cotton, 2003, 30(3): 13-14. 简桂良, 邹亚飞, 马存. 棉花黄萎病连年流行的原因及对策[J]. 中国棉花, 2003, 30(3): 13-14. |
| [3] |
Liang H, Huang J, Zhao J, et al. Studies on biocontrol of cotton Verticillium Wilt[J]. Biotechnology Bulletin, 2015, 31(5): 1-6. 梁宏, 黄静, 赵佳, 等. 生物防治棉花黄萎病的研究进展[J]. 生物技术通报, 2015, 31(5): 1-6. |
| [4] |
Xu L, Zhu LF, Zhang XL. Research on resistance mechanism of cotton to Verticillium Wilt[J]. Acta Agronomica Sinica, 2012, 38(9): 1553-1560. 徐理, 朱龙付, 张献龙. 棉花抗黄萎病机制研究进展[J]. 作物学报, 2012, 38(9): 1553-1560. |
| [5] |
Zhang ML, Xia RZ, Liao XL. Research progress of prevention methods on cotton Verticillium Wilt[J]. Modern Agricultural Science and Technology, 2014(7): 129-131. 章茂林, 夏日照, 廖晓兰. 棉花黄萎病防治方法研究进展[J]. 现代农业科技, 2014(7): 129-131. |
| [6] |
Rodriguez RJ, White JF, Arnold AE, et al. Fungal endophytes: diversity and functional roles[J]. New Phytologist, 2009, 182(2): 314-330. DOI:10.1111/j.1469-8137.2009.02773.x |
| [7] |
Zhang Y, Feng ZL, Feng HJ, et al. Control effect of endophytic fungus Chaetomium globosum CEF-082 against Verticillium Wilt in Gossypium hirsutum[J]. Acta Phytopathologica Sinica, 2016, 46(5): 697-706. 张芸, 冯自力, 冯鸿杰, 等. 内生球毛壳属真菌CEF-082对棉花黄萎病的控制作用[J]. 植物病理学报, 2016, 46(5): 697-706. |
| [8] |
Liu Z. Analysis of the community structures of endophytic bacteria and funfus in the roots of Verticillium-infected cotton in Xinjiang[D]. Beijing: Doctoral Dissertation of China Agricultural University, 2015 (in Chinese) 刘政. 新疆黄萎病田棉花根部内生细菌和真菌群落结构分析[D]. 北京: 中国农业大学博士学位论文, 2015 |
| [9] |
Li ZF, Wang LF, Feng ZL, et al. Isolation, identification and phylogenetic analysis on the endophytic fungi of cotton[A]//Proceedings of the 2013 annual meeting of China Cotton Association[C]. Changsha: China Cotton Association, 2013: 1 (in Chinese) 李志芳, 王玲飞, 冯自力, 等. 棉花内生真菌的分离鉴定和种群分析[A]//中国棉花学会2013年年会论文集[C]. 长沙: 中国棉花学会, 2013: 1 |
| [10] |
Li HL, Yuan HX, Huang JL, et al. The effects of organic amendments on cotton Verticillium Wilt and microbes in rhizosphere[J]. Shandong Science, 2005, 18(3): 26-29. 李洪连, 袁虹霞, 黄俊丽, 等. 有机改良剂对棉花黄萎病的防治效果及其对根际微生物区系的影响(英文)[J]. 山东科学, 2005, 18(3): 26-29. |
| [11] |
Wang LF. Diversity of endophytic fungi from cotton and evaluation of antifungal activity against cotton Verticillium Wilt[D]. Anyang: Master's Thesis of Chinese Academy of Agricultural Sciences, 2014 (in Chinese) 王玲飞. 棉花内生真菌多样性分析及对黄萎病生防潜力评估[D]. 安阳: 中国农业科学院棉花研究所硕士学位论文, 2014 |
| [12] |
Zhang Y. Control effects and mechanism research of cotton endophytic fungi against Verticillium Wilt in Gossypium hirsutum[D]. Yangling: Master's Thesis of Northwest Agriculture and Forestry University, 2016 (in Chinese) 张芸. 棉花内生真菌对棉花黄萎病的控制作用及机理研究[D]. 杨凌: 西北农林科技大学硕士学位论文, 2016 |
| [13] |
Li CH, Zhao MW, Tang CM, et al. Population dynamics and identification of endophytic bacteria antagonistic toward plant-pathogenic fungi in cotton root[J]. Microbial Ecology, 2010, 59(2): 344-356. DOI:10.1007/s00248-009-9570-4 |
| [14] |
Gasoni L, de Gurfinkel BS. Biocontrol of Rhizoctonia solani by the endophytic fungus Cladorrhinum foecundissimum in cotton plants[J]. Australasian Plant Pathology, 2009, 38(4): 389-391. DOI:10.1071/AP09013 |
| [15] |
Olsrud M, Michelsen A, Wallander H. Ergosterol content in ericaceous hair roots correlates with dark septate endophytes but not with ericoid mycorrhizal colonization[J]. Soil Biology and Biochemistry, 2007, 39(5): 1218-1221. DOI:10.1016/j.soilbio.2006.11.018 |
| [16] |
Browning R Jr. Effects of endophyte-infected tall fescue on indicators of thermal status and growth in Hereford and Senepol steers[J]. Journal of Animal Science, 2004, 82(2): 634-643. DOI:10.2527/2004.822634x |
| [17] |
Promputtha I, Hyde KD, McKenzie EHC, et al. Can leaf degrading enzymes provide evidence that endophytic fungi becoming saprobes?[J]. Fungal Diversity, 2010, 41(1): 89-99. DOI:10.1007/s13225-010-0024-6 |
| [18] |
Pilon M, Owen JD, Garifullina GF, et al. Enhanced selenium tolerance and accumulation in transgenic Arabidopsis expressing a mouse selenocysteine lyase[J]. Plant Physiology, 2003, 131(3): 1250-1257. DOI:10.1104/pp.102.014639 |
| [19] |
Rasmussen S, Parsons AJ, Fraser K, et al. Metabolic profiles of Lolium perenne are differentially affected by nitrogen supply, carbohydrate content, and fungal endophyte infection[J]. Plant Physiology, 2008, 146(3): 1440-1453. DOI:10.1104/pp.107.111898 |
| [20] |
Wang Q, Zhang D, Zhao DM, et al. Development of a real-time fluorescence quantitative PCR assay for detection of Alternaria solani causing early blight of potatoes[J]. Journal of Agricultural University of Hebei, 2016, 39(6): 32-37, 62. 王倩, 张岱, 赵冬梅, 等. 马铃薯早疫病菌实时荧光定量PCR检测方法的建立[J]. 河北农业大学学报, 2016, 39(6): 32-37, 62. |
| [21] |
Srivastava S, Gupta PS, Lal S, et al. Rapid identification of endophytic fungi of sugarcane (Saccharum spp. hybrid) using PCR-RFLP of rDNA[J]. Journal of Environmental Biology, 2017, 38(1): 21-26. DOI:10.22438/jeb/ |
| [22] |
Wang HW, Dai CC, Zhu H, et al. Survival of a novel endophytic fungus Phomopsis liquidambari B3 in the indole-contaminated soil detected by real-time PCR and its effects on the indigenous microbial community[J]. Microbiological Research, 2014, 169(12): 881-887. DOI:10.1016/j.micres.2014.05.006 |
| [23] |
Kelemu S, Dongyi H, Guixiu H, et al. Detecting and differentiating Acremonium implicatum: developing a PCR-based method for an endophytic fungus associated with the genus Brachiaria[J]. Molecular Plant Pathology, 2003, 4(2): 115-118. DOI:10.1046/j.1364-3703.2003.00157.x |
| [24] |
Zhou QW, Yu LF, Lu H, et al. Microscopic distribution and quantitative detection of endophytic fungus Undifilum oxytropis from Oxytropis glabra DC and Astragalus variabilis[J]. Acta Microbiologica Sinica, 2014, 54(5): 572-581. 周启武, 于龙凤, 路浩, 等. 小花棘豆和变异黄芪内生真菌显微分布及定量检测[J]. 微生物学报, 2014, 54(5): 572-581. |
| [25] |
Su D, Ren AZ, Gao YB. Detection and quantification of the endophyte in Lolium perenne L.[J]. Microbiology China, 2006, 33(5): 12-16. 苏丹, 任安芝, 高玉葆. 黑麦草内生真菌感染状况的检测及定量分析[J]. 微生物学通报, 2006, 33(5): 12-16. |
| [26] |
Frasz SL, Walker AK, Nsiama TK, et al. Distribution of the foliar fungal endophyte Phialocephala scopiformis and its toxin in the crown of a mature white spruce tree as revealed by chemical and qPCR analyses[J]. Canadian Journal of Forest Research, 2014, 44(9): 1138-1143. DOI:10.1139/cjfr-2014-0171 |
| [27] |
Tellenbach C, Grünig CR, Sieber TN. Suitability of quantitative real-time PCR to estimate the biomass of fungal root endophytes[J]. Applied and Environmental Microbiology, 2010, 76(17): 5764-5772. DOI:10.1128/AEM.00907-10 |
| [28] |
Cook D, Gardner DR, Welch KD, et al. Quantitative PCR method to measure the fungal endophyte in locoweeds[J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 6050-6054. DOI:10.1021/jf901028z |
| [29] |
Zeng WB, Chang CX, Li JP, et al. Micro-morphological variation pattern of Isaria cicadae[J]. Acta Microbiologica Sinica, 2017, 57(3): 350-362. 曾文波, 常衬心, 李建平, 等. 蝉棒束孢显微形态变异式样[J]. 微生物学报, 2017, 57(3): 350-362. |
| [30] |
Horváth A, Pető Z, Urbán E, et al. A novel, multiplex, real-time PCR-based approach for the detection of the commonly occurring pathogenic fungi and bacteria[J]. BMC Microbiology, 2013, 13(1): 300. DOI:10.1186/1471-2180-13-300 |
| [31] |
Xiao R, Yu ZZ, Elsharawy AA, et al. SYBR GreenⅠreal time RT-PCR assay for quantitatively detecting the occurrence of Verticillium dahliae of cotton in naturally infested soil[J]. Mycosystema, 2011, 30(4): 598-603. 肖蕊, 余真真, Elsharawy AA, 等. 土壤中棉花黄萎病菌SYBR GreenⅠ荧光RT-PCR定量检测技术研究[J]. 菌物学报, 2011, 30(4): 598-603. |
| [32] |
Ek-Ramos MJ, Zhou WQ, Valencia CU, et al. Spatial and temporal variation in fungal endophyte communities isolated from cultivated cotton (Gossypium hirsutum)[J]. PLoS One, 2013, 8(6): e66049. DOI:10.1371/journal.pone.0066049 |
 2018, Vol. 45
2018, Vol. 45