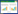扩展功能
文章信息
- 王琪, Paulina Simon, 刘锦钰, 迟玉新, 代先祝, 杜红霞, 张晓辉, 五十岚泰夫, 杨彩云, 罗锋
- WANG Qi, PAULINA Simon, LIU Jin-Yu, CHI Yu-Xin, DAI Xian-Zhu, DU Hong-Xia, ZHANG Xiao-Hui, YASUO Igarashi, YANG Cai-Yun, LUO Feng
- 滇池中溶藻细菌的分离鉴定及其溶藻效应
- Identification of algicidal bacterium Sp37
- 微生物学通报, 2018, 45(12): 2614-2623
- Microbiology China, 2018, 45(12): 2614-2623
- DOI: 10.13344/j.microbiol.china.180028
-
文章历史
- 收稿日期: 2018-01-10
- 接受日期: 2018-03-27
- 网络首发日期(www.cnki.net): 2018-04-12
在海洋、湖泊和河流等水体中,藻类快速生长并聚集可引起赤潮与水华的发生。近年来,伴随着水体富营养化和气候变暖等环境问题的突出,水华与赤潮在世界范围内频发[1]。水华和赤潮可带来多种危害:藻类大量繁殖会堵塞管道,影响用水系统,降低水中溶解氧,影响水体中鱼类等生存;一些藻类还会产生藻毒素(如微囊藻毒素),严重危害人类及周边其他生物的健康[2]。因此水华和赤潮问题亟待有效解决。藻类的控制和治理主要有物理法、化学法和生物法,在目前利用物理、化学等方法治理水华效果不理想或者容易产生二次污染的情况下,环境友好型的生物法为治理藻类提供了一条新的途径。目前,利用溶藻细菌进行水华和赤潮的治理成为国内外研究的热点[3-5]。
滇池是我国西南地区第一大淡水湖,有“高原明珠”之称。近些年来,滇池的富营养化程度加重,以铜绿微囊藻(Microcystis aeruginosa)为优势种的蓝藻水华的暴发越来越频繁,造成每年4–11月均为水华发生期[6],其中7−9月是水华发生的高峰期[7]。目前对滇池中蓝藻水华溶藻菌的研究仅限于溶藻方式、溶藻范围等。例如,从滇池分离并鉴定的短小芽孢杆菌(Bacillus pumilus) DC-L5[8]、纺锤形赖氨酸芽孢杆菌(Lysinibacillus fusiformis) DC-L14[9]、蜡状芽孢杆菌(B. cereus) YA1-1、蕈状芽孢杆菌(B. mycoides) YA2-3[10]等溶藻菌,发现是通过分泌胞外物质间接溶藻;史顺玉分离获得了对6株蓝藻及2株绿藻均有溶藻作用的溶藻菌假单胞菌(Pseudomona sp.) DC10[11],这些研究对相关溶藻菌的溶藻机理均未作出阐释。本研究从滇池分离得到多株细菌,基于一株前期从滇池中分离获得的铜绿微囊藻进行溶藻菌的筛选,对其溶藻能力和方式作出阐释,并初步分析其溶藻特性和溶藻机理,以期为实现以溶藻菌控制滇池蓝藻水华提供优质的控藻菌资源与理论指导。
1 材料与方法 1.1 主要试剂和仪器NaCl、酵母提取物、胰蛋白胨,北京索莱宝科技有限公司;FastDNA Spin Kit,MP biomedical公司;DNA通用纯化试剂盒,厦门鹭隆生物科技公司;PCR反应体系中所用试剂和酶,TaKaRa公司;引物,重庆擎科兴业生物技术有限公司。
人工气候培养箱,宁波东南仪器有限公司;天平、pH计,赛多利斯科学仪器有限公司;立式高速冷冻离心机,Tomy公司;台式高速冷冻离心机,Beckman公司;PCR仪,郎基科学仪器有限公司;紫外可见分光光度计,岛津公司;多功能酶标仪,Bio-Tek公司。
1.2 溶藻菌的分离鉴定与培养细菌的分离:将采集的滇池水体梯度稀释后,涂布于LB固体平板培养基(LB固体培养基(g/L):NaCl 10.0,酵母提取物5.0,胰蛋白胨10.0,琼脂糖1.5,pH调整为7.0−7.2),30 ℃避光培养2−3 d。待菌落长出后,选取形态特征不同的单菌落,进行多次划线,最终获得纯菌。共获得120株细菌,将菌株用甘油冻存法保存于−80 ℃。
细菌的鉴定:通过16S rRNA基因测序鉴定。PCR引物为27F (5′-AGAGTTTGATCCTGGCTCA G-3′)和1492R (5′-TACGGYTACCTTGTTACGACT T-3′)。PCR反应体系(25 μL):2.5 μL 10×PCR buffer (Mg2+ free),2.5 μL MgCl2 (25 mmol/L),0.5 μL dDTP,上、下游引物10 μmol/L各0.5 μL,0.25 μL Taq酶(5 U/μL),2 μL DNA模板,补足水至25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃ 5 min。取2 μL PCR产物进行琼脂糖凝胶电泳,然后用凝胶成像仪检测电泳条带。PCR产物送北京擎科新业生物技术有限公司进行测序。
细菌的培养:溶藻相关的研究中,细菌培养于1/6 LB液体培养基中,30 ℃、180 r/min培养。LB全营养培养基会对蓝藻的生长产生影响,LB稀释实验结果显示,1/6 LB对蓝藻的生长基本无影响,因此本研究中用于溶藻实验的细菌均培养于1/6 LB中。
细菌生长曲线的测定:取200 μL菌悬液接种于20 mL 1/6 LB培养基中,30 ℃、180 r/min培养,设3组平行;每隔2 h取样测定其在600 nm处吸光度(OD600);以OD600表征其生长情况,便于后续实验取样。
1.3 蓝藻的分离与培养 1.3.1 蓝藻的分离所用蓝藻培养基为BG11培养基[12]。滇池水体偏碱性,pH在8.8−8.9左右,因此将所用由滇池分离的藻种的培养基pH调至8.8。采用镜检和毛细管分离的方法分离蓝藻:将水样和无菌水分别滴于载玻片上,在显微镜下观察,选择目标藻团,使用毛细管挑取水样中的藻团,放入一滴无菌水中,再从放入藻团的水滴中挑取目标藻团,以此类推直至挑取单个藻细胞或单个藻团为止。将最后获取的藻细胞接入备有BG11培养基的试管中培养。培养一个月后镜检如只有单一种类,则视为单藻分离成功,并富集培养为后续鉴定做准备。分离过程中所有器皿都经灭菌处理。
1.3.2 蓝藻的鉴定藻类初步鉴定主要参考《浙江省主要常见淡水藻类图集(饮用水水源)》[13],根据显微形态将滇池水样中微囊藻分离出,后续通过cpcBA基因进行微囊藻种类鉴定[14-15]。DNA提取采用改良CTAB法进行[16];PCR引物PCβF (5′-GGCTGCTTGTTT ACGCGACA-3′)和PCαR (5′-CCAGTACCACCAG CAACTAA-3′)[14]。PCR反应体系(25 μL):2.5 μL 10×PCR buffer (Mg2+ free),2.5 μL MgCl2 (25 mmol/L),0.5 μL dDTP,上、下游引物10 μmol/L各0.5 μL,0.25 μL Taq酶5 U/μL,2 μL DNA模板,补足水至25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃ 8 min;取3 μL PCR产物进行琼脂糖凝胶电泳,然后用凝胶成像仪检测电泳条带。PCR产物送由北京擎科新业生物技术有限公司进行测序。
1.3.3 蓝藻的培养采用BG11培养基在28 ℃、光照3 000 lx、光暗比14׃10条件下培养。
1.3.4 蓝藻生长曲线的测定将5 mL藻液接种于100 mL BG11液体培养基中,设3组平行;每隔3 d取样测定其叶绿素a含量和在680 nm处的吸光度(OD680);以OD680表征其大致生长情况和叶绿素a含量,便于后续实验取样。
1.4 溶藻菌的筛选溶藻菌的筛选采用藻菌共培养的方法。将各菌株在上述培养条件下的菌悬液,取1 mL菌液以体积比5% (体积比)等量加入20 mL藻液中,并以加入1/6 LB的藻液为对照,能使藻液黄化的菌株则为溶藻菌。选取其中溶藻作用快、溶藻效率高的菌株作为候选实验菌株。
1.5 细菌对藻细胞的溶藻试验 1.5.1 细菌对藻细胞的溶解作用将细菌液体培养至稳定期,取1 mL OD600约为0.67时(Sp37接种于1/6 LB中生长至稳定期的OD值)的菌液按照5% (体积比)添加到20 mL对数生长期的初始叶绿素a浓度约为3.6 mg/L的藻液(如无特别说明,后续实验中所用菌液均为OD600约为0.67的菌液,藻液均为叶绿素a浓度约为3.6 mg/L的藻液)中,并向相同藻液中加入等量1/6 LB作为对照,各设3组平行;每隔12 h取样,用于测定叶绿素a浓度。叶绿素a测定方法采用热乙醇法[17-18]。溶藻率计算方法为:Ae=(C0−Ct)/C0×100%。其中,Ae是作用于蓝藻的溶藻率;C0和Ct分别代表对照组和处理组的叶绿素a含量。
1.5.2 细菌的溶藻方式及溶藻物质的特性溶藻方式:取稳定期的原菌液、无菌水洗涤3次并以1/6 LB重悬的菌体、用0.22 μm滤膜过滤的无菌滤液各1 mL分别按照5% (体积比)添加进20 mL藻液中共培养,向相同藻液中加入等量1/6 LB作为对照,各设3组平行;于第4天取样进行叶绿素a的测定。
溶藻物质稳定性:将培养至稳定期的菌悬液过滤得到的无菌滤液的pH用1 mol/L HCl溶液和1 mol/L NaOH溶液分别调成3.0、5.0、7.0、9.0、11.0,在室温下处理3 h后调回原pH,取1 mL无菌滤液以5% (体积比)分别添加20 mL藻液进行共培养;将无菌滤液置于−20、40、60、80、100 ℃等温度下处理3 h后恢复至室温,取1 mL无菌滤液以5% (体积比)分别添加进20 mL藻液进行共培养;加入未经任何处理的无菌滤液作为对照,每组设3个平行。共培养4 d后取样测定各组体系的叶绿素a浓度。
1.6 藻细胞经无菌滤液处理后的生理生化响应将细菌培养至稳定期,取其无菌滤液1 mL与20 mL藻液进行共培养,设置3个平行样品,分别在3、12和18 h取样,取样之后去上清,用无菌水洗涤3次,将藻细胞保存于−80 ℃备用。根据试剂盒操作说明测定藻细胞过氧化氢酶(CAT)、还原型谷胱甘肽(GSH)以及丙二醛(MDA)的含量。各生理生化指标均利用南京建成试剂盒进行测定。
2 结果与分析 2.1 微藻与溶藻细菌的分离鉴定经鉴定一共获得11株微囊藻和3株绿藻,选取其中的铜绿微囊藻DCM4、水华微囊藻DCM1、惠氏微囊藻DCM11、单针藻(Monoraphidium sp.) DCA4、栅藻(Scenedesmus sp.) DCA5以及从日本购买的铜绿微囊藻NIES-843作为实验藻株。
从滇池水体分离出17株具有高效溶藻能力的细菌。本文选取其中一株作用速度快、溶藻效率高的菌株Sp37。将Sp37的16S rRNA基因序列与EzBioCloud网站中已登录的16S rRNA基因序列进行核苷酸序列同源性比较,结果发现,Sp37与多株芽孢杆菌(Bacillus)的相似性达99%以上,其中与一株Bacillus siamensis的相似性最高,达99.93%。据此将Sp37归于Bacillus siamensis。Sp37菌株的系统发育树见图 1。

|
| 图 1 基于菌株Bacillus siamensis Sp37的16S rRNA基因序列同源性构建的系统发育树 Figure 1 Phylogenetic tree based on 16S rRNA gene sequence homolog of Bacillus siamensis Sp37 注:括号中的数字为GenBank登录号;标尺长度代表进化距离. Note: Numbers in parenthesis represented GenBank accession number; The scale bar represents the evolutionary distance. |
|
|
将Sp37接种在液体1/6 LB中培养,每隔2 h取样,测定其600 nm处吸光度(OD600),绘制生长曲线如图 2所示。从图 2中可以看出,Sp37迟缓期在0−6 h,对数生长期在6−14 h,14 h后进入稳定期。后续选取细菌浓度较高的稳定期进行溶藻相关试验。
|
| 图 2 细菌Bacillus siamensis Sp37的生长曲线 Figure 2 The growth curve of Bacillus siamensis Sp37 |
|
|
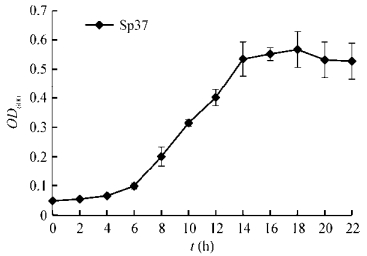
Sp37对DCM4有明显溶藻作用(图 3):在初始叶绿素a浓度约为3.6 mg/L的藻液中加入Sp37,共培养12 h之后DCM4的生长就受到抑制,叶绿素a含量不再增加,共培养1 d后,溶藻率达到42.7%±3.6%,说明菌株对铜绿微囊藻DCM4的溶藻效果非常好;共培养4 d后,铜绿微囊藻DCM4的去除率达到92.4%±1.5% (图 3),说明菌株Sp37对DCM4的溶藻效果很好。目前已有芽孢杆菌溶解藻的报道,包括芽孢杆菌能选择性杀死铜绿微囊藻[19-20],短小芽孢杆菌(B. pumilus)对多种微囊藻有溶藻效果[8]。而本研究分离的溶藻菌Bacillus siamensis Sp37目前尚未有杀藻功能的相关报道。另外,目前所报道的关于溶藻菌研究中目标藻的初始叶绿素a含量都较低(0.5−1.0 mg/L)[20-21],且溶藻所需要时间都较长(达到80%的溶藻率,所需时间 > 7 d)[5, 12]。本实验采用的供试藻叶绿素a的含量(3.6 mg/L)远高于自然水华的叶绿素a含量(0.04−0.39 mg/L)[22-23],而菌株Sp37能够在短时间内杀死该浓度的藻,这对以后Sp37的实际应用提供了更大的可能性。
|
| 图 3 菌株Sp37对铜绿微囊藻DCM4作用下的叶绿素a含量变化(A)及溶藻效率(B) Figure 3 Content of Chlorophyll-a (A) and algicidal effect (B) of Sp37 on M. aeruginosa DCM4 注:图中Test指加入培养Sp37到稳定期的菌悬液与藻液共培养,Control指加入1/6 LB与藻液共培养. Note:Test is indicated that the culture of Sp37 was inoculated in M. aeruginosa DCM4 and co-cultivated; Control is indicated that the 1/6 LB was inoculated in M. aeruginosa DCM4 and co-cultivated. |
|
|
为了确定Sp37的溶藻对象是否有一定的种类特异性,本研究选择了能引起水华的3株蓝藻及2株绿藻进行Sp37的溶藻实验,主要包括水华微囊藻DCM1、惠氏微囊藻DCM11、铜绿微囊藻NIES843、单针藻DCA4、栅藻DCA5。从表 1中可以看出,菌株Sp37对微囊藻DCM1、DCM11和NIES843都有溶藻效果,其中对铜绿微囊藻NIES843的溶藻效果最好,在共培养8 d时溶藻效率为99.8%±0.0%;对水华微囊藻DCM1和惠氏微囊藻DCM11也具有较好溶藻效果,在共培养第8天时溶藻率分别为79.4%±2.5%和69.8%±1.8%;对绿藻中的单针藻DCA4和栅藻DCA5则没有溶藻效果。由此说明,菌株Sp37可能对微囊藻有选择性的溶藻作用,而不对其他藻产生危害。微囊藻是我国最常见的淡水水华蓝藻,也常产生微囊藻毒素[2, 24],微囊藻毒素是一种肝毒素,长期饮用含有微囊藻毒素的水源可能会引发肝癌。因此筛选出能够高效且迅速地溶解微囊藻的菌株,具有实际应用意义[25]。
| Phylum | Algae strain | Algicidal ratio (t=8 d, %) |
| Cyanobacteria | DCM1 (Microcystis flos-aquae) | 79.4±2.5 |
| Cyanobacteria | DCM11 (Microcystis wesenbergii) | 69.8±1.8 |
| Cyanobacteria | NIES843 (Microcystis aeruginosa) | 99.8±0.0 |
| Chlorophyta | DCA4 (Monoraphidium sp.) | − |
| Chlorophyta | DCA5 (Scenedesmus) | − |
| 注:−:没有溶藻现象. Note: −: No algicidal effect. |
||
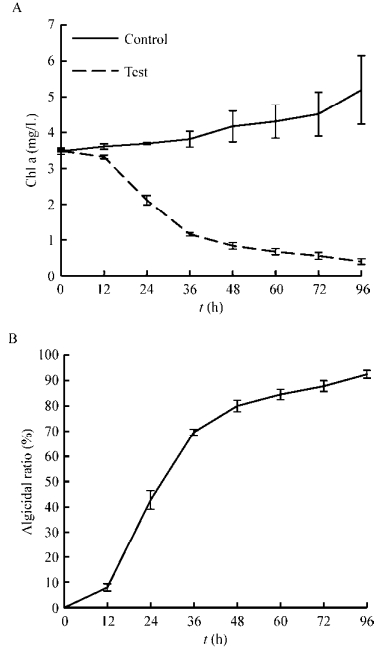
溶藻细菌主要有直接溶藻和间接溶藻两种方式。为了研究菌株Sp37对铜绿微囊藻DCM4的作用方式,将Sp37的原菌液、洗涤后的菌体和无菌过滤液分别接入藻液进行共培养。共培养4 d后,各组都对DCM4有一定杀藻效果(图 4)。其中Sp37原菌液和无菌滤液的溶藻效果较好,4 d后的溶藻率分别为86.8%±4.3%和81.1%±2.2%,两者没有显著差异(t-test,P > 0.05);经无菌水洗过的菌体对DCM4的溶藻效果较差,溶藻率为25.4%±7.3%。上述结果表明菌株Sp37的溶藻方式是间接溶藻,即通过释放某些溶藻活性物质杀死铜绿微囊藻DCM4。经无菌水洗涤过后的菌体对DCM4也有一定的溶藻效果,可能是由于细菌在藻液中生长仍然能够分泌溶藻物质。目前已报道的溶藻菌主要都是通过分泌抑制藻类生长或者溶解藻细胞的胞外物质来间接攻击藻类,例如,Su等分离到一株对甲藻有溶藻作用的交替假单胞菌,也是通过分泌活性物质溶藻[26];Skerratt等分离到多株对甲藻有间接溶藻作用的细菌[3];Yang等分离了一株对铜绿微囊藻有较好的溶藻效果的地杆菌属溶藻菌[5]。
|
| 图 4 细菌Sp37菌液不同组分对铜绿微囊藻DCM4的溶藻率 Figure 4 The algicidal effect of different culture ingredients of Sp37 on M. aeruginosa DCM4 |
|
|
由上述结果可知,菌株Sp37不是通过细胞直接接触藻细胞攻击DCM4,而是通过分泌溶藻物质杀死DCM4。为了初步了解该溶藻物质的特性,对Sp37无菌滤液做了不同处理后再与DCM4进行共培养。图 5结果显示,无菌滤液经不同pH (3.0,5.0,7.0,9.0,11.0)和温度(−20、40、60、80、100℃)处理之后的溶藻效率与未经任何处理的无菌滤液的溶藻效率没有显著差异(P > 0.05),说明Sp37分泌的胞外溶藻物质的活性在酸碱、冷冻和高温处理后并没有发生明显变化。由上述结果可知菌株Sp37分泌的溶藻物质具有酸碱稳定性和冷热稳定性,说明应该不是蛋白质或者多肽类物质。

|
| 图 5 Sp37无菌滤液经不同处理后对DCM4的溶藻效率 Figure 5 Algicidal effect of cell-free filtrate of Sp37 treated at different acidity-alkalinity (A) and temperature (B) on DCM4 注:A:无菌滤液经不同pH处理后的溶藻效率,B:无菌滤液经不同温度处理后的溶藻效率. Note: A: The algicidal efficiency of cell-free filtrate treated at different pH; B: The algicidal efficiency of cell-free filtrate treated at different temperature. |
|
|
藻类在正常情况下和各种环境胁迫下都能产生活性氧自由基,但在正常情况下细胞内活性氧的产生和清除处于一种动态平衡的状态。当藻细胞遭受外界环境胁迫时可能会引起活性氧的增加,从而启动活性氧清除机制,并引起氧化损伤。抗氧化系统包括酶抗氧化系统和非酶抗氧化系统。
为了研究藻细胞内酶抗氧化系统对溶藻作用的响应,选取藻细胞内过氧化氢酶(CAT)含量进行测定。CAT是抗氧化系统中最重要的酶之一,能够促进分解细胞代谢产生的对机体有害的H2O2,防止H2O2在体内积累对细胞造成损害。结果如图 6A所示,DCM4藻细胞CAT的含量随着Sp37无菌滤液处理时间的增加而上升。在处理18 h时,处理组藻细胞内的CAT含量相对于对照组显著升高(P < 0.05)。上述结果表明,随着SP37无菌滤液处理时间的延长,触发了藻细胞的防御机制,使得藻细胞的CAT含量上升以抵御伤害。傅丽君等在研究溶藻菌对塔玛亚历山大藻时也发现,溶藻菌的上清液处理藻细胞前期使得CAT有一定增长趋势[27]。

|
| 图 6 Sp37无菌滤液对DCM4藻细胞CAT (A)和GSH (B)含量的影响 Figure 6 Influence of Sp37 cell-free filtrate on the CAT (A) and GSH (B) of DCM4 Note: *: P < 0.05; **: P < 0.01. |
|
|
在非酶抗氧化系统中,还原型谷胱甘肽(GSH)也可以清除ROS。GSH中含有巯基,巯基在自身氧化时清除ROS。在处理3 h时处理组的GSH含量高于空白组,然而从12 h开始,处理组的GSH含量开始下降;在处理12 h和18 h时,处理组的GSH含量显著低于空白组(P < 0.01) (图 6B)。GSH含量在经Sp37无菌滤液处理前期升高而后期降低,可能是因为GSH在清除ROS的同时,自身转换成了氧化型谷胱甘肽(GSSG),导致GSH含量降低。在Tan等的研究中,溶藻菌对球形棕囊藻的溶藻作用中,GSH的含量也是呈现出先上升再下降的趋势[28]。
以上结果表明,Sp37产生的溶藻物质诱导了DCM4酶抗氧化系统和非酶抗氧化系统的响应,以减缓活性氧造成的氧化压力。
2.6.2 溶藻作用对藻细胞膜完整性的影响为了探究Sp37的无菌滤液是否对藻细胞完整性造成损伤,测定了细胞膜的脂质过氧化产物丙二醛(MDA)的含量,以了解溶藻过程对细胞膜完整性的影响。在处理3 h和12 h时,处理组和对照组没有明显的变化;但是处理18 h之后,处理组的MDA含量显著高于对照组(P < 0.01) (图 7),表明在溶藻物质的作用下藻细胞膜发生较强的脂质过氧化反应。MDA的升高可能是因为Sp37无菌滤液对藻细胞造成胁迫,藻细胞产生大量ROS,虽然藻细胞启动了抗氧化机制,酶抗氧化和非酶抗氧化物质都显著上升,但是最终也未能完全清除ROS,最终造成藻细胞膜的氧化损伤。黄昌妙等[29]发现水华鱼腥藻在多株溶藻菌活性代谢产物的胁迫下,MDA浓度急剧上升,藻细胞膜脂质过氧化程度加剧,膜系统和功能受损。史顺玉的研究结果也表明,加入溶藻细菌之后藻细胞的MDA含量明显提高[30]。

|
| 图 7 Sp37无菌滤液对DCM4藻细胞MDA含量的影响 Figure 7 Influence of Sp37 cell-free filtrate on the MDA of DCM4 Note: *: P < 0.05; **: P < 0.01. |
|
|
本研究从滇池水华区分离出溶藻菌Sp37,经16S rRNA基因鉴定为Bacillus siamensis。该菌对铜绿微囊藻、水华微囊藻、惠氏微囊藻都有较强的溶藻能力,对高浓度的铜绿微囊藻DCM4有高效杀灭作用;菌株Sp37是通过分泌一种或多种具有酸碱稳定性和冷热稳定性的非蛋白类物质实现对DCM4的间接溶藻。总的来说,Sp37分泌的溶藻物质对远高于水华叶绿素a浓度的水华藻铜绿微囊藻有强烈的杀灭效果,且性质稳定易于保存,在今后的水华防治中有极大的应用前景。
一般认为,溶藻菌分泌杀藻活性物质是作用于藻的生理过程[31]而影响藻的生长。在本研究中Sp37无菌滤液处理DCM4的过程中,藻细胞中与酶抗氧化机制相关的CAT含量和非酶抗氧化机制中的GSH含量都发生了显著变化。可知Sp37无菌滤液对藻细胞产生了氧化胁迫,使得DCM4抗氧化系统被激发来减缓氧化胁迫对藻细胞造成的损害。但18 h处理组藻细胞MDA含量的上升,表明细胞膜脂质过氧化的发生,说明藻细胞的抗氧化机制最终未能阻止Sp37无菌滤液对藻细胞造成严重的氧化胁迫。本研究通过藻细胞在溶藻菌作用下生理生化的响应来初步推断,溶藻菌Sp37无菌滤液对藻细胞产生氧化胁迫,造成藻细胞损伤,最终导致藻细胞死亡。另外,对Sp37无菌滤液的具体溶藻机制、分泌的溶藻活性物质的确认及其生物安全性还有待于进一步研究。本研究获得的高效铜绿微囊藻杀藻菌,为淡水水体(尤其是滇池)中蓝藻水华的微生物治理提供了优质的控藻菌资源;对其杀藻特性的进一步解析,为杀藻菌在水华治理的实际应用提供了重要的理论指导。
| [1] |
O'Neil JM, Davis TW, Burford MA, et al. The rise of harmful cyanobacteria blooms: The potential roles of eutrophication and climate change[J]. Harmful Algae, 2012, 14: 313-334. DOI:10.1016/j.hal.2011.10.027 |
| [2] |
Oh HM, Lee SJ, Jang MH, et al. Microcystin production by Microcystis aeruginosa in a phosphorus-limited chemostat[J]. Applied & Environmental Microbiology, 2000, 66(1): 176-179. |
| [3] |
Skerratt JH, Bowman JP, Hallegraeff G, et al. Algicidal bacteria associated with blooms of a toxic dinoflagellate in a temperate Australian estuary[J]. Marine Ecology Progress, 2002, 244: 1-15. DOI:10.3354/meps244001 |
| [4] |
Niu DD, Zheng QS, Liu ZP, et al. Algicidal effect of an algae-lysing bacterium YZ on Microcystis aeruginosa[J]. China Environmental Science, 2011, 31(2): 321-326. (in Chinese) 牛丹丹, 郑青松, 刘兆普, 等. 溶藻细菌YZ对铜绿微囊藻的溶藻特性研究[J]. 中国环境科学, 2011, 31(2): 321-326. |
| [5] |
Yang L, Maeda H, Yoshikawa T, et al. Algicidal effect of bacterial isolates of Pedobacter sp. against cyanobacterium Microcystis aeruginosa[J]. Water Science and Engineering, 2012, 5(4): 375-382. |
| [6] |
Liu LP. Characteristics of blue algal bloom in Dianchi Lake and analysis on its cause[J]. Research of Environmental Sciences, 1999, 12(5): 36-37. (in Chinese) 刘丽萍. 滇池水华特征及成因分析[J]. 环境科学研究, 1999, 12(5): 36-37. DOI:10.3321/j.issn:1001-6929.1999.05.010 |
| [7] |
Lu WK, Yu LX, Ou XK, et al. Relationship between occurrence frequency of cyanobacteria bloom and meteorological factors in Lake Dianchi[J]. Journal of Lake Sciences, 2017, 29(3): 534-545. (in Chinese) 鲁韦坤, 余凌翔, 欧晓昆, 等. 滇池蓝藻水华发生频率与气象因子的关系[J]. 湖泊科学, 2017, 29(3): 534-545. |
| [8] |
Lu LL, Li GB, Shen YW, et al. Isolation, identification and characterization of a strain of blue-green algae-lysing bacterium from Lake Dianchi[J]. Acta Hydrobiologica Sinica, 2009, 33(5): 860-865. (in Chinese) 卢兰兰, 李根保, 沈银武, 等. 溶藻细菌DC-L5的分离、鉴定及其溶藻特性[J]. 水生生物学报, 2009, 33(5): 860-865. |
| [9] |
Lu LL, Li GB, Shen YW, et al. Isolation, identification and characterization of blue-green algae-lysing strain DC-L14 from Lake Dianchi, China[J]. Chinese Journal of Applied and Environmental Biology, 2009, 15(1): 106-109. (in Chinese) 卢兰兰, 李根保, 沈银武, 等. 溶藻细菌DC-L14的分离、鉴定与溶藻特性[J]. 应用与环境生物学报, 2009, 15(1): 106-109. |
| [10] |
Ning H, Zhang RX, Chen H, et al. ARDRA analysis of Bacillus spp. isolated from Lake Dianchi and their algae-lytic effect[J]. Journal of Lake Sciences, 2008, 20(5): 675-680. (in Chinese) 宁华, 张荣先, 陈浩, 等. 滇池中芽孢杆菌的ARDRA分类及溶藻特性[J]. 湖泊科学, 2008, 20(5): 675-680. DOI:10.3321/j.issn:1003-5427.2008.05.018 |
| [11] |
Shi SY. Studies on the ecophysiological effects and mechanisms of algae-lysing bacteria agaist the algae[D]. Wuhan: Doctoral Dissertation of Institute of Hydrobiology, Chinese Academy of Sciences, 2006 (in Chinese) 史顺玉.溶藻细菌对藻类的生理生态效应及作用机理研究[D].武汉: 中国科学院水生生物研究所博士学位论文, 2006 |
| [12] |
Pei HY, Hu WR, Qu YB, et al. Algae-lytic character and its identification of one algae-lysing bacterium[J]. China Environmental Science, 2005, 25(3): 283-287. (in Chinese) 裴海燕, 胡文容, 曲音波, 等. 一株溶藻细菌的溶藻特性及其鉴定[J]. 中国环境科学, 2005, 25(3): 283-287. DOI:10.3321/j.issn:1000-6923.2005.03.007 |
| [13] |
Chen Q. Most Commom Freshwater Algal Images of Zhejiang Province: Drinking Water Sources[M]. Beijing: China Environmental Science Press, 2010. (in Chinese) 陈茜. 浙江省主要常见淡水藻类图集:饮用水水源[M]. 北京: 中国环境科学出版社, 2010. |
| [14] |
Li XQ, Yang F, Yin LH, et al. Separation, identification and toxigenicity of algae in bloom of Meiliang Bay of Lake Taihu[J]. Journal of Southeast University (Natural Science Edition), 2010, 40(6): 1332-1336. (in Chinese) 李小琴, 杨飞, 尹立红, 等. 太湖水华藻的分离、鉴定和产毒特性[J]. 东南大学学报:自然科学版, 2010, 40(6): 1332-1336. |
| [15] |
Bozarth CS, Schwartz AD, Shepardson JW, et al. Population turnover in a Microcystis bloom results in predominantly nontoxigenic variants late in the season[J]. Applied & Environmental Microbiology, 2010, 76(15): 5207-5213. |
| [16] |
Li JL, Wang S, Yu J, et al. A modified CTAB protocol for plant DNA extraction[J]. Chinese Bulletin of Botany, 2013, 48(1): 72-78. (in Chinese) 李金璐, 王硕, 于婧, 等. 一种改良的植物DNA提取方法[J]. 植物学报, 2013, 48(1): 72-78. |
| [17] |
Chen YW, Chen KN, Hu YH. Discussion on possible error for phytoplankton chlorophyll-a concentration analysis using hot-ethanol extraction method[J]. Journal of Lake Sciences, 2006, 18(5): 550-552. (in Chinese) 陈宇炜, 陈开宁, 胡耀辉. 浮游植物叶绿素a测定的"热乙醇法"及其测定误差的探讨[J]. 湖泊科学, 2006, 18(5): 550-552. DOI:10.3321/j.issn:1003-5427.2006.05.019 |
| [18] |
Wintermans JF, De Mots A. Spectrophotometric characteristics of chlorophylls a and b and their phenophytins in ethanol[J]. Biochimica et Biophysica Acta, 1965, 109(2): 448-453. DOI:10.1016/0926-6585(65)90170-6 |
| [19] |
Guan YH, Ma J, Lei GY, et al. Isolation, identification and algicidal characteristics of an algicidal bacterium[J]. Acta Scientiae Circumstantiae, 2008, 28(7): 1288-1293. (in Chinese) 关英红, 马军, 雷国元, 等. 一株溶藻菌株的分离鉴定及溶藻特性[J]. 环境科学学报, 2008, 28(7): 1288-1293. DOI:10.3321/j.issn:0253-2468.2008.07.005 |
| [20] |
Xuan HL, Dai XZ, Li J, et al. A Bacillus sp. strain with antagonistic activity against Fusarium graminearum kills Microcystis aeruginosa selectively[J]. Science of the Total Environment, 2017, 583: 214-221. DOI:10.1016/j.scitotenv.2017.01.055 |
| [21] |
Li Y, Liu L, Xu Y, et al. Stress of algicidal substances from a bacterium Exiguobacterium sp. h10 on Microcystis aeruginosa[J]. Letters in Applied Microbiology, 2017, 64(1): 57-65. DOI:10.1111/lam.12678 |
| [22] |
Wang L, Cai QH, Zhang M, et al. Spatiotemporal dynamics and related affecting factors of summer algal blooms in Xiangxi Bay of Three Gorges Reservoir[J]. Chinese Journal of Applied Ecology, 2009, 20(8): 1940-1946. (in Chinese) 王岚, 蔡庆华, 张敏, 等. 三峡水库香溪河库湾夏季藻类水华的时空动态及其影响因素[J]. 应用生态学报, 2009, 20(8): 1940-1946. |
| [23] |
Zhu LP, Gao G, Tang XM, et al. Variation of bacteria in water and attached on Microcystis colonies and their activity during the algal blooms[J]. Journal of Lake Sciences, 2009, 21(3): 395-400. (in Chinese) 朱丽萍, 高光, 汤祥明, 等. 微囊藻水华期间水体及藻体上细菌的动态[J]. 湖泊科学, 2009, 21(3): 395-400. DOI:10.3321/j.issn:1003-5427.2009.03.013 |
| [24] |
Orr PT, Jones GJ. Relationship between microcystin production and cell division rates in nitrogen-limited Microcystis aeruginosa cultures[J]. Limnology & Oceanography, 1998, 43(7): 1604-1614. |
| [25] |
Xi Y, Wu G, Zhang Y, et al. The isolation and preliminary study on an algae-lysing bacterium in freshwater[J]. Journal of Central China Normal University (Natural Sciences), 2003, 37(2): 222-226. (in Chinese) 席宇, 吴刚, 张勇, 等. 一株淡水溶藻细菌的分离及初步研究[J]. 华中师范大学学报:自然科学版, 2003, 37(2): 222-226. |
| [26] |
Su JQ, Yang XR, Zheng TL, et al. Isolation and characterization of a marine algicidal bacterium against the toxic dinoflagellate Alexandrium tamarense[J]. Harmful Algae, 2007, 6(6): 799-810. DOI:10.1016/j.hal.2007.04.004 |
| [27] |
Fu LJ, Li D, Wu CJ, et al. Effects of algicidal bacterium BS03 (Microbulbifer sp.) on the growth and antioxidant systems of Alexandrium tamarense[J]. Acta Microbiologica Sinica, 2012, 52(6): 784-790. (in Chinese) 傅丽君, 李东, 吴承集, 等. 溶藻细菌BS03(Microbulbifer sp.)对塔玛亚历山大藻生长及抗氧化系统的影响[J]. 微生物学报, 2012, 52(6): 784-790. |
| [28] |
Tan S, Hu XL, Yin PZ, et al. Photosynthetic inhibition and oxidative stress to the toxic Phaeocystis globosa caused by a diketopiperazine isolated from products of algicidal bacterium metabolism[J]. Journal of Microbiology, 2016, 54(5): 364-375. DOI:10.1007/s12275-016-6012-0 |
| [29] |
Huang CM, Pan WB, Li Y, et al. Effect of three algicidal bacterial strains on antioxidase activities of Anabaena Flos-aquae[J]. Environmental Science and Technology, 2009, 22(6): 10-13. (in Chinese) 黄昌妙, 潘伟斌, 李燕, 等. 三株溶藻菌对水华鱼腥藻抗氧化酶活性的影响[J]. 环境科技, 2009, 22(6): 10-13. |
| [30] |
Shi SY, Shen YW, Li DH, et al. Isolation, identification and algae-lytic characteristic of a bacterium Staphylococcus sp[J]. China Environmental Science, 2006, 26(5): 587-590. (in Chinese) 史顺玉, 沈银武, 李敦海, 等. 溶藻细菌DC21的分离、鉴定及其溶藻特性[J]. 中国环境科学, 2006, 26(5): 587-590. DOI:10.3321/j.issn:1000-6923.2006.05.018 |
| [31] |
Lu HS, Liu WJ, Zhang Y, et al. Identification of algicidal bacterium R1 and its influence on the metabolism of scenedesmus in a co-culture[J]. Microbiology China, 2016, 43(3): 495-503. (in Chinese) 陆洪省, 刘文君, 张瑶, 等. 溶藻菌R1的分离鉴定以及对栅藻共处代谢的影响[J]. 微生物学通报, 2016, 43(3): 495-503. |
 2018, Vol. 45
2018, Vol. 45