扩展功能
文章信息
- 许艳婷, 宋瑞雪, 田聪琦, 李祎
- XU Yan-Ting, SONG Rui-Xue, TIAN Cong-Qi, LI Yi
- 抑藻菌株Bacillus sp. hsn03分离鉴定及其对铜绿微囊藻的抑制效果与特征
- Isolation and identification of Bacillus sp. hsn03 with algicidal activity on Microcystis aeruginosa
- 微生物学通报, 2018, 45(12): 2592-2602
- Microbiology China, 2018, 45(12): 2592-2602
- DOI: 10.13344/j.microbiol.china.180046
-
文章历史
- 收稿日期: 2018-01-13
- 接受日期: 2018-02-06
- 网络首发日期(www.cnki.net): 2018-03-20
2. 厦门大学生命科学学院 福建 厦门 361102
2. School of Life Sciences, Xiamen University, Xiamen, Fujian 361102, China
我国可利用的淡水资源有限,特别是随着生活垃圾的随意丢弃和含有大量氮、磷元素工业废水的肆意排放,严重污染了现有的淡水湖泊资源[1-3]。由于氮、磷等元素的大量增加导致藻类等水生生物快速繁殖,从而使淡水水体呈现蓝绿色的现象就是水华,是水体富营养化的一种特征[4]。蓝藻形成水华的频率非常高,形成水华后会引起水质恶化,不仅会造成水生生物的死亡,还会威胁人体健康[5-6]。因此,有效治理蓝藻水华是治理淡水水源污染的当务之急。
目前国内外对水华的治理方法有很多[6]。有研究者通过在水体中投加特殊品种的鱼类,让鱼类捕食蓝藻用于蓝藻的清除,虽然有一定作用,但鱼类的摄食和排泄会加速磷的活化,反而促进了藻类的生长[7]。还有研究者采用物理方法如超声波法或直接过滤除藻,但此法对水体中藻浓度有较大要求且成本高[8]。而化学方法一般通过投加高锰酸钾、硫酸铜等化学试剂来达到杀藻的效果,然而此法必然容易导致水中金属盐浓度上升,再次对水体环境造成伤害。生物方法则是利用微生物与蓝藻进行竞争性生长,或者通过微生物分泌的胞外物质来缓解蓝藻水华的危害,又因微生物分布广、种类多、效率高、具有专一性和生态安全性[9]。因此,生物方法是当前最为安全有效的除藻方法。
本文以铜绿微囊藻(Microcystis aeruginosa 7806)为研究目标,从养猪场养殖废水中筛选一株具有明显抑藻效果的细菌菌株hsn03,对其进行了进化地位确定、形态鉴定和生理生化鉴定,并对抑藻方式、胞外抑藻物质性质及所含官能团进行初步探究,为进一步将抑藻菌应用于铜绿微囊藻的治理奠定基础。
1 材料与方法 1.1 主要试剂和仪器胰化蛋白胨、氯化钠、酵母粉、柠檬酸、柠檬酸铁、NaNO3、K2HPO4、MgSO4·7H2O、CaCl2·7H2O、Na2CO3均为国产分析纯;细菌基因组DNA提取试剂盒,TaKaRa公司。光照培养箱,宁波莱福科技有限公司;超净工作台,苏州净化设备有限公司;恒温振荡培养箱,上海龙跃仪器设备有限公司;高速冷冻离心机,贝克曼公司;PCR仪,上海伯乐生命医学产品有限公司;光学显微镜,尼康公司;傅里叶红外光谱仪,Bruker公司。
1.2 供试菌种、藻种及其培养菌株hsn03分离于养猪场新鲜养殖废水中,采用LB培养基(g/L:胰化蛋白胨10.0,氯化钠10.0,酵母粉5.0,pH 7.2)于37 ℃、150 r/min振荡培养。供试藻种为铜绿微囊藻(Microcystis aeruginosa 7806),购于中国科学院野生生物种质库,采用BG11培养基于光照强度50 μE/(m2·s),温度25±1 ℃,昼夜比L:D=12 h:12 h的条件下培养。BG11培养基(g/L):NaNO3 1.500,K2HPO4 0.040,MgSO4·7H2O 0.075,CaCl2·7H2O 0.036,Na2CO3 0.020,柠檬酸0.006,柠檬酸铁0.006,微量元素溶液A5 1.0 mL,EDTA 0.001,蒸馏水1 000 mL,用于铜绿微囊藻的培养。微量元素混合溶液A5 (g/L):H3BO4 2.860,MnCl2·4H2O 1.810,ZnSO4 0.222,Na2MoO4 0.390,CuSO4·5H2O 0.079,Co(NO3)2·6H2O 0.490。
1.3 实验方法 1.3.1 杀藻菌株hsn03的分离取养猪场新鲜养殖废水20 mL,通过用玻璃珠将废水混合均匀,获得细菌样品。采取梯度稀释法将样品分别涂布在LB固体培养基表面,置于37 ℃培养2-3 d。挑取不同形态单菌落划线于LB固体平板,置于37 ℃培养2-3 d,重复该步骤直至得到纯培养。分别将0.5 mL不同纯培养的发酵产物接种于OD680为0.22的10 mL铜绿微囊藻培养液中,于120 r/min振荡5 min后,再在25±1 ℃,昼夜比L:D=12 h:12 h,光照强度50 μE/(m2·s)条件下培养7 d,0.5 mL灭菌的BG11培养基加入藻液中作为对照组,处理组和对照组分别设置3个平行;观察处理组中对7806藻有抑藻作用的菌株,从而筛选出抑藻菌株。
1.3.2 菌株hsn03的菌落形态观察及简单染色将菌株hsn03接种到LB固体平板上,于37 ℃恒温培养24-48 h,观察细菌菌落形态。并通过简单染色后,在油镜下观察细菌细胞形态。
1.3.3 菌株hsn03的生理生化鉴定参照Analytic Products INC (API)方法及其他生理生化鉴定,对菌株hsn03进行20 E和20 NE等生理生化指标测定;产色素实验为取一滴20%的KOH溶液滴在载玻片上,挑取适量菌体于液滴中,若液滴变为红色、粉色或褐色,则证明是阳性,可以产生色素;抑藻细菌降解淀粉、尿素能力实验为将淀粉、尿素以1%的添加量加入到LB固体培养基中,将菌株接种到该固体培养基上,在37 ℃条件下培养2-3 d,若菌落周围有透明圈形成则表明该菌株具有降解该化合物的能力,否则没有降解该化合物的能力;接触酶实验为将双氧水按1:1稀释,在干净培养皿盖中滴加稀释后的双氧水,然后用无菌枪头从待测菌的新鲜平板上稍刮一点涂布在双氧水滴上,若立刻剧烈产生气泡,则该菌为接触酶阳性;若只有微弱气泡产生,则该菌为接触酶弱;若不产生气泡,则该菌为接触酶阴性。
1.3.4 菌株hsn03的16S rRNA基因测定以菌株hsn03的基因组DNA为模板,用16S rRNA基因扩增的通用引物27F (5′-AGAGTTTGAT CCTGGCTCAG-3′)和1492R (5′-GGTTACCTTGTT ACGACTT-3′)进行PCR。PCR反应体系为:27F和1492R (10 μmol/L)各1 μL,DNA (50 ng/μL) 10 μL,Taq DNA聚合酶(5 U/μL) 0.5 μL,10×Buffer 5 μL,dNTPs (2.5 mmol/L) 1 μL,加ddH2O补足至50 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 1 min,55 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃ 8 min。PCR扩增后的目的条带送生工生物工程(上海)股份有限公司测序。将测序结果与NCBI的GenBank数据库以及EzTaxon数据库[10]进行比对,选取与所测序列相似性较高的种或属。应用ClustalX和MEGA 4生物软件[11],采用Neighbor-Joining法构建系统发育树。
1.3.5 菌株hsn03的抑藻效果实验将培养至对数期的菌株hsn03的发酵液(OD600为0.80)按照5.0% (体积比)的添加量加入到铜绿微囊藻培养液中,添加同样体积的无菌LB液体培养基的藻液为对照组,以上处理组与对照组分别设置3个平行,将处理组和对照组同时置于25±1 ℃,12 h光照,12 h黑暗,光照强度50 μE/(m2·s)条件下培养,每天连续取样用酶标仪测定处理组与对照组藻细胞在OD680条件下的吸光度值,并按照公式计算抑藻率。
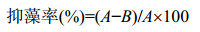
|
其中,A为对照组中藻细胞在OD680条件下的吸光度值,B为处理组中藻细胞在OD680条件下的吸光度值。
1.3.6 菌株hsn03的抑藻方式将培养至对数期(OD600为0.80)的菌株hsn03进行以下处理:(1)细菌发酵液,未经任何处理的发酵液;(2)无菌上清,即将菌株hsn03的发酵液经8 000 r/min离心5 min除去菌体后收集上清;(3)细菌菌体,即将菌株hsn03的发酵液按照上述条件离心后,除去上清得到的菌体。将细菌发酵液、无菌上清和细菌菌体分别按照5.0% (体积比)的添加量加入铜绿微囊藻藻培养液中,同时以添加相同体积的无菌LB液体培养基的藻液为对照组,处理组与对照组均设置3个平行,测定藻细胞在OD680条件下的初始吸光度值之后,每隔24 h测一次,连续测定7 d。
1.3.7 不同添加量的菌株hsn03的上清对藻细胞的抑制效果将菌株hsn03的上清液分别按照1%、3%、5%、7%、9%的添加量加入到铜绿微囊藻7806培养液中,并分别添加不同体积的灭菌LB培养基于藻液中作为对照组(不同体积LB培养基对藻细胞生长无影响),每组实验均设置3个重复,均置于25 ℃,光照强度为50 μE/(m2·s)光照培养箱中培养,测定藻细胞在OD680条件下的初始吸光度值之后,每隔24 h测一次,连续测定7 d。
1.3.8 抑藻物质性质的探究(1) 热稳定性。取菌株hsn03的无菌上清于5个离心管中,分别在40、60、80、99 ℃水浴处理2 h,以及1×105 Pa高压蒸汽灭菌处理20 min,冷却至室温后将各处理组上清液按7.0%的终浓度加入藻液中进行抑藻活性检测。以加入等量灭菌LB液体培养基为对照组和未处理上清为阳性对照组,每组实验均设置3个重复,置于25 ℃,光照强度为50 μE/(m2·s)光照培养箱中培养,测定藻细胞初始OD680值,之后每隔24 h测一次,连续测定7 d。
(2) 酸碱稳定性。取菌株hsn03上清液,用1 mol/L的NaOH和5 mol/L的HCl溶液分别调节pH至3.0、5.0、9.0、11.0,室温处理2 h后,再回调至初始pH,以未处理的无菌上清液作为阳性对照,各处理组的上清液以7%的终浓度添加到藻液中进行抑藻活性检测,以加入等量灭菌LB液体培养基的藻液为对照组,每组实验均设置3个重复,置于25 ℃,光照强度为50 μE/(m2·s)光照培养箱中培养,测定藻细胞初始OD680值,之后每隔24 h测一次,连续测定7 d。
(3) 蛋白酶K处理。取菌株hsn03的上清液,加入蛋白酶K使浓度为100 μg/mL,并于55 ℃的水浴锅中处理2 h,将处理后的上清液按终浓度为7%的添加量加入到藻液中,以加入等量灭菌LB液体培养基的藻液为对照组和加入等量未处理上清的藻液为阳性对照组,每组实验均设置3个重复,置于25 ℃,光照强度为50 μE/(m2·s)光照培养箱中培养,测定藻细胞初始OD680值,之后每隔24 h测一次,连续测定7 d。
(4) 有机溶剂萃取。取菌株hsn03的上清液,分别用不同极性的有机溶剂(二氯甲烷、三氯甲烷、正丁醇、甲苯)按有机溶剂与上清液5:1 (体积比)的比例萃取抑藻物质;取萃取1 h后的有机相用旋转蒸发仪蒸干,用少量二甲亚砜(DMSO)溶解后加入到藻液中做抑藻实验。以加入等量灭菌DMSO的藻液为对照组和加入等量未处理上清的藻液为阳性对照组,每组实验均设置3个重复。
1.3.9 抑藻物质透析处理及成分分析取菌株hsn03的上清液分别于透析袋[MWCO (Molecular weight cut off)=100 Da、MWCO=500 Da和MWCO=1 kD]中,置于无菌蒸馏水中透析48 h (隔24 h换新鲜的无菌蒸馏水),取透析后的上清按终浓度7%的添加量分别加入到藻液中,以加入等量灭菌LB液体培养基的藻液为对照组和加入等量未处理上清的藻液为阳性对照组,每组实验均设置3个重复。为了进一步确定该抑藻物质的组成成分,将透析后有抑藻能力和无抑藻能力的处理组的化学基团用傅里叶红外(FITR)光谱仪在波数频率为400-4 000 cm-1范围内测定,并对傅里叶红外光谱图做出分析。
1.3.10 数据分析显著性分析采用Origin 8.5进行分析,其中“*”代表P < 0.05,“**”代表P < 0.01。
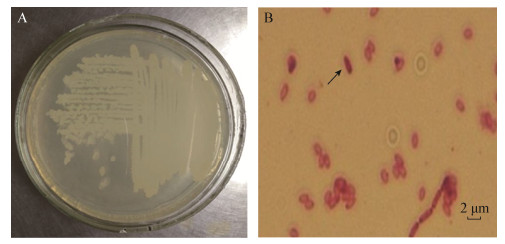
2 结果与分析 2.1 菌株hsn03的形态特征及生理生化鉴定菌株hsn03在LB固体培养基上生长24 h后,可以观察到菌株hsn03菌落为浅黄色,呈圆形,边缘不齐整,表面有褶皱,不透明,如图 1A所示;将细菌细胞进行简单染色后,在光学显微镜下可观察到细菌细胞呈短杆状,椭圆形,该细菌细胞长约2 μm,宽约0.5 μm (图 1B中箭头指出),且视野中可见大量芽孢。对菌株hsn03进行生理生化实验,结果如表 1所示。将菌株hsn03菌体涂于滴有20% KOH的载玻片上,液滴的颜色并未变为红色、粉色或褐色,说明其不能产色素。涂于滴有稀释的双氧水的平皿里,产生大量的气泡,说明该菌接触酶阳性。将菌株hsn03接种于添加尿素、淀粉的LB固体平板上,经过培养,菌落周围并未出现透明圈,说明该菌没有降解淀粉、尿素的能力。
|
| 图 1 菌株hsn03的菌落形态(A)及细胞形态(B) Figure 1 Colony morphology (A) and cell morphology (B) of strain hsn03 |
|
|
| 表型检测 Phenotypic tests |
结果 Results |
| Reduction of nitrate to nitrite | + |
| Denitrification | - |
| Indole production | - |
| D-glucose fermentation | + |
| Arginine dihydrolase | + |
| UREase | - |
| Aesculin hydrolysis | + |
| Gelatin hydrolysis | + |
| D-glucose | + |
| L-arabinose | + |
| D-mannose | + |
| D-mannitol | + |
| N-acetyl-glucosamine | + |
| D-maltose | + |
| Potassium gluconate | + |
| Capric acid | - |
| Adipic acid | - |
| Malic acid | + |
| Trisodium citrate | + |
| Phenylacetic acid | - |
| β-galactosidase | + |
| Lysine decarboxylase | - |
| Ornithine decarboxylase | - |
| CITrate utilization | + |
| H2S production | - |
| UREase | - |
| Tryptophane deaminase | - |
| INDole production | - |
| Acetoin production | + |
| GELatinase | + |
| Glucose | + |
| Mannitol | + |
| Inositol | + |
| Sorbitol | w |
| Rhamnose | w |
| Saccharose | + |
| Melibiose | - |
| Amygdalin | + |
| Arabinose | + |
| Note: +: Positive; w: Weakly positive; -: Negative. | |
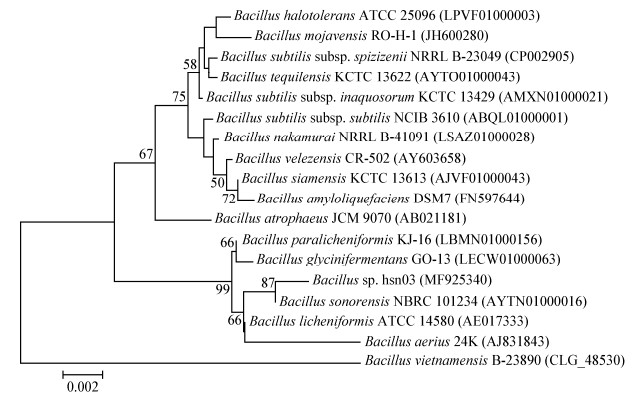
将测序后的16S rRNA基因序列提交至NCBI的GenBank数据库以及EzTaxon数据库进行比对,结果表明该菌株与芽孢杆菌属(Bacillus)的菌株Bacillus sonorensis NBRC101234 (AYTN01000016)有最高相似性,为99.59%。通过ClustalX和MEGA 4生物软件,采用Neighbor-Joining法构建系统发育树,从图 2可以看出,该菌株与Bacillus sonorensis NBRC101234 (AYTN01000016)在同一分支中。结合菌株形态特征及生理生化指标和系统进化树分析,确定该菌株为芽孢杆菌属的一株细菌,且命名为Bacillus sp. hsn03 (MF925340)。
|
| 图 2 菌株hsn03的16S rRNA基因的系统进化树 Figure 2 Neighbor-Joining tree showing the phylogenetic positions of strain hsn03 based on 16S rRNA gene sequences |
|
|
为了确定菌株hsn03的抑藻方式,分别将菌株hsn03的发酵液(OD600=0.80)、无菌上清及细菌细胞按照终浓度5.0% (体积比)的添加量加入藻液中进行抑藻实验。如图 3A所示,添加了无菌LB培养基的对照组的藻细胞,其OD680值逐渐增大,在第7天时达到1.05。添加了细菌细胞处理组的藻细胞,其OD680值也在逐渐增大,在第7天OD680值达到1.00,与对照组几乎相同,该值的大小与藻细胞的数量成正比,说明藻细胞生长旺盛,表明该菌菌体几乎无抑藻效果。而添加了无菌上清与发酵液的藻液,与对照组相比,藻细胞的OD680值在处理过程中前3天处于较低的稳定水平,OD680值均维持在0.21,第3天到第5天呈现出略微上升的趋势,第5天时OD680值分别维持在0.35和0.30,第7天分别为0.30和0.25,这表明无菌上清与发酵液均能明显抑制藻细胞的生长。
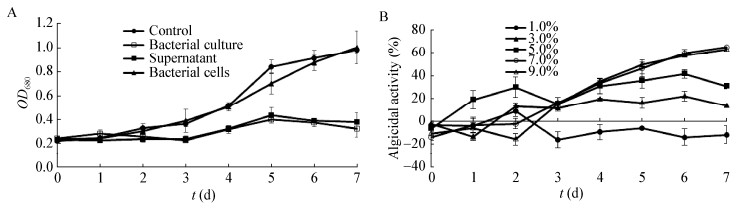
|
| 图 3 菌株hsn03的抑藻效果来源(A)和不同添加量的发酵液及处理时间的抑藻效果(B) Figure 3 The algicidal source of strain 03 (A) and effects of different dosages of bacterial culture and treatment times on algicidal activity of strain hsn03 (B) 注:所有的误差棒代表 3个生物学重复的标准差. Note: All error bars indicate the SE of the three biological replicates. |
|
|
由图 3B可知,在分别添加了1%、3%、5%、7%和9%无菌上清的处理组中藻细胞呈现出不同的生长状态。在整个处理过程中,1%处理组藻细胞的抑藻率一直维持在较低水平,且为负值,该结果表明1%的添加量无抑藻效果。3%和5%处理组随着处理时间的延长,其抑藻率虽有些波动,但整体呈上升趋势,抑藻率较低,在第7天时分别为15%和30%。7%和9%处理组在第2天之后均对藻细胞的生长表现出明显的抑制效果,抑藻率的增长程度大且稳定,而当添加量为7%和9%时,其抑藻率在第7天均达到较高水平,而9%的添加量并没有比7%表现出更高的抑藻效果。因此,结果表明无菌上清的添加量为7%左右时,抑藻效果最好。
2.4 抑藻物质性质由图 4A可知,菌株hsn03的胞外抑藻物质在不同温度处理后的抑藻效果仍维持比较稳定的水平。各处理温度作用下的胞外抑藻物质与未经任何处理的阳性对照组相比仍具有较高的抑藻活性,在121 ℃条件下处理后仍有较好的抑藻效果,结果表明温度对该物质几乎没有影响,抑藻物质具有热稳定性。
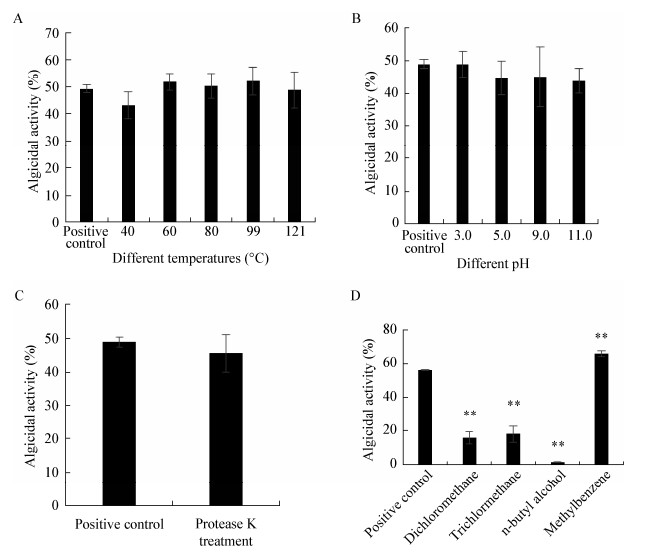
|
| 图 4 菌株hsn03的上清经不同温度(A)、pH (B)、蛋白酶K (C)和有机溶剂萃取(D)处理后的抑藻效果 Figure 4 Effect of different temperature (A), pH (B), protease K (C), organic solvent extraction (D) on the algicidal activity of the supernatant 注:所有的误差棒代表 3个生物学重复的标准差. **代表与阳性对照相比在统计学上的显著差异P < 0.01. Note: All error bars indicate the SE of the three biological replicates. ** represents a statistically significant difference of P < 0.01 when compared to the positive control. |
|
|
由图 4B可知,在pH为3.0、5.0、9.0、11.0时,胞外抑藻物质的活性与阳性对照组相比没有明显差别。表明菌株hsn03胞外抑藻物质的活性不受酸碱的影响,具有酸碱稳定性。
由图 4C可知,菌株hsn03的胞外抑藻物质经蛋白酶K处理后的抑藻效果与阳性对照组几乎没有差别,表明该抑藻物质不是蛋白类物质。
由图 4D可知,经过二氯甲烷、氯仿、正丁醇萃取后的胞外抑藻物质的抑藻率显著低于阳性对照组(P < 0.01),而经甲苯萃取后的胞外抑藻物质的
抑藻率显著高于阳性对照组(P < 0.01),说明二氯甲烷、氯仿和正丁醇不能从抑藻物质中萃取出有效成分,而甲苯能从抑藻物质中萃取出有效成分。该抑藻物质的极性小于甲苯。
2.5 抑藻物质透析处理及成分分析为了确定抑藻物质的分子量范围,进行了透析实验(图 5A)。结果表明,在截留分子量为500 Da和100 Da的透析袋透析处理后的抑藻物质对铜绿微囊藻7806表现出明显的抑藻效果,显著高于截留分子量为1 kD的透析袋透析后的处理组(P < 0.01)。该结果表明透析处理后,该抑藻物质可以通过1 kD透析袋,不能通过500 Da透析袋,分子量大于500 Da且小于1 kD。
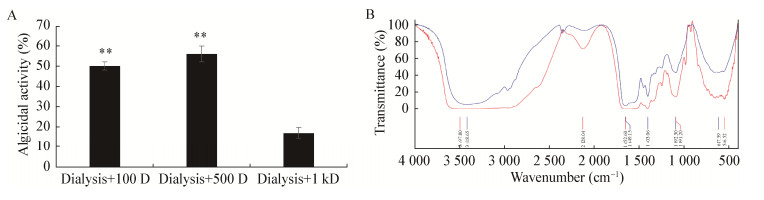
|
| 图 5 菌株hsn03的上清经透析处理后的抑藻效果(A)及抑藻物质透析后的官能团图谱(B) Figure 5 Effect of different dialysis treatment (A) on the algicidal activity of the supernatant and the functional groups of algicidal substance after dialysis were analyzed using FTIR spectroscopy (B) 注:波长检测范围在400-4 000 cm-1. Note: The spectra at 400-4 000 cm-1 are reproduced. |
|
|
为了进一步确定该抑藻物质中化学基团成分,将透析后有抑藻能力(500 Da)和无抑藻能力(1 kD)的物质做傅里叶红外光谱分析,结果如图 5B所示。发现无抑藻效果的傅里叶红外光谱图与有抑藻效果的傅里叶红外光谱图相比,在1 650 cm–1和1 092 cm–1处代表蛋白质和所有糖衍生物的吸收峰仍然存在,但在2 128 cm–1处的吸收峰消失了,这表明抑藻物质可能和2 128 cm–1处的吸收峰有关,2 128 cm–1处的吸收峰代表叁键和累积双键伸缩振动区域。因此可以得出结论,该抑藻活性物质应包含叁键和累积双键。
3 讨论目前水体富营养化和藻类污染问题愈发严重,其中铜绿微囊藻就是最常见的水华蓝藻之一。由于该藻可以产生微囊藻毒素,不仅破坏水生生态系统的平衡还威胁人类健康,因此对铜绿微囊藻引起的淡水水华问题已引起人们的广泛关注[12-13]。由于细菌等微生物具有经济、环境友好等特点,且与藻类有着复杂紧密的联系,所以利用细菌杀/抑藻来治理水华,已成为新的研究方向[14]。
本研究从养殖废水中筛选到一株对铜绿微囊藻7806具有抑制效果的菌株hsn03,为了更好地开展抑藻研究,我们首先对该菌株进行了形态特征观察、生理生化特征研究和分子鉴定,通过一系列研究最终确定菌株hsn03属于芽孢杆菌(Bacillus sonorensis)属,与Bacillus sonorensis NBRC101234 (AYTN01000016)有最高相似性,为99.59%,将菌株hsn03命名为Bacillus sp. hsn03 (MF925340)。芽孢杆菌属具有生长快、易运输和分布广泛等优点,在生物防治领域、水质净化和促进饲料中营养素降解等方面有着广泛的应用[15]。而芽孢杆菌属在杀藻领域也有报道,Guan等从东海表层海水样品中分离出芽孢杆菌属的Bacillus strain LP-10,表明Bacillus strain LP-10可能是一个潜在控制有害藻华的生物剂,对赤潮藻——球形棕囊藻有杀藻效果[16]。
在所分离筛选的控藻细菌中溶藻菌报道的较多[17-18],而抑藻菌相对较少。抑藻菌一般适用于抑制浓度较低的藻细胞生长,尤其适合在赤潮或水华发生初期使用,通过抑制藻细胞生长以达到控制藻类生物量,阻止藻类大量增殖的效果。而溶/杀藻菌则通常适用于浓度较高的藻液,一般通过分泌抑/杀藻物质从而有效地裂解藻细胞,以缓解赤潮或水华暴发的危害[19]。微生物对藻细胞的抑制方式主要有两种,一种是微生物与藻细胞直接接触表现出抑藻效果,为直接抑藻;另一种是微生物分泌胞外抑藻物质来表现出抑藻效果,为间接抑藻[20]。为了确定菌株hsn03的抑藻方式,将该菌株的发酵产物、无菌上清和细菌菌体进行抑藻实验,结果表明菌株的发酵产物和无菌上清均有较高的抑藻效果,而细菌菌体无抑藻效果。这就表明菌株hsn03中起抑藻效果的抑藻物质是细菌分泌的胞外物质,属于间接抑藻。这与已报道的芽孢杆菌B1能分泌一种细胞外物质作用于球形棕囊藻的抑藻方式相似[21]。将不同添加量的菌株hsn03的无菌上清作用于藻细胞,发现随着添加量的增加,抑藻效果越明显,说明抑藻效果具有浓度依赖性。这与已报道的微生物通过间接作用所表现出的抑藻或者杀藻能力存在浓度依赖性的研究结果相似[22]。
为了确定该抑藻物质的性质,将无菌上清分别在不同温度、pH、蛋白酶K等条件下处理,结果表明处理后的无菌上清均仍具有良好的抑藻效果,说明该抑藻物质具有较高的热稳定性、酸碱稳定性且非蛋白类物质。而无菌上清在经过不同极性大小的有机溶剂萃取后,发现只有经过甲苯萃取后的无菌上清有抑藻效果,这就表明该抑藻物质可萃取到甲苯中,极性小于甲苯。将胞外物质在截留分子量为1 kD的透析袋透析后,透析袋内的物质没有抑藻能力,而在截留分子量为500 Da和100 Da的透析袋透析后,透析袋内的物质有抑藻能力,这说明抑藻物质的分子量大于500 Da且小于1 kD。为了进一步确定该抑藻物质的组成成分,将通过500 Da和1 kD透析袋透析后的傅里叶红外光谱图对比,发现无抑藻效果的傅里叶红外光谱图中在波数为2 128 cm–1处的吸收峰消失了,这表明抑藻物质可能和2 128 cm–1处的吸收峰有关,波数在2 128 cm–1处的吸收峰代表叁键和累积双键[23]。细菌的次级代谢产物类型非常多,具有抑藻能力的胞外物质有很多种,如蛋白质、脂肪酸、多糖、色素等[24-25]。有报道细菌的胞外抑藻物质为小分子物质,如Guan等[16]发现芽孢杆菌可以分泌一种耐高温的小分子物质对球形棕囊藻的生长有明显的抑制效果;但本研究中菌株hsn03所分泌的胞外抑藻物质与已报道的并不相同,该胞外物质分子量在500 Da和1 kD之间,耐高温,耐酸碱,因此可以推测,该胞外抑藻物质不是蛋白质、多糖等大分子物质,有可能是一种新型的含有叁键和累积双键的小分子抑藻活性物质。该抑藻物质的发现及其性质的研究为蓝藻水华治理提供了更多的理论基础,若能广泛应用,将对环境的治理起到巨大的作用。
4 结论本研究通过对一株高效抑藻菌株hsn03进行形态学观察、生理生化特征检测和分子鉴定,确定该菌株hsn03属于芽孢杆菌属(Bacillus sp.),与芽孢杆菌属菌株Bacillus sonorensis NBRC 101234的16S rRNA基因的最高相似性为99.59%。菌株hsn03通过分泌胞外抑藻物质从而对铜绿微囊藻(M. aeruginosa 7806)表现出抑藻效果,并且当添加量为7.0%时,该抑藻效果最为明显。通过对胞外抑藻物质的性质探究,确定该抑藻物质是一种耐高温、耐酸碱、分子量在500 Da和1 kD之间含有叁键和累积双键的非蛋白、非多糖的小分子物质。
| [1] |
Sheng H, Liu H, Wang CY, et al. Analysis of cyanobacteria bloom in the Waihai part of Dianchi Lake, China[J]. Ecological Informatics, 2012, 10: 37-48. DOI:10.1016/j.ecoinf.2012.03.007 |
| [2] |
Zhu X, Zhu JH, Hu MM. General thinkingon the management of blue algae outbreak in the Taihu lake, the Chaohu lake and the Dianchi lake[J]. Meteorological and Environmental Research, 2015, 6(1): 48-54, 58. |
| [3] |
Kong FX, Ma RH, Gao JF, et al. The theory and practice of prevention, forecast and warning on cyanobacteria bloom in Lake Taihu[J]. Journal of Lake Sciences, 2009, 21(3): 314-328. (in Chinese) 孔繁翔, 马荣华, 高俊峰, 等. 太湖蓝藻水华的预防、预测和预警的理论与实践[J]. 湖泊科学, 2009, 21(3): 314-328. DOI:10.3321/j.issn:1003-5427.2009.03.002 |
| [4] |
Schindler DW, Hecky RE, Findlay DL, et al. Eutrophication of lakes cannot be controlled by reducing nitrogen input: results of a 37-year whole-ecosystem experiment[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(32): 11254-11258. DOI:10.1073/pnas.0805108105 |
| [5] |
Reynolds CS. Cyanobacterial water-blooms[J]. Advances in Botanical Research, 1987, 13: 67-143. DOI:10.1016/S0065-2296(08)60341-9 |
| [6] |
Makower AK, Schuurmans JM, Groth D, et al. Transcriptomics-aided dissection of the intracellular and extracellular roles of microcystin in Microcystis aeruginosa PCC 7806[J]. Applied and Environmental Microbiology, 2015, 81(2): 544-554. DOI:10.1128/AEM.02601-14 |
| [7] |
Lu KH, Yan WJ, Su SA. Environmental and ecological engineering on control and remediation of eutrophicated waterbodies: by using ameliorated alum plasma and fishes to control blue-green blooms of qiaodun reservoir[J]. Acta Scientiae Circumstantiae, 2002, 22(6): 732-737. (in Chinese) 陆开宏, 晏维金, 苏尚安. 富营养化水体治理与修复的环境生态工程——利用明矾浆和鱼类控制桥墩水库蓝藻水华[J]. 环境科学学报, 2002, 22(6): 732-737. DOI:10.3321/j.issn:0253-2468.2002.06.009 |
| [8] |
Li JP, Long H, Song C, et al. Study on the removal of algae from lake water and its attendant water quality changes using ultrasound[J]. Desalination and Water Treatment, 2014, 52(25/27): 4762-4771. |
| [9] |
Sun PF, Cai H, Bai NL, et al. Revealing the characteristics of a novel bioflocculant and its flocculation performance in Microcystis aeruginosa removal[J]. Scientific Reports, 2015, 5: 17465. DOI:10.1038/srep17465 |
| [10] |
Chun J, Lee JH, Jung Y, et al. EzTaxon: a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J]. International Journal of Systematic and Evolutionary Microbiology, 2007, 57(10): 2259-2261. DOI:10.1099/ijs.0.64915-0 |
| [11] |
Tamura K, Dudley J, Nei M, et al. MEGA4: Molecular Evolutionary Genetics Analysis (MEGA) software version 4.0[J]. Molecular Biology and Evolution, 2007, 24(8): 1596-1599. DOI:10.1093/molbev/msm092 |
| [12] |
Yu CC, Wu C, Zheng WW, et al. Pollutions by algae and microcystins in surface water in Shenqiu County in Huaihe River basin[J]. Journal of Environment and Health, 2013, 30(11): 967-971. (in Chinese) 虞聪聪, 伍晨, 郑唯韡, 等. 淮河流域沈丘县地表水藻类及其毒素污染状况研究[J]. 环境与健康杂志, 2013, 30(11): 967-971. |
| [13] |
Hettiarachchi IU, Sethunga S, Manage PM. Contamination status of algae toxins microcystins in some selected water bodies in sri lanka[A]//Proceedings of International Forestry and Environment Symposium[C]. Sri Lanka: University of Sri Jayewardenepura, 2014
|
| [14] |
Fu LJ, An XL, Li D, et al. Isolation and alga-inhibiting characterization of Vibrio sp. BS02 against Alexandrium tamarense[J]. World Journal of Microbiology and Biotechnology, 2011, 27(12): 2949-2956. DOI:10.1007/s11274-011-0778-3 |
| [15] |
Cheng X, Li KT, Huang L. Research on growth characteristics and algicidal effects of Bacillus subtilis[J]. Biotechnology Bulletin, 2017, 33(7): 120-125. (in Chinese) 程新, 李昆太, 黄林. 一株枯草芽孢杆菌的生长特性及抑藻效果研究[J]. 生物技术通报, 2017, 33(7): 120-125. |
| [16] |
Guan CW, Guo XY, Cai GJ, et al. Novel algicidal evidence of a bacterium Bacillus sp. LP-10 killing Phaeocystis globosa, a harmful algal bloom causing species[J]. Biological Control, 2014, 76: 79-86. DOI:10.1016/j.biocontrol.2014.05.007 |
| [17] |
Shi SY, Liu YD, Shen YW, et al. Lysis of Aphanizomenon flos-aquae (Cyanobacterium) by a bacterium Bacillus cereus[J]. Biological Control, 2006, 39(3): 345-351. DOI:10.1016/j.biocontrol.2006.06.011 |
| [18] |
Li Y, Zhu H, Zhang HJ, et al. Toxicity of algicidal extracts from Mangrovimonas yunxiaonensis strain LY01 on a HAB causing Alexandrium tamarense[J]. Journal of Hazardous Materials, 2014, 278: 372-381. DOI:10.1016/j.jhazmat.2014.06.032 |
| [19] |
Li Y, Zhu H, Lei XQ, et al. The death mechanism of the harmful algal bloom species Alexandrium tamarense induced by algicidal bacterium Deinococcus sp. Y35[J]. Frontiers in Microbiology, 2015, 6: 992. |
| [20] |
Li D, An XL, Fu LJ, et al. Isolation, identification and characterization of algicidal bacterium BS03 against Alexandrium tamarense[J]. Acta Scientiae Circumstantiae, 2013, 33(1): 44-52. (in Chinese) 李东, 安新丽, 傅丽君, 等. 溶藻细菌BS03分离、鉴定及其对塔玛亚历山大藻生长的影响[J]. 环境科学学报, 2013, 33(1): 44-52. |
| [21] |
Li Q, Zhao L, Yin PH. Characteristics study of extracellular active substance of Bacillus sp. B1 on Phaeocystis globosa[J]. Environmental Science, 2012, 33(3): 838-843. (in Chinese) 李蔷, 赵玲, 尹平河. 芽孢杆菌B1胞外活性物质对球形棕囊藻的溶藻特性研究[J]. 环境科学, 2012, 33(3): 838-843. |
| [22] |
Li Y, Zhu H, Guan CW, et al. Towards molecular, physiological, and biochemical understanding of photosynthetic inhibition and oxidative stress in the toxic Alexandrium tamarense induced by a marine bacterium[J]. Applied Microbiology and Biotechnology, 2014, 98(10): 4637-4652. DOI:10.1007/s00253-014-5578-x |
| [23] |
Zeng GM, Wang P, Wang Y. Algicidal efficiency and mechanism of Phanerochaete chrysosporium against harmful algal bloom species[J]. Algal Research, 2015, 12: 182-190. DOI:10.1016/j.algal.2015.08.019 |
| [24] |
Li Y, Zhu H, Lei XQ, et al. The first evidence of deinoxanthin from Deinococcus sp. Y35 with strong algicidal effect on the toxic dinoflagellate Alexandrium tamarense[J]. Journal of Hazardous Materials, 2015, 290: 87-95. DOI:10.1016/j.jhazmat.2015.02.070 |
| [25] |
An XL, Zhang BZ, Zhang HJ, et al. Discovery of an algicidal compound from Brevibacterium sp. BS01 and its effect on a harmful algal bloom-causing species, Alexandrium tamarense[J]. Frontiers in Microbiology, 2015, 6: 1235. |
 2018, Vol. 45
2018, Vol. 45