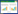扩展功能
文章信息
- 胡翔颖, 刘文婷, 刘卫东, 詹秀倩, 郭瑞庭, 李华钟, 郑迎迎
- HU Xiang-Ying, LIU Wen-Ting, LIU Wei-Dong, ZHAN Xiu-Qian, GUO Rui-Ting, LI Hua-Zhong, ZHENG Ying-Ying
- 来源于Rhinocladiella mackenziei的玉米赤霉烯酮水解酶的表达纯化与酶学性质
- Expression, purification and characterization of a novel zearalenone hydrolase from Rhinocladiella mackenziei
- 微生物学通报, 2018, 45(12): 2585-2591
- Microbiology China, 2018, 45(12): 2585-2591
- DOI: 10.13344/j.microbiol.china.180099
-
文章历史
- 收稿日期: 2018-01-31
- 接受日期: 2018-04-20
- 网络首发日期(www.cnki.net): 2018-05-12
2. 工业酶国家工程实验室 中国科学院天津工业生物技术研究所 天津 300308
2. Industrial Enzymes National Engineering Laboratory, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
玉米赤霉烯酮(Zearalenone,ZEN),又称F-2毒素,是一种具有类雌激素作用的非类固醇类真菌毒素,主要由禾谷镰刀菌和三线镰刀菌等真菌在玉米、大麦、小麦、高粱等谷物中释放,是最常见的一种镰刀菌毒素[1]。玉米赤霉烯酮作为全球污染粮食最广泛的霉菌毒素之一,在大部分谷物以及农副产品中都可检测到它的存在。玉米赤霉烯酮具有类雌激素的活性,能与雌激素受体结合,引起种猪等家畜或者家禽早熟,导致生殖周期紊乱,给养殖业带来巨大的损失[2-4]。此外,玉米赤霉烯酮具有潜在的致癌性,经食物链流入人体后,引起食道癌、乳腺癌等发病率增加[5-6]。
物理吸附和化学降解是目前市场上使用较多的脱毒方法,但物理吸附由于缺乏对ZEN的选择性,常造成其他营养物质的损失,而化学降解则可能产生新的有毒物质,不能实现完全脱毒[7-8]。近年来生物酶法脱毒受到越来越广泛的关注,酶法脱毒条件温和,不产生有害的化学物质,并可将营养成分的损失降到最低[9]。目前研究较多的ZEN降解酶是来源于粉红粘帚菌的玉米赤霉烯酮水解酶ZHD101[10-11],因其具有高效降解ZEN的能力而受到越来越广泛的关注,但Takahashi-Ando等[12]对ZHD101的酶学性质表征表明,ZHD101最适温度为37-45 ℃,最适pH为10.5,在50 ℃条件下没有活性,过于温和的反应条件使其无法实现在工业上的大规模应用。为了实现玉米赤霉烯酮的生物法完全脱毒,需要进一步挖掘酶学性质更加突出的ZEN降解酶。
本研究通过对GenBank数据库的挖掘,发现了一种来源于麦氏喙枝孢霉的蛋白RmZHD (GenBank登录号:ACW19936.1),其与ZHD101 (GenBank登录号:ALI16790.1)的蛋白序列相似性最高,为65% (图 1)。通过对RmZHD蛋白进行质粒构建、表达纯化以及酶学性质的表征,发现RmZHD对ZEN的水解活力与ZHD101相当,但RmZHD具有更高的热稳定性,使得RmZHD具有较高的应用潜力。通过与ZHD101的比较,本研究发现了一些影响热稳定性的重要结构和序列特征,这些结果将对玉米赤霉烯酮降解酶的耐热性改造及应用提供理论基础。
|
| 图 1 RmZHD和ZHD101等同源蛋白序列比对 Figure 1 Sequence alignment of RmZHD, ZHD101 and other homologous proteins |
|
|
正向引物(5′-GACGACGACAAGATGGCTGCT ACCAGAAC-3′)和反向引物(5′-GAGGAGAAGCCC GGTTACTTCAGGTACTTTCTGGAGG-3′)由华大基因公司合成;实验中所用载体pET-46 EK/LIC购自NOVAGEN公司。
1.1.2 主要试剂和仪器Phusion高保真DNA聚合酶、T4 DNA连接酶,Thermo Science公司;DNA Marker,上海捷瑞生物工程有限公司;PCR产物纯化试剂盒、质粒提取试剂盒、BCA试剂盒,康维世纪生物科技有限公司;蛋白Marker,Invitrogen公司;咪唑,Merck公司;LB培养基,碧迪医疗器械(上海)有限公司;其他试剂均为国产分析纯。
PCR仪、高速冷冻离心机,Eppendorf公司;核酸电泳仪、凝胶成像系统,Bio-Rad公司;AKTA purifier纯化系统、Ni-NTA亲和层析柱、DEAE阴离子交换柱,GE公司;低温高压细胞破碎机,广州聚能生物科技有限公司;台式冷冻离心机,Thermo公司;高效液相色谱仪,安捷伦科技有限公司;液相色谱柱,月旭科技上海有限公司;蛋白质电泳仪,Invitrogen公司。
1.2 方法 1.2.1 质粒构建通过将ZHD101的氨基酸序列在GenBank中进行BLASTp比对,选取序列相似性在50%-70%之间,及活性中心附近氨基酸有差异的序列进行基因合成和催化活性分析,发现来源于麦氏喙枝孢霉的Rmzhd基因具有较高的催化活力。因此本研究选择Rmzhd基因进行深入研究。
委托华大基因公司对Rmzhd基因进行序列全合成,运用聚合酶链式反应(Polymerase chain reaction,PCR)对Rmzhd基因进行体外扩增。PCR反应体系(50 μL):2 U/μL Phusion DNA聚合酶0.5 μL,100 ng/μL的模板1 μL,10 μmol/L正、反向引物各2.5 μL,2.5 mmol/L dNTP mix 4 μL,100% DMSO 1.5 μL,5×GC buffer 10 μL,ddH2O 28 μL。PCR反应条件:95 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min,25个循环;72 ℃ 7 min。得到的PCR产物纯化后运用pET-46 EK/LIC载体试剂盒构建到pET-46 EK/LIC载体上,将构建好的载体转入大肠杆菌DH5ɑ感受态细胞中,然后将菌液涂到含有氨苄青霉素(Amp)抗性的LB平板上,次日挑取单菌落送至华大基因公司测序。测序正确的克隆提取质粒存于-20 ℃,用于后续的表达纯化实验。
1.2.2 RmZHD的表达纯化将构建好的pET-46-Rmzhd质粒转入大肠杆菌BL21(DE3)感受态细胞中,然后将菌液涂到含有氨苄青霉素(Amp)抗性的LB平板上,次日挑取单菌落于5 mL含有100 μg/mL氨苄青霉素(Amp)的小试管中,37 ℃、220 r/min培养使菌体生长至OD600值达0.6-0.8时,转接至100 mL的LB培养基中,37 ℃、220 r/min培养使菌体生长至OD600值达0.6-0.8时转入5 L的LB大瓶中,37 ℃、220 r/min培养4 h降温至16 ℃,加诱导剂IPTG至终浓度0.2 mmol/L,降温诱导18 h后离心收集菌体。
将得到的菌体用25 mmol/L Tris、150 mmol/L NaCl、20 mmol/L咪唑、pH 7.5的缓冲液重悬,经低温高压细胞破碎机破碎(4 ℃,20 min)后4 ℃、15 500 r/min离心90 min,离心后的上清液即为粗酶液。将粗酶液加入到用25 mmol/L Tris、150 mmol/L NaCl、20 mmol/L咪唑、pH 7.5的缓冲液平衡的Ni-NTA亲和层析柱中,使用咪唑梯度(20- 250 mmol/L)洗脱His-标记的蛋白。然后将蛋白透析到25 mmol/L Tris、pH 7.5的缓冲液中,再用DEAE阴离子交换柱进一步纯化,蛋白用0-250 mmol/L NaCl线性洗脱。以上所有纯化步骤都是在4 ℃使用AKTA purifier纯化系统进行的。然后将含有目标组分的蛋白浓缩至25 mg/mL,储存在25 mmol/L Tris、150 mmol/L NaCl、pH 7.5的缓冲液中、保存于-80 ℃。
1.2.3 活性测定RmZHD的酶活定义为:每分钟反应减少1 μmol的底物所需酶量定义为1 U。每个反应体系210 μL,其中包括5 μL底物(5 mg/mL ZEN)和5 μL酶(0.25 mg/mL RmZHD),200 μL的25 mmol/L Tris、150 mmol/L NaCl、pH 7.5反应缓冲液。30 ℃反应10 min之后,加入50 μL 1 mol/L HCl和300 μL甲醇终止反应。产物过滤后取20 µL使用配备有Welch Ultimate XB-C18柱(4.6 mm×250 mm,5 μm)的高效液相色谱系统分析。样品在柱温为30 ℃条件下用60%的乙腈以0.6 mL/min的流速洗脱下来,吸光度检测波长为254 nm,底物的出峰时间为13 min,根据峰面积计算底物的减少量。
蛋白在pH 6.0、7.0、8.0 (磷酸盐缓冲液),pH 7.5、8.0、8.5、9.0 (Tris-HCl缓冲液),pH 8.6、9.6、10.6 (甘氨酸-氢氧化钠缓冲液)的反应缓冲液中反应10 min确定其最适反应pH值。加有底物的反应缓冲液(25 mmol/L Tris,150 mmol/L NaCl,pH 7.5)分别在25、30、35、40、42、45、47、50、55 ℃条件下孵育2 min,加入蛋白在不同温度条件下反应10 min确定其最适反应温度。蛋白分别在40、45、50、55、60 ℃下加热处理1、2、4、6、10 min,处理后的蛋白溶液立即放入30 ℃冷却,30 ℃、8 000 r/min离心1 min后取上清测残余酶活,确定其热稳定性。所有实验均进行2次平行实验,实验结果取平均值。
1.2.4 序列和结构分析多序列比对使用Clustal Omega (https://www.ebi.ac.uk/Tools/msa/clustalo/)和ESPript (http://espript.ibcp.fr/ESPript/cgi-bin/ESPript.cgi)进行[13];利用ESBRI在线工具(http://bioinformatica.isa.cnr.it/ESBRI)计算盐桥数目;氢键数目和蛋白表面特征利用DSSP程序[14]计算。结构比对图利用Pymol软件生成(http://pymol.sourceforge.net/)。
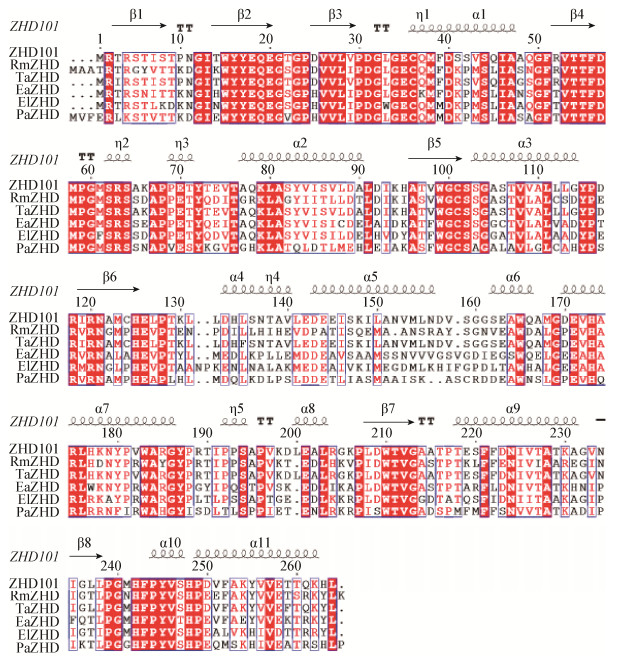
2 结果与讨论 2.1 RmZHD蛋白的表达纯化利用Ni-NTA亲和层析柱和DEAE阴离子交换柱对粗酶液进行纯化(表 1)。将纯化后的蛋白用SDS-聚丙烯酰胺(SDS-PAGE)进行分析,结果如图 2所示。目的蛋白的分子量为29.5 kD,纯化的蛋白分子量与目的蛋白分子量相符合,确定为RmZHD蛋白,可用于后续酶学性质分析。
| 纯化步骤 Purification step |
总蛋白 Protein (mg) |
总活力 Total activity (U) |
回收率 Recovery (%) |
比活力 Specific activity (U/mg) |
纯化倍数 Fold |
| Crude extracts | 2 975.0 | 127.50 | 100.0 | 0.043 | 1 |
| Ni-NTA | 52.2 | 65.70 | 51.5 | 1.270 | 30 |
| DEAE | 25.0 | 34.75 | 27.2 | 1.390 | 32 |
|
| 图 2 RmZHD纯化电泳图 Figure 2 Purification and the SDS-PAGE analysis of RmZHD 注:M:蛋白Marker;1:纯化的RmZHD蛋白. Note: M: Protein marker; 1: The purified RmZHD. |
|
|
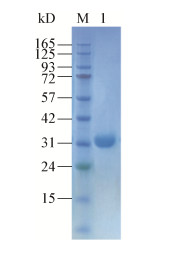
RmZHD蛋白纯化后稀释至0.25 mg/mL进行最适反应条件的测定,结果如图 3所示。在酸性条件下,RmZHD的活性受到抑制,活性很低,随着pH值的升高,RmZHD的活性逐渐增强,当pH值增加到8.6时酶的活性最高,pH值继续增加时酶的活性降低,当pH值为10.6时蛋白仍有活性,但活性仅为最高活性的28.5% (图 3A)。RmZHD蛋白在不同温度的反应体系中反应10 min得到如图 3B的测定结果,随着反应温度的升高,蛋白的活性逐渐增强,当温度到45 ℃时蛋白活性最高,当温度继续升高蛋白活性开始降低,当温度为55 ℃时蛋白的活性仅为最高活性的8.3%。由此可确定RmZHD蛋白在pH 8.6和反应温度45 ℃条件下的活性最高。
|
| 图 3 pH和温度对RmZHD活性的影响 Figure 3 The effects of pH and temperature on RmZHD activities 注:A:pH值对RmZHD活性的影响;B:温度对RmZHD活性的影响. Note: A: The effects of pH on RmZHD activities; B: The effects of temperature on RmZHD activities. |
|
|
RmZHD蛋白在40、45、50、55、60 ℃下加热处理1、2、4、6、10 min,处理过后的蛋白在反应体系中30 ℃反应10 min,得到如图 4A所示的结果,结果显示RmZHD在温度达到55 ℃时酶才开始失活,酶加热处理2 min之后还有40%的活性。用相同的方法测定ZHD101的热稳定性,比较发现ZHD101在50 ℃时酶就开始失活,酶加热处理1 min仅剩30%的活性(图 4B),由此可确定RmZHD具有较高的热稳定性。

|
| 图 4 RmZHD和ZHD101的热稳定性比较 Figure 4 The thermostability comparison of RmZHD and ZHD101 注:A:RmZHD热稳定性;B:ZHD101热稳定性. Note: A: The thermostability of RmZHD; B: The thermostability of ZHD101. |
|
|
热稳定性是工业酶的重要性质。具有高热稳定性的酶在工业应用中可以减少用量,提高催化效率,降低微生物污染[15]。饲料业中的工业酶更需要具备高热稳定性以耐受造粒工艺的高温。蛋白热稳定性通常与分子中更多的相互作用(氢键、疏水作用、离子键、二硫键、金属键等)和更紧固的整体结构有关[16]。通过将RmZHD和ZHD101 (PDB ID:3WZL)的结构[17-18](2个蛋白结构均已被本实验室解析)进行比较发现(表 2),RmZHD和ZHD101结构中均没有二硫键和糖基化修饰,氢键数目也类似。但RmZHD中盐桥的数目明显多于ZHD101,盐桥数目的增加通常被认为与热稳定性相关[19-20]。另外,通过对2个蛋白的氨基酸组成比对发现,RmZHD的脯氨酸含量比ZHD101高(8.3%和6.8%),且4个多余脯氨酸中的3个位于暴露于溶剂的Loop区(图 5)。暴露于溶剂的脯氨酸被认为是可以赋予蛋白质高的热稳定性[21-22],推测较高的溶剂暴露脯氨酸含量可能赋予RmZHD较高的热稳定性。综上所述,通过结构和序列比对分析,本研究认为高的盐桥数目和溶剂暴露脯氨酸含量可能是导致RmZHD具有较高热稳定性的原因。
| Enzyme | RmZHD | ZHD101 |
| Disulfide bridge | 0 | 0 |
| Hydrogen bond | 185 | 198 |
| Salt bridge | 23 | 17 |
| Percentage of proline | 22 (8.3%) | 18 (6.8%) |
| Percentage of glycine | 19 (7.1%) | 20 (7.6%) |
| Percentage of arginine | 13 (4.9%) | 10 (3.8%) |
| Protein surface area exposed to the solvent (Å2) | 11 123.1 | 11 031.6 |
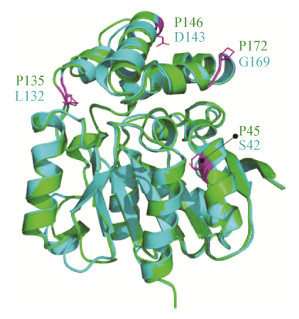
|
| 图 5 RmZHD和ZHD101的结构比较 Figure 5 The structural comparison of RmZHD and ZHD101 注:绿色:RmZHD结构;蓝绿色:ZHD101结构. Note: Green: The structure of RmZHD; Cyan: The structure of ZHD101. |
|
|
本研究获得了一个新型玉米赤霉烯酮水解酶RmZHD,对RmZHD的酶学性质表征发现其具有较高的耐热性,通过结构和序列比对分析,发现较高的盐桥数目和溶剂暴露脯氨酸含量可能是导致RmZHD具有较高热稳定性的原因。下一步的研究将通过突变验证较高盐桥数目和溶剂暴露脯氨酸对RmZHD蛋白耐热性的影响,并以此为依据对RmZHD进行分子改造,为促进ZEN水解酶在工业上的应用提供基础。
| [1] |
Zinedine A, Soriano JM, Moltó JC, et al. Review on the toxicity, occurrence, metabolism, detoxification, regulations and intake of zearalenone: An oestrogenic mycotoxin[J]. Food and Chemical Toxicology, 2007, 45(1): 1-18. |
| [2] |
Guan S, Ji C, Zhou T, et al. Aflatoxin B1 degradation by Stenotrophomonas maltophilia and other microbes selected using coumarin medium[J]. International Journal of Molecular Sciences, 2008, 9(8): 1489-1503. DOI:10.3390/ijms9081489 |
| [3] |
Amézqueta S, Schorr-Galindo S, Murillo-Arbizu M, et al. OTA-producing fungi in foodstuffs: a review[J]. Food Control, 2012, 26(2): 259-268. |
| [4] |
Chen JC, Wiley AA, Kauffold J, et al. Perinatal zearalenone exposure affects RXFP1, RXFP2, and morphoregulatory gene expression in the neonatal porcine uterus[J]. Annals of the New York Academy of Sciences, 2009, 1160(1): 188-189. DOI:10.1111/j.1749-6632.2008.03815.x |
| [5] |
Ahamed S, Foster JS, Bukovsky A, et al. Signal transduction through the Ras/Erk pathway is essential for the mycoestrogen zearalenone-induced cell-cycle progression in MCF-7 cells[J]. Molecular Carcinogenesis, 2001, 30(2): 88-98. |
| [6] |
Yu ZL, Hu DS, Li Y. Effects of zearalenone on mRNA expression and activity of cytochrome P450 1A1 and 1B1 in MCF-7 cells[J]. Ecotoxicology & Environmental Safety, 2004, 58(2): 187-193. |
| [7] |
Jouany JP. Methods for preventing, decontaminating and minimizing the toxicity of mycotoxins in feeds[J]. Animal Feed Science and Technology, 2007, 137(3/4): 342-362. |
| [8] |
Shan M, Xu ZR, Feng JL. Research progress of mycotoxin detoxification in feed[J]. Feed Research, 2005(11): 40-42. (in Chinese) 单妹, 许梓荣, 冯健蕾. 饲料中霉菌毒素脱毒方法的研究进展[J]. 饲料研究, 2005(11): 40-42. DOI:10.3969/j.issn.1002-2813.2005.11.012 |
| [9] |
Cai YH, Hu YC, Zhao HC, et al. Advance in toxicity and biodegradation of zearalenone[J]. Progress in Veterinary Medicine, 2012, 33(5): 102-105. (in Chinese) 蔡雨函, 胡延春, 赵黑成, 等. 玉米赤霉烯酮的毒性及生物降解研究进展[J]. 动物医学进展, 2012, 33(5): 102-105. DOI:10.3969/j.issn.1007-5038.2012.05.024 |
| [10] |
Kakeya H, Takahashi-Ando N, Kimura M, et al. Biotransformation of the mycotoxin, zearalenone, to a non-estrogenic compound by a fungal strain of Clonostachys sp.[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(12): 2723-2726. DOI:10.1271/bbb.66.2723 |
| [11] |
Utermark J, Karlovsky P. Role of zearalenone lactonase in protection of Gliocladium roseum from fungitoxic effects of the mycotoxin zearalenone[J]. Applied and Environmental Microbiology, 2007, 73(2): 637-642. |
| [12] |
Takahashi-Ando N, Ohsato S, Shibata T, et al. Metabolism of zearalenone by genetically modified organisms expressing the detoxification gene from Clonostachys rosea[J]. Applied and Environmental Microbiology, 2004, 70(6): 3239-3245. DOI:10.1128/AEM.70.6.3239-3245.2004 |
| [13] |
Robert X, Gouet P. Deciphering key features in protein structures with the new ENDscript server[J]. Nucleic Acids Research, 2014, 42(W1): W320-W324. DOI:10.1093/nar/gku316 |
| [14] |
Kabsch W, Sander C. Dictionary of protein secondary structure: pattern recognition of hydrogen-bonded and geometrical features[J]. Biopolymers, 1983, 22(12): 2577-2637. DOI:10.1002/(ISSN)1097-0282 |
| [15] |
Eijsink VGH, Bj rk A, G seidnes S, et al. Rational engineering of enzyme stability[J]. Journal of Biotechnology, 2004, 113(1/3): 105-120. |
| [16] |
Li WF, Zhou XX, Lu P. Structural features of thermozymes[J]. Biotechnology Advances, 2005, 23(4): 271-281. |
| [17] |
Peng W, Ko TP, Yang YY, et al. Crystal structure and substrate-binding mode of the mycoestrogen-detoxifying lactonase ZHD from Clonostachys rosea[J]. RSC Advances, 2014, 4(107): 62321-62325. DOI:10.1039/C4RA12111B |
| [18] |
Xu ZX, Liu WD, Chen CC, et al. Enhanced α-Zearalenol hydrolyzing activity of a mycoestrogen-detoxifying lactonase by structure-based engineering[J]. ACS Catalysis, 2016, 6(11): 7657-7663. DOI:10.1021/acscatal.6b01826 |
| [19] |
Wang GZ, Wu JJ, Lin J, et al. The disruption of two salt bridges of the cold-active xylanase XynGR40 results in an increase in activity, but a decrease in thermostability[J]. Biochemical and Biophysical Research Communications, 2016, 481(1/2): 139-145. |
| [20] |
Guo J, Coker AR, Wood SP, et al. Structure and function of the thermostable L-asparaginase from Thermococcus kodakarensis[J]. Acta Crystallographica Section D: Structural Biology, 2017, 73(11): 889-895. DOI:10.1107/S2059798317014711 |
| [21] |
Suzuki Y, Hatagaki K, Oda H. A hyperthermostable pullulanase produced by an extreme thermophile, Bacillus flavocaldarius KP 1228, and evidence for the proline theory of increasing protein thermostability[J]. Applied Microbiology and Biotechnology, 1991, 34(6): 707-714. |
| [22] |
Watanabe K, Masuda T, Ohashi H, et al. Multiple proline substitutions cumulatively thermostabilize Bacillus cereus ATCC7064 oligo-1, 6-glucosidase. Irrefragable proof supporting the proline rule[J]. European Journal of Biochemistry, 1994, 226(2): 277-283. |
 2018, Vol. 45
2018, Vol. 45