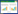扩展功能
文章信息
- 张彦位, 张娟, 堵国成, 陈坚
- ZHANG Yan-Wei, ZHANG Juan, DU Guo-Cheng, CHEN Jian
- 天冬氨酸提高乳酸乳球菌Lactococcus lactis NZ9000酸胁迫抗性的作用机制
- Improvement of acid-tolerance of Lactococcus lactis NZ9000 by aspartate
- 微生物学通报, 2018, 45(12): 2563-2575
- Microbiology China, 2018, 45(12): 2563-2575
- DOI: 10.13344/j.microbiol.china.180022
-
文章历史
- 收稿日期: 2018-01-08
- 接受日期: 2018-03-26
- 网络首发日期(www.cnki.net): 2018-05-15
2. 江南大学生物工程学院 江苏 无锡 214122;
3. 江南大学糖化学与生物技术教育部重点实验室 江苏 无锡 214122;
4. 江南大学粮食发酵工艺与技术国家工程实验室 江苏 无锡 214122
2. School of Biotechnology, Jiangnan University, Wuxi, Jiangsu 214122, China;
3. Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi, Jiangsu 214122, China;
4. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi, Jiangsu 214122, China
乳酸菌(Lactic acid bacteria,LAB)属于革兰氏阳性菌,是一类兼性厌氧、不产芽孢、可发酵碳水化合物生成乳酸和其他风味物质的细菌,在食品、饮料和微生态菌剂等领域被广泛应用,属于重要的发酵微生物[1]。在发酵生产和应用过程中,乳酸的大量生成以及人或动物的胃肠道都会使乳酸菌遭受强烈的酸胁迫,影响乳酸菌的生长与代谢,进而抑制其目的产物的进一步积累和益生功能的发挥,因此,提高乳酸菌酸胁迫抗性尤为迫切[2-3]。目前,改善酸胁迫抗性的方法主要有适应性进化[4]、过量表达胁迫抗性相关的应激蛋白[5]、添加或异源表达海藻糖以及亚铁血红素等保护剂[6-7]。
氨基酸作为维持细胞生长代谢的重要原料物质,在提高细胞酸胁迫抗性中发挥着重要作用。目前的相关研究主要集中于谷氨酸脱羧酶途径和精氨酸脱亚胺酶途径。谷氨酸脱羧酶途径主要通过谷氨酸在谷氨酸脱羧酶作用下消耗胞内H+生成γ-氨基丁酸来维持胞内pH (pHi)的平衡[8-10];精氨酸脱亚胺酶途径中精氨酸逐步代谢生成NH3和ATP,中和H+的同时也有利于H+排出胞外[11-13]。此外,支链氨基酸(缬氨酸、亮氨酸、异亮氨酸)的合成会竞争消耗丙酮酸,降低甲酸等产量,缓和胁迫压力,从而改善乳酸菌的酸胁迫抗性。Len等[14]发现酸胁迫下其合成过程中编码转氨酶的ilvE转录水平上调2.70倍;Santiago等[15]将ilvE敲除,重组菌株的酸胁迫抗性显著降低。然而,相较于谷氨酸脱羧酶途径和精氨酸脱亚胺酶途径,对其它氨基酸代谢途径在改善微生物酸胁迫抗性方面的研究还非常有限,相关的作用机理也有待进一步探究。
本团队前期研究中通过适应性进化,获得了酸胁迫下存活率为对照菌株4 100倍的耐酸突变株——干酪乳杆菌Lbz-1,进一步分析发现耐酸突变株胞内天冬氨酸(Asp)积累量显著增加[16]。为了进一步发掘Asp在作为酸胁迫主体乳酸菌中的抗酸胁迫作用,本研究以乳酸菌模式菌Lactococcus lactis NZ9000为研究对象,验证Asp在改善酸胁迫方面的作用效果,并进一步探究其具体的作用机制,以期为氨基酸代谢途径的抗酸作用机制解析和工业耐酸菌株的构建提供新的思路。
1 材料与方法 1.1 菌株、质粒和培养条件所用菌株为Lactococcus lactis NZ9000 (保藏编号:LLN,CP002094;荷兰“NIZO Food Research”奶制品研究所),质粒为pNZ8148[17]。L. lactis NZ9000在GM17培养基(M17中添加5 g/L的葡萄糖)和只含游离氨基酸的SA化学合成培养基[18]培养,培养温度为30 ℃。
1.2 主要试剂和仪器M17肉汤培养基(Oxoid)、天冬氨酸(Asp),生工生物工程(上海)股份有限公司;GeneJET PCR纯化试剂盒、SpeⅠ、SphⅠ内切酶和NuPAGE 10% Bis-Tris Gel,Thermo Scientific公司;Solution Ⅰ、PrimerSTAR HS (Premix)、PrimeScriptTM Reagent Kit和SYBR® Premix ExTaqTM,大连宝生物工程有限公司;Nisin、缬氨霉素与尼日利亚菌素,Sigma公司;BCA蛋白定量试剂盒、RNAprep Pure Cell/Bacteria Kit,天根生化科技有限公司;ATP Assay Kit、BCECF AM荧光探针,碧云天生物技术研究所;Ammonia Assay Kit,ScienCell公司;细胞丙酮酸激酶(PK)总活性比色法定量检测试剂盒,上海杰美基因医药科技有限公司;AmpliteTM Colorimetric NAD/NADH Ratio Assay Kit,AAT Bioquest®公司;其他试剂均为国产分析纯。
组织和细胞匀浆仪,MP Biomedicals公司;LightCycler®480 system,罗氏公司;Agilent 1260高效液相色谱仪,安捷伦科技(中国)有限公司;多功能酶标仪,Thermo Scientific公司;凝胶成像仪、电转化仪,Bio-Rad公司。
1.3 Asp最适添加浓度的测定30 ℃静置培养12 h的种子液以2%的接种量转接至外源Asp浓度分别为0、40、60、80 mmol/L的GM17培养基中,待生长至对数中期(5 h)、稳定中期(9 h)、稳定中后期(13 h)时,取10 mL菌液于4 ℃、8 000 r/min离心10 min,菌体用等体积磷酸缓冲液(200 mmol/L,pH 7.00)重悬后8 000 r/min离心3 min,洗涤2次,液氮预冻,保存备用。将菌体重悬于1 mL上述磷酸缓冲液中于室温下解冻,菌悬液转移至破碎管中,使用FastPrep-24振荡破碎细胞,12 000 r/min离心5 min取上清液,向上清液中加入等体积的5%三氯乙酸(TCA)混匀,静置30 min沉淀蛋白,12 000 r/min离心5 min取上清,0.22 μm的水系滤膜过滤备用。
高效液相色谱仪分析方法:邻二甲苯(OPA)进行柱前衍生;色谱柱:ODS HYPERSIL (250 mm× 4.60 mm×5 μm);柱温:40 ℃;流速:1 mL/min;紫外检测器:激发波长338 nm,接收波长262 nm[19]。
1.4 L. lactis NZ9000酸胁迫抗性的分析如1.3培养12 h的种子液以2%的接种量转接至含60 mmol/L Asp和pH分别为6.0、5.5、5.0、4.5 (乳酸调节)的GM17培养基中,于30 ℃静置培养。每隔1 h取样,测定600 nm处的吸光值,以GM17培养基为空白对照。以OD600为纵坐标,培养时间为横坐标,绘制L. lactis NZ9000的生长曲线。每次测定3个平行,结果取平均值。
如1.3培养12 h的种子液以2%的接种量转接至GM17培养基中,待菌体生长至对数中期(5 h),取5 mL菌液于8 000 r/min离心3 min,用0.85%生理盐水重悬后8 000 r/min离心3 min,洗涤2次,加等体积pH 4.0和含60 mmol/L Asp的GM17培养基进行胁迫培养。分别胁迫0、1.5、2.5、3.5 h后,取900 μL菌液于8 000 r/min离心3 min,用0.85%生理盐水洗涤并梯度稀释至合适浓度,取10 μL点种于GM17琼脂培养基上,30 ℃培养24 h,单菌落计数并计算存活率(活菌计数的有效范围为30−300 CFU)[20]。
1.5 荧光实时定量PCRL. lactis NZ9000在GM17培养基中生长至对数中期(5 h),8 000 r/min离心3 min,0.85%生理盐水洗涤、收集菌体,加等体积pH 4.0 GM17胁迫培养。胁迫3.5 h后离心、洗涤、离心收集菌体,液氮冷冻后迅速研磨,按照RNAprep Pure Cell/Bacteria Kit说明书提取总RNA,并立即使用PrimeScriptTM Reagent Kit将RNA反转录为cDNA。根据L. lactis NZ9000目的基因的序列,使用Beacon Designer 7软件设计实时荧光定量PCR (RT-PCR)的引物(表 1),以16S rRNA基因作为内参基因。RT-PCR反应体系:2×SYBR® Premix ExTaq™ 7.5 μL,上、下游引物(10 μmol/L)各0.6 μL,cDNA模板(200 ng/μL) 1.2 μL,无菌水5.1 μL。RT-PCR反应条件:95 ℃ 5 min;95 ℃ 5 s,55 ℃ 20 s,共40个循环。
| 引物 Primers |
序列 Sequences (5′→3′) |
| acnBF | ACAGATAGTCATACAACAAT |
| acnBR | CTAACATTACAGCCTCAG |
| argGF | CTTGGCATATTCAGGTGGAT |
| argGR | AAGCGGCAATGACATCAA |
| argHF | TCAAGTAGCAACCGATATG |
| argHR | GGCATAAGAGTGTCAACA |
| LdhF | ACTTATTACGGAATTGGAATG |
| LdhR | TTACGACAGATGGAACAC |
| adeF | CTTCACCTCATTCCATCA |
| adeR | TCAGCAAGATAAGCGATT |
| serⅡF | TGTTCCACATCCAGAAGAA |
| serⅡR | ATTCCAGTCACGGTCATT |
| glyAF | CAATCCACTTCCTTATGC |
| glyAR | TTAGCCAAGACTTCATCA |
| aspBF | TCAATCATTCATCCAATCCT |
| aspBR | TTACGACAGCCATTCTTG |
| gltBF | TCGTGACAGGAAGAGATG |
| gltBR | GATACAACCAATCGCAACT |
| pyOF | TCAGCAAGATAAGCGATT |
| pyOR | CTTCACCTCATTCCATCA |
| gadF | GCCTATCAGTTAGTTCAA |
| gadR | CAGTTGTTCTTGGATATTC |
| akF | CTGGAAGAATTGAAGATA |
| akR | ATATAAGGAATGACTGAAG |
| pdHF | CTCATATTCCACCAGTAA |
| pdHR | TGCTTATCATAGTCAACA |
| thrAF | GCAGACAATATCCACAACTT |
| thrAR | GACTCGGTAAGCCAGAAT |
| glkF | CAGGAATCGTTCGCTTAG |
| glkR | TTACTTCATCACCATTGTCAA |
| pfkF | GCTCAAGTAGAAGGACAAC |
| pfkR | GTCACCACCGATTACAAC |
| pgkF | TCCATTCGTAGCAATCCTT |
| pgkR | CCACCACCGATGATAACT |
| pkF | CGTTGTTACTGGAGATAA |
| pkR | CATCATCAATCAAGATAGTT |
| pycAF | GAACCTCGTCAACCTCTACT |
| pycAR | CACATATTCAACTACCGCATCA |
| gltAF | AACAATACTGACCAATCCTT |
| gltAR | GCTAACGACTGCTCTAAG |
| gapdhF | AACAGTCGTATTCAACAC |
| gapdhR | GTATGAGTGGACAGTAGT |
| 16S rRNAF | GCTAATACCGCATAATAACTT |
| 16S rRNAR | TATGTATCATCGCCTTGG |
为了避免GM17培养基中多肽对胞内氨基酸含量测定的影响,将如1.3培养12 h的种子液以2%的接种量转接至SA合成培养基中,菌体生长至对数中期(5 h),8 000 r/min离心3 min,用0.85%生理盐水重悬、离心,洗涤2次,加等体积pH 4.0和含60 mmol/L Asp的SA合成培养基进行胁迫培养。分别胁迫0、1.5、2.5、3.5 h后取10 mL菌液离心、洗涤、离心收集菌体并用液氮预冻,保存备用。按照1.3的方法破碎细胞、制备液相样品并测定氨基酸的含量。
1.7 胞内ATP、丙酮酸激酶(PK)酶活、氧化还原电位和pHi的测定L. lactis NZ9000在GM17培养基中生长至对数中期(5 h),8 000 r/min离心3 min,用0.85%生理盐水洗涤、收集菌体,随后在pH 4.0条件下进行胁迫培养。胁迫0、0.5、1.0、1.5、2.5、3.5 h后,取样、离心、洗涤,液氮预冻后进行破碎。取破碎液上清液,分别用ATP Assay Kit、细胞丙酮酸激酶(PK)总活性比色法定量检测试剂盒和AmpliteTM Colorimetric NAD/NADH Ratio Assay Kit测定胞内ATP的含量、PK活性以及胞内NAD+/NADH的比率。
1.8 重组菌株L. lactis NZ9000-pNZ8148-ansB表达载体的构建与转化在KEGG中获得编码天冬酰胺酶的基因ansB的序列,利用Primer Primier 5设计引物ansBF和ansBR (表 2),上、下游引物的5′端分别加入Xba Ⅰ和Sac Ⅰ两个酶切位点(引物中划线部分)。以L. lactis NZ9000的基因组为模板,通过PCR扩增获得ansB基因。PCR反应体系:2×Prime STAR HS (Premix) 25.0 μL,引物ansBF和ansBR (10 μmol/L)各2.0 μL,L. lactis NZ9000的基因组模板2.0 μL,无菌水19.0 μL。PCR反应条件:95 ℃ 3 min;95 ℃ 5 s,55 ℃ 15 s,72 ℃ 1 min,28个循环。质粒pNZ8148和PCR扩增产物分别用Xba Ⅰ和Sac Ⅰ进行酶切,酶切产物纯化后用DNA连接酶将目的基因与载体连接。利用电转化的方法将重组质粒和空质粒转入L. lactis NZ9000,通过氯霉素抗性筛选获得重组菌株L. lactis NZ9000-pNZ8148-ansB和对照菌株L. lactis NZ9000-pNZ8148。
| 引物 Primers |
序列 Sequences (5′→3′) |
| ansBF | ATATATCTAGAATGAAAAAAATCTTAATTCTCCAC |
| ansBR | ATATAGAGCTCTTAATTTTCCAAAAAAGGACG |
重组菌株和对照菌株在含有10 mg/L氯霉素的GM17培养基中生长至OD600约为0.4,加入10 mg/L的Nisin诱导天冬酰胺酶表达。待菌株生长至稳定中期(9 h),8 000 r/min离心3 min,用0.85%生理盐水洗涤、收集菌体。用磷酸缓冲液(100 mmol/L,pH 7.2)重悬菌体,使用FastPrep-24振荡破碎细胞,4 ℃、10 000 r/min离心10 min后取上清进行SDS-PAGE分析和酶活力测定。
SDS-PAGE分析[21]采用5%的上层浓缩胶和12%的下层分离胶,制备方法参考上海碧云天生物技术有限公司南通分公司的产品说明书。5×Loading buffer的制备:1.25 mL Tris-HCl (1 mol/L,pH 6.8),0.5 g SDS,25.0 mg溴酚蓝,2.5 mL甘油,加去离子水溶解并定容至5 mL,室温保存备用。取40 μL样品,加10 μL 5×Loading buffer,70 ℃加热10 min,10 000 r/min离心30 s,取上清液20 μL上样进行电泳。电泳结束后,蛋白胶在考马斯亮蓝R-250溶液染色1 h,10% (体积比)醋酸脱色至出现清晰的蓝色蛋白条带。
利用奈氏试剂显色法测定天冬酰胺酶的活性。酶活性单位:1 min转化L-asparagine生成1 μmol/L Asp和NH3所需要的酶量定义为1个酶活力单位(U)[22]。
1.10 胁迫条件下重组菌株酸胁迫抗性的分析在含有10 mg/L氯霉素的GM17培养基中培养重组菌株和对照菌株至OD600约为0.4,加入10 mg/L的Nisin诱导生长,待菌株生长至对数中后期(6 h),8 000 r/min离心3 min,0.85%生理盐水洗涤、离心、收集菌体,加等体积pH 3.6的GM17进行胁迫培养。每隔0.25 h取样,点板,测定重组菌株的存活率。
1.11 胁迫条件下重组菌株胞内氨基酸、NH4+和ATP含量的测定Nisin诱导重组菌株和对照菌株生长至对数中后期(6 h),8 000 r/min离心3 min,0.85%生理盐水洗涤、收集菌体,加等体积pH 3.6的GM17培养基进行胁迫培养。每隔0.5 h取样,收集菌体,破碎细胞,取细胞破碎液测定胞内氨基酸、NH4+和ATP。
选用Ammonia Assay Kit (ScienCell)测定胞内NH4+浓度,原理是在α-酮戊二酸和谷氨酸脱氢酶存在条件下NADPH被氧化生成NADP,随着反应的进行,在340 nm处的吸光度逐渐降低,NH4+浓度与其氧化速率成正比,根据氧化速率求出样品中NH4+的浓度。
2 结果与分析 2.1 Asp最适添加浓度的确定随着外源Asp浓度的增加和培养时间的延长,L. lactis NZ9000胞内Asp的积累量会不断增加,直至达到饱和。通过高效液相色谱仪对不同外源Asp浓度下L. lactis NZ9000的胞内含量进行了测定,结果如表 3所示。当外源Asp浓度高于60 mmol/L时,
| 时间Time (h) | 外源Asp浓度Concentration of exogenous Asp (mmol/L) | |||
| 0 | 40 | 60 | 80 | |
| 5 | 12.29±0.04 | 26.23±0.09 | 35.47±0.11 | 33.14±0.07 |
| 9 | 25.76±0.12 | 50.43±0.06 | 56.51±0.09 | 56.80±0.12 |
| 13 | 25.53±0.08 | 44.36±0.02 | 43.83±0.07 | 46.01±0.03 |
胞内含量不再增加,维持在56 μg/mg蛋白左右,L. lactis NZ9000的胞内Asp含量已达到饱和,因此选用60 mmol/L为最适添加浓度进行后续实验。
2.2 Asp对L. lactis NZ9000酸胁迫抗性的影响为了确定Asp对L. lactis NZ9000酸胁迫抗性的影响,测定了在含有Asp的pH分别为6.0、5.5、5.0、4.5胁迫条件下,L. lactis NZ9000的生长性能。结果如图 1所示。在pH 6.0、5.5、5.0的培养条件下,Asp的存在使稳定期(12 h) L. lactis NZ9000的生物量分别增加23.9%、63.3%和463.0%。实验结果表明,酸胁迫条件下,Asp可以明显提高L. lactis NZ9000的生长性能。
|
| 图 1 不同pH下L. lactis NZ9000的生长曲线 Figure 1 Growth curves of L. lactis NZ9000 under different pH 注:A:pH 6.0;B:pH 5.5;C:pH 5.0;D:pH 4.5.误差线为3次平行实验的标准差. Note: A: pH 6.0; B: pH 5.5; C: pH 5.0; D: pH 4.5. Error bars indicate standard deviations (n=3). |
|
|
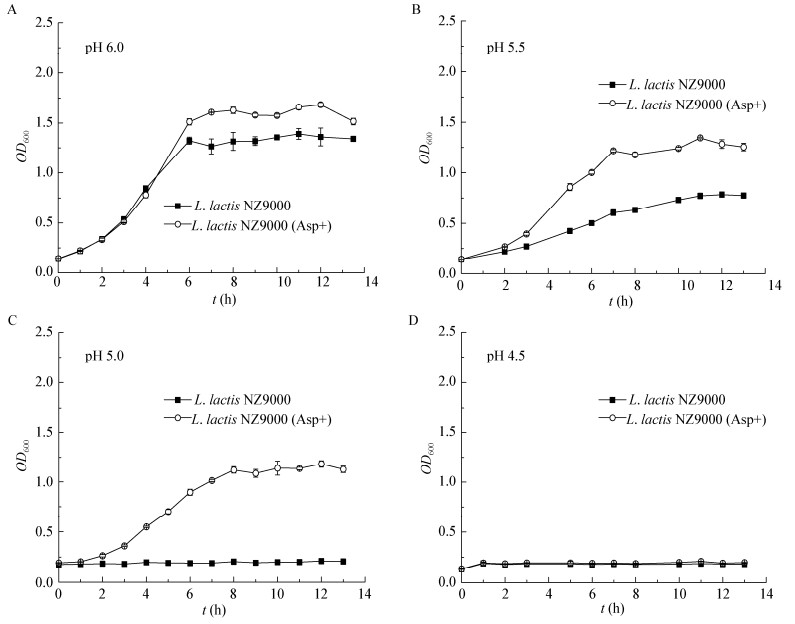
为了进一步确定酸胁迫条件下Asp对L. lactis NZ9000耐受性的影响,测定了pH 4.0时菌株的存活率。结果如图 2所示,胁迫3.5 h后,菌株存活率为对照的75倍,表明Asp可显著提高L. lactis NZ9000在pH 4.0胁迫条件下的存活率。
|
| 图 2 胁迫条件下Asp对L. lactis NZ9000存活率的影响 Figure 2 The effect of Asp on the survival rate of L. lactis NZ9000 under acid stress 注:误差线:标准差(n=3);**:差异显著(P≤0.05). Note: Error bars indicate standard deviations (n=3); **: Significant difference (P≤0.05). |
|
|
通过生长性能和存活率分析,验证了Asp可显著提高L. lactis NZ9000的酸胁迫抗性。
2.3 Asp对L. lactis NZ9000关键基因转录水平的影响上述实验结果证实Asp可有效提高L. lactis NZ9000的酸胁迫抗性。Asp在L. lactis NZ9000的代谢方式包括:(1)在转氨酶的作用下生成草酰乙酸和谷氨酸;(2)在裂解酶的作用下生成精氨酸和延胡索酸。草酰乙酸和延胡索酸参与三羧酸循环为细胞提供了更多的能量;谷氨酸和精氨酸分别经谷氨酸脱羧酶途径和精氨酸脱亚胺酶途径代谢提高了细胞的酸胁迫抗性[23-24]。我们利用RT-PCR确定了胁迫条件下Asp对L. lactis NZ9000糖酵解和三羧酸循环主要产能途径,及Asp代谢途径中关键基因转录水平的影响。如图 3所示(R代表胁迫前后基因转录水平的比值),因为天冬氨酸转氨酶在Asp合成和代谢过程中具有极高的专一性[24],pH 4.0胁迫3.5 h后,编码天冬氨酸转氨酶(L-aspartate aminotransferase)的AspB基因转录上调2.24倍,表明Asp在L. lactis NZ9000的主要代谢方式是在转氨酶作用下生成草酰乙酸(Oxaloacetate)和谷氨酸(Glu)。

|
| 图 3 L. lactis NZ9000中葡萄糖和氨基酸代谢机制及Asp对其中关键基因转录水平的影响 Figure 3 Schematic representation of glucose and amino acid pathway in L. lactis NZ9000 and effect of Asp on the transcriptional level of key genes 注:A:L. lactis NZ9000中葡萄糖和氨基酸代谢机制;B:Asp对关键基因转录水平的影响. R:胁迫前后基因转录水平的比值. Note: A: Schematic representation of glucose and amino acid pathway in L. lactis NZ9000; B: Effect of Asp on the transcriptional level of key genes. R: The ratio of gene transcription levels before and after acid stress. |
|
|
为了确定天冬氨酸转氨酶途径和谷氨酸脱羧酶途径的代谢强弱,分别测定了其代谢产物Glu和GABA的含量。同时,为了避免多肽水解对胞内氨基酸含量的影响,选用只含游离氨基酸的化学合成培养基培养L. lactis NZ9000,利用高效液相色谱仪测定了胁迫条件下外源Asp对胞内Glu和GABA含量的影响,结果见图 4。pH 4.0胁迫条件下Asp的存在使胞内Glu和GABA的含量明显增加,胁迫3.5 h后,其含量分别为对照的2.28和2.22倍,与基因转录水平的分析结果一致。

|
| 图 4 胁迫条件下Asp对胞内Glu和GABA含量的影响 Figure 4 Effect of Asp on the content of other Glu and GABA under acid stress 注:A:Glu的含量;B:GABA的含量;误差线:标准差(n=3);**:差异显著(P≤0.05);*:差异显著(P≤0.1). Note: A: Content of Glu; B: Content of GABA; Error bars indicate standard deviations (n=3); **: Significant difference (P≤0.05); *: Significant difference (P≤0.1). |
|
|
上述RT-PCR结果表明,胁迫条件下Asp使得糖酵解和三羧酸循环产能途径中关键基因上调,可能为细胞提供了更多的能量,更好地维持了pHi的相对稳定。为了进一步证实该结论,对pH 4.0胁迫条件下L. lactis NZ9000胞内ATP、PK酶活力、氧化还原电位和pHi进行了测定,结果如图 5所示。

|
| 图 5 胁迫条件下Asp对胞内ATP、PK酶活力、NAD+/NADH和pHi的影响 Figure 5 Effect of Asp on the contents of intracellular ATP, activity of PK, ratio of NAD+/NADH and intracellular pH under acid stress 注:A:胞内ATP的浓度;B:PK酶活;C:NAD+/NADH;D:pHi.误差线:标准差(n=3);**:差异显著(P≤0.05);*:差异显著(P≤0.1). Note: A: Intracellular ATP concentration; B: Activity of PK; C: NAD+/NADH; D: Intracellular pH. Error bars indicate standard deviations (n=3); **: Significant difference (P≤0.05); *: Significant difference (P≤0.1). |
|
|
从图 5可以看出,胁迫条件下,Asp的存在可明显提高L. lactis NZ9000胞内ATP的含量,pH 4.0条件下胁迫3.5 h后ATP含量为对照组的42倍;pH 4.0胁迫初期,L. lactis NZ9000的PK酶活力明显升高,随着胁迫时间的延长,酶活力迅速下降,Asp可以保持PK酶活力相对稳定,胁迫3.5 h后约为对照组的1.6倍;酸胁迫使L. lactis NZ9000胞内NAD+含量明显升高,氧化呼吸产能无法正常进行,而Asp可以维持NAD+/NADH的相对平衡;胁迫3.5 h后,对照组的pHi不断下降,其ΔpH为0.24,而Asp的存在使pHi的下降明显降低,ΔpH仅为0.10,有效地保证了pHi的相对平衡。
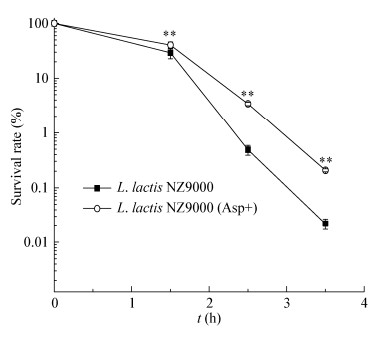
2.6 L. lactis NZ9000-pNZ8148-ansB的诱导表达和酶活测定上述实验结果证实,胞内Asp的积累可有效提高L. lactis NZ9000的酸胁迫抗性。依靠外源添加方法,胞内Asp积累量较对照增加了2.19倍,酸胁迫抗性得到明显改善,但是由于Asp和Glu有共同的转运蛋白AcaP[25],大量外源Asp对转运蛋白的竞争严重抑制了胞内Glu的积累[3]。Glu作为L. lactis NZ9000的必需氨基酸在菌株生长和抵御酸胁迫方面都发挥重要作用,因此,为了避免转运载体的竞争对Glu含量的影响,通过分子生物学手段使L. lactis NZ9000积累更多的Asp,从而提高其酸胁迫抗性。重组菌株诱导培养后,收集菌体进行了SDS-PAGE分析并测定了L-asparaginase的酶活力,结果如图 6所示。L-asparaginase的分子量为34.97 kD,从图 6A中可以看出L-asparaginase在L. lactis NZ9000中成功表达。与对照菌株相比,L. lactis NZ9000-pNZ8148- ansB的天冬酰胺酶酶活提高了5.57倍(图 6B)。
|
| 图 6 L. lactis NZ9000-pNZ8148-ansB SDS-PAGE分析(A)和天冬酰胺酶的酶活力(B) Figure 6 SDS-PAGE analysis of L. lactis NZ9000-pNZ8148-ansB (A) and activity of L-asparaginase (B) 注:M:Marker;Control:L. lactis NZ9000-pNZ8148;AnsB:L. lactis NZ9000-pNZ8148-ansB.误差线:标准差(n=3);**:差异显著(P≤0.05). Note: M: Marker; Control: L. lactis NZ9000-pNZ8148; AnsB: L. lactis NZ9000-pNZ8148-ansB. Error bars indicate standard deviations (n=3); **: Significant difference (P≤0.05). |
|
|
诱导培养L. lactis NZ9000-pNZ8148-ansB,并进一步降低pH加剧胁迫。如图 7所示,pH 3.6胁迫培养0.5 h后,重组菌株L. lactis NZ9000- pNZ8148-ansB的存活率为对照的11.11倍,重组菌株的酸胁迫抗性得到显著提高,表明通过基因工程手段增加菌株胞内Asp积累量是提高其酸胁迫抗性的有效方法。

|
| 图 7 胁迫条件下L. lactis NZ9000-pNZ8148-ansB的存活率 Figure 7 The survival rates of L. lactis NZ9000-pNZ8148- ansB under acid stress 注:误差线:标准差(n=3);**:差异显著(P≤0.05);*:差异显著(P≤0.1). Note: Error bars indicate standard deviations (n=3); **: Significant difference (P≤0.05); *: Significant difference (P≤0.1). |
|
|
为了进一步验证天冬酰胺酶的作用效果,测定了胁迫培养后L. lactis NZ9000-pNZ8148-ansB胞内氨基酸和NH4+的含量,结果如图 8所示。Asp作为谷氨酸(Glu)、苏氨酸(Thr)和亮氨酸(Leu)的前体物质,随着其胞内积累量的增加,Glu、Thr和Leu的含量均增加。pH 3.6条件下胁迫0.5 h后Asp、Glu、Thr和Leu含量分别为对照菌株的2.14、2.84、2.77和6.49倍。此外,天冬酰胺酶催化天冬酰胺生成Asp和NH3,胁迫过程中NH3可以中和H+生成NH4+,重组菌株L. lactis NZ9000-pNZ8148- ansB胞内NH4+明显高于对照菌株,胁迫1 h后胞内NH4+含量为对照菌株的3.75倍。

|
| 图 8 胁迫条件下L. lactis NZ9000-pNZ8148-ansB胞内氨基酸和NH4+的含量 Figure 8 The contents of intracellular amino acids and NH4+ of L. lactis NZ9000-pNZ8148-ansB under acid stress 注:A:胞内氨基酸含量;B:胞内NH4+含量.误差线:标准差(n=3);**:差异显著(P≤0.05);*:差异显著(P≤0.1). Note: A: Content of intracellular aa; B: Content of intracellular NH4+. Error bars indicate standard deviations (n=3); **: Significant difference (P≤0.05); *: Significant difference (P≤0.1). |
|
|
上述实验结果证明,胁迫过程中,胞内Asp含量的增加可以为细胞提供更多的ATP,因此测定了重组菌株胞内ATP的含量,结果如图 9所示。pH 3.6胁迫条件下,初期由于应激反应,重组菌株和对照菌株胞内ATP含量均迅速升高,但重组菌株ATP的含量明显高于对照菌株,胁迫1 h后重组菌株胞内ATP含量为对照菌株的2.4倍。

|
| 图 9 胁迫条件下L. lactis NZ9000-pNZ8148-ansB胞内ATP的含量 Figure 9 The contents of intracellular ATP of L. lactis NZ9000-pNZ8148-ansB under acid stress 注:误差线:标准差(n=3);*:差异显著(P≤0.1). Note: Error bars indicate standard deviations (n=3); *: Significant difference (P≤0.1). |
|
|
草酰乙酸会迅速被降解成丙酮酸,同时作为中间代谢物参与三羧酸循环,使得有氧呼吸产能途径中关键基因转录上调,为细胞提供更多的ATP[26]。胁迫条件下,H+-ATPase需消耗大量ATP将H+泵出来维持pHi的相对平衡[27]。同时,胞内Glu含量增加,编码谷氨酸脱羧酶的基因gad上调,Glu在谷氨酸脱羧酶的催化下消耗H+脱羧并生成碱性较强的GABA,减轻细胞的胁迫压力,维持L. lactis NZ9000 pHi的相对平衡[28]。pHi自我调节是乳酸菌应对酸胁迫的重要响应机制,菌株正常的生长代谢及益生作用的发挥均需要维持pHi的相对平衡[29-30]。胞内微环境分析发现,Asp可有效维持胞内NAD+/NADH和pHi的相对平衡,保证细胞生长代谢的正常进行[25, 31-33];Asp代谢产物Thr和Leu含量增加,Thr在苏氨酸脱氨酶的作用下可释放NH3中和H+[26],Leu合成过程中会竞争性消耗丙酮酸,降低甲酸等有机酸的产量,进而缓解细胞的胁迫压力[15]。本研究证实了Asp可有效提高L. lactis NZ9000的酸胁迫抗性,进一步揭示了Asp的作用机制。我们的研究结果表明,天冬氨酸转氨酶在乳酸菌生长代谢过程中发挥着重要作用。胁迫条件下,天冬氨酸转氨酶催化Asp生成草酰乙酸和谷氨酸,分别通过提供ATP和消耗胞内H+的方式缓解细胞受到的胁迫压力。此外,为了提高L. lactis NZ9000胞内Asp的积累量,我们过量表达了L-天冬酰胺酶,重组菌株胞内Asp的含量和存活率分别提高了2.14倍和11.11倍,这提供了一种改善乳酸菌酸胁迫抗性的有效方式。我们的研究结果可拓展对氨基酸抗酸胁迫的研究认识,深化Asp提高乳酸菌酸胁迫抗性的作用机制解析,同时也为工业耐酸菌株的构建提供了新的思路。
| [1] |
Benbouziane B, Ribelles P, Aubry C, et al. Development of a Stress-Inducible Controlled Expression (SICE) system in Lactococcus lactis for the production and delivery of therapeutic molecules at mucosal surfaces[J]. Journal of Biotechnology, 2013, 168(2): 120-129. DOI:10.1016/j.jbiotec.2013.04.019 |
| [2] |
Azizan KA, Ressom HW, Mendoza ER, et al. 13C based proteinogenic amino acid (PAA) and metabolic flux ratio analysis of Lactococcus lactis reveals changes in pentose phosphate (PP) pathway in response to agitation and temperature related stresses[J]. PeerJ, 2017, 5: e3451. DOI:10.7717/peerj.3451 |
| [3] |
Weidmann S, Maitre M, Laurent J, et al. Production of the small heat shock protein Lo18 from Oenococcus oeni in Lactococcus lactis improves its stress tolerance[J]. International Journal of Food Microbiology, 2017, 247: 18-23. DOI:10.1016/j.ijfoodmicro.2016.06.005 |
| [4] |
Zhang J, Wu CD, Du GC, et al. Enhanced acid tolerance in Lactobacillus casei by adaptive evolution and compared stress response during acid stress[J]. Biotechnology & Bioprocess Engineering, 2012, 17(2): 283-289. |
| [5] |
Almarza O, Nú ez D, Toledo H. The DNA-binding protein HU has a regulatory role in the acid stress response mechanism in Helicobacter pylori[J]. Helicobacter, 2015, 20(1): 29-40. DOI:10.1111/hel.2014.20.issue-1 |
| [6] |
Carvalho AL, Cardoso FS, Bohn A, et al. Engineering trehalose synthesis in Lactococcus lactis for improved stress tolerance[J]. Applied & Environmental Microbiology, 2011, 77(12): 4189-4199. |
| [7] |
Lechardeur D, Cesselin B, Fernandez A, et al. Using heme as an energy boost for lactic acid bacteria[J]. Current Opinion in Biotechnology, 2011, 22(2): 143-149. DOI:10.1016/j.copbio.2010.12.001 |
| [8] |
He A, Penix SR, Basting PJ, et al. Acid evolution of Escherichia coli K-12 eliminates amino acid decarboxylases and reregulates catabolism[J]. Applied & Environmental Microbiology, 2017, 83(12): e00442-17. |
| [9] |
Feehily C, Karatzas KAG. Role of glutamate metabolism in bacterial responses towards acid and other stresses[J]. Journal of Applied Microbiology, 2013, 114(1): 11-24. |
| [10] |
Chattopadhyay MK, Tabor H. Polyamines are critical for the induction of the glutamate decarboxylase-dependent acid resistance system in Escherichia coli[J]. Journal of Biological Chemistry, 2013, 288(47): 33559-33570. DOI:10.1074/jbc.M113.510552 |
| [11] |
Savino MJ, Sánchez LA, Saguir FM, et al. Lactic acid bacteria isolated from apples are able to catabolise arginine[J]. World Journal of Microbiology & Biotechnology, 2012, 28(3): 1003-1012. |
| [12] |
Cusumano ZT, Caparon MG. Citrulline protects Streptococcus pyogenes from acid stress using the arginine deiminase pathway and the F1Fo-ATPase[J]. Journal of Bacteriology, 2015, 197(7): 1288-1296. DOI:10.1128/JB.02517-14 |
| [13] |
Valenzuela M, Cáceres A, Almarza O, et al. Characterization of the arginine decarboxylase gene (ORF HP0422, speA) involved in acid tolerance in Helicobacter pylori[J]. Helicobacter, 2014, 19(3): 182-193. DOI:10.1111/hel.2014.19.issue-3 |
| [14] |
Len ACL, Harty DWS, Jacques NA. Proteome analysis of Streptococcus mutans metabolic phenotype during acid tolerance[J]. Microbiology, 2004, 150(5): 1353-1366. DOI:10.1099/mic.0.26888-0 |
| [15] |
Santiago B, MacGilvray M, Faustoferri RC, et al. The branched-chain amino acid aminotransferase encoded by ilvE is involved in acid tolerance in Streptococcus mutans[J]. Journal of Bacteriology, 2012, 194(8): 2010-2019. DOI:10.1128/JB.06737-11 |
| [16] |
Wu CD. Lactobacillus casei against acid stress physiological mechanism analysis[D]. Wuxi: Doctoral Dissertation of Jiangnan Univerisity, 2012 (in Chinese) 吴重德.干酪乳杆菌抵御酸胁迫的生理机制解析[D].无锡: 江南大学博士学位论文, 2012 |
| [17] |
Shi WJ, Li Y, Gao XL, et al. Improvement of the respiration efficiency of Lactococcus lactis by decreasing the culture pH[J]. Biotechnology Letters, 2016, 38(3): 495-501. |
| [18] |
Jensen PR, Hammer K. Minimal requirements for exponential growth of Lactococcus lactis[J]. Applied & Environmental Microbiology, 1993, 59(12): 4363-4366. |
| [19] |
Su JK, Wang X, Lu JQ, et al. Determination of amino acids with OPA-FMOC by on-line derivatization[J]. Chinese Journal of Experimental Traditional Medical Formulae, 2012, 18(15): 135-138. (in Chinese) 苏建坤, 王雪, 卢建秋, 等. OPA-FMOC在线衍生化法测定氨基酸的含量[J]. 中国实验方剂学杂志, 2012, 18(15): 135-138. DOI:10.3969/j.issn.1005-9903.2012.15.038 |
| [20] |
Zhai ZY, An HR, Wang GH, et al. Functional role of pyruvate kinase from Lactobacillus bulgaricus in acid tolerance and identification of its transcription factor by bacterial one-hybrid[J]. Scientific Reports, 2015, 5: 17024. DOI:10.1038/srep17024 |
| [21] |
Laemmli UK. Cleavage of structural proteins during the assembly of the head of Bacteriophage T4[J]. Nature, 1970, 227(5259): 680-685. DOI:10.1038/227680a0 |
| [22] |
Batool T, Makky EA, Jalal M, et al. A comprehensive review on L-asparaginase and its applications[J]. Applied Biochemistry & Biotechnology, 2016, 178(5): 900-923. |
| [23] |
Kieronczyk A, Skeie S, Langsrud T, et al. The nature of aroma compounds produced in a cheese model by glutamate dehydrogenase positive Lactobacillus INF15D depends on its relative aminotransferase activities towards the different amino acids[J]. International Dairy Journal, 2004, 14(3): 227-235. DOI:10.1016/j.idairyj.2003.07.001 |
| [24] |
Dudley EG, Steele JL. Lactococcus lactis LM0230 contains a single aminotransferase involved in aspartate biosynthesis, which is essential for growth in milk[J]. Microbiology, 2001, 147(1): 215-224. DOI:10.1099/00221287-147-1-215 |
| [25] |
Trip H, Mulder NL, Lolkema JS. Cloning, expression, and functional characterization of secondary amino acid transporters of Lactococcus lactis[J]. Journal of Bacteriology, 2013, 195(2): 340-350. DOI:10.1128/JB.01948-12 |
| [26] |
van de Guchte M, Serror P, Chervaux C, et al. Stress responses in lactic acid bacteria[J]. Antonie Van Leeuwenhoek, 2002, 82(1/4): 187-216. DOI:10.1023/A:1020631532202 |
| [27] |
Ajdić D, Mcshan WM, Mclaughlin RE, et al. Genome sequence of Streptococcus mutans UA159, a cariogenic dental pathogen[J]. Proceedings of the National Academy of Sciences of the United States of America, 2002, 99(22): 14434-14439. DOI:10.1073/pnas.172501299 |
| [28] |
Damiano MA, Bastianelli D, Al Dahouk S, et al. Glutamate decarboxylase-dependent acid resistance in Brucella spp.: distribution and contribution to fitness under extremely acidic conditions[J]. Applied & Environmental Microbiology, 2015, 81(2): 578-586. |
| [29] |
Karatzas KAG, Suur L, O'Byrne CP. Characterization of the intracellular glutamate decarboxylase system: analysis of its function, transcription, and role in the acid resistance of various strains of Listeria monocytogenes[J]. Applied & Environmental Microbiology, 2012, 78(10): 3571-3579. |
| [30] |
Le Lay J, Bahloul H, Sérino S, et al. Reducing activity, glucose metabolism and acid tolerance response of Bacillus cereus grown at various pH and oxydo-reduction potential levels[J]. Food Microbiology, 2015, 46: 314-321. DOI:10.1016/j.fm.2014.07.007 |
| [31] |
Cole SPC. Multidrug resistance protein 1 (MRP1, ABCC1), a "Multitasking" ATP-binding cassette (ABC) transporter[J]. Journal of Biological Chemistry, 2014, 289(45): 30880-30888. DOI:10.1074/jbc.R114.609248 |
| [32] |
Tachon S, Chambellon E, Yvon M. Identification of a conserved sequence in flavoproteins essential for the correct conformation and activity of the NADH oxidase NoxE of Lactococcus lactis[J]. Journal of Bacteriology, 2011, 193(12): 3000-3008. DOI:10.1128/JB.01466-10 |
| [33] |
Zuljan FA, Repizo GD, Alarcon SH, et al. α-Acetolactate synthase of Lactococcus lactis contributes to pH homeostasis in acid stress conditions[J]. International Journal of Food Microbiology, 2014, 188: 99-107. DOI:10.1016/j.ijfoodmicro.2014.07.017 |
 2018, Vol. 45
2018, Vol. 45