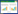扩展功能
文章信息
- 姚伶俐, 潘海峰, 田文娟, 惠天聪, 谢志鹏, 张建国
- YAO Ling-Li, PAN Hai-Feng, TIAN Wen-Juan, HUI Tian-Cong, XIE Zhi-Peng, ZHANG Jian-Guo
- 代谢工程改造大肠杆菌合成丁二酸及发酵罐放大工艺
- Production of succinate by a metabolic engineered Escherichia coli and its scale-up process in fermentor
- 微生物学通报, 2018, 45(12): 2541-2551
- Microbiology China, 2018, 45(12): 2541-2551
- DOI: 10.13344/j.microbiol.china.180113
-
文章历史
- 收稿日期: 2018-02-05
- 接受日期: 2018-04-19
- 网络首发日期(www.cnki.net): 2018-05-30
2. 杭州宝晶生物股份有限公司 浙江 杭州 311106
2. Hangzhou Bioking Biology Co. Ltd., Hangzhou, Zhejiang 311106, China
丁二酸,又称琥珀酸,是三羧酸循环的重要中间产物。丁二酸是优良的C4平台化合物,可广泛用于复杂化学药物、精细化工加工及可降解的聚合物前体物质,同时被美国能源部列为未来最有潜力的生物基大宗化学药品之一[1]。现今工业化生产方式主要通过电解法及催化加氢法。其中电解法是在电解槽中以顺酐或马来酸为原料电解生成丁二酸,此法工业化生产具有电耗大、电解槽易腐蚀且维修困难、污水排放量大等缺点;而催化加氢法则是采用丁烷为底物生成马来酸酐,然后在催化剂的作用下进行加氢反应生成丁二酸,存在催化剂价格昂贵、设备要求高、以不可再生资源为原料等缺点[2]。因此,为避免不可再生资源的使用,解决资源短缺及减少能耗,研究微生物发酵法制备丁二酸成为解决问题的关键,该方法以可再生且价格低廉的糖为原料,利用高产丁二酸菌株可实现大规模生产。
微生物合成丁二酸目前研究最多的菌株为琥珀酸放线杆菌Actinobacillus succinogenes、产琥珀酸厌氧螺菌Anaerobiospirillum succinciproducens、谷氨酸棒状杆菌Corynebacterium glutamicum和大肠杆菌Escherichia coli[3-4]。但大多数菌株代谢复杂、发酵培养时营养要求高,从而增加了发酵成本,给工业化生产造成障碍。由于大肠杆菌培养条件简单、发酵周期短、代谢网络研究清晰、基因改造简单等优势,成为工业化研究的主要对象。大肠杆菌好氧发酵过程中,丁二酸为三羧酸循环(TCA)途径的中间产物,积累较少,因此多数研究采用好氧培养、厌氧发酵产酸的两阶段发酵模式,即好氧发酵增加菌体浓度,厌氧阶段则生产丁二酸及产生乙酸、乳酸等副产物[5]。副产物的产生影响丁二酸的得率,因此对菌株进行代谢工程改造,减少副产物生成、强化丁二酸产生途径成为代谢改造的主要手段。大肠杆菌NZN111同时缺失编码乳酸脱氢酶的基因ldhA和丙酮酸甲酸裂解酶的基因pflB,在含葡萄糖培养基中生长受抑制[6]。Donnelly等对NZN111进行葡萄糖耐受筛选,成功筛选到编码葡萄糖磷酸转移酶基因ptsG的突变菌株AFP111,解除了葡萄糖对菌体的生长代谢抑制[7]。Vemuri等改造AFP111,质粒过表达大肠杆菌本身没有而来源于枯草芽孢杆菌Bacillus subtilis的催化丙酮酸合成草酰乙酸的丙酮酸羧化酶基因pyc,通过5 L发酵罐发酵和Na2CO3调节pH,丁二酸得率达到1.68 mol/mol葡萄糖[8],为迄今为止丁二酸最高得率。但由于需要IPTG诱导表达,成本较高且工艺控制难度大,而且质粒容易丢失导致菌株性能不稳定,限制了其工业化应用。
本研究以AFP111为出发菌株进行代谢工程改造,通过敲除副产物乙酸生成的关键酶基因ackA-pta、tdcDE,同时过表达glk,旨在以非质粒型、无需诱导表达的方式提高丁二酸得率,降低副产物乙酸产量,并建立和优化5 L发酵罐发酵工艺,在100 L发酵罐进行工艺放大。
1 材料与方法 1.1 材料 1.1.1 菌株、质粒、引物和培养基实验所用菌株和质粒的相关信息见表 1,引物相关信息见表 2。
| 菌株和质粒 Strains and plasmids |
相关特性 Characteristics |
来源 Sources |
| AFP111 | ΔldhA::Kan, ΔpflB::Cam, ptsG* | Lab collection |
| SX01 | AFP111, ΔackA-pta::FRT | This study |
| SX02 | SX01, ΔtdcDE::FRT | This study |
| SX03 | SX02, M1-12-glk::FRT | This study |
| pKD46 | Bla β γ exo (Red recombinase) temperature-conditional replicator, Amp | Lab stock |
| pCP20 | FLP recombinase helper plasmid, Amp | Lab stock |
| pIJ773 | Template plasmid with Apramycin gene and FLP recognition target and FLP recognition target | Lab stock |
| Note: *: with mutation. | ||
| Primers | Primers sequence (5′→3′) |
| ackA-pta-up | ATGTCGAGTAAGTTAGTACTGGTTCTGAACTGCGGTAGTTCTTCACTGAATAAGCTTGATATTCCGGGGATCCG |
| ackA-pta-down | TTACTGCTGCTGTGCAGACTGAATCGCAGTCAGCGCGATGGTGTAGACGAGTGTAGGCTGGAGCTGCTTC |
| ackA-ptajd1 | ATGTCGAGTAAGTTAGTACTGG |
| ackA-ptajd2 | TTACTGCTGCTGTGCAGA |
| tdcDE-up | TCAGAGCGCCTGGGTAAAGGTACGTGAAATAACATCCTGTTGCTGTTCACTAAGCTTGATATTCCGGGGATCCG |
| tdcDE-down | ATGAATGAATTTCCGGTTGTTTTGGTTATTAACTGTGGTTCGTCTTCGATGTGTAGGCTGGAGCTGCTTC |
| tdcDEjd1 | ATAACATCCTGTTGCTGTTC |
| tdcDEjd2 | GGTTATTAACTGTGGTTCGTC |
| aac-up | TAAGCTTGATATTCCGGGGATCCG |
| aac-M1-12-down | AGCTGTTTCCTGGTTTAAACTGACTGACGCACCAAAAGGGCTCAATTATATCAACGTTGTTATCTCTTGTCAACACCGCCAGAGATAAGTGTAGGCTGGAGCTGCTTC |
| aac-M1-12-1 | CATCGCTGCAATTGGTGCTGAAACGATAAAGTAATTGTGTGACCCAGATCTGACCTAAGCTTGATATTCCGGGGATCCG |
| aac-M1-12-2 | AGACGTGCGTTGGTGCCGCCCACATCACCGACTAATGCATACTTTGTCATAGCTGTTTCCTGGTTTAAACTG |
| glkjd1 | GTAATTGTGCAGATC |
| glkjd2 | CGACTAATGCATACTTTGTCAT |
| 注:M1-12启动强度为LacZ启动强度的0.1倍[9];NNNNN:改造基因的同源臂序列(50 bp);NNNNN:M1-12启动子序列(88 bp). Note: M1-12 promoter was 0.1 times that of the induced E. coli LacZ promoter[9]; NNNNN: The modified gene homologous arm (50 bp); NNNNN: The sequence of M1-12 promoter (88 bp). |
|
种子培养基(LB,g/L):酵母提取物5.0,胰蛋白胨10.0,NaCl 10.0。固体培养基加入1.5% (质量体积比)琼脂粉。
发酵培养基:Na2HPO4·2H2O 11.6 g/L,KH2PO4 1.1 g/L,NH4Cl 1.0 g/L,葡萄糖2.0 g/L,酵母提取物5.0 g/L,玉米浆25.0 mL/L,pH 7.0。
根据需要添加Amp (氨苄青霉素)、Kan (卡那霉素)、Apra (阿普拉霉素)至终浓度分别为100、50、50 mg/L。
1.1.2 主要试剂和仪器酵母抽提物和胰蛋白胨购自Oxiod公司;玉米浆购自杭州宝晶生物股份有限公司;碱式MgCO3购自上海泗联化工厂有限公司;Na2CO3购自中盐安徽红四方股份有限公司;其它相关试剂为国药分析纯。
胶回收试剂盒、蛋白浓度测定试剂盒、抗生素、PCR引物,生工生物工程(上海)股份有限公司;DL5000 Marker、2×T5 Super PCR mix (Colony),北京擎科新业生物技术有限公司;FastPfu Fly DNA Polymerase、dNTPs,北京全式金生物技术有限公司;异柠檬酸裂解酶(ICL)、丙酮酸激酶(Pyk)、苹果酸脱氢酶(Mdh)酶活测定试剂盒,北京索莱宝有限公司;AckA酶活测定试剂盒,上海大齐生物股份有限公司。
电转仪,Eppendorf公司;发酵罐,上海保兴生物设备工程有限公司;超声破碎仪,宁波海曙科生超声设备有限公司;高效液相色谱分析仪,安捷伦公司;SBA-40C生物传感分析仪,山东省科学院生物研究所。
1.2 方法 1.2.1 乙酸产生关键酶基因ackA-pta、tdcDE的敲除一步重叠PCR获得同源重组片段(同源序列为目的改造基因始末各50 bp)。
PCR体系(500 μL):无菌水320 μL,5×Fly buffer 100 μL,dNTPs (2.5 mmol/L) 40 μL,ackA-pta/tdcDE- up/down引物(10 μmol/L)各10 μL,pIJ773质粒10 μL,FastPfu Fly DNA Polymerase (2.5 U/μL) 10 μL。PCR条件:95 ℃ 5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。将产物使用胶回收试剂盒回收浓缩至120 μL,取40 μL进行电转化。
利用一步同源重组法进行基因敲除[10]。利用CaCl2法制备菌体感受态后转化pKD46质粒,利用Amp抗性挑取转化成功菌株,30 ℃、200 r/min培养8 h,制备超级感受态进行电转化(2 500 V,3 ms),将电转化后菌液浓缩100 μL涂布于Apra抗性平板,30 ℃培养36 h,挑取平板转化子进行PCR验证,分别以原始菌株基因组和菌液为模板进行验证。PCR体系(25 μL):无菌水11 μL,2×T5 Super PCR mix 11 μL,ackA-pta/tdcDE-jd1/jd2引物(10 μmol/L)各0.5 μL,菌液(无菌水稀释至50 μL) 2 μL或1 μL原始菌株基因组为模板。PCR条件:98 ℃ 2 min;98 ℃ 20 s,48 ℃ 20 s,72 ℃ 50 s,25个循环;72 ℃ 5 min。首先挑取经过PCR验证改造成功的菌株于含Apra终浓度为50 mg/L的LB液体培养基中,30 ℃、200 r/min培养8 h后将温度调至42 ℃培养过夜,进行pKD46温敏质粒的敲除。根据抗性筛选,可在Kan、Apra抗性生长而在Amp抗性下不生长即为成功消除pKD46的菌株。随后转化pCP20质粒,利用Amp抗性挑取转化成功菌株,30 ℃、200 r/min培养8 h后42 ℃培养过夜,利用抗性筛选挑取只在Kan抗性下生长而不能在Apra、Amp抗性下生长的菌株,即为成功消除了pCP20质粒和Apra抗性标记(含一个FRT位点),该菌株可进行下一基因改造。
1.2.2 丁二酸生成途径glk启动子改造两步重叠PCR获得同源重组片段。
第一步PCR扩增含有启动子抗性片段。PCR体系(100 μL):无菌水64 μL,5×Fly buffer 20 μL,dNTPs (2.5 mmol/L) 8 μL,aac-up/aac-M1-12-glk-down引物(10 μmol/L)各2 μL,pIJ773质粒2 μL,FastPfu Fly DNA Polymerase (2.5 U/μL) 2 μL。PCR条件:95 ℃ 5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。将PCR产物使用胶回收试剂盒回收浓缩至50 μL。
第二步PCR扩增含有目的改造基因同源臂片段。PCR反应体系(500 μL)各成分用量与1.2.1中同体系用量相同,此时引物为aac-M1-12-1/2,无菌水320 μL,5×Fly buffer 100 μL,dNTPs (2.5 mmol/L) 40 μL,aac-M1-12-1/2引物(10 μmol/L)各10 μL,FastPfu Fly DNA Polymerase (2.5 U/μL) 10 μL,模板为第一步回收产物10 μL。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 5 min。该扩增片段替换glk基因ATG (起始密码子)上游100 bp基因序列。PCR产物使用胶回收试剂盒浓缩至120 μL,取40 μL进行电转化。电转化条件及验证体系同1.2.1,此时使用引物对glkjd1/2进行鉴定。
1.2.3 培养方法一级种子:-20 ℃保存的甘油菌50 μL接种至5 mL LB液体培养基中,Kan终浓度为50 mg/L,37 ℃、200 r/min培养8 h。
摇瓶发酵转接一级种子100 μL于50 mL发酵培养基中,Kan终浓度为50 mg/L,37 ℃、200 r/min培养至OD600至13左右(好氧发酵),将全部发酵液转至100 mL密闭蓝盖瓶(厌氧发酵),加5.0 g糖和5.0 g碱式MgCO3后37 ℃、200 r/min继续培养,取样测量至葡萄糖浓度低于3 g/L时结束发酵。
5 L发酵罐发酵:取一级种子液100 μL于装有50 mL LB的250 mL三角瓶中,Kan终浓度为50 mg/L,37 ℃、200 r/min培养16 h作为二级种子。转接1.5%二级种子于3 L装液量的发酵罐,两阶段发酵。好氧阶段:初始葡萄糖10 g/L,通气量0.2 m3/h,转速250-550 r/min控制溶氧高于5%,2 mol/L NaOH调节pH为7.0,OD600至13左右转入厌氧发酵,温度37 ℃。厌氧阶段:转速300 r/min,温度37 ℃,直接加固态葡萄糖至终浓度为100 g/L。碱式MgCO3为pH调节剂,直接加入等质量碱式MgCO3。Na2CO3和NaOH混合碱液以自动调节pH。
100 L发酵罐发酵:转接600 μL一级种子液于装液量300 mL的1 000 mL三角瓶共3瓶,作为二级种子,转接1.5%二级种子液于100 L发酵罐,装液量60 L,两阶段发酵。好氧阶段:初始葡萄糖10 g/L,通气量4.0 m3/h,转速180-330 r/min控制溶氧在5%以上,2 mol/L NaOH调节pH为7.0,温度37 ℃,菌株培养OD600至13左右转入厌氧发酵。厌氧阶段:关闭空气阀门,直接加入总葡萄糖5.0 kg,2 mol/L Na2CO3和0.5 mol/L NaOH调节pH 6.8,温度37 ℃,转速200 r/min,残糖低于3 g/L时结束发酵。
1.2.4 发酵及代谢产物分析细胞生长量用分光光度计于波长600 nm处测定吸光度值,葡萄糖含量利用SBA-40C生物传感分析仪测定。采用高效液相色谱仪测定丁二酸和乙酸的浓度,色谱条件如下:Prevail Organic Acid色谱柱,流动相为25 mmol/L KH2PO4水溶液(pH 2.5),流速1.0 mL/min,柱温25 ℃,紫外检测器检测波长215 nm。
1.2.5 相关酶活测定ICL、Pyk、AckA、Mdh酶活测定按照试剂盒进行测定;Glk酶活按照文献[11]测定磷酸烯醇式丙酮酸羧激酶(Pck),磷酸烯醇式丙酮酸羧化酶(Ppc)酶活按照文献[12]测定。
蛋白浓度采用Bradford试剂盒测定。
2 结果与分析 2.1 ackA-pta、tdcDE敲除及glk启动子改造鉴定结果按照1.2.1和1.2.2方法扩增到大小为1 480 bp的ackA-pta、tdcDE敲除片段及1 568 bp的glk启动子改造片段(图略)。根据转化子的验证,分别以基因组和突变菌液为模板,使用引物对ackA-ptajd1/2鉴定扩增产物大小分别为3 422 bp和1 759 bp,表明ackA-pta被成功敲除(图 1)。引物对tdcDEjd1/2进行敲除鉴定的扩增产物大小分别为3 537 bp和1 480 bp,表明tdcDE被成功敲除(图 1)。使用glkjd1/2为引物鉴定改造结果,扩增产物大小分别为142 bp和1 510 bp (图 1),表明glk被成功改造。随后Apra抗性片段、FRT位点及pKD46、pCP20温敏质粒按照1.2.1所示方法验证消除。
|
| 图 1 ackA-pta、tdcDE敲除和glk启动子改造电泳验证图 Figure 1 The agarose gel electrophoresis of deleting ackA-pta, tdcDE and rebuilding glk promoter M:DL5000标准;1:ackA-pta突变株PCR产物;2:ackA-pta野生型PCR产物;3:tdcDE突变株PCR产物;4:tdcDE野生型PCR扩增;5:glk野生型PCR产物;6:glk突变株PCR产物. Note: M: DL5000 marker; 1: PCR product of mutation type ackA-pta; 2: PCR product of wild type ackA-pta; 3: PCR product of mutation type tdcDE; 4: PCR product of wild type tdcDE; 5: PCR product of wild type glk; 6: PCR product of mutation type glk. |
|
|
研究表明ackA-pta、tdcDE为乙酸产生途径关键基因[13],poxB对乙酸影响较小[14],丙酮酸氧化酶(PoxB)为膜蛋白,保护辅酶A处于活化状态,对大肠杆菌生长速率起决定性作用[15],因此主要敲除ackA-pta、tdcDE来减少乙酸生成。为进一步阐明该基因改造对丁二酸代谢途径关键酶活性的影响,对丁二酸产生的关键酶进行酶活测定。Pyk调节糖代谢流副产物与丁二酸之间的分配,Pck、Ppc、Mdh酶活影响丁二酸得率,ICL为乙醛酸途径关键酶。通过草酰乙酸-苹果酸-延胡索酸-丁二酸途径每生成1 mol丁二酸消耗2 mol NADH,而通过乙醛酸途径生成1 mol丁二酸消耗1.25 mol NADH,因此更有利于丁二酸生成[16]。酶活性的测定可初步探究基因改造对整体代谢的影响,具体代谢途径如文献[13]所示。
2.2.2 乙酸关键酶基因ackA-pta敲除对发酵结果的影响如表 3所示,以AFP111为出发菌株敲除ackA-pta获得的SX01菌株其乙酸产量下降了44.86%,丁二酸得率增加4.55%,丙酮酸含量下降了39.53%,丁二酸生产效率及葡萄糖利用速率分别下降了2.56%、8.79%。同时,表 4的酶活测定结果显示Ack酶活下降了57.44%,再次验证了ackA-pta敲除成功。ICL酶活提高1.36倍,Pck、Ppc、Mdh酶活分别较出发菌株提高1.20、1.08、1.26倍,Pyk酶活下降了97%,从而使得磷酸烯醇式丙酮酸(PEP)流向丁二酸生成加强,因此丙酮酸含量下降。其中Pyk酶活下降是由于ackA-pta敲除后acetyl-CoA含量增加,而acetyl-CoA是Pyk酶活的抑制剂[17],从而影响该酶活性。丁二酸生产效率和糖利用速率下降可能与敲除ackA-pta使得ATP减少而导致菌体代谢减慢有关。
| 菌株 Strain |
糖利用速率 Glucose utilization rate (g/(L·h)) |
生产效率 Productivity (g/(L·h)) |
丁二酸得率 Succinate yield (mol/mol) |
丁二酸 Succinate (g/L) |
乙酸 Acetate (g/L) |
丙酮酸 Pyruvate (g/L) |
| AFP111 | 0.91±0.02 | 0.78±0.03 | 1.32±0.06 | 86.21±4.21 | 17.52±2.41 | 0.86±0.04 |
| SX01 | 0.83±0.01 | 0.76±0.08 | 1.38±0.04 | 90.78±1.53 | 9.66±0.98 | 0.52±0.11 |
| SX02 | 0.69±0.03 | 0.66±0.02 | 1.45±0.01 | 95.21±2.05 | 8.16±0.39 | 0.18±0.03 |
| SX03 | 1.04±0.05 | 1.07±0.01 | 1.57±0.03 | 102.76±1.59 | 5.58±0.36 | 0.05±0.08 |
| 菌株 Strains |
酶 Enzymes |
||||||
| Glk | Pck | Ppc | ICL | AckA | Pyk | Mdh | |
| AFP111 | - | 32.05±2.35 | 15.31±2.93 | 58.24±3.12 | 219.02±3.42 | 71.09±3.36 | 338.15±13.82 |
| SX01 | - | 38.55±8.17 | 16.52±1.35 | 79.21±7.91 | 93.22±6.32 | 68.76±4.22 | 427.72±10.33 |
| SX02 | 21.38±3.55 | 45.75±5.39 | 18.58±2.31 | 100.74±2.53 | 0 | 55.72±2.15 | 483.72±15.13 |
| SX03 | 78.22±5.28 | 49.43±5.27 | 21.33±5.03 | 134.69±5.42 | - | 51.09±3.36 | 525.35±8.77 |
| 注:-:该酶活未检测;所有酶活为好氧培养结束时测定. Note: -: Not detected; All the enzyme activity were measured after aerobic fermentation. |
|||||||
虽然已敲除ackA-pta,但此时测定乙酸激酶依然具有活性,表明菌体内存在与Pta功能相似的酶,TdcD与AckaA具有相似酶活[18]。由于tdcD和tdcE在基因组位置上紧邻,在SX01菌株基础上,敲除tdcDE获得菌株SX02,乙酸产量下降了15.53%,丁二酸得率提高5.07% (表 3)。菌株SX02的AckA酶活测定为0 (表 4),再次表明tdcDE敲除成功。Pyk酶活下降了81%,使得丙酮酸含量下降了65.38%;Pck、Ppc、Mdh、ICL酶活分别提高1.87、1.12、1.13、1.21倍,增强了丁二酸生成途径。糖利用速率和丁二酸生产效率分别下降了16.87%、13.16%,可能与ATP进一步合成较少有关。
2.2.4 glk启动子改造对大肠杆菌发酵生产丁二酸的影响虽然丁二酸得率在减少乙酸产量过程中得到增加,但丁二酸生产效率及葡萄糖利用速率下降,因此考虑增加葡萄糖利用速率以期提高丁二酸得率。大肠杆菌内有2种葡萄糖转运途径:(1) PTS葡萄糖转运系统,以PEP为磷酸供体;(2) GalP/Glk葡萄糖转运系统,以ATP为磷酸供体[19]。AFP111菌株是ptsG突变菌株,ptsG突变使该酶酶活下降,减弱葡萄糖抑制现象,提高PEP含量,减少丙酮酸积累,提高丁二酸浓度[20]。Lu等在PTS突变菌株中过表达galP及glk,结果发现单独过表达glk更能显著提高葡萄糖利用效率[9]。
在SX02菌株基础上对glk启动子改造获得菌株SX03,较SX02的Glk酶活提高3.66倍,葡萄糖利用速率提高了50.72%,丁二酸得率提高了8.28%,生产效率提高了62.12%,乙酸产量下降了31.62%,丙酮酸含量下降了72.22%。推测产生该现象的原因是:在ptsG突变菌中,由于PTS系统糖转运减弱,使得GalP/Glk葡萄糖转运系统的糖转运功能加强,而本文过表达glk后提高了Glk酶活,使GalP/Glk转运系统的糖转运效率进一步加强,更进一步减弱了PTS系统糖转运效率,PEP含量增加,丙酮酸含量降低。通过SX03酶活测定,Pyk酶活下降了92%,Pck、Ppc、Mdh、ICL酶活分别较菌株SX02提高1.19、1.15、1.09、1.34倍,更进一步从代谢机制上解释了过表达glk使丁二酸提高的原因。
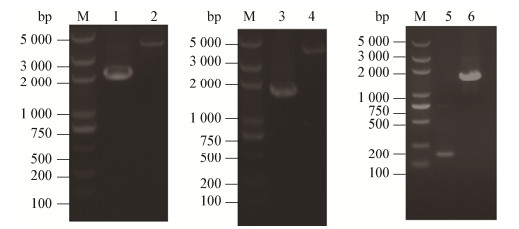
2.3 碱式MgCO3为pH中和剂的AFP111和SX03菌株5 L发酵罐发酵结果对比代谢工程菌株SX03的摇瓶发酵结果表明该菌株具有进一步发酵放大的潜质,因此将其进行5 L发酵罐放大发酵验证。发酵结果如图 2所示,出发菌株AFP111产生乙酸16.38 g/L,产生丁二酸83.58 g/L (终体积3.2 L),生产效率为0.91 g/(L·h),丁二酸得率为1.36 mol/mol葡萄糖;菌株SX03产生乙酸3.97 g/L,产生丁二酸98.92 g/L,生产效率为1.57 g/(L·h),丁二酸得率为1.62 mol/mol葡萄糖,相比出发菌株AFP111,乙酸产量下降了75.76%,生产效率提高72.52%,丁二酸得率提高19.12%。
|
| 图 2 菌株AFP111 (A)和SX03 (B)厌氧阶段发酵结果 Figure 2 The fermentation results by AFP111 (A) and SX03 (B) in anaerobic phase |
|
|
MgCO3对菌体代谢具有促进作用,因为Mg2+是多种代谢酶的辅酶[21],但其价格昂贵。CaCO3抑制菌体生长代谢,使菌体产丁二酸较困难,NaHCO3和Na2CO3调节pH时糖利用率较高,但是由于两者在进行pH调节时对发酵液产生稀释作用,尤以NaHCO3稀释作用较明显[22]。各调节剂市场价格大致为Na2CO3 1 600元/t、NaHCO3 1 800元/t、MgCO3 3 600元/t,因此选用Na2CO3作为pH调节剂不仅降低发酵液的稀释,更有利于工业化降低成本。Na2CO3作为MgCO3的替代pH调节剂,碱性中和性较低,因此加入0.5 mol/L NaOH为混合pH调节剂,NaOH可抑制HCO3-水解,减少Na2CO3加入。
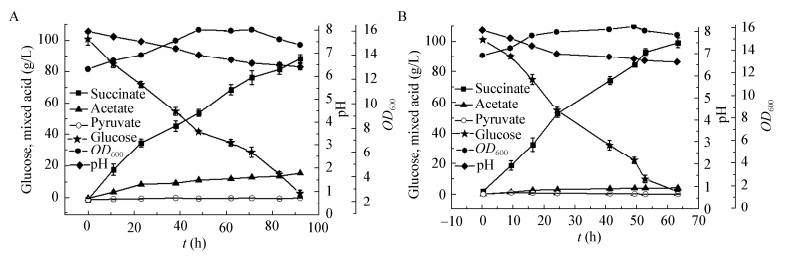
相关研究表明发酵液pH为影响菌体生成丁二酸的重要因素[23],因此需要对pH进行梯度优化。如图 3A所示,pH 6.8时,丁二酸产量为68.82 g/L,得率为1.61 mol/mol葡萄糖,乙酸产量为2.67 g/L,生产效率为0.80 g/(L·h)。
|
| 图 3 菌株SX03厌氧阶段pH (A)与转速(B)优化结果 Figure 3 The optimization results of pH (A) and agitation speed (B) by SX03 in anaerobic phase |
|
|
搅拌转速影响物质间接触面积,从而对发酵产物产生影响[24]。优化结果如图 3B所示,转速250 r/min条件下产丁二酸得率较高,丁二酸产量为72.33 g/L,得率为1.66 mol/mol,达到丁二酸的最大理论得率1.71 mol/mol葡萄糖[25]的96.51%,乙酸产量为2.24 g/L,生产效率为0.85 g/(L·h)。可能由于该转速下罐体剪切力对菌体代谢损伤较小,从而提高了丁二酸含量,减少了乙酸生成。
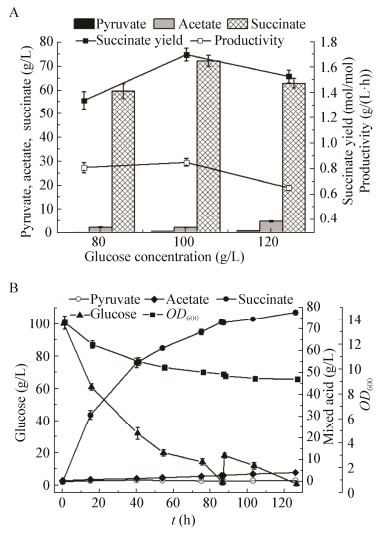
2.4.2 葡萄糖浓度优化不同葡萄糖浓度对菌体代谢抑制程度不同,虽然高糖使菌体代谢缓慢,有时甚至产生抑制现象,但高糖浓度可使菌体更充分利用原料,产生较高浓度丁二酸[22]。pH 6.8、转速250 r/min条件下,探究厌氧阶段的初始葡萄糖浓度对发酵结果的影响。如图 4A所示,100 g/L葡萄糖时丁二酸得率较高。根据以上优化结果表明在pH中和剂替换后,优化后pH 6.8、转速250 r/min、葡萄糖浓度100 g/L条件下发酵生产丁二酸,丁二酸得率为1.66 mol/mol葡萄糖,乙酸产量为2.24 g/L,相比以碱式MgCO3为pH中和剂的丁二酸得率变化不大,但乙酸质量下降20.65%。
|
| 图 4 菌株SX03厌氧阶段葡萄糖浓度优化结果 Figure 4 The optimization results of glucose concentration by SX03 in anaerobic phase 注:A:分批发酵;B:分批补料发酵. Note: A: Batch fermentation; B: Batch feeding fermentation. |
|
|
利用pH、转速、初始糖浓度优化后的条件,探索分批补料发酵对丁二酸得率的影响。当葡萄糖消耗完全,再次补加终浓度为20 g/L葡萄糖,最终生成77.90 g/L丁二酸,终体积4.7 L,丁二酸得率为1.44 mol/mol葡萄糖,乙酸4.13 g/L。如图 4B所示,补料后厌氧阶段糖耗速率下降了20%且丁二酸得率下降了14.46%。相关研究表明Na2CO3调节pH利用Actinobacillus succinogenes发酵生产丁二酸,中后期出现菌体絮凝现象[22],本文后期菌体代谢缓慢及副产物含量上升可能由于菌体絮凝引起,因此推测采用直接分批发酵相比补料发酵可能更有利于高产丁二酸及减少副产物乙酸的形成。
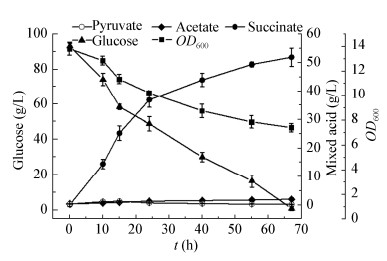
2.5 SX03菌株100 L罐发酵结果基于以上5 L发酵罐工艺,对菌株SX03进行100 L发酵罐发酵放大验证,发酵结果如图 5所示,厌氧发酵67 h,终体积82 L,产丁二酸51.95 g/L,产乙酸1.91 g/L,丁二酸得率为1.30 mol/mol葡萄糖,生产效率为0.79 g/(L·h)。结果表明该改造菌株的乙酸产量始终维持在较低水平,改造取得了较大成功。但相比5 L发酵罐丁二酸得率降低,其原因主要在于放大过程中传质、装液量以及剪切力等条件发生改变,影响菌体代谢,从而对丁二酸得率产生影响。因此下一步可对100 L发酵罐工艺作调整,以期提高丁二酸得率。
|
| 图 5 菌株SX03的100 L发酵罐厌氧阶段发酵结果 Figure 5 The fermentation results by SX03 in a 100-L fermentor in anaerobic phase |
|
|
微生物发酵法生产丁二酸,国外有小规模生产模式,但国内由于相关研究起步较晚,目前并未实现全面工业化生产。为推进发酵法生产丁二酸进程,同时达到节约能源的目的,构建高产丁二酸菌株及节约成本成为考虑的主要问题。本文选择AFP111为出发菌株进行代谢工程改造,敲除ackA-pta获得菌株SX01,经酶活测定发现Pck酶活相比Ppc酶活提高较多,可能由于发酵培养基中含有玉米浆所致,相关研究表明当培养基中含有玉米浆时,玉米浆中的天冬氨酸和苹果酸对谷氨酸棒状杆菌中Ppc酶具有抑制作用[26]。同时ICL酶活提高,增强了乙醛酸途径,该结果与Zhu等敲除副产物产生基因后对菌株代谢流分析表明敲除ackA-pta可显著增强乙醛酸途径生成丁二酸的结论一致[16]。随后敲除tdcDE及过表达glk,获得一株高产丁二酸菌株SX03,5 L罐发酵放大培养,乙酸产量为3.97 g/L,丁二酸得率为1.62 mol/mol葡萄糖,相比出发菌株
AFP111同等条件下乙酸产量下降了75.76%,丁二酸得率提高19.12%。Ma等通过基因改造获得重组菌株E. coli BA106,引入质粒以及使用IPTG诱导表达,3 L罐发酵MgCO3调节pH条件下,丁二酸得率为1.09 mol/mol葡萄糖[27],本研究的丁二酸得率与其相比具有发酵竞争优势。
基于经济考虑,为进一步降低生产成本,以NaOH和Na2CO3混合碱液为pH调节剂替换MgCO3,优化替换pH中和剂后厌氧发酵条件,优化结果为pH 6.8、转速250 r/min、发酵100 g/L葡萄糖,生成乙酸2.24 g/L,丁二酸得率为1.66 mol/mol葡萄糖,相比碱式MgCO3为pH中和剂乙酸产量下降了20.65%,丁二酸得率提高2.47%。由于pH中和剂的替换,每生产1 t丁二酸可降低生产成本2 000元左右。丁二酸得率相比Vemuri等的以Na2CO3为pH中和剂所获得的迄今最大丁二酸得率1.68 mol/mol葡萄糖相差不大[8],但本文改造菌株发酵未引入质粒及使用诱导剂IPTG,避免了由于质粒在长期发酵中易丢失,以及使用IPTG增加生产成本的问题,具有发酵竞争优势。
本研究首次对改造高产菌株进行100 L发酵罐发酵初试,乙酸产量为1.91 g/L,丁二酸得率为1.30 mol/mol葡萄糖。丁二酸得率高于赵锦芳等对基因改造Escherichia coli在15 L罐发酵,丁二酸得率的1.16 mol/mol葡萄糖[28],同时高于Li等对基因改造Escherichia coli在7 L罐发酵丁二酸得率的1.23 mol/mol葡萄糖[29]。
本研究构建了一株高产丁二酸大肠杆菌,降低了副产物乙酸含量,提高了丁二酸得率,完成5 L发酵罐工艺优化,获得了制备丁二酸较优的发酵工艺,降低了发酵法制备丁二酸成本;初步100 L罐发酵验证表明该菌株具有工业化应用潜质。虽然相比5 L罐发酵丁二酸得率下降,由于此时100 L罐发酵为初试阶段,后期可通过进一步对发酵工艺进行优化,推动进一步发酵放大。
| [1] |
Chen KQ, Jiang M, Wei P, et al. Kinetic models for anaerobic fermentation of butanedioic acid[J]. Journal of Chemical Industry and Engineering, 2008, 59(11): 2819-2823. (in Chinese) 陈可泉, 姜岷, 韦萍, 等. 厌氧发酵生产丁二酸的动力学模型[J]. 化工学报, 2008, 59(11): 2819-2823. DOI:10.3321/j.issn:0438-1157.2008.11.020 |
| [2] |
Yang RH, Yang XJ. Research progress of production technology on succinic acid[J]. Synthetic Technology and Application, 2015(2): 33-39. (in Chinese) 杨如惠, 杨效军. 丁二酸生产工艺技术进展[J]. 合成技术及应用, 2015(2): 33-39. DOI:10.3969/j.issn.1006-334X.2015.02.014 |
| [3] |
Yue FF, Jiang M, Ma JF, et al. Construction of engineered Escherichia coli for succinate production[J]. China Brewing, 2010, 29(2): 25-29. (in Chinese) 岳方方, 姜岷, 马江锋, 等. 产琥珀酸大肠杆菌工程菌株的构建[J]. 中国酿造, 2010, 29(2): 25-29. DOI:10.3969/j.issn.0254-5071.2010.02.007 |
| [4] |
Jiang M, Ma JF, Chen KQ, et al. The progress of recombinant Escherichia coli for production of succinic acid[J]. Microbiology China, 2008, 36(1): 120-124. (in Chinese) 姜岷, 马江锋, 陈可泉, 等. 重组大肠杆菌产琥珀酸研究进展[J]. 微生物学通报, 2008, 36(1): 120-124. DOI:10.3969/j.issn.0253-2654.2008.01.027 |
| [5] |
Wendisch VF, Bott M, Eikmanns BJ. Metabolic engineering of Escherichia coli and Corynebacterium glutamicum for biotechnological production of organic acids and amino acids[J]. Current Opinion in Microbiology, 2006, 9(3): 268-274. |
| [6] |
Stols L, Donnelly MI. Production of succinic acid through over-expression of NAD+-dependent malic enzyme in an Escherichia coli mutant[J]. Applied and Environmental Microbiology, 1997, 63(7): 2695-2701. |
| [7] |
Donnelly MI, Millard CS, Clark DP, et al. A novel fermentation pathway in an Escherichia coli mutant producing succinic acid, acetic acid, and ethanol[J]. Applied Biochemistry and Biotechnology, 1998, 70-72: 187-198. DOI:10.1007/BF02920135 |
| [8] |
Vemuri GN, Eiteman MA, Altman E. Succinate production in dual-phase Escherichia coli fermentations depends on the time of transition from aerobic to anaerobic conditions[J]. Journal of Industrial Microbiology and Biotechnology, 2002, 28(6): 325-332. DOI:10.1038/sj.jim.7000250 |
| [9] |
Lu J, Tang JL, Liu Y, et al. Combinatorial modulation of galP and glk gene expression for improved alternative glucose utilization[J]. Applied Microbiology and Biotechnology, 2012, 93(6): 2455-2462. DOI:10.1007/s00253-011-3752-y |
| [10] |
Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12): 6640-6645. DOI:10.1073/pnas.120163297 |
| [11] |
Tang JL, Zhu XN, Lu J, et al. Recruiting alternative glucose utilization pathways for improving succinate production[J]. Applied Microbiology and Biotechnology, 2013, 97(6): 2513-2520. DOI:10.1007/s00253-012-4344-1 |
| [12] |
Zhang XL, Jantama K, Moore JC, et al. Metabolic evolution of energy-conserving pathways for succinate production in Escherichia coli[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(48): 20180-20185. DOI:10.1073/pnas.0905396106 |
| [13] |
Jantama K, Zhang XL, Moore JC, et al. Eliminating side products and increasing succinate yields in engineered strains of Escherichia coli C[J]. Biotechnology and Bioengineering, 2008, 101(5): 881-893. DOI:10.1002/bit.v101:5 |
| [14] |
Abdel-Hamid AM, Attwood MM, Guest JR. Pyruvate oxidase contributes to the aerobic growth efficiency of Escherichia coli[J]. Microbiology, 2001, 147(6): 1483-1498. DOI:10.1099/00221287-147-6-1483 |
| [15] |
Liu ZW, Xue YP, Zhen YG. Controling acetic acid in recombinant Escherichia coli fermentations[J]. Bulletin of Fermentation Science and Technology, 2014, 43(2): 21-26. (in Chinese) 刘兆巍, 薛亚平, 郑裕国. 重组大肠杆菌发酵过程中乙酸的控制[J]. 发酵科技通讯, 2014, 43(2): 21-26. DOI:10.3969/j.issn.1674-2214.2014.02.006 |
| [16] |
Zhu LW, Li XH, Zhang L, et al. Activation of glyoxylate pathway without the activation of its related gene in succinate-producing engineered Escherichia coli[J]. Metabolic Engineering, 2013, 20: 9-19. DOI:10.1016/j.ymben.2013.07.004 |
| [17] |
Shen T, Wang JY. Biochemistry[M]. Beijing: Higher Education Press, 1990: 79. (in Chinese) 沈同, 王镜岩. 生物化学[M]. 北京: 高等教育出版社, 1990: 79. |
| [18] |
Meng G, Wei AY, Jia HP, et al. Construction of a tdcD gene deletion strain of Escherichia coli and the study of its application in L-tryptophan fermentation process with high glucose tolerance[J]. Bulletin of Fermentation Science and Technology, 2015, 44(2): 12-16. (in Chinese) 孟刚, 魏爱英, 贾慧萍, 等. 大肠杆菌tdcD基因缺失株的构建及其用于耐高糖L-色氨酸发酵的研究[J]. 发酵科技通讯, 2015, 44(2): 12-16. DOI:10.3969/j.issn.1674-2214.2015.02.003 |
| [19] |
Gosset G. Improvement of Escherichia coli production strains by modification of the phosphoenolpyruvate: sugar phosphotransferase system[J]. Microbial Cell Factories, 2005, 4: 14. DOI:10.1186/1475-2859-4-14 |
| [20] |
Lin H, Bennett GN, San KY. Effect of carbon sources differing in oxidation state and transport route on succinate production in metabolically engineered Escherichia coli[J]. Journal of Industrial Microbiology & Biotechnology, 2005, 32(3): 87-93. |
| [21] |
Podkovyrov SM, Zeikus JG. Purification and characterization of phosphoenolpyruvate carboxykinase, a catabolic CO2-fixing enzyme, from Anaerobiospirillum succiniciproducens[J]. Journal of General Microbiology, 1993, 139(2): 223-228. DOI:10.1099/00221287-139-2-223 |
| [22] |
Yang ZN, Jiang M, Li J, et al. Effects of different neutralizing agents on succinate production by Actinobacillus succinogenes NJ113[J]. Chinese Journal of Biotechnology, 2010, 26(11): 1500-1506. (in Chinese) 杨卓娜, 姜岷, 李建, 等. 不同pH调节剂对产琥珀酸放线杆菌NJ113发酵产丁二酸的影响[J]. 生物工程学报, 2010, 26(11): 1500-1506. |
| [23] |
Zheng P, Zhou W, Ni Y, et al. Environmental factors affecting the succinic acid production by Actinobacillus succinogenes CGMCC1593[J]. Chinese Journal of Biotechnology, 2008, 24(6): 1051-1055. (in Chinese) 郑璞, 周威, 倪晔, 等. 环境因素对琥珀酸放线杆菌Actinobacillus succinogenes CGMCC1593发酵生产丁二酸的影响[J]. 生物工程学报, 2008, 24(6): 1051-1055. DOI:10.3321/j.issn:1000-3061.2008.06.024 |
| [24] |
Chen KQ, Jiang M, Su L, et al. CO2 fixation by Actinobacillus succinogenes in succinic acid production[J]. Chemical Engineering, 2009, 37(1): 49-52. (in Chinese) 陈可泉, 姜岷, 苏溧, 等. 产琥珀酸放线杆菌固定CO2制备丁二酸[J]. 化学工程, 2009, 37(1): 49-52. |
| [25] |
Jantama K, Haupt MJ, Svoronos SA, et al. Combining metabolic engineering and metabolic evolution to develop nonrecombinant strains of Escherichia coli C that produce succinate and malate[J]. Biotechnology and Bioengineering, 2008, 99(5): 1140-1153. DOI:10.1002/(ISSN)1097-0290 |
| [26] |
Chatterjee R, Millard CS, Champion K, et al. Mutation of the ptsG gene results in Increased production of succinate in fermentation of glucose by Escherichia coli[J]. Applied and Environmental Microbiology, 2001, 67(1): 148-154. DOI:10.1128/AEM.67.1.148-154.2001 |
| [27] |
Ma JF, Gou DM, Liang LY, et al. Enhancement of succinate production by metabolically engineered Escherichia coli with co-expression of nicotinic acid phosphoribosyltransferase and pyruvate carboxylase[J]. Applied Microbiology and Biotechnology, 2013, 97(15): 6739-6747. DOI:10.1007/s00253-013-4910-1 |
| [28] |
Zhao JF, Hua BW, Wang YZ, et al. The construction and anaerobic fermentation of high yield succinic acid recombinant Escherichia coli[J]. Food and Fermentation Industries, 2013, 39(1): 6-10. (in Chinese) 赵锦芳, 华渤文, 王永泽, 等. 高产琥珀酸重组大肠杆菌的构建及厌氧发酵[J]. 食品与发酵工业, 2013, 39(1): 6-10. |
| [29] |
Li YK, Li MJ, Zhang X, et al. A novel whole-phase succinate fermentation strategy with high volumetric productivity in engineered Escherichia coli[J]. Bioresource Technology, 2013, 149: 333-340. DOI:10.1016/j.biortech.2013.09.077 |
 2018, Vol. 45
2018, Vol. 45