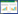扩展功能
文章信息
- 王萍, 董俊芳, 邹清华
- WANG Ping, DONG Jun-Fang, ZOU Qing-Hua
- 利用Red重组系统敲除鼠伤寒沙门氏菌Ⅵ型分泌系统相关基因
- Knockout of hcp genes in Salmonella typhimurium by Red recombination system
- 微生物学通报, 2018, 45(11): 2529-2536
- Microbiology China, 2018, 45(11): 2529-2536
- DOI: 10.13344/j.microbiol.china.171050
-
文章历史
- 收稿日期: 2017-12-14
- 接受日期: 2018-04-16
- 网络首发日期(www.cnki.net): 2018-05-28
沙门氏菌是一种重要的食源性病原菌[1],可导致腹泻、伤寒和副伤寒。大多数人通常持续4−7 d后无需治疗即可自愈[2],而急性沙门氏菌感染会致命,在美国每年约400人因急性沙门氏菌感染而死亡。鼠伤寒沙门氏菌是近几年报道频率较高的血清型[3]之一,可引起人类腹泻以及小鼠的系统性疾病,常被用作研究伤寒症的疾病模型[4]。
Ⅵ型分泌系统(The type Ⅵ secretion system,T6SS)是一种在霍乱弧菌(Vibrio cholerae)中首次被鉴定出来的细菌分泌系统[5],广泛存在于革兰氏阴性菌中[6]。T6SS一般包括13个基因序列较为保守的核心基因编码的核心组分,此外也包含一些非核心基因编码的组分和游离在T6SS外的孤岛(Orphan)基因编码的组分。研究发现T6SS在细菌间的竞争[7]、细菌对真核细胞(阿米巴原虫[8]、巨噬细胞[3]、酵母菌[9]等)的抗吞噬作用以及细菌对动植物宿主的致病性[5, 10]等方面均发挥了重要作用。T6SS尾复合体内管部分的溶血素共调节蛋白(Hemolysin- coregulated protein,Hcp)既可以作为构成内管的结构蛋白,负责效应蛋白的传递,同时Hcp蛋白本身又可以作为一种效应蛋白,在靶细胞的定殖方面起重要的作用。鼠伤寒沙门氏菌拥有3种Hcp蛋白,分别由位于毒力岛6 (Salmonella pathogenicity island,SPI6)上的STM14_0324和STM14_0327以及位于毒力岛之外的孤岛上的STM14_3785编码。目前对这3种Hcp蛋白的功能尚无较清楚的阐述。
基因敲除技术在研究沙门氏菌致病机制方面具有重要的作用。目前最常用的研究方法是自杀质粒介导的同源重组[11]。自杀质粒主要采用温度敏感型质粒pHSG415[11],它在较高温度条件下不复制,而在28 ℃会进行滚环复制从而使基因重组,但重组后的基因有可能被敲除,也有可能回复为野生型的状态。因此使用这种同源重组方式重组效率不高,耗时也较长。Red重组系统是近些年发展起来的一种敲除系统,Datsenko等[12]首次将Red重组系统用于大肠杆菌的基因敲除,该系统需要pKD46、pKD4和pCP20三种质粒。pKD46包含3个关键基因,它们的编码产物有利于线性DNA插入基因组,防止线性DNA降解;pKD4包含抗性基因并且两侧含有FRT位点;而pCP20携带基因的编码产物可特异性识别FRT位点,导致抗性基因片段环化,最终将抗性基因消除。Red同源重组技术具有所需同源序列短、无需构建重组质粒的特点[13],目前已较为广泛地应用于易于制作感受态的细菌如大肠杆菌的基因敲除。在沙门氏菌中此方法尚未完全建立。本研究拟通过优化Red重组系统的条件,对鼠伤寒沙门氏菌的hcp基因进行敲除,从而建立一套方便可行的方法用于沙门氏菌的基因敲除。
1 材料与方法 1.1 材料 1.1.1 菌株和质粒野生型菌株14028S,基因缺失菌株14028S Δhcp1、14028SΔhcp2,实验所需质粒pKD46、pKD4和pCP20,均为实验室保存。本研究所构建菌株为14028SΔhcp3、Δhcp1Δhcp2、Δhcp1Δhcp3、Δhcp2 Δhcp3以及Δhcp1Δhcp2Δhcp3,如表 1所示。
| 菌株和质粒 Bacteria strains and plasmids |
描述及特征 Characteristics |
来源 References |
| Strains | ||
| S. typhimurium 14028S | S. typhimurium 14028S wild type | Preserved by our lab |
| 14028SΔhcp1 | S. typhimurium 14028S STM14_0324 (Hcp 1) gene knock-out mutant | Preserved by our lab |
| 14028SΔhcp2 | S. typhimurium 14028S STM14_0327 (Hcp 2) gene knock-out mutant | Preserved by our lab |
| 14028SΔhcp3 | S. typhimurium 14028S STM14_3785 (Hcp 3) gene knock-out mutant | Constructed by this study |
| 14028SΔhcp1Δhcp2 | S. typhimurium 14028S STM14_0324 and STM14_0327 gene knock-out mutant | Constructed by this study |
| 14028SΔ hcp1Δhcp3 | S. typhimurium 14028S STM14_0324 and STM14_3785 gene knock-out mutant | Constructed by this study |
| 14028SΔhcp2Δhcp3 | S. typhimurium 14028S STM14_3785 and STM14_0327 gene knock-out mutant | Constructed by this study |
| 14028SΔhcp1Δhcp2Δhcp3 | S. typhimurium 14028S STM14_0324, STM14_0327 and STM14_3785 gene knock-out mutant | Constructed by this study |
| Plasmids | ||
| pKD46 | AmpR | Preserved by our lab |
| pKD4 | KanR, AmpR | Preserved by our lab |
| pCP20 | AmpR | Preserved by our lab |
细菌基因组DNA提取试剂盒,北京百泰克生物技术有限公司;SanPrep柱式PCR产物纯化试剂盒、SanPrep柱式胶回收试剂盒、氨苄西林(Ampicillin,Amp)、氯霉素(Chloramphenicol,Cam)和卡那霉素(Kanamycin,Kana),生工生物工程(上海)股份有限公司;AxyPrep DNA Plasmid Miniprep Kit 250-prep,Axygen生物公司;限制性内切酶,大连宝生物有限责任公司;LB肉汤(LB broth)和LB琼脂(LB agar)培养基,北京陆桥技术有限责任公司。
台式高速离心机,贺利氏控股集团;PCR热循环仪,Eppendorf公司;凝胶成像仪、电热恒温水浴槽,北京市医疗设备总厂;DYY-5型稳压稳流电泳仪,北京市六一仪器厂;THZ-C恒温振荡器,江苏培英仪器设备公司;MicroPulser电击仪及电击杯,Bio-Rad公司。
1.2 实验方法 1.2.1 引物设计根据NCBI公布的鼠伤寒沙门氏菌14028S的全基因组序列(GenBank序列号为CP001363.1),分别查找所需敲除靶基因的位置,由于本实验室已拥有Δhcp1与Δhcp2菌株,因此查找了hcp1基因(STM14_0324)与hcp3基因(STM14_3785)所在位置,选取了其前后各56 bp作为引物的同源片段,并分别在引物3′端加上了扩增质粒pKD4卡那霉素抗性基因的上、下游引物序列。鉴定引物选取目的基因前后序列中G+C%含量适宜的20 bp碱基序列,最终引物序列如表 2所示。
| 引物名称 Primers name |
序列 Sequences (5′→3′) |
| Hcp1-F | AAAAGATATAGATAAAATCAGGTTTATTTTAAGTAAAACTTAATAAGGATATAAAAGTGTAGGCTGGAGCTGCTTC |
| Hcp1-R | TAAAATCAAAACAATAAAACCAGCCAGACATAACATCTGGCCGGAAAAACAGCCGCATATGAATATCCTCCTTAG |
| Hcp3-F | GCCGCCGGTATTCGTCTGGCTGCTGAACTGCCACCTGATCAACAAGGAGATAAATCGTGTAGGCTGGAGCTGCTTC |
| Hcp3-R | TATCCCCTCAACCAAGAGCCTGTCGAATAGCGCGACCGGAATGGTTGGTGTCATCACATATGAATATCCTCCTTAG |
| Hcp1-jdF | TGACGCAACCAATACCTGCT |
| Hcp1-jdR | CAGCCAGACATAACATCTGGC |
| Hcp2-jdF | GCATACGTTCTCTTGCTCTG |
| Hcp2-jdR | TACGCCATTCATTCACTGTA |
| Hcp3-jdF | TTGCGTCGTACCAATTCATG |
| Hcp3-jdR | ATAAGAGTCACAAGCGCTGG |
| 注:划线片段为同源序列. Note: The underlined sequences are homologous sequences. |
|
以质粒pKD4或其稀释产物为模板,利用Hcp1或Hcp3的引物对,用高保真酶进行PCR扩增。PCR反应体系:模板1 μL,上、下游引物(10 μmol/L)各4 μL,2×Pfu buffer mix 50 μL,去离子水41 μL。PCR反应条件:94 ℃ 3 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 4 min,35个循环;72 ℃ 5 min。利用胶回收试剂盒对PCR产物进行回收。
1.2.3 感受态的制备以及质粒pKD46的电转化需要敲除基因的靶细菌于37 ℃培养过夜,次日取60 μL于3 mL LB液体培养基中,37 ℃、300 r/min培养3 h,立刻置冰水浴中30 min,随后在4 ℃、4 000 r/min离心10 min,弃上清,用预冷的去离子水洗涤2次,再用10%的预冷甘油洗涤1次,加300 μL甘油重悬细胞并分装。将1−2 μL pKD46质粒加入需要转化的感受态细菌悬液内,混匀置于冷的电击杯内,选择EC1模式,电击后加入800 μL LB培养液。将细菌于30 ℃、200 r/min下培养1 h,在含有50 μg/mL氨苄青霉素抗性的平板上均匀涂板,30 ℃培养过夜后对长出的菌落提取质粒进行鉴定。
1.2.4 Red重组酶的诱导表达以及同源片段的电转化将鉴定正确的含pKD46的菌培养过夜,取60 μL于3 mL液体LB培养基中,37 ℃、300 r/min培养1.5 h后加入L-阿拉伯糖(使其终浓度为100 mmol/L),继续培养1.5 h诱导Red重组酶表达。将培养物置于冰水中预冷30 min,再按照1.2.3中的方法制备感受态。取5 μL含有目的片段前后各56 bp同源片段的中间为卡那霉素抗性基因的PCR扩增产物与感受态细胞混匀,进行电转化,于30 ℃、200 r/min培养1 h,将培养物涂布于含有50 μg/mL卡那霉素的LB琼脂平皿上30 ℃培养过夜。选取长出的单菌落提取DNA后用鉴定引物进行PCR扩增鉴定。
1.2.5 质粒pKD46的消除将鉴定正确的菌在42 ℃、180 r/min培养15 h,梯度稀释后于37 ℃培养过夜获得单菌落。将单菌落分别用含卡那霉素或氨苄青霉素的平板上培养,选取在卡那霉素平板上生长,在氨苄青霉素平板上不生长的菌落,进行下一步实验。
1.2.6 卡那霉素抗性基因的消除按照1.2.3中的方法将消除掉pKD46的菌株制作成感受态,电转化转入5 mL的pCP20,在含有氨苄青霉素的LB平板上30 ℃培养24 h。对长出的菌落提取质粒确定pCP20转入情况。将转入pCP20的菌转接到无抗生素的LB液体培养基中,42 ℃培养12 h,梯度稀释后培养获得单菌落,挑取单菌落分别涂到含卡那霉素的平板及不含抗生素的平板上,选取卡那霉素敏感的菌落进行下一步实验。
1.2.7 质粒pCP20的消除将消除掉卡那霉素抗性的菌株于42 ℃、180 r/min培养15 h,梯度稀释,选取稀释106和108的菌液涂平板,37 ℃培养过夜后分别将单菌落在无抗生素以及含卡那霉素的LB平板和含氨苄青霉素的LB平板上划线,37 ℃培养过夜,挑取在无抗生素平板上生长,在含卡那霉素和氨苄青霉素的LB平板上均不生长的菌落,即为目的基因敲除成功的菌,进行测序鉴定。
2 结果与分析 2.1 Hcp1与Hcp3同源片段扩增结果PCR扩增出来的片段应为两端各有56 bp与hcp1及hcp3基因同源,中间为质粒pKD4上2个FRT位点前后20 bp之间的包括卡那霉素抗性基因的序列,最终应扩增出1 589 bp片段,琼脂糖凝胶电泳显示扩增产物大小正确。
2.2 质粒pKD46的转化将pKD46电转化导入目的细菌后提取的质粒进行酶切鉴定,pKD46长度为6 329 bp,单酶切后电泳结果显示出现预期长度条带。
2.3 同源片段转化与重组将同源片段电转化到含有pKD46的目的菌后,挑取卡那霉素平板上长出的单菌落,用位于目的基因两侧的鉴定引物进行PCR鉴定。如果重组成功,hcp1被卡那霉素基因替代后用鉴定引物扩增的片段长度应为1 860 bp,未被卡那霉素基因替代的hcp1应为869 bp。结果发现,直接以pKD4为模板扩增出来的同源片段电转化时假阳性结果较为显著(图 1A)。挑取的20个菌落仅有1个菌落同源片段重组成功,其他19个菌落的目的基因并未被卡那霉素基因所代替,其卡那霉素抗性应该是PCR时作为模板的pKD4转入所导致。于是将pKD4稀释10倍后作为模板进行PCR扩增,用得到的同源片段进行电转化,结果发现能显著降低假阳性率(图 1B)。挑取的9个菌落均重组成功。利用稀释后的质粒作为模板的同源重组方法,以14028S WT、14028SΔhcp1以及14028SΔhcp2为亲本,敲除hcp3;以14028SΔhcp2为亲本,敲除hcp1;Δhcp1Δhcp2及Δhcp2Δhcp3为亲本,分别敲除hcp3及hcp1,均得到预期结果。将PCR产物进行测序后结果显示目的基因敲除成功,卡那霉素抗性基因成功插入。
|
| 图 1 单菌落PCR鉴定结果 Figure 1 PCR results of individual colonies 注:M:Marker;1:阴性对照. A:直接以pKD4为模板的扩增产物电转化后单菌落PCR鉴定结果,2−20:挑取单菌落进行PCR后琼脂糖凝胶电泳结果,其中仅16号为同源重组成功的菌,其他均为pKD4转入导致的假阳性. B:以稀释10倍的pKD4为模板的扩增产物电转化后单菌落鉴定结果,2:hcp3未敲除株对照;3:hcp1未敲除株对照;4−12:挑取单菌落进行PCR后琼脂糖凝胶电泳结果,显示均重组成功. Note: M: Marker; 1: Negative control. A: PCR results of the colonies using pKD4 as template, 2−20: PCR results of the colonies, number 16 is the only colony with hcp1 knocked out successfully. B: PCR results of the colonies using 10-fold diluted pKD4 as template, 2: hcp3 positive control; 3: hcp1 positive control; 4−12: PCR results of the colonies. |
|
|
pKD46是一种温度敏感型质粒,在30 ℃时能正常复制,而在42 ℃时丢失,丢失质粒的菌在含有氨苄青霉素的环境中无法增殖。将细菌在42 ℃培养15 h后对菌液梯度稀释涂板,过夜培养后挑取单菌落,分别在含氨苄青霉素和卡那霉素的LB培养基内继续培养,筛选到了在含有氨苄青霉素的培养基内无法生长,而在含卡那霉素的培养基内能明显生长的菌落,表明此菌落中的质粒被消除,保存菌株并进行后续实验。
2.5 卡那霉素抗性基因的消除及质粒pCP20的消除将消除pKD46的菌株电转化导入质粒pCP20,在含有氨苄青霉素的培养基中培养,提取质粒后在10 000 bp左右有条带出现,质粒长度为9 332 bp,因此认为质粒转化成功。
质粒pCP20是一个温度敏感型质粒,因此转化入pCP20的菌株按消除pKD46的方法操作,最终分别在无抗生素平板、含氨苄青霉素的平板以及含卡那霉素的平板上进行鉴定,仅在不含抗生素平板上生长,在含氨苄青霉素的平板以及含卡那霉素的平板上均不能生长的菌落为pCP20消除成功的菌落。
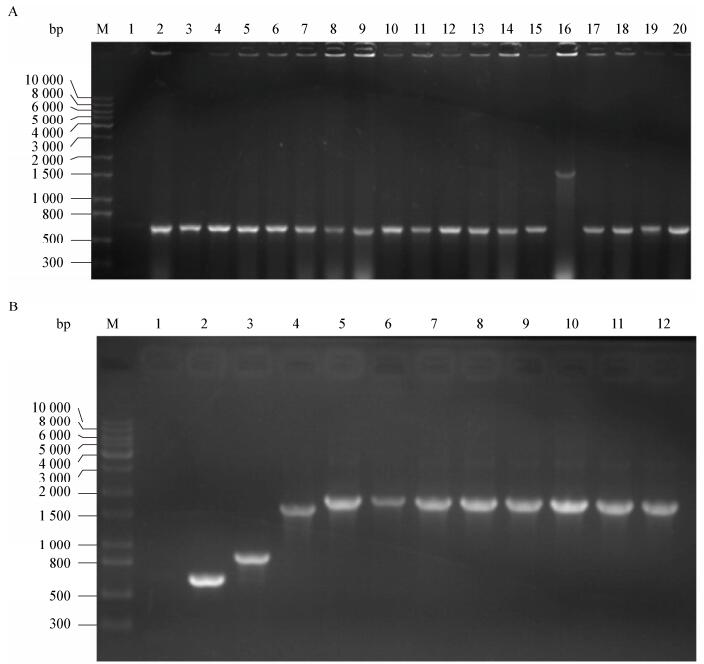
2.6 缺失菌株的PCR鉴定将鉴定正确的菌用鉴定引物进行PCR扩增,琼脂糖凝胶电泳确认。基因敲除成功且抗性基因也消除后,Δhcp1扩增结果应为427 bp,Δhcp3扩增结果应为191 bp,图 2显示了部分基因缺失菌株的PCR鉴定结果,结果显示均鉴定正确。对PCR产物进行测序确认,结果显示目的基因敲除成功。
|
| 图 2 基因敲除后PCR扩增结果 Figure 2 PCR results of gene knock-out strains 注:M:Marker;1:阴性对照;2:hcp1未敲除株对照;3:hcp3未敲除株对照;4、5、6、7:分别为Δhcp3、Δhcp1Δhcp2、Δhcp1Δhcp3、Δhcp2Δhcp3 PCR扩增结果. Note: M: Marker; 1: Negative control; 2: hcp1 positive control; 3: hcp3 positive control; 4, 5, 6, 7: PCR results of gene knock-out strains Δhcp3, Δhcp1Δhcp2, Δhcp1Δhcp3, Δhcp2Δhcp3. |
|
|
目前,虽然Red重组系统已经广泛应用于多种细菌如大肠杆菌的基因敲除中,但因为沙门氏菌生理特征与大肠杆菌差异较大,应用范围不如大肠杆菌。本实验通过优化Red重组系统的条件成功构建了沙门氏菌的缺失株。在实验过程中,我们认为有以下注意事项以及改进措施可用作沙门氏菌基因敲除的参考。
3.1 同源片段的长度选择及假阳性的降低目前通过Red重组系统进行基因敲除时设计的同源片段通常在40−60 bp左右,张雪等在对大肠杆菌进行基因修饰时发现,若是将同源重组片段设计为56 bp则可以显著降低假阳性[14],另外有研究发现在大肠杆菌中提高同源片段长度(每侧280 bp)也能显著降低假阳性[15]。本实验室曾经使用40 bp的同源重组片段进行基因敲除,但成功率极低。考虑到280 bp片段较长,虽然可能增加成功率,但同时也会提高实验的复杂程度。本实验将同源片段设置为56 bp,发现转化后可获得上百个单克隆,重组效率比较理想,因此推荐使用56 bp作为沙门氏菌基因敲除的同源片段碱基数。
在用质粒pKD4作为模板进行PCR扩增后发现pKD4极易造成干扰,假阳性较为显著。由于提取的质粒一般都会有甲基化修饰,而扩增的线性化片段则没有,因此有文献建议通过Dpn Ⅰ酶对最终PCR产物进行酶切以去除模板质粒[16],避免太多假阳性结果。本实验通过将模板质粒稀释10倍后进行PCR扩增,之后对扩增的产物切胶回收再进行电击转化,发现假阳性明显降低。
3.2 含pKD46菌株感受态的制备及保存转化目的片段前需要用L-阿拉伯糖诱导质粒pKD46的重组酶,Serra-Moreno等[15]发现在制作含pKD46细菌的感受态前1.5 h用100 mmol/L的L-阿拉伯糖处理,线性片段转化的成功率更高。李伟星等[17]在对大肠杆菌转化pKD46时发现,制作感受态后置于−70 ℃保存对后续电转化并无影响,与本研究观察到的现象一致。但在用L-阿拉伯糖诱导pKD46产生重组酶后制作的感受态需要立即电转化,存入−80 ℃一段时间后电转化成功率明显下降。
3.3 质粒转化后培养温度的选择本研究在转化pKD46与pCP20后,将细菌均放置在质粒复制最适温度30 ℃下培养,但文献[15]分别进行30 ℃及37 ℃培养后发现,在37 ℃下细菌的生长速度更快。为了严格控制实验条件,本研究选择了30 ℃。
3.4 温度敏感型质粒的消除消除Red重组系统中的温度敏感型质粒一般都是在42 ℃或是43 ℃培养6 h,但文献[18]培养时间为15 h,本研究分别对培养6 h和15 h的菌进行了鉴定,发现培养15 h后质粒消除的概率明显升高。此外,培养菌时加抗生素与不加抗生素效果也存在差异:转入目的片段后菌具有卡那霉素抗性,为了使菌株保持其抗性,在消除质粒pKD46时,本研究用含卡那霉素与不含卡那霉素的培养基分别将菌培养相同的时间,鉴定后发现含卡那霉素培养基培养出来的细菌中质粒pKD46的消除率较低,可能是细菌在有抗生素的环境下产生了某种保护机制,使pKD46较难消除。
本实验成功构建了鼠伤寒沙门氏菌14028S菌株Hcp蛋白相关基因的缺失株,这些菌株的获得为进一步研究3种Hcp蛋白的功能奠定了基础。
| [1] |
Scallan E, Mahon BE. Foodborne diseases active surveillance network (FoodNet) in 2012: a foundation for food safety in the United States[J]. Clinical Infectous Diseases, 2012, 54(S5): S381-S384. |
| [2] |
Besser JM. Salmonella epidemiology: A whirlwind of change[J]. Food Microbiology, 2018, 71: 55-59. DOI:10.1016/j.fm.2017.08.018 |
| [3] |
Kariuki S, Revathi G, Kariuki N, et al. Characterisation of community acquired non-typhoidal Salmonella from bacteraemia and diarrhoeal infections in children admitted to hospital in Nairobi, Kenya[J]. BMC Microbiology, 2006, 6: 101. DOI:10.1186/1471-2180-6-101 |
| [4] |
Marcus SL, Brumell JH, Pfeifer CG, et al. Salmonella pathogenicity islands: big virulence in small packages[J]. Microbes and Infection, 2000, 2(2): 145-156. DOI:10.1016/S1286-4579(00)00273-2 |
| [5] |
Pukatzki S, Ma AT, Sturtevant D, et al. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(5): 1526-1533. |
| [6] |
Suarez G, Sierra JC, Kirtley ML, et al. Role of Hcp, a type 6 secretion system effector, of Aeromonas hydrophila in modulating activation of host immune cells[J]. Microbiology, 2010, 156(Pt 12): 3678-3688. |
| [7] |
Sana TG, Flaugnatti N, Lugo KA, et al. Salmonella typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut[J]. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(34): E5044-E5051. DOI:10.1073/pnas.1608858113 |
| [8] |
Riquelme S, Varas M, Valenzuela C, et al. Relevant genes linked to virulence are required for Salmonella typhimurium to survive intracellularly in the social amoeba Dictyostelium discoideum[J]. Frontiers in Microbiology, 2016, 7: 1305. |
| [9] |
Haapalainen M, Mosorin H, Dorati F, et al. Hcp2, a secreted protein of the phytopathogen Pseudomonas syringae pv. tomato DC3000, is required for fitness for competition against bacteria and yeasts[J]. Journal of Bacteriology, 2012, 194(18): 4810-4822. DOI:10.1128/JB.00611-12 |
| [10] |
Peng Y, Wang XR, Shou J, et al. Roles of Hcp family proteins in the pathogenesis of the porcine extraintestinal pathogenic Escherichia coli type Ⅵ secretion system[J]. Scientific Reports, 2016, 6: 26816. DOI:10.1038/srep26816 |
| [11] |
White AP, Collinson SK, Burian J, et al. High efficiency gene replacement in Salmonella enteritidis: chimeric fimbrins containing a T-cell epitope from Leishmania major[J]. Vaccine, 1999, 17(17): 2150-2161. DOI:10.1016/S0264-410X(98)00491-5 |
| [12] |
Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products[J]. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12): 6640-6645. DOI:10.1073/pnas.120163297 |
| [13] |
Hu K, Shi ZX, Sai DJ, et al. The red recombination system and its application to gene knock-out in microorganism[J]. Hereditas (Beijing), 2003, 25(5): 628-632. (in Chinese) 胡堃, 史兆兴, 赛道建, 等. Red重组系统及在微生物基因敲除中的应用[J]. 遗传, 2003, 25(5): 628-632. DOI:10.3321/j.issn:0253-9772.2003.05.030 |
| [14] |
Zhang X, Wen TY. Advances of red recombination system in Escherichia coli gene modification[J]. China Biotechnology, 2008, 28(12): 89-93. (in Chinese) 张雪, 温廷益. Red重组系统用于大肠杆菌基因修饰研究进展[J]. 中国生物工程杂志, 2008, 28(12): 89-93. |
| [15] |
Serra-Moreno R, Acosta S, Hernalsteens JP, et al. Use of the lambda Red recombinase system to produce recombinant prophages carrying antibiotic resistance genes[J]. BMC Molecular Biology, 2006, 7: 31. DOI:10.1186/1471-2199-7-31 |
| [16] |
Li Y, Zhang XX, Guo MZ, et al. Deletion of sopB gene of Salmonella typhimurium LT2 by λRed recombination system[J]. Biotechnology Bulletin, 2014(9): 171-177. (in Chinese) 李晔, 张西轩, 郭梦征, 等. 利用λRed重组系统敲除鼠伤寒沙门氏菌sopB基因[J]. 生物技术通报, 2014(9): 171-177. |
| [17] |
Li WX, Zhang L, Wang Y, et al. Study on the efficiency of transforming pKD46 into competent cells from Escherichia coli K12[J]. Hubei Agricultural Sciences, 2010, 49(8): 1803-1806. (in Chinese) 李伟星, 张力, 王扬, 等. 不同条件对大肠杆菌K12转化质粒pKD46效率研究[J]. 湖北农业科学, 2010, 49(8): 1803-1806. DOI:10.3969/j.issn.0439-8114.2010.08.004 |
| [18] |
Lü XL. Construction of three major pathogenicity islands deleted-mutants of Salmonella enterica serovar Enteritidis and evaluation of their immune efficacy in chickens[D]. Daqing: Master's Thesis of Heilongjiang Bayi Agricultural University, 2015 (in Chinese) 吕雪莲.肠炎沙门氏菌三种主要毒力岛基因缺失株的构建及其免疫效力研究[D].大庆: 黑龙江八一农垦大学硕士学位论文, 2015 http://cdmd.cnki.com.cn/Article/CDMD-10223-1015587727.htm |
 2018, Vol. 45
2018, Vol. 45