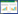扩展功能
文章信息
- 李巧玉, 陈坚, 曾伟主, 方芳
- LI Qiao-Yu, CHEN Jian, ZENG Wei-Zhu, FANG Fang
- 酱醪中魏斯氏菌的分离及特性分析
- Isolation and characterization of Weissella strains from soy sauce moromi mash
- 微生物学通报, 2018, 45(11): 2449-2462
- Microbiology China, 2018, 45(11): 2449-2462
- DOI: 10.13344/j.microbiol.china.171068
-
文章历史
- 收稿日期: 2017-12-21
- 接受日期: 2018-03-27
- 网络首发日期(www.cnki.net): 2018-04-12
2. 食品科学与技术国家重点实验室 江南大学 江苏 无锡 214122;
3. 粮食发酵工艺与技术国家工程实验室 江南大学 江苏 无锡 214122
2. State Key Laboratory of Food Science and Technology, Jiangnan University, Wuxi, Jiangsu 214122, China;
3. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi, Jiangsu 214122, China
酱油是一种传统调味品,它与人们的生活息息相关[1]。酱油发酵是一个多种微生物共同作用的混菌发酵过程。传统酱油酿造是以大豆和小麦为主要原料,经过微生物及其酶系的长期作用,赋予了酱油良好的风味和丰富的营养[2-3]。微生物种群对于酱油的发酵进程和风味物质合成具有重要影响,它们是酱油发酵的核心[4-5]。因此,系统解析与微生物物质代谢相关的酱油发酵和食品组分合成机制,有助于利用生物技术进行发酵过程优化控制,从而保证酱油产品品质的稳定和提高其食品安全性[6-7]。
魏斯氏菌是一类重要的乳酸菌,存在于酱油、泡菜、豆豉、香肠等发酵食品中,在发酵食品中具有广泛的应用价值[8-9]。魏斯氏菌在食品发酵过程中可增加食品中有机酸、短链脂肪酸、酯类等风味物质含量[10]。它们在食品发酵过程中产生的纤维素也赋予食品具有降血液中胆固醇和控制体重的作用[11-12]。魏斯氏菌也是高盐稀态酱油发酵过程细菌中的优势菌属[13],目前对魏斯氏菌在酱油发酵过程中的功能尚不完全清楚[14]。随着生活水平的提高,人们对食品安全的关注日益增加。发酵食品在加工过程中,由于微生物对氮源的不彻底利用,会产生氨(胺)类危害物,对食品安全有潜在的影响。生物胺广泛存在于各类发酵食品中,在酱油中的含量也较高[7, 15]。国际上规定食品中组胺的含量应低于500 mg/kg,而目前市售的部分酱油中组胺的总含量超过标准[16]。氨基甲酸乙酯是一种可致癌的氨(胺)类危害物,它由微生物利用氮源的代谢产物(尿素、瓜氨酸等,氨基甲酸乙酯的前体)与乙醇反应生成[17]。因此分析酱醪来源魏斯氏菌与氨(胺)类危害物合成和积累的关系,对于在酱油发酵过程中合理利用或控制魏斯氏菌具有重要指导意义[18]。
本研究以高盐稀态酱油为研究对象,通过分离优势魏斯氏菌属的菌株以及考察菌株的生理生化特性,解析其与酱油发酵过程物质合成与代谢的关系,为魏斯氏菌在发酵食品中的应用提供理论依据。
1 材料与方法 1.1 实验材料 1.1.1 酱醪样品本研究所用高盐稀态酱油(1-20 d,15 ℃,21-120 d,30 ℃;第20天添加鲁氏接合酵母)的酱醪样品取自广东珠江桥生物科技股份有限公司的酱油晒罐。获得的发酵0-120 d酱醪样品保存于-80 ℃,用于菌株分离和微生物宏基因组制备。
1.1.2 菌株融合魏斯氏菌(Weissella confusa)、类肠膜魏斯氏菌(Weissella paramesenteroides)和食窦魏斯氏菌(Weissella cibaria),由本实验室分离。
1.1.3 培养基MRS培养基(g/L):蛋白胨10.0,牛肉粉5.0,酵母粉4.0,葡萄糖20.0,磷酸氢二钾2.0,乙酸钠5.0,柠檬酸三铵2.0,硫酸镁0.2,硫酸锰0.1,吐温80 1.0 mL/L。
精氨酸利用培养基(g/L):酵母膏5.0,牛肉膏5.0,NaCl 180.0,葡萄糖0.5,硫酸镁0.2,硫酸锰0.1,硫酸铁0.4,碳酸钙0.1,磷酸氢二钾2.0,精氨酸5.0,吐温80 1.0 mL/L。
魏斯氏菌分离培养基(g/L):MRS培养基,万古霉素0.2,那他霉素0.1。
产胞外多糖检测培养基(g/L)[19-20]:添加10% (质量体积比)蔗糖的MRS培养基。
产短链脂肪酸检测培养基(g/L)[21]:葡萄糖20.0,可溶性淀粉10.0,酵母膏10.0,蛋白胨10.0,吐温80 1.0 mL/L,氯化钠180.0。
1.1.4 主要试剂和仪器PCR用DNA聚合酶PrimeSTAR® Max DNA Polymerase和SYBR® Premix ExTaqTM Ⅱ均购自宝生物有限公司;核酸浓度检测用Qubit® dsDNA HS试剂盒购自赛默飞世尔科技有限公司;宏基因组提取试剂盒Power Max® Soil DNA Isolation Kit购自安必胜科技有限公司;万古霉素和那他霉素购自青岛宝博生物科技有限公司;组胺、酪胺、尸胺、腐胺、色胺、苯乙胺、精胺、亚精胺、氨基酸混合标准品、丹磺酰氯、2-辛醇和邻苯二甲醛(OPA)购自西格玛有限公司;其他试剂购自国药集团化学试剂有限公司。
红外光谱仪购自尼高力仪器公司;荧光定量PCR仪购自罗氏有限公司;气相色谱质谱联用仪购自岛津公司;高效液相色谱仪购自安捷伦公司;酶标仪和超微量分光光度计购自赛默飞世尔科技有限公司。
1.2 实验方法 1.2.1 魏斯氏菌的分离及筛选使用含万古霉素(0.2 g/L)和那他霉素(0.1 g/L)的MRS培养基从酱醪中分离和筛选魏斯氏菌[22]。选取发酵第7、14、25天的酱醪样品,取15 g酱醪置于烧杯中,加入135 mL无菌生理盐水并加入适量的玻璃珠,100 r/min振荡5 min,室温静置5 min后取1 mL菌悬液,将菌液梯度稀释涂布,37 ℃静置培养1-3 d[23]。
1.2.2 菌株鉴定提取分离得到菌株的基因组DNA,用细菌16S rRNA基因通用引物27F (5′-AGAGTTTGATCCTG GCTCAG-3′)和1492R (5′-GGTTACCTTGTTACGA CTT-3′),recN基因引物recNR (5′-GCTCTGAAG TGATTTTATCTGACA-3′)和recNF (5′-AACCATG CGGTTGTTGGTA-3′)扩增菌株的16S rRNA基因和recN基因(可用于魏斯氏菌种间鉴定)[24]。扩增产物送至生工生物工程(上海)股份有限公司进行测序,测序结果与NCBI数据库中序列进行比对分析,用MEGA 6.0软件构建进化树[25],确定菌株的属种。
1.2.3 菌株耐环境胁迫能力分析将菌株接种于MRS液体培养基,37 ℃静置培养24 h,取1 mL菌液10 000 r/min离心10 min。用浓度为0.8% (质量体积比)的无菌生理盐水清洗2遍,以1 mL无菌水重悬浮后,将菌液按10% (质量体积比)的接种量添加到含18% (质量体积比) NaCl的MRS培养基中,以0、12、24、36、72、240 h取样梯度稀释涂平板计活菌数[26-27]。
将菌株接种于MRS液体培养基,37 ℃静置培养24 h,取1 mL菌液10 000 r/min离心10 min。用浓度为0.8% (质量体积比)的无菌生理盐水清洗2遍,以1 mL无菌水重悬浮后,取样梯度稀释涂平板计算初始活菌数,将上述菌液按10% (质量体积比)的接种量添加到MRS培养基中,分别在15-25 ℃条件下培养,24 h取样梯度稀释涂布并进行活菌计数。培养起始和终点时的活菌数以C0和C1表示,单位为CFU/mL,相对生长速率=(lgC1-lgC0)/24[28]。
1.2.4 胞外多糖含量及结构分析将菌株接种到产胞外多糖液体培养基中,30 ℃静置培养48 h。取10 mL培养液,加入2 mL 80% (质量体积比)的三氯乙酸,冰浴,搅拌30 min。4 ℃、4 000 r/min离心20 min去菌体和蛋白,往上清液中加入3倍体积冰冻无水乙醇,4 ℃冷藏过夜,多糖呈絮状沉淀析出[29]。4 ℃、4 000 r/min离心20 min,用10 mL蒸馏水溶解多糖沉淀,加入1.0 mL浓度为6% (质量体积比)的苯酚混匀再加到5.0 mL浓硫酸中,静置10 min后摇匀,室温放置20 min,490 nm测吸光值[30]。将用乙醇沉淀后溶解的胞外多糖进行冷冻干燥,制得的样品在红外灯照射下,采用K-Br圆盘法将多糖制成透光薄片。胞外多糖结构分析使用Nicolet Nexus 470FT-IR红外光谱仪在4 000-500 cm-1范围内进行检测[20]。
1.2.5 短链脂肪酸测定短链脂肪酸采用SPME-GC-MS法测定[21]。将魏斯氏菌在产短链脂肪酸检测培养基中培养10 d,取10 mL培养液10 000 r/min离心15 min收集上清,向上清液中加4 g氯化钠,充分溶解后再添加66.2 μg/L的2-辛醇作为内标,60 ℃萃取40 min,采用顶空进样[21]。GC-MS分析方法以及数据处理参照文献[31]。
1.2.6 生物胺含量测定菌株产生物胺培养条件:将培养好的魏斯氏菌垂悬于含有组氨酸、酪氨酸、赖氨酸、色氨酸、精氨酸、鸟氨酸和苯丙氨酸各5 g/L的MRS培养基中,37 ℃静置培养48 h。
菌株降解生物胺反应条件:将培养好的魏斯氏菌垂悬于含有生物胺(100 mg/L)的MRS培养基中,37 ℃反应48 h。
取10 mL培养液,10 000 r/min离心5 min收集上清,备用。取5 mL上清液,加到10 mL的5% (质量体积比)三氯乙酸溶液中,加入20 µL (100 µL/mL)内标(1, 7-二氨基庚烷)混匀,振荡提取60 min,3 600 r/min离心20 min取上清液,连续提取2次,合并上清液定容至25 mL,正丁醇/氯仿(1׃1,体积比)萃取[32]。衍生化方法及色谱条件与Takebe等的研究方法相同[13]。
1.2.7 ADI途径关键酶活测定将魏斯氏菌接种至MRS培养基中静置培养24 h。取30 mL的菌液离心后去上清,用PBS (pH 7.0)缓冲液清洗菌体2-3次,然后加入30 mL的精氨酸利用培养基,置于37 ℃培养4-6 h。取培养液20 mL,4 ℃、5 000 r/min离心10 min,用PBS缓冲液清洗菌体2-3次,破壁后离心取上清,所得上清是菌株的酶液。
酶活测定方法与Zhang等的测定方法相同[18]。向150 μL含有50 mmol/L相应底物的反应液中加入2.3 mL PBS缓冲液(50 mmol/L,pH 7.0)和50 μL酶液(以添加PBS缓冲液的反应体系为对照)。在37 ℃反应30 min后添加2.5 mL 5% (质量体积比)三氯乙酸终止反应。将反应液稀释一定倍数后,经孔径为0.22 μm的滤膜过滤,用高效液相色谱法测定样品中瓜氨酸含量,然后利用公式计算相应的酶活力[33]。
酶活(U/mL)=稀释倍数×转化所生成的瓜氨酸(µmoL/mL)/转化时间(min)。
1.2.8 氨基酸测定按5% (质量体积比)接种量将魏斯氏菌的种子液(109 CFU/mL)接种至精氨酸利用培养基中,37 ℃静置培养4 d。游离氨基酸测定采用高效液相色谱法[34-35]。
1.2.9 微生物宏基因组制备及荧光定量PCR扩增宏基因组制备:称取5 g酱醪样品置于烧杯中,用无菌生理盐水洗涤2次。将洗涤后的酱醪转移至研钵中,加入液氮,充分研磨使细胞破碎。然后使用PowerMax® Soil DNA Isolation Kit试剂盒按照说明书操作提取微生物的基因组[36]。使用NanoDrop 2000超微量分光光度计测定微生物基因组DNA浓度并评估纯度。采用0.6% (质量体积比)的琼脂糖凝胶电泳检测基因组DNA完整度。
以魏斯氏菌recN基因序列设计特异性引物用于RT-PCR扩增(表 1)。微生物的定量采用绝对定量法,即采用已知浓度的标准品制备标准曲线,对未知浓度的样品进行其拷贝数的测定。对标准品进行10倍梯度稀释,然后以标准品为模板进行RT-PCR反应。反应完成时,以阈值循环数Ct (即每个反应管内的荧光信号达到设定的阈值时所经历的循环数)作为横坐标,标准浓度的对数作为纵坐标绘制标准曲线[37]。
| 基因 Gene |
引物序列 Sequences (5′→3′) |
扩增长度 Size (bp) |
| W. confusa recN | GGCGGATTGGTCTCTTTTTG | 198 |
| CACGCTCAGTAACCGTGTGC | ||
| W. cibaria recN | GCATCCGTCAGTTCATCAC | 186 |
| GATTACGCACTTACCACAGG | ||
| W. paramesenteroides recN | GCTCTGAAGTGATTTTATCTGAC | 174 |
| AACCATGCGGTTGTTGGTA |
使用SPSS 19.0软件对数据进行相关性分析,所有试验均重复3次。
2 结果与分析 2.1 高盐稀态酱油酱醪中魏斯氏菌的分离及其鉴定采用选择性分离的方法从高盐稀态酱油不同发酵时期的酱醪中共分离得到110株可在含万古霉素(0.2 g/L)和那他霉素(0.1 g/L)的MRS平板上生长的菌株。结合菌落及菌体形态特征分析与保守序列比对的方法,可以对菌株进行种间鉴定[38]。根据菌株的菌落形态特征,选取了16株菌落呈白色,圆形微隆起,表明光滑不透明,并且显微镜镜检下形态为革兰氏阳性,无芽孢,无鞭毛不运动的棒状菌株进行菌种鉴定。嗜盐四联球菌也是酱油发酵过程存在于酱醪中的乳酸菌[39],因此选择Tetragenococcus halophilus NBRC 12172菌株的相关基因作为外参,以16S rRNA基因和recN基因的部分序列构建系统发育树(图 1)。通过比对菌株的16S rRNA基因序列,确定这16株菌为魏斯氏菌(图 1A)。保守基因recN常用于魏斯氏菌或其他乳酸菌的种间鉴定[24, 40]。将分离得到的16株魏斯氏菌的recN基因序列与GenBank中的序列进行比对,确定它们分别为:7株融合魏斯氏菌(Weissella confusa)、4株类肠膜魏斯氏菌(Weissella paramesenteroides)和5株食窦魏斯氏菌(Weissella cibaria) (图 1B)。由图 1可知,酱醪来源的W. confusa和W. cibaria亲缘关系较近,W. paramesenteroides与它们区别较大。为考察菌株的生理和代谢特性,分别选取W. paramesenteroides (01、20、28、30)、W. confusa (02、14、25、40)以及W. cibaria (03、17、35、36) 3个种的菌株用于后续研究。
|
| 图 1 酱醪来源魏斯氏菌的系统发育树 Figure 1 Phylogenetic trees of Weissella isolated from soy sauce moromi 注:基于魏斯氏菌16S rRNA基因(A)和recN基因(B)构建的系统发育树.分支点数值表示置信度;比例尺表示碱基替换率;0.02表示2%的替换率;括号内序号表示嗜盐四联球菌NBRC 12172的GenBank登录号以及与测序结果最相近的GenBank登录号. Note: Neighbor-Jointing trees built by MEGA 6.0 based on 16S rRNA gene (A) and recN (B) partial sequences of Weissella strains; Scores represent confidence levels; The bar scale indicates the rate of substitution per base, 0.02 represents a replacement rate of 2%; The numbers in brackets represent the GenBank accession number for Tetragenococcus halophilus NBRC 12172 and those most relevant sequences. |
|
|
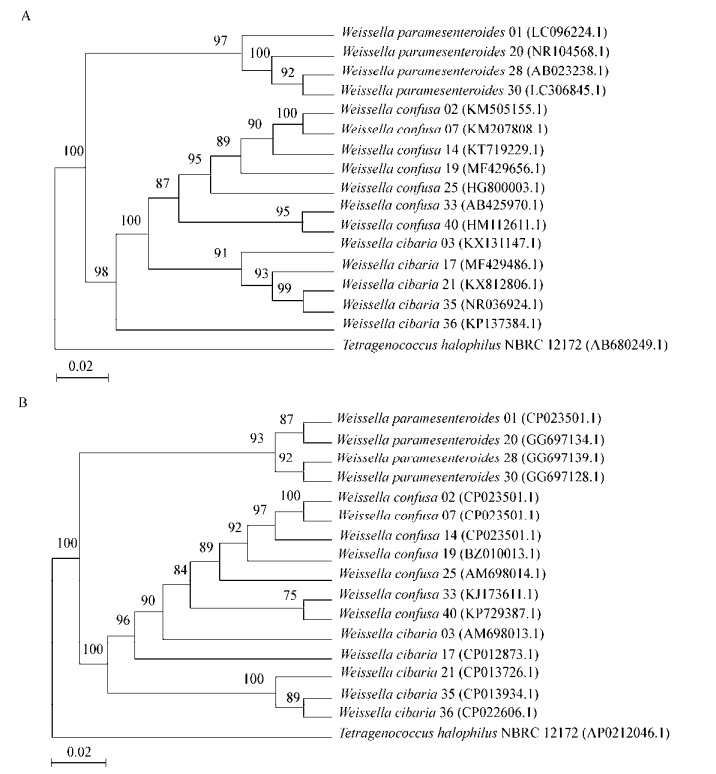
魏斯氏菌是酱油发酵过程酱醪中细菌的优势菌属,高盐稀态酱油发酵过程的酱醪中魏斯氏菌主要包括W. paramesenteroides、W. confusa和W. cibaria[26]。分析酱醪中魏斯氏菌主要种的菌株的数量随酱油发酵时间的变化规律,对阐明这类菌对酱醪体系的适应性以及预测它们在酱油发酵过程中的活跃时期和对酱油发酵的贡献具有重要意义。因此,采用RT-PCR方法分别对酱油发酵过程酱醪中W. paramesenteroides、W. confusa和W. cibaria的绝对数量进行了分析(图 2)。结果表明,在整个酱油发酵周期W. paramesenteroides的数量最多,为108 copy/g酱醪(1个copy表示按照标准质粒copy数换算的细胞数),W. confusa数量较少,W. cibaria的数量最少。
|
| 图 2 魏斯氏菌的数量随酱油发酵时间的变化规律 Figure 2 Quantification of Weissella in moromi mash during soy sauce fermentation |
|
|
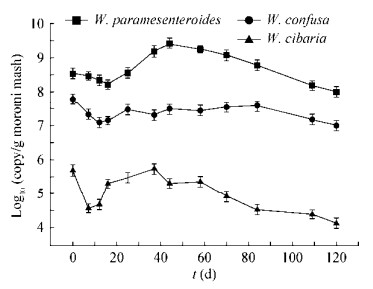
酱醪是高盐体系,只有耐盐微生物才能存活或生长及进行物质代谢。由于酱醪中魏斯氏菌是细菌中的优势菌,说明魏斯氏菌有耐受高盐的能力。3个种的魏斯氏菌在酱油发酵过程中的数量有很大不同,这可能与菌株对环境胁迫的耐受性有关。本研究以酱醪的含盐浓度为参考标准,比较了魏斯氏菌对18% (质量体积比) NaCl的耐受性。由图 3A可知,W. paramesenteroides在18% (质量体积比) NaCl的培养体系中,活菌数下降水平与对照相比少于1个数量级,因此我们认为它在三类魏斯氏菌中是耐盐性较好的;W. cibaria和W. confusa在含有18% (质量体积比) NaCl的培养体系中的活菌数下降水平比对照低1-2个数量级,与W. paramesenteroides相比,对盐的耐受性较差(图 3A)。
|
| 图 3 魏斯氏菌耐高盐能力和在较低温度下生长情况比较 Figure 3 Comparison of the tolerance to salt and growth of Weissella strains 注:A:耐盐性比较;B:在较低温度下生长情况比较. Note: A: Comparison of salt tolerance of Weissella; B: Growth rate of Weissella cultivated at different temperatures. |
|
|
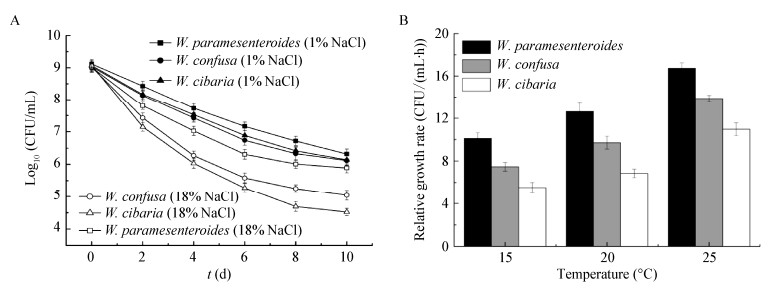
高盐稀态酱油发酵前期是15 ℃的较低温度发酵,后期升温至30 ℃。较低的温度对菌株的生长和代谢有较大影响。由图 2可知,魏斯氏菌的数量在酱油发酵前期下降了1-2个数量级,除了受盐胁迫外,菌株生长可能还受较低温度的影响。通过考察魏斯氏菌在较低温度下生长情况发现,3个种的魏斯氏菌在15-25 ℃培养条件下均可以生长。然而,W. paramesenteroides在15-25 ℃培养条件下的生长情况好于其他两个种的菌株,其相对生长速率是W. confusa和W. cibaria的1.2倍和1.5倍以上(图 3B)。
以上结果表明,W. paramesenteroides对盐的耐受性和在较低温度下生长能力均高于W. cibaria和W. confusa,这可能是它占酱醪魏斯氏菌中优势菌种的主要原因之一。
2.4 魏斯氏菌产胞外多糖特性分析魏斯氏菌可利用发酵食品中含有的单糖合成葡聚糖、果聚糖和非消化性寡糖等胞外多糖。微生物合成的多糖具有益生作用,它可以增加发酵食品的口感和营养[41-42]。本研究考察的酱醪来源的魏斯氏菌均有合成胞外多糖的能力。其中W. confusa合成胞外多糖的能力强于W. paramesenteroides和W. cibaria。W. confusa 02合成胞外多糖的产量最高,达到3.34 g/L (图 4A)。
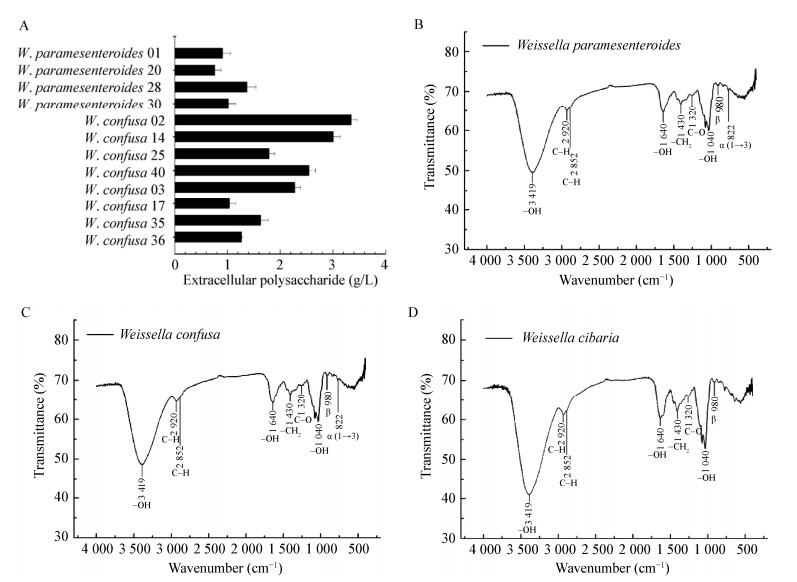
|
| 图 4 魏斯氏菌胞外多糖产量及多糖结构解析 Figure 4 The titer and structure of extracellular polysaccharide produced by Weissella 注:A:魏斯氏菌胞外多糖产量;B-D:魏斯氏菌所产胞外多糖的红外光谱. Note: A: Production of extracellular polysaccharide; B-D: Infra-red spectrum of extracellular polysaccharide produced by Weissella. |
|
|
为进一步分析魏斯氏菌所产胞外多糖的结构,对3个种的魏斯氏菌所产胞外多糖的结构进行了解析。3个种的魏斯氏菌的多糖在980 cm-1处均有吸收峰,说明胞外多糖分子中有β-键官能团(图 4B)。W. paramesenteroides和W. confusa的胞外多糖分子在822 cm-1处有特征吸收峰,表明该多糖是含α-(1-3)键的多糖。通过对3种胞外多糖结构分析,推测W. paramesenteroides和W. confusa所产多糖是含有α-型和β-型的多糖,W. cibaria所产多糖是含有β-型的多糖。以上结果说明,魏斯氏菌可能对酱油中α-型和(或) β-型多糖的合成有一定贡献。
2.5 魏斯氏菌生产短链脂肪酸的特性分析酱油中含有多种功能物质,包括氨基酸、寡肽、胞外多糖和挥发性脂肪酸等。从食品中摄入的短链脂肪酸可迅速被肠胃吸收,因而对于维持肠道的正常功能具有重要作用[43-44]。为了研究酱油中含有的短链脂肪酸是否与魏斯氏菌的物质代谢有关,分析了魏斯氏菌合成短链脂肪酸的情况。由图 5可知,酱醪来源的魏斯氏菌可以合成乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸六种短链脂肪酸。其中W. paramesenteroides合成短链脂肪酸的种类最多,能力最强;W. cibaria合成短链脂肪酸能力次之;W. cibaria合成短链脂肪酸能力相比最弱。W. paramesenteroides 28是所有菌株中在实验条件下可以合成全部6种短链脂肪酸的唯一菌株。W. paramesenteroides种的菌株合成丁酸和戊酸的能力较强。
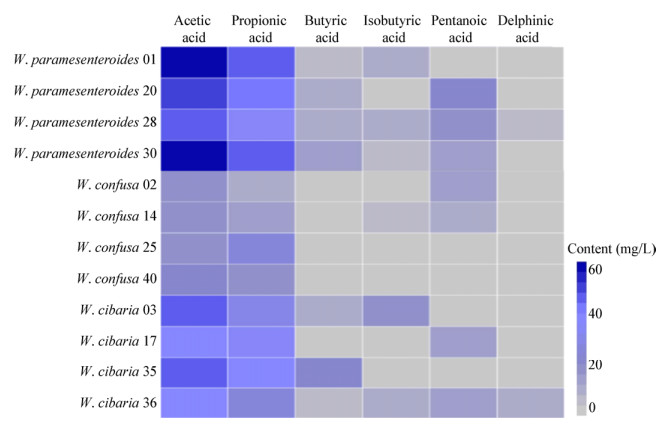
|
| 图 5 魏斯氏菌产短链脂肪酸能力分析 Figure 5 Analysis of short chain fatty acids produced by Weissella 注:图中右侧比例代表各物质浓度(mg/L). Note: The values represent concentrations of corresponding compounds. |
|
|
生物胺和氨基甲酸乙酯是酱油中含有的氨(胺)类危害物。它们的合成和积累均与细菌的氮源代谢有关。生物胺主要是氨基酸在乳酸菌的氨基酸脱羧酶作用生成的[45]。过量摄入生物胺会使人产生恶心、过敏等身体不适反应[46-47]。对酱醪来源魏斯氏菌产生物胺的能力分析发现,考察的W. cibaria菌株均不产生物胺;W. paramesenteroides能产尸胺、酪胺、亚精胺和苯乙胺(表 2),W. confusa 14可生成组胺。将不产生物胺的W. cibaria 17加入含有生物胺的溶液中,发现W. cibaria 17在2 d内可降解24%组胺、15%酪胺、13%苯乙胺和12%的色胺。
| 菌株 Strains |
组胺 Histamine (mg/L) |
尸胺 Cadaverine (mg/L) |
酪胺 Tyramine (mg/L) |
色胺 Tryptamine (mg/L) |
精胺 Spermine (mg/L) |
亚精胺 Spermidine (mg/L) |
腐胺 Putrescine (mg/L) |
苯乙胺 Phenylethylamine (mg/L) |
| W. paramesenteroides 01 | - | 0.14 | 0.21 | - | - | 2.39 | - | 0.53 |
| W. paramesenteroides 20 | - | 0.53 | 0.94 | - | - | 2.42 | - | 1.21 |
| W. paramesenteroides 28 | - | - | - | - | - | - | - | - |
| W. paramesenteroides 30 | - | - | - | - | - | - | - | - |
| W. confusa 02 | - | - | - | - | - | - | - | - |
| W. confusa 14 | 0.96 | - | - | - | - | 0.71 | - | - |
| W. confusa 25 | - | - | - | - | - | - | - | - |
| W. confusa 40 | - | - | - | - | - | - | - | - |
| W. cibaria 03 | - | - | - | - | - | - | - | - |
| W. cibaria 17 | - | - | - | - | - | - | - | - |
| W. cibaria 35 | - | - | - | - | - | - | - | - |
| W. cibaria 36 | - | - | - | - | - | - | - | - |
| 注:-:未检测出. Note: -: Not detected. |
||||||||
酱油中氨基甲酸乙酯主要是细菌精氨酸脱亚氨基(ADI)途径利用精氨酸的不完全代谢产物——瓜氨酸,与乙醇反应生成[48]。ADI途径的3个反应分别由精氨酸脱亚胺酶(ADI)、鸟氨酸转氨酶(OTC)和鸟氨酸氨基甲酸激酶(CK)催化[44]。ADI和OTC分别催化瓜氨酸的生成和分解,两酶活性的比值> 1表示瓜氨酸是积累的,比值< 1则代表瓜氨酸是消耗的。因此,分析两者的活性可以预测菌株是否积累氨基甲酸乙酯前体瓜氨酸。通过分析魏斯氏菌在18% (质量体积比) NaCl培养条件下的ADI和OTC活性,发现除了W. paramesenteroides 28和W. paramesenteroides 30外,其他魏斯氏菌在此培养条件下ADI和OTC活性之比均小于1 (表 3)。而对魏斯氏菌合成和积累瓜氨酸的能力分析表明,这两株菌积累瓜氨酸的能力均高于其他菌(表 4)。虽然W. paramesenteroides的有些菌株可积累少量瓜氨酸(精氨酸转化为瓜氨酸的转化率是6%-12%),但是与嗜酸乳酸足球菌(精氨酸转化为瓜氨酸的转化率是54%-99%)和葡萄球菌(精氨酸转化为瓜氨酸的转化率是27%-32%)相比,它积累瓜氨酸的能力要弱很多[18, 33]。此结果进一步证实魏斯氏菌不是酱醪中氨基甲酸乙酯前体瓜氨酸的主要产生菌。
| Strains | ADI activity (U/mL) | OTC activity (U/mL) | ADI/OTC (%) |
| W. paramesenteroides 01 | 0.51 | 0.65 | 78.5 |
| W. paramesenteroides 20 | 0.45 | 0.49 | 91.8 |
| W. paramesenteroides 28 | 0.47 | 0.46 | 102.2 |
| W. paramesenteroides 30 | 0.41 | 0.37 | 110.8 |
| W. confusa 02 | 0.44 | 0.57 | 77.2 |
| W. confusa 14 | 0.35 | 0.42 | 83.3 |
| W. confusa 25 | 0.39 | 0.45 | 86.7 |
| W. confusa 40 | 0.37 | 0.44 | 84.1 |
| W. cibaria 03 | 0.36 | ND | ND |
| W. cibaria 17 | 0.41 | 0.47 | 87.2 |
| W. cibaria 35 | 0.33 | 0.36 | 91.7 |
| W. cibaria 36 | 0.35 | 0.41 | 85.4 |
| 注:酶活(U/mL)=稀释倍数×转化所生成的瓜氨酸(µmoL/mL)/转化时间(min);ND:未检测到酶活. Note: Enzyme activity (U/mL)=Dilution multiple×conversion of citrulline (µmoL/mL)/conversion time (min); ND: Not detected. |
|||
| Strains | ΔArg (g/L) |
ΔCit (g/L) |
ΔCit/ΔArg (%) |
| W. paramesenteroides 01 | 2.56±0.02 | 0.16±0.01 | 6.25±0.04 |
| W. paramesenteroides 20 | 2.74±0.03 | 0.24±0.01 | 8.75±0.05 |
| W. paramesenteroides 28 | 2.45±0.01 | 0.25±0.03 | 10.21±0.02 |
| W. paramesenteroides 30 | 2.41±0.05 | 0.29±0.02 | 12.03±0.06 |
| W. confusa 02 | 2.50±0.01 | 0.20±0.01 | 8.00±0.02 |
| W. confusa 14 | 2.57±0.04 | 0.21±0.01 | 8.17±0.04 |
| W. confusa 25 | 2.38±0.01 | 0.23±0.03 | 9.66±0.03 |
| W. confusa 40 | 2.44±0.02 | 0.17±0.03 | 6.97±0.05 |
| W. cibaria 03 | 2.47±0.01 | 0.22±0.02 | 8.91±0.02 |
| W. cibaria 17 | 2.43±0.03 | 0.23±0.01 | 9.47±0.03 |
| W. cibaria 35 | 2.27±0.02 | 0.15±0.01 | 6.61±0.02 |
| W. cibaria 36 | 2.11±0.01 | 0.19±0.03 | 9.00±0.04 |
| 注:∆Arg:精氨酸的消耗量;∆Cit:瓜氨酸的积累量,∆Cit=∆Arg-∆Orn;ΔCit/ΔArg:精氨酸到瓜氨酸的转化率. Note: ∆Arg: Consumption of arginine; ∆Cit: Accumulation of citrulline, ∆Cit=∆Arg-∆Orn; ΔCit/ΔArg: The conversion ratio of arginine to citrulline. |
|||
魏斯氏菌是参与酱油发酵的细菌中的优势菌属,对于酱油发酵进程和风味有重要的影响和贡献[49-50]。研究表明,W. confusa、W. cibaria和W. paramesenteroides是高盐稀态酱油发酵体系中魏斯氏菌属的3个优势种[25]。高盐稀态酱油发酵过程中魏斯氏菌的组成变化以及菌株在酱油发酵过程中的作用尚不清楚。因此,对魏斯氏菌适应环境性能的研究及其用于发酵食品的安全性评估,不仅有助于拓展乳酸菌的知识领域,更可为其在食品发酵中的应用提供理论依据。
本研究从高盐稀态酱油酱醪中分离得到魏斯氏菌W. confusa、W. cibaria和W. paramesenteroides 3个优势菌种的12株菌。通过分析发现,W. paramesenteroides对高浓度氯化钠的耐受性和在较低温度下的生长情况优于其他两个种的菌,这可能是导致它成为酱醪中优势菌种的原因。随着生活水平的提高,人们对食品安全的关注日益增加。发酵食品在加工过程中,由于微生物对氮源的不彻底利用,会产生氨(胺)类危害物,对食品安全有潜在的影响。邹阳等研究了高盐稀态酱油中生物胺的形成机制,发现高盐稀态酱油发酵过程中生物胺的变化与细菌总数、乳酸菌具有一定的相关性,但是没有明确酱油发酵中产生生物胺的具体微生物[7]。本研究筛选得到的12株魏斯氏菌在18% (质量体积比) NaCl培养条件下,大多数菌株不产生物胺,有3株菌产生物胺,有1株菌可降解多种生物胺,为进一步明确酱油发酵过程中细菌产生物胺的作用机理提供依据。Zhang等对高盐稀态酱油发酵过程中优势菌属积累瓜氨酸的能力进行了分析,发现W. confusa和W. cibaria积累瓜氨酸的能力较弱[18, 33]。本研究证实酱醪来源优势菌属W. paramesenteroides也积累瓜氨酸,其积累瓜氨酸的能力高于W. confusa和W. cibaria,低于嗜酸乳酸足球菌和葡萄球菌。进一步证实了魏斯氏菌积累瓜氨酸的能力较弱。
酱油良好的风味来自于有机酸、胞外多糖、脂肪酸、氨基酸、酯类等物质,这些风味物质的形成与微生物代谢密切相关。Bounaix等研究发现来源于面包的Weissella cibaria和Weissella confusa具有合成α-型多糖的能力[41]。李魁等研究发现酱油中含有β-葡聚糖等微生物胞外多糖,微生物合成的多糖具有益生作用[42]。胡传旺等通过对高盐稀态酱油中细菌微生物的代谢物进行分析,发现魏斯氏菌在18% (质量体积比) NaCl培养条件下均能产乳酸等有机酸[26]。本研究通过分析发现酱醪来源的12株魏斯氏菌在高盐体系中能生成α-型胞外多糖、β-型胞外多糖、乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸等多种功能性物质,可能对提高酱油的口感和营养有一定贡献。
本研究分析酱醪来源魏斯氏菌与氨(胺)类危害物合成和积累的关系,对于在酱油发酵过程中合理利用或控制魏斯氏菌具有重要的指导意义。
| [1] |
Zhang JR, Fang F, Chen J, et al. Metabolism of ethyl carbamate precursors in soy sauce by Zygosaccharomyces rouxii ZQ02[J]. Acta Microbiologica Sinica, 2016, 56(6): 956-963. (in Chinese) 张继冉, 方芳, 陈坚, 等. 鲁氏接合酵母对酱油中氨基甲酸乙酯前体物的代谢[J]. 微生物学报, 2016, 56(6): 956-963. |
| [2] |
Feng YZ. The evolution and formation mechanism of key aroma compounds during the process of high-salt liquid fermentation soy sauce[D]. Guangzhou: Doctoral Dissertation of South China University of Technology, 2015 (in Chinese) 冯云子.高盐稀态酱油关键香气物质的变化规律及形成机理的研究[D].广州: 华南理工大学博士学位论文, 2015 |
| [3] |
Kataoka S. Functional effects of Japanese style fermented soy sauce (shoyu) and its components[J]. Journal of Bioscience and Bioengineering, 2005, 100(3): 227-234. DOI:10.1263/jbb.100.227 |
| [4] |
Zhang YJ. Study on flavor and physiological active of soy sauce[D]. Hangzhou: Master's Thesis of Zhejiang Gongshang University, 2012 (in Chinese) 张怡洁.酱油的风味及其生理活性的研究[D].杭州: 浙江工商大学硕士学位论文, 2012 |
| [5] |
Geng YH, Xie XH, Li GJ. Dynamic changes in bacterial community structure during soy sauce fermentation[J]. Modern Food Science and Technology, 2015, 31(8): 83-87. (in Chinese) 耿予欢, 谢显华, 李国基. 酱油发酵过程中细菌群落结构的动态变化[J]. 现代食品科技, 2015, 31(8): 83-87. |
| [6] |
Yan YZ, Qian YL, Ji FD, et al. Microbial composition during Chinese soy sauce koji-making based on culture dependent and independent methods[J]. Food Microbiology, 2013, 34(1): 189-195. DOI:10.1016/j.fm.2012.12.009 |
| [7] |
Zou Y. Study on formation mechnism and control of biogenic amines during the process of high-salt diluted soy sauce[D]. Guangzhou: Master's Thesis of South China University of Technology, 2012 (in Chinese) 邹阳.高盐稀态酱油生产过程中生物胺的形成机制及发酵调控研究[D].广州: 华南理工大学硕士学位论文, 2012 |
| [8] |
Kajala I, Shi Q, Nyyssölä A, et al. Cloning and characterization of a Weissella confusa dextransucrase and its application in high fibre baking[J]. PLoS One, 2015, 10(1): e0116418. DOI:10.1371/journal.pone.0116418 |
| [9] |
Fusco V, Quero GM, Cho GS, et al. The genus Weissella: taxonomy, ecology and biotechnological potential[J]. Frontiers in Microbiology, 2015, 6: 155. |
| [10] |
Li QY, Fang F, Du GC, et al. The application of Weissella strains in fermented foods[J]. Food and Fermentation Industries, 2017, 43(10): 241-247. (in Chinese) 李巧玉, 方芳, 堵国成, 等. 魏斯氏菌在发酵食品中的应用[J]. 食品与发酵工业, 2017, 43(10): 241-247. |
| [11] |
Wolter A, Hager AS, Zannini E, et al. Influence of dextran-producing Weissella cibaria on baking properties and sensory profile of gluten-free and wheat breads[J]. International Journal of Food Microbiology, 2014, 172: 83-91. DOI:10.1016/j.ijfoodmicro.2013.11.015 |
| [12] |
Yang JP, Wang J, Zhang XH, et al. The research advance of exopolysaccharides from lactic acid bacteria and its application in food industry[J]. Food and Fermentation Industries, 2016, 42(1): 264-272. (in Chinese) 杨靖鹏, 王静, 张晓辉, 等. 乳酸菌胞外多糖研究进展以及在食品工业中的应用[J]. 食品与发酵工业, 2016, 42(1): 264-272. |
| [13] |
Takebe Y, Takizaki M, Tanaka H, et al. Evaluation of the biogenic amine-production ability of lactic acid bacteria isolated from Tofu-misozuke[J]. Food Science and Technology Research, 2016, 22(5): 673-678. DOI:10.3136/fstr.22.673 |
| [14] |
Zhang JR. Formation mechanism and elimination strategy of ethyl carbamate in soy sauce[D]. Wuxi: Doctoral Dissertation of Jiangnan University, 2016 (in Chinese) 张继冉.酱油中氨基甲酸乙酯的产生机制和消除策略研究[D].无锡: 江南大学博士学位论文, 2016 |
| [15] |
Kongkiattikajorn J. Potential of fermented sausage-associated lactic acid bacteria to degrade biogenic amines during storage[A]//Kongo M. Lactic Acid Bacteria - R & D for Food, Health and Livestock Purposes[M]. Croatia: InTech Press, 2013: 97-128
|
| [16] |
Liu J, Run J, Sun KJ. Safety of biogenic amines in foods[J]. Food Science, 2013, 34(5): 322-326. (in Chinese) 刘景, 任婧, 孙克杰. 食品中生物胺的安全性研究进展[J]. 食品科学, 2013, 34(5): 322-326. |
| [17] |
Zhang MH. Functional analysis of Bacillus amyloliquefaciens JY06 and its mutants for soy sauce fermentation[D]. Wuxi: Master's Thesis of Jiangnan University, 2017 (in Chinese) 张梦寒.解淀粉芽孢杆菌JY06及其突变株用于酱油发酵的特性研究[D].无锡: 江南大学硕士学位论文, 2017 |
| [18] |
Zhang JR, Du GC, Chen J, et al. Characterization of a Bacillus amyloliquefaciens strain for reduction of citrulline accumulation during soy sauce fermentation[J]. Biotechnology Letters, 2016, 38(10): 1723-1731. DOI:10.1007/s10529-016-2147-7 |
| [19] |
Tian YH, Wang LL, Yi H, et al. Endurance of temperature, ammonium hydroxide and ethanol by several strains of Bacillus[J]. Chemistry and Bioengineering, 2005, 22(7): 38-39. (in Chinese) 田亚红, 王丽丽, 仪宏, 等. 几种芽孢杆菌对温度、氨水和乙醇耐受性的研究[J]. 化学与生物工程, 2005, 22(7): 38-39. DOI:10.3969/j.issn.1672-5425.2005.07.014 |
| [20] |
Kang Z, Zeng Y, Yang M, et al. Production, purification and structural study of an exopolysaccharide from Lactobacillus plantarum BC-25[J]. Carbohydrate Polymers, 2016, 144(10): 205-214. |
| [21] |
Ecker J, Scherer M, Schmitz G, et al. A rapid GC-MS method for quantification of positional and geometric isomers of fatty acid methyl esters[J]. Journal of Chromatography B, 2012, 897(4): 98-104. |
| [22] |
Kamboj K, Vasquez A, Balada-Llasat JM. Identification and significance of Weissella species infections[J]. Frontiers in Microbiology, 2015, 6: 1204. |
| [23] |
Assamio AA, Krabi ER, Ehon AF, et al. Isolation and screening of Weissella strains for their potential use as starter during attiéké production[J]. Biotechnologie, Agronomie, Société et Environnement, 2016, 20(3): 355-362. |
| [24] |
Arahal DR, Sanchez E, Macian MC, et al. Value of recN sequences for species identification and as a phylogenetic marker within the family "Leuconostocaceae"[J]. International Microbiology, 2008, 11(1): 33-39. |
| [25] |
Chin HS, Breidt F, Fleming HP, et al. Identifications of predominant bacterial isolates from the fermenting kimchi using ITS-PCR and partial 16S rDNA sequence analyses[J]. Journal of Microbiology and Biotechnology, 2006, 16(1): 68-76. |
| [26] |
Hu CW. Dynamics of microbial community during soy sauce fermentation and functional analysis strains isolated from moromi[D]. Wuxi: Master's Thesis of Jiangnan University, 2017 (in Chinese) 胡传旺.酱油发酵过程微生物群落解析及功能研究[D].无锡: 江南大学硕士学位论文, 2017 |
| [27] |
Qi W, Hou LH, Guo HL, et al. Effect of salt-tolerant yeast of Candida versatilis and Zygosaccharomyces rouxii on the production of biogenic amines during soy sauce fermentation[J]. Journal of the Science of Food and Agriculture, 2014, 94(8): 1537-1542. DOI:10.1002/jsfa.2014.94.issue-8 |
| [28] |
Tian YH, Wang LL, Yi H, et al. Endurance of temperature, ammonium hydroxide and ethanol by several strains of Bacillus[J]. Chemistry and Bioengineering, 2005, 22(7): 38-39. (in Chinese) 田亚红, 王丽丽, 仪宏, 等. 几种芽孢杆菌对温度、氨水和乙醇耐受性的研究[J]. 化学与生物工程, 2005, 22(7): 38-39. DOI:10.3969/j.issn.1672-5425.2005.07.014 |
| [29] |
Jang MH, Kim MD. Exploration of β-glucosidase activity of lactic acid bacteria isolated from kimchi[J]. Food Engineering Progress, 2010, 14(3): 243-248. |
| [30] |
Park JH, Ahn HJ, Kim SG, et al. Dextran-like exopolysaccharide-producing Leuconostoc and Weissella from kimchi and its ingredients[J]. Food Science and Biotechnology, 2013, 22(4): 1047-1053. DOI:10.1007/s10068-013-0182-x |
| [31] |
Gao LH, Liu T, An XJ, et al. Analysis of volatile flavor compounds influencing Chinese-type soy sauces using GC-MS combined with HS-SPME and discrimination with electronic nose[J]. Journal of Food Science and Technology, 2017, 54(1): 130-143. DOI:10.1007/s13197-016-2444-0 |
| [32] |
Li ZJ. Methods for determination of genetic amines in food and amine-producing bacteria and its application[D]. Qingdao: Doctoral Dissertation of Ocean University of China, 2007 (in Chinese) 李志军.食品中生物胺及其产生菌株检测方法研究[D].青岛: 中国海洋大学博士学位论文, 2007 |
| [33] |
Zhang JR, Fang F, Chen J, et al. The arginine deiminase pathway of koji bacteria is involved in ethyl carbamate precursor production in soy sauce[J]. FEMS Microbiology Letters, 2014, 358(1): 91-97. DOI:10.1111/fml.2014.358.issue-1 |
| [34] |
Goh KM, Lai OM, Abas F, et al. Effects of sonication on the extraction of free-amino acids from moromi and application to the laboratory scale rapid fermentation of soy sauce[J]. Food Chemistry, 2017, 215: 200-208. DOI:10.1016/j.foodchem.2016.07.146 |
| [35] |
Vatanavicharn N, Ratanarak P, Liammongkolkul S, et al. Amino acid disorders detected by quantitative amino acid HPLC analysis in Thailand: An eight-year experience[J]. Clinica Chimica Acta, 2012, 413(13/14): 1141-1144. |
| [36] |
Tao JL, Lu ZM, Wang ZM, et al. Detection of the variation of microorganisms in acetic acid fermentation of Zhenjiang aromatic vinegar through real-time quantitative PCR[J]. Food and Fermentation Industries, 2013, 39(2): 156-160. (in Chinese) 陶京兰, 陆震鸣, 王宗敏, 等. 实时荧光定量PCR监测镇江香醋醋酸发酵过程中微生物变化[J]. 食品与发酵工业, 2013, 39(2): 156-160. |
| [37] |
Wieschebrock M, Seitter M, Hertel C. Quantitative detection of lactic acid bacteria in dried sourdoughs using real-time PCR[J]. European Food Research and Technology, 2011, 233(4): 617-624. DOI:10.1007/s00217-011-1537-2 |
| [38] |
Zhao LL. Isolation and identification of lactic acid bacteria and its application in fermented soybean drink product[D]. Beijing: Master's Thesis of Beijing Technology and Business University, 2009 (in Chinese) 赵丽丽.乳酸菌的分离鉴定及其在酸豆乳加工中的应用[D].北京: 北京工商大学硕士学位论文, 2009 |
| [39] |
Lee M, Cho KH, Han ES, et al. Development and application of PCR-based Weissella species detection method with recN gene targeted species-specific primers[J]. Korean Journal of Microbiology and Biotechnology, 2011, 39(1): 70-76. |
| [40] |
Wu T, Yi YL, Xie WJ, et al. Isolation and identification of halotolerant biosurfactant-producing bacteria and its application in bioremediation of petroleum-contaminated saline soil[J]. Acta Scientiae Circumstantiae, 2013, 33(12): 3359-3367. (in Chinese) 吴涛, 依艳丽, 谢文军, 等. 产生物表面活性剂耐盐菌的筛选鉴定及其对石油污染盐渍化土壤的修复作用[J]. 环境科学学报, 2013, 33(12): 3359-3367. |
| [41] |
Bounaix MS, Robert H, Gabriel V, et al. Characterization of dextran-producing Weissella strains isolated from sourdoughs and evidence of constitutive dextransucrase expression[J]. FEMS Microbiology Letters, 2010, 311(1): 18-26. DOI:10.1111/fml.2010.311.issue-1 |
| [42] |
Li K. Study on the development of healthy soy sauce using oat and residual biomass of beer[J]. China Brewing, 2006, 25(2): 37-39. (in Chinese) 李魁. 利用燕麦和啤酒废弃生物质酿造酱油的研究[J]. 中国酿造, 2006, 25(2): 37-39. DOI:10.3969/j.issn.0254-5071.2006.02.011 |
| [43] |
Wu J, Wu ZJ, Shao L. Effect of Lactobacillus exopolysaccharides on human faecal microbiota and production of short-chain fatty acids in vitro[J]. Chinese Journal of Microecology, 2015, 27(3): 266-271. (in Chinese) 吴江, 吴正钧, 邵丽. 乳杆菌胞外多糖对人体粪便菌群及其产生短链脂肪酸的影响[J]. 中国微生态学杂志, 2015, 27(3): 266-271. |
| [44] |
Liao DY, Fang F, Chen J, et al. Isolation and arginine metabolism detection of a Tetragenococcus halophilus strain[J]. Journal of Food Science and Biotechnology, 2016, 35(1): 48-53. (in Chinese) 廖淡宜, 方芳, 陈坚, 等. 嗜盐四联球菌的分离及其精氨酸代谢[J]. 食品与生物技术学报, 2016, 35(1): 48-53. DOI:10.3969/j.issn.1673-1689.2016.01.007 |
| [45] |
Tong TT. Bacterial diversity of Sichuan Pickle and screening of strains with potency for degrading biogenic amines[D]. Wuxi: Master's Thesis of Jiangnan University, 2015 (in Chinese) 佟婷婷.四川泡菜细菌多样性分析及降生物胺菌株筛选[D].无锡: 江南大学硕士学位论文, 2015 |
| [46] |
Yu JZ, Xu F, Xu Y. Analysis on the change rule of biogenic amines during the process of high-salt diluted soy sauce[J]. Food and Fermentation Industries, 2016, 42(10): 44-49. (in Chinese) 于金芝, 徐峰, 徐莹. 高盐稀态酱油生产过程中的生物胺变化规律[J]. 食品与发酵工业, 2016, 42(10): 44-49. |
| [47] |
Sun X, Zhou K, Gong Y, et al. Determination of biogenic amines in Sichuan-style spontaneously fermented sausages[J]. Food Analytical Methods, 2016, 9(8): 2299-2307. DOI:10.1007/s12161-016-0417-6 |
| [48] |
Zhang MH, Li QY, Zhou ZH, et al. Reduction of ethyl carbamate in soy sauce by Bacillus amyloliquefaciens mutants[J]. Acta Microbiologica Sinica, 2017, 57(12): 1817-1826. (in Chinese) 张梦寒, 李巧玉, 周朝晖, 等. 解淀粉芽孢杆菌诱变育种及其突变株在降低酱油中氨基甲酸乙酯的应用[J]. 微生物学报, 2017, 57(12): 1817-1826. |
| [49] |
Sulaiman J, Gan HM, Yin WF, et al. Microbial succession and the functional potential during the fermentation of Chinese soy sauce brine[J]. Frontiers in Microbiology, 2014, 5: 556. |
| [50] |
Tanaka Y, Watanabe J, Mogi Y. Monitoring of the microbial communities involved in the soy sauce manufacturing process by PCR-denaturing gradient gel electrophoresis[J]. Food Microbiology, 2012, 31(1): 100-106. DOI:10.1016/j.fm.2012.02.005 |
 2018, Vol. 45
2018, Vol. 45