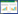扩展功能
文章信息
- 杜贺超, 李秀秀, 陆兆新, 别小妹, 赵海珍, 张充, 吕凤霞
- DU He-Chao, LI Xiu-Xiu, LU Zhao-Xin, BIE Xiao-Mei, ZHAO Hai-Zhen, ZHANG Chong, LU Feng-Xia
- Plantaricin 163对热杀索丝菌的抗菌活性及其作用机制
- Antibacterial activity and mechanism of action of Plantaricin 163 against Brochothrix thermosphacta
- 微生物学通报, 2018, 45(11): 2439-2448
- Microbiology China, 2018, 45(11): 2439-2448
- DOI: 10.13344/j.microbiol.china.171049
-
文章历史
- 收稿日期: 2017-12-13
- 接受日期: 2018-04-04
- 网络首发日期(www.cnki.net): 2018-04-13
热杀索丝菌(Brochothrix thermosphacta)是一种革兰氏阳性兼性厌氧型长杆菌,最适生长温度为20−25 ℃。研究已报道,热杀索丝菌广泛存在于真空包装和气调包装中,是引起牛、羊、猪等肉制品及水产品腐败的主要微生物之一。江芸等[1]的研究表明热杀索丝菌是真空包装冷却猪肉4 ℃贮藏末期中的优势腐败菌之一。Reid等[2]研究发现热杀索丝菌是真空包装牛肉中主要的嗜冷菌之一。Silbande等[3]研究认为热杀索丝菌是金枪鱼冰贮过程中的主要腐败菌。因其兼性厌氧和嗜冷的特点,即便在真空包装和冷藏条件下也能生长繁殖,利用营养产生腐败物质,导致肉品腐败和变质[4]。不仅造成经济损失,也给人类健康带来危害。因此,开发针对热杀索丝菌的高效防腐剂对于肉制品及水产品的防腐保鲜具有重要意义。目前人们对食品防腐剂的使用要求越来越严格,化学防腐剂因存在安全和残留问题引起社会恐慌,天然生物防腐剂因安全、环保、高效的特点正在逐渐受到研究者的关注[5-6]。
细菌素是由乳酸菌产生的一类抗菌多肽和蛋白,能有效抑制食源性致病菌和腐败菌[7]。乳酸菌本身具有无毒、高稳定性和安全性的特性(Generally regarded as safe,GRAS),使得乳酸菌细菌素在食品保鲜上的应用受到了广泛的关注[8]。关于细菌素作用机制的研究主要集中在Ⅰ类和Ⅱa类,不同类型的细菌素作用机理不尽相同,总的来说包括细胞膜损伤、阻碍细胞分裂以及影响基因表达和蛋白的产生[9]。大部分细菌素能通过与敏感菌细胞膜上特异位点结合,使细胞膜形成孔道,破坏膜结构的完整性从而引起离子、氨基酸和ATP外渗,进而导致细胞死亡。细胞壁前体类脂Ⅱ (Lipid Ⅱ)是最常见的结合位点,其次还有细胞膜相关的甘露磷酸转移酶系统(Man-PTS)[10-12]。有的细菌素如Nisin与Lipid Ⅱ特异性结合,不仅细胞膜形成孔道,低浓度时还能抑制细胞壁的合成,从而发挥双重作用机制[13]。此外,还能通过干扰DNA、RNA和蛋白质的代谢来杀死敏感菌[14]。目前,关于细菌素作用机制的研究主要集中在对G+致病菌的研究,对热杀索丝菌作用机制的研究鲜有报道。
本实验室前期通过Illumina MiSeq高通量测序和聚合酶链式反应-变性梯度凝胶电泳(PCR- DGGE)的方法[15],发现热杀索丝菌是鲫鱼在4 ℃真空贮藏过程中的主要腐败菌,并筛选到一种高效生物保鲜剂Plantaricin 163,能够明显延长鲫鱼的贮藏期。Plantaricin 163是一种由植物乳杆菌(Lactobacillus plantarum)产生的分子量为3 553.2 Da的新型广谱细菌素,MALDI-TOF-MS/MS分析显示Plantaricin 163由32个氨基酸组成:VFHAYSARGN YYGNCPANWPSCRNNYKSAGGK。同时,它有极强的热稳定性,对蛋白酶敏感,对革兰氏阳性菌和革兰氏阴性菌都有很好的抑制效果,有作为天然生物保鲜剂的巨大应用潜力[16]。本文为阐明Plantaricin 163作为鲫鱼防腐保鲜剂的机理,研究Plantaricin 163对热杀索丝菌抗菌活性和作用机理。以期为Plantaricin 163天然保鲜剂的开发利用和复配剂的筛选提供理论依据。
1 材料与方法 1.1 材料 1.1.1 菌种热杀索丝菌分离自腐败的鲫鱼;植物乳杆菌163 GCMGC (No. 8224)分离自贵州泡菜,以上菌株均保藏于南京农业大学食品科技学院酶工程实验室。
1.1.2 培养基、主要试剂和仪器MRS培养基(g/L):蛋白胨10.0,牛肉膏10.0,酵母粉5.0,K2HPO4 2.0,柠檬酸二铵2.0,乙酸钠5.0,葡萄糖20.0,MgSO4·H2O 0.58,MnSO4·4H2O 0.25,吐温-80 1.0 mL,蒸馏水1 000 mL,调节pH至6.2−6.4,7×104 Pa灭菌20 min。STAA培养基,青岛高科技园海博生物技术有限公司。碘化丙啶(Propidium iodide,PI)、戊二醛,Sigma公司。高速冷冻离心机,Eppendorf公司;紫外分光光度计,SHIMADZU公司;pH计,Thermo公司;DDS-电导率仪,上海精密科学仪器有限责任公司;流式细胞分析仪,Beckman公司;扫描电子显微镜,CARL ZEISS公司;离子溅射仪,深圳市速普仪器有限公司;透射电子显微镜,电子株式会社。
1.2 方法 1.2.1 Plantaricin 163的制备取保藏的L. plantarum 163接种于100 mL MRS培养基,37 ℃静置培养,转接2次复壮后,按照1% (体积比)接种于1 000 mL新鲜MRS培养基,37 ℃静置培养24 h,4 ℃、10 000 r/min离心15 min得发酵上清液。按照Hu等[16]的方法,用硫酸铵沉淀、凝胶层析和HPLC等方法分离纯化Plantaricin 163。真空冷冻干燥后备用。
1.2.2 最小抑菌浓度的测定最小抑菌浓度的测定参考美国临床实验室标准化协会(Clinical and laboratory standards institute,CLSI)指南[17]。将冻干的Plantaricin 163配置成浓度为1 024 μg/mL的储备液,无菌条件下用无菌水二倍梯度稀释,按稀释度从高到低加入96孔板的第1−11列,每孔加100 μL,第12列加入等量的无菌水作为空白对照。收集生长至对数期的热杀索丝菌,配制成浓度约为106 CFU/mL的菌悬液,每孔加入100 μL菌悬液。混匀后将96孔板置于25 ℃培养箱中静置培养24 h,用酶标仪测定OD600值。以未见指示菌生长(即OD600不增高)的最低浓度为Plantaricin 163对热杀索丝菌的最小抑菌浓度(Minimum inhibitory concentration,MIC)[18]。每组实验重复5次。
1.2.3 杀菌动力学测定参考Han等[19]报道的方法略作修改,热杀索丝菌按1% (体积比)接种于100 mL STAA培养基中,25 ℃、180 r/min振荡培养至对数期,调整OD600为0.4,每瓶培养基中添加终浓度为1×MIC和2×MIC的Plantaricin 163继续培养,分别在0、30、60、120、240、360、480 min各取1 mL菌液,以平板计数法测其活菌数(CFU)。以添加等量无菌水的菌液作为对照。实验重复3次,结果取平均值。
1.2.4 Plantaricin 163对热杀索丝菌电导率的影响通过测定电导率的变化来分析Plantaricin 163对热杀索丝菌细胞膜通透性的影响。将热杀索丝菌37 ℃、180 r/min振荡培养至对数期,0.02 mol/L PBS清洗2次,并用PBS调整OD600为0.4,每瓶培养基中添加Plantaricin 163至终浓度为1×MIC和2×MIC,分别于0、0.5、1.0、1.5、2.0、3.0 h取出定量培养液,4 ℃、5 000 r/min离心5 min,用电导仪测定上清液的电导率值。以空白的STAA培养基调零为参比,以添加蒸馏水的实验组为空白对照。实验取5次平均值。
1.2.5 Plantaricin 163对热杀索丝菌上清液OD260、OD280的影响通过测定细胞上清在波长260 nm和280 nm吸光度的变化,初步分析Plantaricin 163对热杀索丝菌细胞膜完整性的影响。具体方法如下,将培养至对数期的热杀索丝菌调整OD600为0.4,加入Plantaricin 163至终浓度为1×MIC和2×MIC,在0、0.5、1.0、1.5、2.0、2.5、3.0 h时取定量培养液,4 ℃、5 000 r/min离心5 min后用紫外分光光度计测上清液的OD260和OD280,以STAA培养基调零为参比,以添加蒸馏水的实验组为空白对照。实验取5次平均值。
1.2.6 流式细胞实验经1×MIC Plantaricin 163处理0、10、30、60 min的细菌样品,5 000 r/min离心5 min,用0.02 mol/L PBS清洗2次,PBS重悬后添加浓度为10 μg/mL的碘化丙啶(Propidium iodide,PI)荧光染料,4 ℃孵育15 min,0.02 mol/L PBS清洗2次洗去未结合的PI染料,通过流式细胞仪在675 nm的发射波长条件下检测被荧光染料结合的菌体细胞数[20]。
1.2.7 扫描电镜和透射电镜分别采用扫描电镜(Scanning electron microscope,SEM)和透射电镜(Transmission electron microscope,TEM)观察敏感菌细胞外部形态变化和内部结构变化。将1×MIC的Plantaricin 163处理30 min和60 min的细菌样品,4 ℃、5 000 r/min离心5 min,用0.02 mol/L PBS清洗2次,菌体沉淀用2.5%的戊二醛固定8 h以上,磷酸缓冲液清洗3次,每次10 min,一式两份分别用于SEM和TEM的处理。SEM样品处理:50%、70%、80%、90%的乙醇梯度脱水各15 min;100%乙醇脱水3次,每次30 min;叔丁醇置换3次,每次30 min;冷冻干燥仪干燥样品,双面胶带将样品黏在样品台上,观察面向上,用离子溅射仪给样品镀10 nm金膜,用扫描电子显微镜观察并采集图像。TEM:1%−2%的锇酸固定2−3 h,磷酸缓冲液清洗3次,每次10 min;用50%、70%、80%、90%的丙酮梯度脱水各15 min,100%丙酮脱水3次,每次30 min;梯度浸渍后将样品放入盛有纯包埋剂的包埋板中,置于37、45、60 ℃条件下聚合各48 h;切成70−90 nm的超薄切片,染色清洗后,用透射电子显微镜观察并采集图像。以0.02 mol/L PBS处理的样品作为对照。
1.3 数据处理与分析应用SPSS 21.0软件对实验数据进行处理分析,结果用平均数±标准差表示。
2 结果与分析 2.1 MIC测定结果30 ℃静置培养24 h后,酶标仪测定菌液OD600。Plantaricin 163稀释到浓度为32 μg/mL时,OD600值不再增加,细菌不再生长,说明Plantaricin 163对热杀索丝菌的MIC为32 μg/mL。同样的方法测得Nisin对热杀索丝菌的MIC为64 μg/mL,可见Plantaricin 163的抑制效果比Nisin好。说明Plantaricin 163对热杀索丝菌有很强的抗菌活性,在食品防腐保鲜方面显示出很好的应用前景。
2.2 杀菌动力学测定了解一种抗菌物质的杀菌规律,对于实际生产应用有很好的指导作用。加入Plantaricin 163后30 min开始(图 1),处理组的活菌数明显下降,1 h时,1×MIC和2×MIC处理组菌活总数和对照组已分别相差2个和3个数量级,说明Plantaricin 163对热杀所丝菌的作用方式是杀菌模式。随着处理时间延长,处理组的菌落总数持续减少,处理4 h时,2×MIC处理组菌落总数的lg值已下降到2以下,6 h后处理组已检测不到活菌,说明Plantaricin 163对热杀所丝菌有很强的杀菌效果,能够完全杀死菌体,且这种杀伤作用存在时间依赖性,也是一个持续发挥作用的过程。同时,2×MIC处理组6 h内的活菌数都低于1×MIC处理组,可见2×MIC处理的杀菌效果明显优于1×MIC处理,说明Plantaricin 163对热杀所丝菌的杀伤作用存在浓度依赖性,可为具体生产实践中处理浓度和时间的应用提供参考依据。这与Zhu等[21]和Wen等[22]报道的植物乳杆菌素的作用规律相同。为了进一步了解Plantaricin 163对热杀索丝菌的作用机制,从细胞膜通透性和完整性,以及细胞外部形态和内部结构的改变等方面研究细胞的变化。

|
| 图 1 Plantaricin 163对热杀索丝菌的杀菌动力曲线 Figure 1 Time kill kinetics of Plantaricin 163 against B. thermosphacta |
|
|
上清电导率的变化能反映出细胞膜通透性的改变。在整个培养时期内,对照组的热杀索丝菌胞外电导率基本保持不变,而各处理组随着时间的延长而增大(图 2)。处理2 h后1×MIC处理组电导率保持在16.0 ms/cm左右,而2×MIC处理组电导率保持在17.0 ms/cm左右。说明Plantaricin 163处理后的热杀索丝菌膜透通性增加,导致离子外流,上清液中电导率增加。细胞膜是细菌抵抗杀菌物质发挥作用的重要屏障,细菌素发挥作用的重要步骤是破坏细胞膜的完整性。可见Plantaricin 163和大部分细菌素发挥作用的机制相似,首先通过与细菌膜上的特异位点结合,形成微小孔洞,引起跨膜电势消失,导致离子和ATP等泄露,因而引起胞外电导率增加[23]。具体与细胞膜的结合位点有待进一步的研究。

|
| 图 2 Plantaricin 163对热杀索丝菌电导率的影响 Figure 2 Effects of Plantaricin 163 on the electrical conductivity of B. thermosphacta |
|
|
为了了解热杀索丝菌细胞膜对核酸和蛋白等大分子物质的通透性,用紫外分光光度计测定处理前后上清液中OD260和OD280。加入Plantaricin 163处理后,上清液的OD260、OD280值不断增加,OD260在2.5 h后稳定(图 3A),OD280在2 h后稳定(图 3B)。最终1×MIC处理组OD260和OD280值分别达到0.72和0.66,2×MIC处理组OD260和OD280值分别达到0.91和0.87。说明Plantaricin 163不仅能增加热杀索丝菌细胞膜的通透性,还能进一步破坏膜的完整性,使细胞内的核酸和蛋白等大分子物质外泄,从而使上清液中OD260和OD280上升[24]。核酸、蛋白质和离子在维持细胞正常生长、代谢和形成细胞结构等方面发挥重要作用,外泄后代谢受阻,也会加速热杀索丝菌的死亡。
|
| 图 3 Plantaricin 163对热杀索丝菌上清液OD260和OD280的影响 Figure 3 Effects of Plantaricin 163 on the UV absorption of the B. thermosphacta supernatant at 260 nm and 280 nm |
|
|
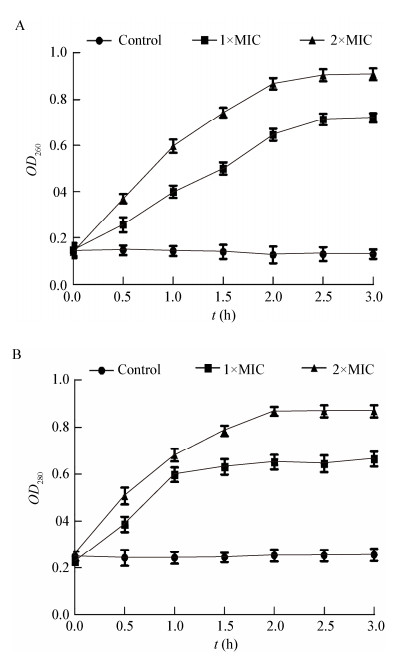
PI是一种可与DNA结合的核酸染料,它不能进入具有完整细胞膜的活细胞,当细胞膜的完整性被破坏后,可进入细胞内与DNA结合,在488 nm的激发波长下能检测到荧光,因此可以根据荧光强度的强弱反应细胞膜的受损伤程度[25]。未处理的热杀索丝菌中被荧光染料结合的细胞仅占5.7% (图 4A),可能是一些自然死亡的菌体。与Plantaricin 163作用10、30、60 min后,被荧光染料结合的细胞比例分别达到35.9%、62.4%和93.8%。图 4E更直观地看出热杀索丝菌的荧光强度随着处理时间的延长不断增加。以上结果进一步说明了Plantaricin 163处理会破坏细胞膜的完整性,且随着时间的延长,与PI结合的细胞不断增多,细胞膜破坏程度增加。细胞完整性的破坏是热杀索丝菌死亡的一个重要原因。
|
| 图 4 Plantaricin 163对热杀索丝菌损伤的流式细胞分析 Figure 4 Flow cytometry of cell damage of B. thermosphacta caused by Plantaricin 163 |
|
|
为了更加直观地观察Plantaricin 163对热杀索丝菌的作用方式,用SEM和TEM观察受试菌的外部形态和内部结构。未经处理的热杀索丝菌菌体呈长杆状,表面光滑,有光泽并伴有明显的二分裂现象(图 5A)。1×MIC细菌素作用30 min时,能观察到菌体表面凹陷、有褶皱(图 5B)。作用1 h时,视野内的菌体褶皱变多,细胞塌陷,表面粗糙(图 5C)。TEM图显示未经Plantaricin 163处理的热杀索丝菌菌体结构完整,内部原生质结构致密,能观察到完整的细胞膜和二分裂的隔膜(图 5D)。细菌素作用30 min时,细胞壁膜界限模糊,破损形成孔洞,内部结构疏松分布不均匀,形成空泡样(图 5E)。作用时间延长到1 h时,细胞破损进一步加重,膜结构脱落,大量内部物质外泄使细胞形成空泡化(图 5F)。以上结果表明,Plantaricin 163处理对热杀索丝菌的外部形态和内部结构均造成明显改变,随着作用浓度的增加,这种破坏程度不断加重。可见,外部形态和内部结构的改变是热杀索丝菌死亡的另一重要原因。

|
| 图 5 扫描电子显微镜和透射电子显微镜观察热杀索丝菌形态和内部结构 Figure 5 Morphology and internal structure of B. thermosphacta observed by scanning electron microscopy (SEM) and transmission electron microscopy (TEM) |
|
|
细菌素作为天然生物防腐剂,在肉制品和水产品保鲜中已得到了广泛使用。在水产品中乳酸菌细菌素被应用于冷冻烟熏蛙鱼、鲈鱼、罗非鱼等的贮藏保鲜中抑制单增李氏特菌和假单胞菌等的生长,显著延长了贮藏期[26]。Plantaricin 163是从植物乳杆菌中分离纯化得到的一种广谱细菌素,它对热杀索丝菌的作用效果优于目前国内唯一获得批准用于食品加工中的细菌素类防腐剂Nisin,显示出很好的应用前景。Plantaricin 163处理热杀索丝菌6 h后检测不到活菌数,说明Plantaricin 163对热杀索丝菌的作用方式为杀菌模式,且这种杀伤作用存在时间依赖性。这与大部分植物乳杆菌素的作用方式相同。目前,除了Plantaricin LC74[27]仅能够抑制细菌生长外,已知植物乳杆菌素的作用方式一般为杀菌和溶菌。
菌体的细胞膜是抵御外来侵害的首道防线,负责选择性渗透和能量驱动等重要生理功能,细胞膜通透性发生改变会影响细胞的正常生理功能。细菌素发挥抗菌作用的机制虽然不同,但作用目标通常是细胞膜,通过破坏细胞膜的通透性,造成膜结构和功能完整性的损失。因此,本研究首先通过测定Plantaricin 163作用过程中上清电导率的变化,来判断细胞膜通透性的变化,结果显示处理后的热杀索丝菌细胞膜通透性不断增加。说明Plantaricin 163对热杀索丝菌的作用也是先从细胞膜开始的。已有研究表明,Plantaricin L-1可以导致单增李斯特菌细胞膜通透性发生改变,使敏感细胞的胞内离子、乳酸脱氢酶、紫外吸收物质和ATP发生不同程度地泄漏,破坏了细胞膜△pH和部分△ψ,最终导致细胞的死亡[28]。Bifidocin A通过增加大肠杆菌细胞膜膜透性,破坏膜质子动力,形成细胞膜孔洞,改变膜完整性,从而使菌体细胞解体[29]。
通过OD260、OD280的测定以及流式细胞试验的分析,表明细胞膜的完整性也受到破坏,核酸和大分子物质外泄,荧光染料进入胞内和DNA结合,这很可能是由于细胞膜上形成孔洞而导致的,这一结果进一步通过SEM和TEM得到了直接观察。细菌素如Piscicocin CS526[30]、Lacticin 3147[31]等作用细胞膜后形成的是只能通过小分子的选择性孔洞,而Plantaricin 163抑菌机制所不同的是处理后细胞膜塌陷并有孔洞出现,细胞壁也受到不同程度的损伤,细胞壁完整性的破坏是细胞膜损伤进一步扩大的结果,形成无选择性的孔洞,可使小分子物质(K+和无机磷离子)和大分子物质(核酸、蛋白等)同时泄漏。还有的细菌素可以不破坏细胞膜直接作用于细胞壁,使其功能受到干扰。例如Lactococcin 972,它并不把细胞膜作为破坏对象,而是通过干扰隔膜的形成来抑制细胞的生长,也会和Lipid Ⅱ形成复合物来抑制肽聚糖的合成,从而导致细胞壁不能合成[32]。
此外,SEM和TEM结果表明,经Plantaricin 163处理后,热杀索丝菌不仅膜结构和外部形态受到影响,内部结构也发生了改变。内部结构疏松分布不均匀,形成空泡样,膜结构扭曲甚至脱落,大量内部物质外泄,细胞形态发生明显改变。在一些细菌素中也发现类似的现象。Rybal'chenko等[33]通过SEM研究表明,嗜酸乳杆菌产生的细菌素作用于弗氏志贺菌会引起敏感细胞的形态的变化破坏其结构。Lactocin XN8-A对金黄色葡萄球菌的SEM和TEM结果显示,与细菌素作用后菌体细胞凹陷,细胞壁受到损伤,内部结构松散[34]。但是Peptide 7显示出不同的作用现象,其虽然增加大肠杆菌细胞膜的通透性但只造成细胞膜的部分损伤,细胞的结构仍存在,仅在细胞表面形成孔洞[35]。这说明细菌素发挥作用的机制十分复杂,不同的细菌素作用方式也有差别。Vijayakumar等[36]研究发现混合不同作用机制的细菌素可以获得强效天然抗菌混合物,以更好地解决熟肉制品容易被污染的问题。因此,明确Plantaricin 163的抗菌机制对于筛选与其复配的保鲜剂也有重要意义。
总之,本实验从细胞膜通透性、细胞壁完整性以及菌体细胞形态和内部结构方面,阐释了Plantaricin 163对热杀索丝菌的作用机理。发现Plantaricin 163能够与热杀索丝菌细胞膜相结合,增加膜通透性,形成孔洞,导致离子等外泄,进而破坏细胞膜完整性,导致核酸、蛋白质等大分子物质泄露,代谢受阻。同时,菌体结构受损,形态发生改变,内部结构受到影响,最终导致细胞死亡。由此可见,Plantaricin 163对热杀索丝菌的作用机制与Class Ⅱ类细菌素相似[37],这与Lactocin XN8-A作用的大肠杆菌和Enterocin CRL35作用的单增李斯特菌显示的结果一致[34, 38]。关于Plantaricin 163进入热杀索丝菌后如何干扰细菌基因表达和蛋白产生,对菌体多种代谢过程产生影响,有待进一步研究。
| [1] |
Jiang Y, Gao F, Xu XL, et al. Microfloral change of vacuum-packaged pork during chilled storage[J]. Food Science, 2011, 32(4): 241-245. (in Chinese) 江芸, 高峰, 徐幸莲, 等. 真空包装冷却猪肉冷藏过程中菌相变化[J]. 食品科学, 2011, 32(4): 241-245. |
| [2] |
Reid R, Fanning S, Whyte P, et al. The microbiology of beef carcasses and primals during chilling and commercial storage[J]. Food Microbiology, 2017, 61: 50-57. DOI:10.1016/j.fm.2016.08.003 |
| [3] |
Silbande A, Adenet S, Smith-Ravin J, et al. Quality assessment of ice-stored tropical yellowfin tuna (Thunnus albacares) and influence of vacuum and modified atmosphere packaging[J]. Food Microbiology, 2016, 60: 62-72. DOI:10.1016/j.fm.2016.06.016 |
| [4] |
Ai YW, Wang HX, Xiong DP. Mechanism research of Brochothrix thermosphacta in protein degradation of chilled pork[J]. Food Science and Technology, 2015, 40(5): 166-170. (in Chinese) 艾有伟, 王宏勋, 熊丹萍. 热杀索丝菌降解猪肉蛋白机制研究[J]. 食品科技, 2015, 40(5): 166-170. |
| [5] |
Motarjemi Y, Moy G, Todd E. Encyclopedia of Food Safety[M]. Amsterdam: Elsevier, 2014: 474-476.
|
| [6] |
Kapetanakou AE, Skandamis PN. Applications of active packaging for increasing microbial stability in foods: natural volatile antimicrobial compounds[J]. Current Opinion in Food Science, 2016, 12: 1-12. |
| [7] |
Arena MP, Silvain A, Normanno G, et al. Use of Lactobacillus plantarum strains as a bio-control strategy against food-borne pathogenic microorganisms[J]. Frontiers in Microbiology, 2016, 7: 464. |
| [8] |
Ahmad V, Khan MS, Jamal QMS, et al. Antimicrobial potential of bacteriocins: in therapy, agriculture and food preservation[J]. International Journal of Antimicrobial Agents, 2017, 49(1): 1-11. DOI:10.1016/j.ijantimicag.2016.08.016 |
| [9] |
Cotter PD, Ross RP, Hill C. Bacteriocins—a viable alternative to antibiotics?[J]. Nature Review Microbiology, 2013, 11(2): 95-105. DOI:10.1038/nrmicro2937 |
| [10] |
Bierbaum G, Sahl HG. Lantibiotics: mode of action, biosynthesis and bioengineering[J]. Current Pharmaceutical Biotechnology, 2009, 10(1): 2-18. DOI:10.2174/138920109787048616 |
| [11] |
Oppedijk SF, Martin NI, Breukink E. Hit'em where it hurts: The growing and structurally diverse family of peptides that target lipid-Ⅱ[J]. Biochimica et Biophysica Acta (BBA) – Biomembranes, 2016, 1858(5): 947-957. DOI:10.1016/j.bbamem.2015.10.024 |
| [12] |
Diep DB, Skaugen M, Salehian Z, et al. Common mechanisms of target cell recognition and immunity for class Ⅱ bacteriocins[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(7): 2384-2389. DOI:10.1073/pnas.0608775104 |
| [13] |
Wiedemann I, Breukink E, van Kraaij C, et al. Specific binding of nisin to the peptidoglycan precursor lipid Ⅱ combines pore formation and inhibition of cell wall biosynthesis for potent antibiotic activity[J]. Journal of Biological Chemistry, 2001, 276(3): 1772-1779. DOI:10.1074/jbc.M006770200 |
| [14] |
Thompson RE, Collin F, Maxwell A, et al. Synthesis of full length and truncated microcin B17 analogues as DNA gyrase poisons[J]. Organic & Biomolecular Chemistry, 2014, 12(10): 1570-1578. |
| [15] |
Li XX, Zeng WW, Lu ZX, et al. PCR-DGGE analysis of microbial community composition and preservation of crucian carp during storage[J]. Food Science, 2017, 38(5): 274-280. 李秀秀, 曾维伟, 陆兆新, 等. 鲫鱼贮藏过程中微生物菌相PCR-DGGE分析及其防腐保鲜[J]. 食品科学, 2017, 38(5): 274-280. |
| [16] |
Hu MZ, Zhao HZ, Zhang C, et al. Purification and characterization of plantaricin 163, a novel bacteriocin produced by Lactobacillus plantarum 163 isolated from traditional Chinese fermented vegetables[J]. Journal of Agricultural and Food Chemistry, 2013, 61(47): 11676-11682. DOI:10.1021/jf403370y |
| [17] |
Clinical and Laboratory Standards Institute. M07-A9: Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically: approved standards[Z]. 9th Edition. CLSI: Wayne, PA, 2012
|
| [18] |
Lü X, Yi LH, Dang J, et al. Purification of novel bacteriocin produced by Lactobacillus coryniformis MXJ 32 for inhibiting bacterial foodborne pathogens including antibiotic-resistant microorganisms[J]. Food Control, 2014, 46: 264-271. DOI:10.1016/j.foodcont.2014.05.028 |
| [19] |
Han JZ, Zhao SM, Ma Z, et al. The antibacterial activity and modes of LI-F type antimicrobial peptides against Bacillus cereus in vitro[J]. Journal of Applied Microbiology, 2017, 123(3): 602-614. DOI:10.1111/jam.2017.123.issue-3 |
| [20] |
Sunny-Roberts EO, Knorr D. Evaluation of the response of Lactobacillus rhamnosus VTT E-97800 to sucrose-induced osmotic stress[J]. Food Microbiology, 2008, 25(1): 183-189. DOI:10.1016/j.fm.2007.05.003 |
| [21] |
Zhu X, Zhao YZ, Sun YL, et al. Purification and characterisation of plantaricin ZJ008, a novel bacteriocin against Staphylococcus spp. from Lactobacillus plantarum ZJ008[J]. Food Chemistry, 2014, 165: 216-223. DOI:10.1016/j.foodchem.2014.05.034 |
| [22] |
Wen LS, Philip K, Ajam N. Purification, characterization and mode of action of plantaricin K25 produced by Lactobacillus plantarum[J]. Food Control, 2016, 60: 430-439. DOI:10.1016/j.foodcont.2015.08.010 |
| [23] |
Ren LY, Yang YY, Zhang JM, et al. Advance on antibacterial mechanism of lactic acid bacteria antimicrobial peptides[J]. China Food Additives, 2015(1): 143-149. (in Chinese) 任璐雅, 杨艳艳, 章检明, 等. 乳酸菌抗菌肽(细菌素)抗菌机理的研究进展[J]. 中国食品添加剂, 2015(1): 143-149. DOI:10.3969/j.issn.1006-2513.2015.01.018 |
| [24] |
Qian SQ. Study on regulation of efficient biosynthesis and control of Aspergillus ochraceus growth by Bacillomycin D[D]. Nanjing: Doctoral Dissertation of Nanjing Agricultural University, 2015: 92-98 (in Chinese) 钱时权. Bacillomycin D的高效合成调控及赭曲霉污染控制研究[D].南京: 南京农业大学博士学位论文, 2015: 92-98 |
| [25] |
Gut IM, Blanke SR, van der Donk WA. Mechanism of inhibition of Bacillus anthracis spore outgrowth by the lantibiotic nisin[J]. ACS Chemical Biology, 2011, 6(7): 744-752. DOI:10.1021/cb1004178 |
| [26] |
Lü XR, Bai FX, Li JR. Research progress in the application of biological preservation with lactic acid bacteria in aquatic products[J]. Science and Technology of Food Industry, 2014, 35(2): 340-345. (in Chinese) 吕欣然, 白凤翎, 励建荣. 乳酸菌生物保鲜在水产品中的应用研究进展[J]. 食品工业科技, 2014, 35(2): 340-345. |
| [27] |
Rekhif N, Atrih A, Lefebvre G. Characterization and partial purification of plantaricin LC74, a bacteriocin produced by Lactobacillus plantarum LC74[J]. Biotechnology Letters, 1994, 16(8): 771-776. DOI:10.1007/BF00133952 |
| [28] |
Zhou W, Liu GR, Li PL, et al. Mode of action of plantaricin L-1, an antilisteria bacteriocin produced by Lactobacillus plantarum[J]. Acta Microbiologica Sinica, 2007, 47(2): 260-264. (in Chinese) 周伟, 刘国荣, 李平兰, 等. 植物乳杆菌素L-1对单核细胞增生李斯特氏菌作用机理的研究[J]. 微生物学报, 2007, 47(2): 260-264. DOI:10.3321/j.issn:0001-6209.2007.02.015 |
| [29] |
Liu GR, Song ZQ, Yang XL, et al. Antibacterial mechanism of bifidocin A, a novel broad-spectrum bacteriocin produced by Bifidobacterium animalis BB04[J]. Food Control, 2016, 62: 309-316. DOI:10.1016/j.foodcont.2015.10.033 |
| [30] |
Suzuki M, Yamamoto T, Kawai Y, et al. Mode of action of piscicocin CS526 produced by Carnobacterium piscicola CS526[J]. Journal of Applied Microbiology, 2005, 98: 1146-1151. DOI:10.1111/jam.2005.98.issue-5 |
| [31] |
Mcauliffe O, Ryan MP, Ross RP, et al. Lacticin 3147, a broad-spectrum bacteriocin which selectively dissipates the membrane potential[J]. Applied and Environmental Microbiology, 1998, 64: 439-445. |
| [32] |
Martínez B, Böttiger T, Schneider T, et al. Specific interaction of the unmodified bacteriocin lactococcin 972 with the cell wall precursor lipid Ⅱ[J]. Applied and Environmental Microbiology, 2008, 74(15): 4666-4670. DOI:10.1128/AEM.00092-08 |
| [33] |
Rybal'chenko OV, Bondarenko VM, Verbitskaia NB. Ultrastructural changes in Shigella flexneri cells during interaction with bacteriocinogenic Lactobacillus acidophilus[J]. Zhurnal Mikrobiologii, Epidemiologii, I Immunobiologii, 2006(4): 50-53. |
| [34] |
Yi LH, Dang J, Zhang LH, et al. Purification, characterization and bactericidal mechanism of a broad spectrum bacteriocin with antimicrobial activity against multidrug-resistant strains produced by Lactobacillus coryniformis XN8[J]. Food Control, 2016, 67: 53-62. DOI:10.1016/j.foodcont.2016.02.008 |
| [35] |
Li LR, Shi YH, Le GW. Antibacterial activity and mechanisms of a new peptide derived from cell-penetrating peptide[J]. Acta Microbiologica Sinica, 2013, 53(9): 950-956. (in Chinese) 李莉蓉, 施用晖, 乐国伟. 来自穿膜肽的新肽的抗菌活性及抑菌机制[J]. 微生物学报, 2013, 53(9): 950-956. |
| [36] |
Vijayakumar PP, Muriana PM. Inhibition of Listeria monocytogenes on Ready-to-Eat meats using bacteriocin mixtures based on Mode-of-Action[J]. Foods, 2017, 6(3): E22. DOI:10.3390/foods6030022 |
| [37] |
Ingolf FN, Dag AB, Dzung BD, et al. Chapter 16-Class Ⅱ Non-lantibiotic bacteriocins[J]. Pittsburgh: Academic Press, 2013, 85-92. |
| [38] |
Minahk CJ, Farías ME, Sesma F, et al. Effect of Enterocin CRL35 on Listeria monocytogenes cell membrane[J]. FEMS Microbiology Letters, 2000, 192(1): 79-83. DOI:10.1111/fml.2000.192.issue-1 |
 2018, Vol. 45
2018, Vol. 45