扩展功能
文章信息
- 乐尧金, 郭众, 阳小燕
- LE Yao-Jin, GUO Zhong, YANG Xiao-Yan
- 肺炎链球菌血红素结合脂蛋白PiuA的表达、纯化和表征
- Expression, purification and characterization of hemin-binding lipoprotein PiuA from Streptococcus pneumoniae
- 微生物学通报, 2018, 45(11): 2409-2417
- Microbiology China, 2018, 45(11): 2409-2417
- DOI: 10.13344/j.microbiol.china.180017
-
文章历史
- 收稿日期: 2018-01-06
- 接受日期: 2018-03-28
- 网络首发日期(www.cnki.net): 2018-04-12
肺炎链球菌是一种革兰氏阳性菌,会引起肺炎、脑膜炎、鼻窦炎、中耳炎、菌血症等一系列疾病,对人类(特别是儿童、老人、艾滋病患者和其他免疫缺陷患者)健康造成重大威胁[1-2]。WHO估算全球每年有至少120万婴幼儿死于肺炎链球菌引起的疾病,其中90%为发展中国家儿童[3-4]。疫苗和抗生素是目前预防和治疗肺炎链球菌感染疾病的主要手段。但是近年来随着各种抗生素在临床上的广泛使用以及不合理应用,导致了细菌的抗药性迅速提高和传播,耐青霉素肺炎链球菌(Penicillin resistant Streptococcus pneumoniae,PRSP)在世界范围内广泛传播(同时伴有对其他抗生素的多重耐药)。一些地区的菌株对青霉素的耐药率高达45%,使得肺炎链球菌感染的治疗面临越来越大的困难[5]。由于耐抗生素的肺炎链球菌的发生率越来越高,抗菌药的研究与开发速度已远远跟不上细菌耐药的速度,因此迫切需要筛选新的药物用于治疗肺炎链球菌感染性疾病。
在过去的10年里,人们发现过渡金属离子在宿主-病原体相互作用过程中发挥着重要作用,尤其是铁离子作为过渡金属对细菌的细胞生理学尤为重要[6-8]。铁是绝大多数细菌生存和感染所必需的元素,但是宿主环境中游离存在的铁离子非常有限(< 10-18 mol/L),所以细菌进化出了对铁离子具有高度亲和力的铁ABC摄取系统(Iron ABC uptake systems),这些系统可直接从宿主细胞中的转铁蛋白、含血红素蛋白和非血红素含铁蛋白中掠夺铁离子。由于铁ABC摄取系统在链球菌中具有高度的保守性,均由类似的蛋白(脂蛋白、ATP结合蛋白和疏水的膜蛋白)构成,且其中的脂蛋白是暴露在细胞膜外的,可以成为这些细菌引发的感染性疾病的疫苗候选物和药物靶标[9-11]。因此,针对细菌铁摄取系统和铁代谢设计的抗菌药物和疫苗也逐渐成为研究热点,对解决当前耐药菌感染和细菌耐药性问题意义重大[12-15]。
肺炎链球菌中已知的铁ABC摄取系统有4个,即血红素转运系统PiuABCD、铁色素转运系统PiaABCD、铁离子转运系统PitABCD、以及新发现的铁转运系统Operon 804[16-18]。其中脂蛋白PiuA和PiaA存在于所有已知的肺炎链球菌中,是小鼠全身和肺部感染模型中所必需的毒力因子,用重组表达的PiuA和PiaA蛋白作为抗原免疫小鼠,能帮助小鼠对抗侵袭性肺炎链球菌疾病,因此PiuA和PiaA蛋白被认为是一种新型的有前景的肺炎链球菌疫苗[19-22]。本实验拟对肺炎链球菌血红素转运系统脂蛋白PiuA进行克隆、表达和纯化,并在体外表征PiuA蛋白的血红素结合特性,为针对PiuABCD血红素转运系统设计抗菌药物奠定基础。
1 材料与方法 1.1 菌株和质粒肺炎链球菌D39 (Streptococcus pneumoniae D39),美国菌种保藏中心(American type culture collection,ATCC);大肠杆菌(Escherichia coli) Top10菌株和载体pBAD-HisA,Invitrogen公司。
1.2 主要试剂和仪器Todd-Hewitt Broth和Yeast extract,OXOID公司;细菌DNA提取试剂盒,OMEGA公司;PrimeSTAR HS (Premix)、DNA Maker、T4 DNA连接酶和各种限制性内切酶,TaKaRa公司;PCR产物纯化回收试剂盒、胶回收试剂盒,天根生化科技有限公司;Ni-NTA亲和层析纯化柱,QIAGEN公司;重组肠激酶,中大南海海洋生物技术工程中心有限公司;L-(+)阿拉伯糖、Hemin和氨苄青霉素,Sigma公司;小鼠His-tag单克隆抗体,碧云天生物技术有限公司;羊抗鼠二抗,Abcam公司;ECL化学发光液,Bio-Rad公司。
普通PCR仪,Applied Biosystems公司;超声波细胞破碎仪,宁波新芝生物仪器公司;圆二色谱仪,应用物理公司;紫外分光光度仪、NanoDrop 2000C超微量分光光度计和电感耦合等离子体质谱仪ICP-MS,Thermo公司;荧光分光光度计,日立高新技术公司。
1.3 piuA基因的克隆、重组质粒pBAD/HisA- piuA的构建和鉴定根据GenBank数据库中肺炎链球菌D39的piuA (spd_1652)基因序列,利用Primer Premier 5.0设计并合成编码去信号肽脂蛋白piuA基因的引物,piuA-F:5′-GGCGGC GAGCTCGAGACCAGT AGCTCTGCTC-3′ (划线部分为Sac Ⅰ酶切位点),piuA-R:5′-CGCCGCGAATTCTTATTTCAAAGCT TTTTG-3′ (划线部分为Eco RⅠ酶切位点),以肺炎链球菌D39总基因组DNA为模板扩增目的基因,PCR反应体系(100 μL):PrimeSTAR HS (Premix) 50 μL,引物piuA-F和piuA-R (10 μmol/L)各4 μL,DNA模板(100 ng/μL) 2 μL,ddH2O 40 μL。PCR反应条件:95 ℃ 5 min; 94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。
用1%琼脂糖凝胶电泳检测PCR产物,利用胶回收试剂盒回收纯化目的片段。用Sac Ⅰ、Eco RⅠ内切酶进行双酶切回收的目的基因片段及载体pBAD-HisA,37 ℃酶切4 h,T4 DNA连接酶连接目的基因和载体,连接比例为目的基因:载体为4: 1,16 ℃连接过夜,取20 μL连接产物转化至E. coli Top10感受态细胞,经氨苄青霉素抗性平板筛选阳性重组子,对其进行双酶切验证及DNA测序验证,经NCBI BLAST比对分析测序结果,得到正确的重组质粒命名为pBAD/HisA- piuA。
1.4 重组蛋白PiuA-His的诱导表达、纯化和不含His标签PiuA蛋白的获得将测序正确的含pBAD/HisA- piuA质粒的Top10菌株接种于含有氨苄青霉素(100 ng/μL)的LB培养基中,37 ℃、220 r/min振荡培养过夜。次日将活化的菌种按1: 100转接入新鲜培养基扩大培养,37 ℃、220 r/min振荡培养至OD600约为0.6-0.8时,加入L-(+)阿拉伯糖至终浓度为0.04%,同样的条件继续诱导表达4-6 h后收集菌体,4 ℃、6 000 r/min离心30 min,并用1×PBS缓冲液洗涤菌体2次。将收集到的菌体于液氮和37 ℃反复冻融3次,然后冰浴超声30 min (5 s开,5 s关)至菌液变澄清透亮,超声破碎物于4 ℃、10 000 r/min离心30 min,弃沉淀,上清液用于过柱纯化。
采用Ni-NTA亲和层析纯化柱对重组蛋白进行纯化,具体步骤根据说明书所示。利用10 kD超滤管浓缩融合蛋白,4 ℃、5 000 r/min超滤至500 μL,用20 mmol/L Tris-HCl (含100 mmol/L NaCl)洗3次。利用重组肠激酶切掉含有6×His标签的融合蛋白(室温,16 h)。将酶切产物再次经Ni-NTA柱分离,上样后的初次流出液即为去掉标签的PiuA蛋白。用12% SDS-PAGE对PiuA蛋白的纯度进行检测,并用Western blotting对获得的PiuA蛋白进行鉴定。
1.5 Western blotting鉴定PiuA蛋白分别取3 μg的PiuA-His重组蛋白和不含His标签的PiuA蛋白于12% SDS-PAGE进行分离,通过湿转法将蛋白转印至PVDF膜上,5%脱脂奶粉封闭2 h,按照1: 1 000比例稀释加入小鼠His-tag单克隆抗体,或者按照1: 2 000比例稀释加入我们自己制备的小鼠PiuA多克隆抗体,4 ℃孵育过夜。洗脱后加入辣根过氧化物酶(HRP)标记的羊抗鼠二抗,室温孵育1 h,再次洗去未结合的二抗,最后通过ECL化学发光液检测。
1.6 PiuA蛋白的血红素结合特性研究 1.6.1 电感耦合等离子体质谱仪(ICP-MS)检测纯化的PiuA蛋白中金属含量纯化后的PiuA蛋白用10 kD超滤管浓缩后经BCA法测定蛋白浓度,用超纯水将蛋白样品稀释至5 μmol/L,在样品中加入10 μmol/L标准品铟作为内参,送暨南大学分析测试中心,用ICP-MS仪器测定样品中的金属元素含量(Fe、Mn、Zn、Cu、In),每个金属元素重复测定3次。
1.6.2 Apo-PiuA蛋白样品的制备纯化后的PiuA蛋白溶液呈粉红色,经ICP-MS测定后含有等摩尔的铁,后续的实验需要用到apo-PiuA (即不含金属元素的PiuA),因此采用盐酸胍变性方法去除PiuA蛋白中的金属离子并通过透析使蛋白尽可能回复到天然活性状态。盐酸胍在高浓度(4-8 mol/L)水溶液时能断裂氢键,从而使蛋白质发生不同程度的变性,且盐酸胍引起的变性通常是可逆的。盐酸胍变性具体步骤:500 μL的高浓度PiuA (25 μg/μL)样品,加入盐酸胍(终浓度为8 mol/L)至2 mL左右,4 ℃处理4 h后,加入50 mmol/L的EDTA至终浓度为25 mmol/L,4 ℃过夜处理(约12 h)。接下来先用20 mmol/L Tris-HCl缓冲液(含10 mmol/L的EDTA和100 mmol/L的NaCl,pH 7.4)透析一次,然后用20 mmol/L Tris-HCl缓冲液(含100 mmol/L的NaCl,pH 7.4)继续透析4次,最后用10 kD超滤管浓缩后经BCA法测定蛋白浓度,将apo-PiuA蛋白样品用超纯水稀释至5 μmol/L,利用ICP-MS仪器测定样品中的金属元素含量(Fe、Mn、Zn、Cu、In)。
1.6.3 圆二色谱(CD)分析PiuA蛋白的二级结构远紫外区(190-250 nm) CD光谱主要反映蛋白质氨基酸间肽键的圆二色性。二级结构不同的蛋白由于α螺旋、β折叠及无规卷曲在远紫外区具有特征吸收峰,在CD光谱中呈现不同的特征谱峰。圆二色谱测定野生型蛋白PiuA、apo-PiuA及结合血红素(Hemin)的PiuA (PiuA+Hemin)的二级结构。高浓度的蛋白样品用20 mmol/L Tris-HCl (含100 mmol/L NaCl,pH 7.4)缓冲液稀释至3 μmol/L的测试蛋白样品,样品池为石英比色皿(1 mm),测定参数如下:扫描波长190-250 nm,扫描温度25 ℃,扫描速率100 nm/min,带宽1.0 nm。每次扫描重复3次,取平均值得到平滑曲线即为最后的CD光谱,扣除缓冲液背景。蛋白二级结构用CDPro软件进行计算。
1.6.4 紫外光谱检测PiuA蛋白与血红素结合情况Apo-PiuA (50 μmol/L)与过量Hemin室温孵育2 h后,依次过脱盐柱和10 kD超滤柱,用缓冲液洗6次,去掉不与PiuA结合以及非特异结合的Hemin,剩下的样品即为血红素特异饱和的PiuA蛋白,命名为PiuA+Hemin。用20 mmol/L Tris-HCl (pH 7.4,含有100 mmol/L NaCl)缓冲液分别制备浓度均为25 μmol/L Hemin溶液、apo-PiuA溶液和PiuA+Hemin溶液各500 μL,分别按照相同的参数用紫外分光光度计从200-600 nm波段进行扫描,每个实验重复扫描3次。
1.6.5 荧光光谱检测PiuA蛋白与血红素结合情况用20 mmol/L Tris-HCl (pH 7.4,含有100 mmol/L NaCl)缓冲液稀释apo-PiuA蛋白至终浓度为3 μmol/L,用相同的缓冲液制备3 mmol/L高浓度的Hemin溶液,依次向apo-PiuA蛋白溶液滴加0.2倍当量的Hemin溶液,每滴加一次,打开磁力搅拌器搅拌5 min,使蛋白与金属离子反应完全,然后扫描荧光猝灭光谱,每次扫描均重复3次,实验条件和参数如下:1 cm四面透光的石英比色皿,内有磁力搅拌子不断搅拌,激发波长280 nm,扫描范围300-450 nm,扫描速度1 200 nm/min,电压530 V,激发单元狭缝5.0 nm,发射单元狭缝5.0 nm,设置自动响应时间,水浴锅温度设置25 ℃恒温。获得的实验数据用Origin 8.5软件中的Hill方程拟合,计算得出PiuA蛋白与Hemin的结合常数K。
2 结果与分析 2.1 重组表达载体pBAD/HisA- piuA构建和鉴定以肺炎链球菌D39总基因组DNA为模板,PCR反应扩增去除信号肽的piuA基因(870 bp),扩增产物经1%琼脂糖凝胶验证(图 1A),与目的基因大小吻合。随机在Amp抗性平板上挑选8个piuA连接转化后的克隆,提取质粒,Sac Ⅰ、Eco RⅠ双酶切鉴定,进行1%琼脂糖凝胶电泳,结果有5个阳性克隆的插入片段与目的基因大小一致(图 1B)。为进一步确认重组质粒的正确性,将所得的阳性克隆送Invitrogen公司测序,测序结果经序列比对显示目的基因与NCBI数据库中的肺炎链球菌D39的piuA基因100%匹配,且没有发生移码和基因突变,表明重组表达载体pBAD/HisA- piuA构建成功。

|
| 图 1 piuA基因的扩增及重组表达载体pBAD/HisA- piuA的鉴定 Figure 1 Amplification of piuA and identification of recombinant plasmid pBAD/HisA- piuA 注:A:PCR扩增piuA基因;B:重组表达载体pBAD/HisA-piuA双酶切验证. Note: A: PCR product of piuA; B: Restriction enzyme analysis recombinant plasmid pBAD/HisA-piuA with Sac I and Eco RⅠ. |
|
|
将测序正确的含pBAD/HisA- piuA质粒的Top10菌株接种到LB培养基中,经L-(+)阿拉伯糖诱导表达4-6 h后收集菌体,超声破碎裂解菌体,裂解后的全蛋白上清液通过Ni-NTA亲和层析柱纯化,用不同浓度咪唑(10-500 mmol/L)进行梯度洗脱,在50 mmol/L咪唑浓度洗脱液中能最大量收获条带单一的PiuA-His融合蛋白(图 2A),表明PiuA-His融合蛋白是可溶性表达的。重组肠激酶能识别序列DDDDK,将His标签切掉,纯化后的不含His标签的PiuA蛋白经12% SDS-PAGE分析,可以看出经过纯化后得到单一的PiuA (31.6 kD)蛋白条带(图 2B),且蛋白纯度在95%以上。另外由于PiuA-His融合蛋白带有标签蛋白His,可与Anti-His抗体发生特异性抗原-抗体反应,因此运用His抗体作为一抗,进行Western blotting检测,从PVDF膜上可观察到特异的单一蛋白条带(图 2C),且分子量大小与PiuA蛋白一致;另一方面,运用PiuA鼠多克隆抗体作为一抗,进行Western blotting检测了PiuA-His和PiuA蛋白,如图 2D所示,从PVDF膜上可观察到特异的单一蛋白条带。以上结果表明PiuA蛋白制备成功,可进一步用于体外生化表征。

|
| 图 2 PiuA-His融合蛋白和PiuA蛋白的纯化检测和Western blotting验证 Figure 2 Detection of PiuA-His fusion protein and PiuA protein with 12% SDS-PAGE, and verification of them by using Western blotting 注:A:12%的SDS-PAGE检测PiuA-His融合蛋白;1:蛋白Marker;2:全蛋白上清液;3:10 mmol/L咪唑洗脱液;4:50 mmol/L咪唑洗脱液;B:12%的SDS-PAGE检测PiuA蛋白,5:纯化后的PiuA蛋白;C:Western blotting验证PiuA-His融合蛋白和PiuA蛋白,His抗体作为一抗;D:Western blotting验证PiuA-His融合蛋白和PiuA蛋白,PiuA鼠多克隆抗体作为一抗. Note: A: Detection of PiuA-His fusion protein with 12% SDS-PAGE; 1: Protein marker; 2: Whole protein supernatant; 3: Proteins eluted with 10 mmol/L imidazole; 4: Proteins eluted with 50 mmol/L imidazole; B: Detection of PiuA protein with 12% SDS-PAGE, 5: Purified PiuA protein; C: Verification of PiuA-His fusion protein and PiuA protein by using Western blotting with His antibody; D: Verification of PiuA-His fusion protein and PiuA protein by using Western blotting with PiuA mouse polyclonal antibody. |
|
|
纯化后的PiuA蛋白溶液呈粉红色,ICP-MS测定结果显示,纯化后的每个PiuA蛋白分子含有一个铁离子,不含其他金属离子(表 1)。经过摸索,最终采用8 mol/L的盐酸胍和25 mmol/L的EDTA对PiuA蛋白进行变性螯合出其中的血红素,获得apo-PiuA蛋白,然后经过48 h的透析使蛋白复性,ICP-MS测定结果显示,apo-PiuA蛋白不含任何金属离子(表 1)。
| Proteins | Fe (μmol/L) | Mn (μmol/L) | Zn (μmol/L) | Cu (μmol/L) | In (μmol/L) |
| PiuA | 5.01±0.22 | 0.15±0.08 | 1.12±0.25 | 0.13±0.08 | 9.95±0.50 |
| apo-PiuA | 0.66±0.12 | 0.25±0.06 | 0.95±0.08 | 0.05±0.00 | 10.18±0.38 |
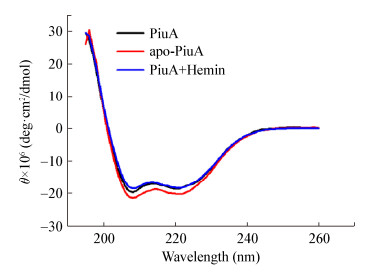
从图 3的CD光谱得知,PiuA、apo-PiuA和PiuA+Hemin蛋白的二级结构几乎一致,表明采用盐酸胍变性方法获得的apo-PiuA蛋白通过透析的方法恢复到了天然的状态,可用于后续的实验。同时发现PiuA蛋白与Hemin结合后,其二级结构几乎不发生改变。
|
| 图 3 CD分析PiuA、apo-PiuA和PiuA+Hemin蛋白的二级结构 Figure 3 Secondary structures of PiuA, apo-PiuA and PiuA+Hemin by using CD analysis |
|
|
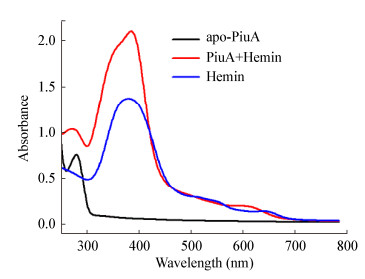
将30 μmol/L血红素溶液、apo-PiuA溶液和PiuA+Hemin溶液分别进行紫外分光光度计扫描后,紫外光谱图 4显示apo-PiuA蛋白只在280 nm处有一蛋白特征吸收峰,PiuA+Hemin蛋白除了在280 nm的蛋白吸收峰外,还在401 nm处有一血红素特征吸收峰,且与等摩尔量的Hemin的吸收峰相比,吸收峰向长波长方向移动,即有明显的红移(图 4),表明PiuA蛋白具有血红素结合能力。
|
| 图 4 apo-PiuA蛋白与血红素结合的紫外光谱检测 Figure 4 UV spectroscopy analysis of PiuA with (PiuA+Hemin) and without (apo-PiuA) hemin |
|
|
apo-PiuA蛋白与血红素结合的强弱可以利用荧光光谱检测,向apo-PiuA蛋白溶液(3 μmol/L)中不断滴加高浓度Hemin,由于apo-PiuA蛋白与Hemin结合后相互作用产生微环境变化从而造成电子跃迁,然后回至基态,在333 nm处发生荧光猝灭现象(图 5A),表明Hemin的结合引起了apo-PiuA蛋白空间构象的变化。根据Origin 8.5软件中的Hill方程[y = Vmax× xn/(kn+ xn)]对Hemin浓度和333 nm处的绝对荧光值做曲线拟合,计算得出apo-PiuA蛋白与Hemin结合常数为K =3.4×105 L/mol (图 5B)。

|
| 图 5 apo-PiuA与血红素结合的荧光光谱图(A)以及Hill方程拟合的曲线(B) Figure 5 Fluorescence spectroscopy of hemin titration to apo-PiuA protein (A), and the fluorescence quenching at 333 nm was fitted with a Hill plot to calculate the binding constant K (B) |
|
|
铁离子是细胞代谢过程中许多蛋白或酶的辅助因子,主要参与电子传递、氧的激活、呼吸作用、过氧化氢物的还原、氨基酸和DNA的合成以及光合作用等代谢过程,是大多数细菌生存以及形成感染的必需元素[8, 23-25]。肺炎链球菌作为当今世界范围内引发感染和死亡的重要病原菌之一,在感染宿主(人)过程中,必须从人体获得养分,这其中就包括铁、锰、锌、铜等微量元素[6]。血红素占人体总铁源的80%以上,为了从人体中获取血红素满足自身的生存和感染,肺炎链球菌进化出了血红素摄取系统PiuABCD。依靠该摄取系统的ATP结合蛋白PiuB提供能量,脂蛋白PiuA作为底物结合蛋白能够直接特异地结合血红素,并与膜蛋白PiuC和PiuD相互作用将血红素释放并转运到肺炎链球菌体内。由于脂蛋白PiuA存在于所有已知的肺炎链球菌中,目前已被证明是潜在的肺炎链球菌疫苗候选物,但是目前对PiuA蛋白结合和释放血红素的过程并没有细致深入地研究。
金属组学(Metallomics)是2002年逐渐发展起来的一门综合研究生命体内金属和类金属元素的分布、存在的形态、属性、含量、与其他生物大分子结合的结构及其在生物体中的生理作用和功能的学科[26],开展金属组学和金属蛋白质组学研究将有助于认识微量元素生物效应及其机理、与微量元素相关疾病的发生机制的基础,同时也是金属药物设计的理论依据[27]。目前常用的研究金属蛋白质体外结构与功能研究的技术主要有电感耦合等离子体质谱仪(ICP-MS)、圆二色谱(CD)、紫外光谱、荧光光谱、停留光谱仪、等温热滴定仪(ITC)、电子顺磁共振(EPR)、X射线衍射、核磁共振(NMR)、X射线吸收光谱等[27]。其中ICP-MS能分析溶液中含量在ppb或者ppb以下的一系列金属元素和B、Si、As、Te、P、Se、S等非金属元素[27];圆二色谱(CD)能利用平面偏振光研究溶液中蛋白质、DNA等生物大分子二级和三级结构和构象变化[28];由于蛋白大分子中含有具有环状共轭体系的芳香族氨基酸,在近紫外区190-400 nm处发生n-π电子跃迁,产生紫外光谱,同样地,蛋白大分子内部的芳香族氨基酸也能在氙灯光源照射下,发生电子跃迁而产生荧光光谱,因此紫外光谱和荧光光谱被广泛应用于研究蛋白质结构和构象、蛋白与小分子或者金属离子的相互作用等[29-30]。
本研究从肺炎链球菌D39基因组中克隆出piuA基因,构建pBAD/HisA-piuA重组表达载体,在大肠杆菌Top10菌株中进行异源表达,运用Ni-NTA亲和层析纯化获得纯度大于95%的PiuA蛋白(不含His标签)。盐酸胍在高浓度(4-8 mol/L)水溶液中能断裂氢键,从而使蛋白质发生不同程度的变性,且盐酸胍引起的变性通常是可逆的,可以通过透析的方法使蛋白恢复到天然的状态。由于纯化后的PiuA蛋白溶液呈粉红色,ICP-MS测定结果显示,纯化后的每个PiuA蛋白分子含有一个铁离子,后续的实验需要apo-PiuA蛋白(即不含金属元素的PiuA蛋白),因此我们采用8 mol/L的盐酸胍和25 mmol/L的EDTA去除PiuA蛋白中的血红素从而获得的apo-PiuA蛋白,并通过透析的方法使其恢复到天然的状态,用圆二色谱扫描apo-PiuA蛋白的二级结构可以看出蛋白完全恢复到天然的状态。最后运用ICP-MS、圆二色谱、紫外光谱和荧光光谱手段表征了apo-PiuA蛋白与血红素结合前后的生化性质的变化,实验结果显示PiuA能特异地结合血红素,结合常数K =3.4×105 L/mol;而且PiuA蛋白与血红素结合后,二级结构几乎不发生改变。此外,后续我们将选取国内一些肺炎链球菌分离株进一步研究其中的PiuA蛋白,并比较其与参考株肺炎链球菌D39菌株的异同。这些结果有利于阐明脂蛋白PiuA的血红素结合特性和机理,为开发针对PiuABCD血红素转运系统的抗菌药物提供了理论基础。
| [1] |
van Der Poll T, Opal SM. Pathogenesis, treatment, and prevention of pneumococcal pneumonia[J]. The Lancet, 2009, 374(9700): 1543-1556. DOI:10.1016/S0140-6736(09)61114-4 |
| [2] |
Kadioglu A, Weiser JN, Paton JC, et al. The role of Streptococcus pneumoniae virulence factors in host respiratory colonization and disease[J]. Nature Reviews Microbiology, 2008, 6(4): 288-301. DOI:10.1038/nrmicro1871 |
| [3] |
WHO. Pneumococcal disease[EB/OL]. http://www.who.int/ith/vaccines/pneumococcal/en/
|
| [4] |
Kim GL, Seon SH, Rhee DK. Pneumonia and Streptococcus pneumoniae vaccine[J]. Archives of Pharmacal Research, 2017, 40(8): 885-893. DOI:10.1007/s12272-017-0933-y |
| [5] |
Yesilkaya H, Andisi VF, Andrew PW, et al. Streptococcus pneumoniae and reactive oxygen species: an unusual approach to living with radicals[J]. Trends in Microbiology, 2013, 21(4): 187-195. DOI:10.1016/j.tim.2013.01.004 |
| [6] |
Turner AG, Ong CIY, Walker MJ, et al. Transition metal homeostasis in Streptococcus pyogenes and Streptococcus pneumoniae[J]. Advances in Microbial Physiology, 2017, 70: 123-191. DOI:10.1016/bs.ampbs.2017.01.002 |
| [7] |
Ge RG, Sun XS. Iron acquisition and regulation systems in Streptococcus species[J]. Metallomics, 2014, 6(5): 996-1003. DOI:10.1039/c4mt00011k |
| [8] |
Cassat JE, Skaar EP. Iron in infection and immunity[J]. Cell Host & Microbe, 2013, 13(5): 509-519. |
| [9] |
Nguyen MT, Gotz F. Lipoproteins of gram-positive bacteria: key players in the immune response and virulence[J]. Microbiology and Molecular Biology Reviews, 2016, 80(3): 891-903. DOI:10.1128/MMBR.00028-16 |
| [10] |
Kohler S, Voβ F, Gómez Mejia A, et al. Pneumococcal lipoproteins involved in bacterial fitness, virulence, and immune evasion[J]. FEBS Letters, 2016, 590(21): 3820-3839. DOI:10.1002/feb2.2016.590.issue-21 |
| [11] |
Counago RM, McDevitt CA, Ween MP, et al. Prokaryotic substrate-binding proteins as targets for antimicrobial therapies[J]. Curr Drug Targets, 2012, 13(11): 1400-1410. DOI:10.2174/138945012803530170 |
| [12] |
Yang XY, Sun B, Zhang L, et al. Chemical interference with iron transport systems to suppress bacterial growth of Streptococcus pneumoniae[J]. PLoS One, 2014, 9(8): e105953. DOI:10.1371/journal.pone.0105953 |
| [13] |
Kim HK, DeDent A, Cheng AG, et al. IsdA and IsdB antibodies protect mice against Staphylococcus aureus abscess formation and lethal challenge[J]. Vaccine, 2010, 28(38): 6382-6392. DOI:10.1016/j.vaccine.2010.02.097 |
| [14] |
Ballouche M, Cornelis P, Baysse C. Iron metabolism: a promising target for antibacterial strategies[J]. Recent Patents on Anti-Infective Drug Discovery, 2009, 4(3): 190-205. DOI:10.2174/157489109789318514 |
| [15] |
Kaneko Y, Thoendel M, Olakanmi O, et al. The transition metal gallium disrupts Pseudomonas aeruginosa iron metabolism and has antimicrobial and antibiofilm activity[J]. The Journal of Clinical Investigation, 2007, 117(4): 877-888. DOI:10.1172/JCI30783 |
| [16] |
Yang XY, He K, Du G, et al. Integrated translatomics with proteomics to identify novel iron-transporting proteins in Streptococcus pneumoniae[J]. Frontiers in Microbiology, 2016, 7(1): 78. |
| [17] |
Brown JS, Gilliland SM, Ruiz-Albert J, et al. Characterization of pit, a Streptococcus pneumoniae iron uptake ABC transporter[J]. Infection and Immunity, 2002, 70(8): 4389-4398. DOI:10.1128/IAI.70.8.4389-4398.2002 |
| [18] |
Brown JS, Gilliland SM, Holden DW. A Streptococcus pneumoniae pathogenicity island encoding an ABC transporter involved in iron uptake and virulence[J]. Molecular Microbiology, 2001, 40(3): 572-585. DOI:10.1046/j.1365-2958.2001.02414.x |
| [19] |
Jomaa M, Terry S, Hale C, et al. Immunization with the iron uptake ABC transporter proteins PiaA and PiuA prevents respiratory infection with Streptococcus pneumoniae[J]. Vaccine, 2006, 24(24): 5133-5139. DOI:10.1016/j.vaccine.2006.04.012 |
| [20] |
Jomaa M, Yuste J, Paton JC, et al. Antibodies to the iron uptake ABC transporter lipoproteins PiaA and PiuA promote opsonophagocytosis of Streptococcus pneumoniae[J]. Infection and Immunity, 2005, 73(10): 6852-6859. DOI:10.1128/IAI.73.10.6852-6859.2005 |
| [21] |
Brown JS, Ogunniyi AD, Woodrow MC, et al. Immunization with components of two iron uptake ABC transporters protects mice against systemic Streptococcus pneumoniae infection[J]. Infection and Immunity, 2001, 69(11): 6702-6706. DOI:10.1128/IAI.69.11.6702-6706.2001 |
| [22] |
Chen YX, Zhou CZ, Shi WW. Streptococcus pneumonia PiuA protein fragment and preparation method thereof. China, CN102807611(B)[P]. 2015-01-07. https://worldwide.espacenet.com/publicationDetails/biblio?CC=CN&NR=102807611B&KC=B&FT=D&ND=4&date=20150107&DB=&locale=en_EP
|
| [23] |
Schaible UE, Kaufmann SH. Iron and microbial infection[J]. Nature Reviews Microbiology, 2004, 2(12): 946-953. DOI:10.1038/nrmicro1046 |
| [24] |
Andrews SC, Robinson AK, Rodríguez-Qui ones F. Bacterial iron homeostasis[J]. FEMS Microbiology Reviews, 2003, 27(2/3): 215-237. |
| [25] |
Wilks A, Burkhard KA. Heme and virulence: how bacterial pathogens regulate, transport and utilize heme[J]. Natural Product Reports, 2007, 24(3): 511-522. DOI:10.1039/b604193k |
| [26] |
Haraguchi H. Metallomics as integrated biometal science[J]. Journal of Analytical Atomic Spectrometry, 2004, 19(1): 5-14. DOI:10.1039/b308213j |
| [27] |
Shi W, Chance MR. Metallomics and metalloproteomics[J]. Cellular and Molecular Life Sciences, 2008, 65(19): 3040-3048. DOI:10.1007/s00018-008-8189-9 |
| [28] |
Ding XL, Gao HQ. Applications and experimental methods of circular dichroism spectroscopy[J]. Experimental Technology and Management, 2008, 25(10): 48-52. (in Chinese) 丁晓岚, 高红旗. 圆二色光谱技术应用和实验方法[J]. 实验技术与管理, 2008, 25(10): 48-52. DOI:10.3969/j.issn.1002-4956.2008.10.014 |
| [29] |
Wierzchowski KL. Photochemistry and UV spectroscopy of proteins and nucleic acids[J]. Postepy Biochemii, 2015, 61(3): 242-252. |
| [30] |
Yin YX, Xiang BQ, Tong L. The application of studying fluorescence spectroscopy on protein[J]. Experimental Technology and Management, 2010, 27(2): 33-36, 40. (in Chinese) 尹燕霞, 向本琼, 佟丽. 荧光光谱法在蛋白质研究中的应用[J]. 实验技术与管理, 2010, 27(2): 33-36, 40. DOI:10.3969/j.issn.1002-4956.2010.02.011 |
 2018, Vol. 45
2018, Vol. 45