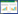扩展功能
文章信息
- 周家智, 石超宏, 朱能武
- ZHOU Jia-Zhi, SHI Chao-Hong, ZHU Neng-Wu
- 绿色木霉菌合成金纳米颗粒的可能性及影响因素
- The possibility and influence factors of biosynthesis gold nanoparticles in Trichoderma viride
- 微生物学通报, 2018, 45(11): 2387-2398
- Microbiology China, 2018, 45(11): 2387-2398
- DOI: 10.13344/j.microbiol.china.171020
-
文章历史
- 收稿日期: 2017-12-02
- 接受日期: 2018-03-19
- 网络首发日期(www.cnki.net): 2018-05-16
2. 广东省农业科学院农业资源与环境研究所 广东 广州 510640;
3. 工业聚集区污染控制与生态修复教育部重点实验室 广东 广州 510006;
4. 固体废物处理与资源化广东省环境保护重点实验室 广东 广州 510006
2. Institute of Agricultural Resources and Environment, Guangdong Academy of Agricultural Sciences, Guangzhou, Guangdong 510640, China;
3. Key Laboratory of Pollution Control and Ecosystem Restoration in Industry Clusters, Ministry of Education, Guangzhou, Guangdong 510006, China;
4. Guangdong Environmental Protection Key Laboratory of Solid Waste Treatment and Recycling, Guangzhou, Guangdong 510006, China
纳米生物技术是一门涉及多学科的技术[1]。金属纳米颗粒具有良好的催化、物理、化学、光学和电子性能[2]。金纳米颗粒(AuNPs)凭借其稳定性、抗氧化性和生物相容性在许多方面有广泛应用,比如光学器件、生物标记、药物运输、催化剂等领域[3-6]。目前,针对金属纳米颗粒的合成方法已开展诸多研究。传统的合成方法如紫外照射法、气溶胶法、光刻法、激光烧蚀法、化学还原法等普遍存在能耗高和成本高及二次污染严重等问题[2, 7-9]。因此,亟需寻找一种清洁、经济、环保的金纳米颗粒合成方法[10-12]。
近年来,利用微生物合成纳米颗粒的研究成果令人振奋[13-14]。许多金属纳米颗粒已被报道可由微生物合成,比如金[3, 6, 11, 15-21]、银[22-23]、铂[24-25]、钯[26];研究者也利用微生物来合成合金纳米颗粒[27-29]。研究表明,菌体耐受Au(Ⅲ)受多种机制调控[15],而Au(Ⅲ)在形成AuNPs前均先被还原为Au(Ⅰ)[17]。金纳米颗粒可通过控制环境因素,在几纳米到几微米的范围内保持高产率[18]。28 kD的蛋白质对金纳米颗粒起形状导向剂的作用[19]。在催化双氯芬酸和三氯乙烯脱氯反应中,使用Pd-Au纳米颗粒后的脱氯速率比只使用Pd和Au颗粒显著提高[25]。真菌在合成纳米颗粒上具有许多优势[30],其中绿色木霉菌(Trichoderma viride)存在于土壤、植物中的纤维素上[31]。本文利用绿色木霉菌合成AuNPs,通过进一步的研究确定微生物合成纳米颗粒的具体机制,并探究合成AuNPs的尺寸、形状、位置等特性和实验参数的关系。目的是探讨绿色木霉菌(Trichoderma viride)在细胞内合成AuNPs的可能性,并研究生物量添加量、初始金离子浓度和溶液的pH对AuNPs特性及合成位置的影响。通过目视检测法、紫外可见(Ultraviolet visible,UV-vis)光谱、X射线衍射(X-ray diffraction,XRD)和透射电镜(Transmission electron microscopy,TEM)等手段分析合成AuNPs的特征。
1 材料与方法 1.1 主要试剂、仪器及培养基氯金酸(HAuCl4),阿拉丁试剂有限公司。火焰原子吸收分光光度计、紫外可见分光光度计,岛津公司;X射线衍射仪、透射电子显微镜,日立公司。
综合马铃薯葡萄糖琼脂培养基(g/L):无水葡萄糖20.0,磷酸二氢钾3.0,七水合硫酸镁1.5,维生素B1 0.01–0.05,待溶解混匀后,用1.0 mol/L的NaOH溶液将培养液的pH调到6.0。
1.2 真菌菌株和生长条件绿色木霉菌(GIM3.141)购自广东省微生物菌种保藏中心。菌种在马铃薯葡萄糖琼脂培养基(PDA)中培养并保藏在冷藏库中以备后用。在进行实验前,将菌种接种到马铃薯葡萄糖(PD)液体培养基中,30 ℃和150 r/min条件下培养。经过3 d的培养,10 ℃、5 000 r/min离心20 min,弃上清后获得T. viride菌体沉淀,用去离子水清洗3次配成菌悬液。
1.3 AuNPs的合成分别选取1、2、4、8 g生物量(湿重)的T. viride,取250 mL锥形瓶作为反应容器,添加100 mL HAuCl4溶液(1 mmol/L),混合溶液在30 ℃、165 r/min条件下培养24 h。AuNPs的形成通过目视检测控制。每间隔6 h通过可见紫外分光光度计测量混合物的吸光度。然后10 ℃、15 000 r/min离心10 min分离反应液,上清液的金离子浓度采用火焰原子吸收分光光度计测量。
探究初始金离子浓度对AuNPs形成及特性的影响:在100 mL HAuCl4溶液中添加8 g生物量的绿色木霉菌,分别控制HAuCl4浓度为0.5、1.0、1.5、2.0 mmol/L进行合成,其余条件同上。
探究溶液pH的影响:在100 mL HAuCl4溶液中添加8 g生物量的绿色木霉菌,通过0.1 mol/L的NaOH或HCl控制pH值为2.0、4.0、6.0和8.0进行培养,其余条件同上。
1.4 AuNPs的特性 1.4.1 紫外可见分光光度计测定采用分光光度计(范围为300-800 nm)测量合成的AuNPs,以去离子水为参照在分辨率为1 nm下操作。AuNPs溶液稀释5倍以避免溶液的高光密度造成的误差。
1.4.2 X射线衍射分析采用X射线衍射对AuNPs进行分析以确定晶体结构。使用装备着Cu Kα射线的D8 ADVANCEX射线衍射仪(波长为0.154 nm)测定,在40 kV电压与40 mA电流下操作。AuNPs装载的生物量通过离心法(10 ℃,15 000 r/min,10 min)收集,用超纯水洗涤3次,然后真空冻干并在研钵中研磨成细粉。测量在2θ角位于20°-90°中,每隔0.02°进行一次测定。
1.4.3 透射电子显微镜研究为了检验合成AuNPs的形态和尺寸,用透射电子显微镜观察,可以确定AuNPs在细胞中合成的确切位置。研究的样品根据Konishi等推荐的方法做准备[32]。AuNPs在10 ℃、15 000 r/min离心10 min,用超纯水洗涤3次后离心收集。取少量菌体悬浮于5 mL含有4%戊二醛的0.1 mol/L二甲基胂酸盐缓冲液中,于4 ℃下前固定(置于冰箱中) 4 h后离心收集并用缓冲液清洗3次,悬浮于2 mL含有1%四氧化锇的0.1 mol/L磷酸盐缓冲液中,于4 ℃固定12 h后离心收集并用缓冲液清洗3次。固定细胞后分别用30%、50%、70%、80%、90%和95%的乙醇水溶液在室温下脱水10 min;紧接着用纯乙醇脱水2次,各15 min;再换成丙酮脱水2次,各15 min。然后,样品分别以1:3、1:1和3:1的树脂丙酮比浸润在环氧树脂中4 h。紧接着用纯树脂处理2次,持续12 h,植入到纯树脂中并在60 ℃聚合24 h,使用超薄切片机切成超薄片,然后放置在包铜炭碳包的TEM网格上,用2%的乙酸双氧铀和柠檬酸铅着色10 min,采用透射电镜进行观察。
2 结果与分析 2.1 绿色木霉菌对合成AuNPs的影响通过一定生物量T. viride与HAuCl4水溶液混合,混合液的颜色渐渐呈现褐色、粉色或紫色,这一过程可说明AuNPs的形成。颜色与色深随着生物量添加量、初始金离子浓度和溶液pH值的不同而变化。研究表明,合成AuNPs的颜色将根据颗粒的形状和粒径从红色到蓝色变化[33]。这种现象是由于AuNPs的表面等离子体共振产生的[20]。通过离心从混合溶液中分离出一定生物量AuNPs,可以发现菌体沉淀是有色的,但上清液是无色的,这表明AuNPs是在细胞内形成。该结果将由紫外可见光谱和透射电镜进一步确定。
如图 1所示,对金纳米颗粒进行XRD是为了确定合成AuNPs的确切晶体结构。2θ角位于38.2°、44.6°、64.9°、77.8°和81.7°分别对应金纳米面心立方结构的(111)、(200)、(220)、(311)和(222)衍射晶面,表明AuNPs纳米颗粒晶体的合成。而且,峰值出现在38.2°,与其余峰值形成强烈对比。反应条件的变化对XRD图谱显示出很小的影响,尽管在衍射峰值位置上有一个轻微的位移,但这是生物合成纳米颗粒的共同特征[34]。
|
| 图 1 生物合成AuNPs的XRD图谱 Figure 1 Representative XRD patterns of biosynthesized AuNPs |
|
|
紫外可见光谱是一种重要的确定金属纳米颗粒合成的方法。图 2表示在反应发生24 h后不同条件下混合溶液的紫外可见吸光度。从图 2中可以明显看出,随着生物量添加量的增加,吸收带的强度也在增加,表明AuNPs生成量在升高。这是因为吸收带的强度与纳米颗粒的数量成正比。同时还可以观察到伴随着生物量添加量的增加,最大吸收波长蓝移的现象。在1、2、4、8 g生物量添加量情况下,吸收峰值分别集中在568、559、546、538 nm。Husseiny等认为,伴随着颗粒尺寸的增大,最大吸收波长倾向于红移,而颗粒尺寸减小会倾向于蓝移[35]。因此,生物量添加量的增加导致颗粒粒径减小,造成了最大吸收波长的蓝移。

|
| 图 2 不同生物量添加量下的混合液紫外全谱图 Figure 2 UV-vis absorbance spectra of the mixture solution under different biomass addition |
|
|
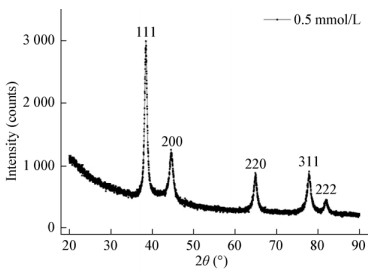
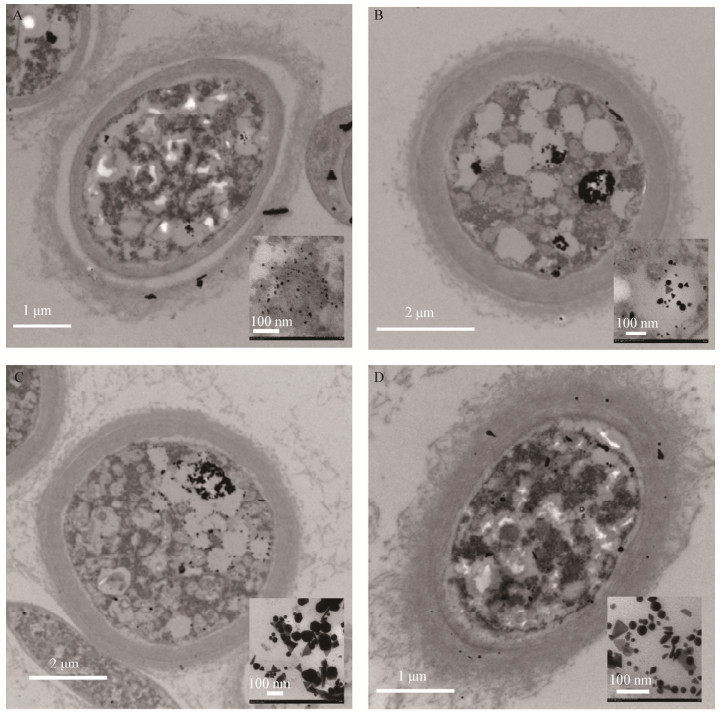
生物量添加量对颗粒特性和粒径分布的影响如图 3所示。AuNPs合成的位置既可以在壁膜间隙,也可以在细胞壁上。在壁膜间隙中观察到小的伪球面、三角形、四边形和六边形AuNPs,而在细胞壁上的AuNPs则大部分是较大的三角形状。图 4是AuNPs的粒径分布图。生物量添加量为1 g或2 g时,AuNPs展现出宽泛的粒度分布范围,从几纳米到超过三百纳米都有;在生物量添加量为4 g和8 g时,生成的AuNPs会在一个相对窄的粒度分布范围内,在4 g生物量添加量时,超过65%的AuNPs粒径范围在20 nm-60 nm间,超过94%的AuNPs小于100 nm;而在8 g生物量添加量情况下,约83%的AuNPs粒径在10 nm-30 nm间,超过98%的AuNPs小于50 nm。总而言之,随着生物量添加量的升高,生成AuNPs的粒径变得更集中。
|
| 图 3 不同生物量添加量合成的AuNPs的透射电镜图 Figure 3 TEM images of AuNPs synthesized with different biomass addition 注:A-D:1、2、4、8 g生物量添加量. Note: A-D: 1, 2, 4, 8 g biomass. |
|
|
|
| 图 4 不同生物量添加量合成的AuNPs粒径分布柱状图 Figure 4 Particle size distribution histograms of AuNPs synthesized with different biomass addition 注:A-D:1、2、4、8 g生物量添加量. Note: A-D: 1, 2, 4, 8 g biomass. |
|
|
图 5表示混合液中初始金离子浓度对合成AuNPs的影响。在初始金离子浓度为0.5 mmol/L和1.0 mmol/L时,只观察到一个吸收峰值;当初始金离子浓度升高到1.5 mmol/L和2.0 mmol/L时,观察到另一个集中在750 nm的低峰值。曾有研究表明,小球面形的AuNPs只展现一个单独的吸收带,但各向异性的颗粒会展现出2–3条吸收带[18]。
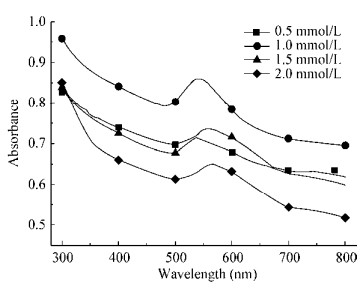
|
| 图 5 不同初始金离子浓度下的混合液紫外全谱图 Figure 5 UV-vis absorbance spectra of the mixture solution under different initial gold ions concentration |
|
|
图 6表示初始金离子浓度对AuNPs特性的影响。当初始金离子浓度为0.5 mmol/L和1.0 mmol/L时,几乎所有的AuNPs在壁膜间隙中合成;当初始金离子浓度升高到1.5 mmol/L或2.0 mmol/L时,许多无定形的AuNPs开始在细胞壁上出现。图 7表示初始金离子浓度对AuNPs粒径分布的影响,随着初始金离子浓度的升高,平均粒径变大,而且粒径分布范围也在变宽。文献[36]指出,金离子首先变成金原子并产生原子核,随后金原子粘附在原子核上,组合成一个金纳米颗粒;在高金离子浓度下,有更多的机会使金原子和原子核接触,因此会产生较大的颗粒,这与我们的实验结果相一致。

|
| 图 6 不同初始金离子浓度合成的AuNPs透射电镜图 Figure 6 TEM images of AuNPs synthesized with different initial gold ions concentration 注:A-D:0.5、1.0、1.5、2.0 mmol/L初始金离子浓度. Note: A-D: 0.5, 1.0, 1.5, 2.0 mmol/L initial gold ions concentration. |
|
|
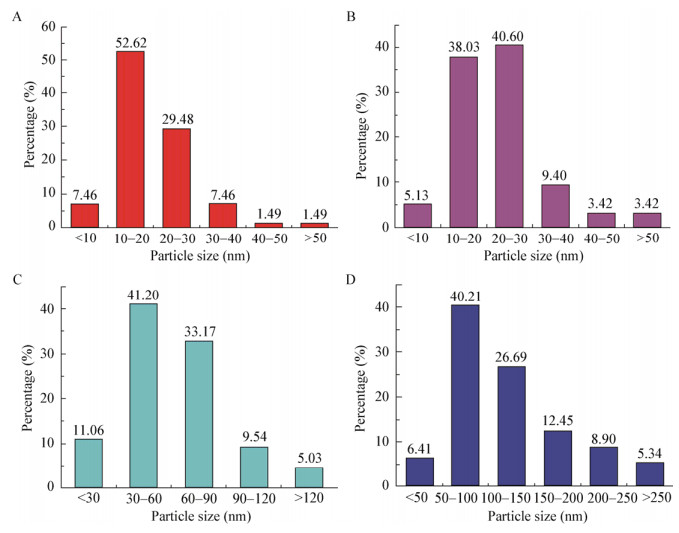
|
| 图 7 不同初始金离子浓度的AuNPs粒径分布柱状图 Figure 7 Particle size distribution histograms of AuNPs synthesized with different initial gold ions concentration 注:A-D:0.5、1.0、1.5、2.0 mmol/L初始金离子浓度. Note: A-D: 0.5, 1.0, 1.5, 2.0 mmol/L initial gold ions concentration. |
|
|
图 8是溶液pH对AuNPs的影响。可以看出,溶液pH对吸收带峰值的位置影响很小,而对吸收带强度的影响更加显著。强酸或强碱条件下会使吸收峰值的强度更强,但其原因还需要进一步研究。
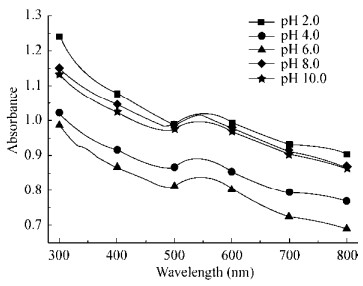
|
| 图 8 不同pH下的混合液紫外全谱图 Figure 8 UV-vis absorbance spectra of the mixture solution under different solution pH |
|
|
图 9和图 10表示溶液pH对AuNPs特性和粒径分布的影响。显然,溶液的pH对AuNPs合成的位置和粒径有很大的影响。当溶液的初始pH调到2.0时,AuNPs大部分在细胞壁上合成,合成的粒径范围从几纳米到超过三百纳米,约70%的AuNPs粒径在50 nm–200 nm的范围内;当溶液pH值调到4.0或更高时,AuNPs在壁膜间隙合成,而且生物合成的AuNPs比pH为2.0时要小。Konishi等[32]的研究表明溶液pH对AuNPs的合成位置有很大的影响,当pH从7.0降到2.0时,会有更大的约为350 nm粒径的AuNPs生成,这与我们的实验结果相一致。
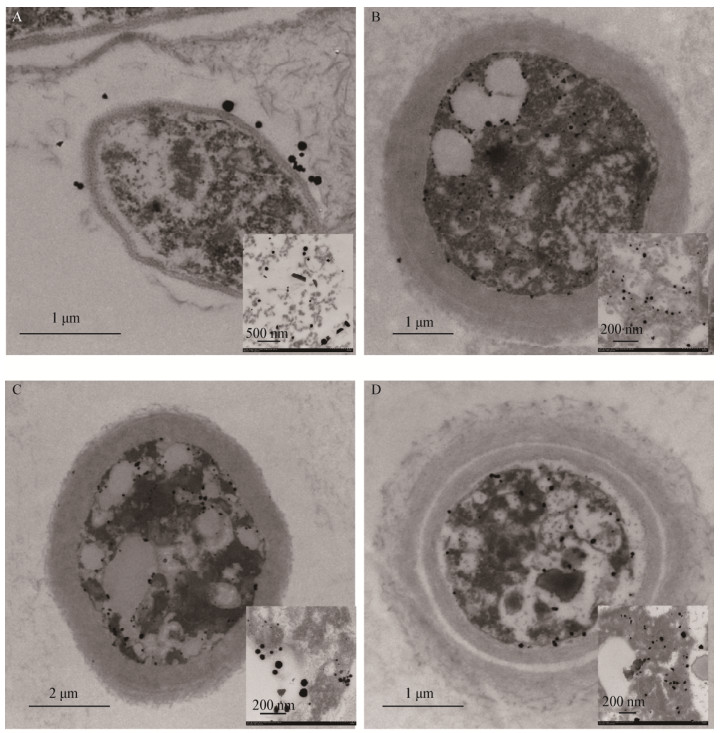
|
| 图 9 不同溶液pH合成的AuNPs透射电镜图 Figure 9 TEM images of AuNPs synthesized with different initial solution pH Note: A: pH 2.0; B: pH 4.0; C: pH 6.0; D: pH 8.0. |
|
|

|
| 图 10 不同溶液pH的AuNPs粒径分布柱状图 Figure 10 Particle size distribution histograms of AuNPs synthesized with different initial solution pH Note: A: pH 2.0; B: pH 4.0; C: pH 6.0; D: pH 8.0. |
|
|
在本实验中,我们通过非致病性真菌绿色木霉菌合成了AuNPs,合成的过程简单、清洁、经济。AuNPs在常温常压下合成,并利用目视检测法、紫外可见分光光度法、X射线衍射、透射电镜进行表征分析。TEM图像显示大部分AuNPs位于壁膜间隙,小部分AuNPs位于细胞壁上。生物量添加量、初始金离子浓度和溶液pH等反应条件对合成AuNPs的形貌和尺寸有很大影响,将来的研究需要进一步探究合成过程中作用的官能团和生物还原剂。
与传统物理、化学方法相比,生物合成金纳米颗粒的方法相对简单、可靠和环保。多种微生物被用于合成纳米颗粒,其中真菌合成的前景更加光明,因为真菌具有更高的耐受性,可分泌大量蛋白质并具有更多的生物量。因此,本实验探究了非致病性真菌绿色木霉菌合成AuNPs的可能性,生物量添加量、初始金离子浓度和溶液pH等反应条件在生物合成过程中的影响以及合成AuNPs的特性。
当AuNPs在溶液中呈现多种颜色时,首先要用目视检测法对颜色变化进行观察,以确定AuNPs的形成。但颜色的亮度和颜色的变换会因实验条件的不同而改变。有研究表明,采用Trichoderma viride合成AuNPs是由生物吸附过程和相对缓慢的生物还原过程组成的[37]。反应体系可通过UV-vis进行分析,多数AuNPs在520-560 nm出现特征吸收峰是由于表面等离子体共振效应(Surface plasmon resonance,SPR)引起的[38]。这一现象说明合成的AuNPs非常稳定,而且没有聚合现象出现。细胞分泌的蛋白质很可能起到结合并稳定AuNPs的作用[9]。据报道,蛋白质可以粘附在金属纳米颗粒上,通过游离胺基、半胱氨酸残基、羧基或羰基覆盖在金属纳米颗粒表面,以避免AuNPs的凝聚,使其变得稳定[5, 13, 16, 20]。
除了目视检测法与紫外可见光谱分析以外,AuNPs的合成由X射线衍射和透射电镜分析进一步表明。2θ角位于38.2°、44.6°、64.9°、77.8°和81.7°分别对应金纳米面心立方结构的(111)、(200)、(220)、(311)和(222)衍射晶面,表明AuNPs纳米颗粒晶体的合成。TEM图像清晰地表明反应条件对AuNPs的合成位置和粒径分布的调控。简而言之,生物量添加量和溶液pH的增加,或初始金离子浓度的减少,对合成小粒径和窄的粒径分布范围AuNPs是有利的,这个结论与许多研究结果一致。Pimprikar等[33]报道细胞数量的增长导致AuNPs粒径的缩小,而平均粒径随着金离子溶液浓度的增大而增大。Das等[3]也报道过,AuNPs的粒径与金离子浓度和真菌菌株Rhizopus oryzae中提取出的无细胞蛋白质的比值之间是正相关关系。He等[39]把pH看作是调控AuNPs粒径和形状的最重要因素:当溶液pH 7.0时,大部分颗粒呈现球形且粒径范围在10 nm-20 nm间;当溶液pH 4.0时大部分纳米颗粒呈现三角形且粒径范围在50 nm-400 nm间。
已有研究普遍认为,金离子首先在细胞壁上被吸附,这些被吸附的离子,一部分直接还原成AuNPs并粘附在细胞壁上,另一部分被运输到细胞质中被小分子物质还原,其AuNPs的合成位置在壁膜间隙上[17]。在金离子还原和AuNPs的形成过程中,金离子首先被还原成金原子,作为后续形成AuNPs的晶核,之后获得的金原子会聚集在晶核上,最终形成不同形貌和粒径的AuNPs。在金离子浓度不变的情况下,菌体生物量投加量的提高会使AuNPs的合成位点增多,AuNPs的合成量提高,颗粒平均粒径变小。据研究,许多官能团如羧基、羰基、羟基和氨基会参与生物吸附和还原过程[3, 28],微生物可以在胞内外或细胞膜上还原Au(Ⅲ)并形成AuNPs,合成位点可能取决于参与还原的酶的亚细胞定位。此外,pH也是影响还原场所和合成位置的重要因素,推测其原因是在低pH条件下,溶液有较高浓度质子,从而使官能团带正电荷,促进氯金酸阴离子与质子化的有效官能团之间的静电作用,提高AuNPs的合成量。一些研究者甚至在基因层面探究金纳米颗粒的生物合成机制,发现Au(Ⅲ)和菌体孵育一定时间后,基因簇中特定功能基因上调表达,导致金盐的还原沉淀,最终使得Au(Ⅰ)-C和AuNPs合成[15]。由于丰富的生物多样性,有必要做更深层次的研究来探索金属纳米颗粒合成的具体机制,以发现可稳定还原和充当封端剂蛋白质的基因工程微生物,从而达到更好地调控金属纳米颗粒的形状、粒径、分散度的效果,甚至实现大规模生物合成金属纳米颗粒的目标,以降低成本和对环境的影响。
| [1] |
Narayanan KB, Sakthivel N. Facile green synthesis of gold nanostructures by NADPH-dependent enzyme from the extract of Sclerotium rolfsii[J]. Colloids & Surfaces A: Physicochemical & Engineering Aspects, 2011, 380(1/3): 156-161. |
| [2] |
Narayanan KB, Sakthivel N. Biological synthesis of metal nanoparticles by microbes[J]. Advances in Colloid & Interface Science, 2010, 156(1/2): 1-13. |
| [3] |
Das SK, Das AR, Guha AK. Microbial synthesis of multishaped gold nanostructures[J]. Small, 2010, 6(9): 1012-1021. DOI:10.1002/smll.200902011 |
| [4] |
Srivastava SK, Yamada R, Ogino C, et al. Biogenic synthesis and characterization of gold nanoparticles by Escherichia coli K12 and its heterogeneous catalysis in degradation of 4-nitrophenol[J]. Nanoscale Research Letters, 2013, 8(1): 70. DOI:10.1186/1556-276X-8-70 |
| [5] |
Sharma N, Pinnaka AK, Raje M, et al. Exploitation of marine bacteria for production of gold nanoparticles[J]. Microbial Cell Factories, 2012, 11(1): 86. DOI:10.1186/1475-2859-11-86 |
| [6] |
Suresh AK, Pelletier DA, Wang W, et al. Biofabrication of discrete spherical gold nanoparticles using the metal-reducing bacterium Shewanella oneidensis[J]. Acta Biomaterialia, 2011, 7(5): 2148-2152. DOI:10.1016/j.actbio.2011.01.023 |
| [7] |
Sadhasivam S, Shanmugam P, Yun K. Biosynthesis of silver nanoparticles by Streptomyces hygroscopicus and antimicrobial activity against medically important pathogenic microorganisms[J]. Colloids & Surfaces B: Biointerfaces, 2010, 81(1): 358-362. |
| [8] |
Castro-Longoria E, Vilchis-Nestor AR, Avalos-Borja M. Biosynthesis of silver, gold and bimetallic nanoparticles using the filamentous fungus Neurospora crassa[J]. Colloids & Surfaces B: Biointerfaces, 2011, 83(1): 42-48. |
| [9] |
Binupriya AR, Sathishkumar M, Yun SI. Biocrystallization of silver and gold ions by inactive cell filtrate of Rhizopus stolonifer[J]. Colloids & Surfaces B: Biointerfaces, 2010, 79(2): 531-534. |
| [10] |
Thirumurugan A, Ramachandran S, Tomy NA, et al. Biological synthesis of gold nanoparticles by Bacillus subtilis and evaluation of increased antimicrobial activity against clinical isolates[J]. Korean Journal of Chemical Engineering, 2012, 29(12): 1761-1765. DOI:10.1007/s11814-012-0055-7 |
| [11] |
Cao YL, Zhu NW, Shi CH, et al. Influence factors and mechanisms of Au3+ biosorption by S. haliotis[J]. Acta Scientiae Circumstantiae, 2016, 36(6): 1962-1970. (in Chinese) 操艳兰, 朱能武, 石超宏, 等. 鲍希瓦氏菌吸附Au3+的影响因素及机理研究[J]. 环境科学学报, 2016, 36(6): 1962-1970. |
| [12] |
Manivasagan P, Venkatesan J, Senthilkumar K, et al. Biosynthesis, antimicrobial and cytotoxic effect of silver nanoparticles using a novel Nocardiopsis sp. MBRC-1[J]. BioMed Research International, 2013, 2013: Article ID 287638. |
| [13] |
Gupta S, Devi S, Singh K. Biosynthesis and characterization of Au-nanostructures by metal tolerant fungi[J]. Journal of Basic Microbiology, 2011, 51(6): 601-606. DOI:10.1002/jobm.v51.6 |
| [14] |
Wu SM, Su YL, Ma LY, et al. Synthesis of nanoparticles using microorganisms: a review of its mechanism[J]. Microbiology China, 2014, 41(12): 2516-2524. (in Chinese) 吴盛美, 苏义龙, 马丽雅, 等. 基于微生物生物合成纳米颗粒机制的研究进展[J]. 微生物学通报, 2014, 41(12): 2516-2524. |
| [15] |
Reith F, Etschmann B, Grosse C, et al. Mechanisms of gold biomineralization in the bacterium Cupriavidus metallidurans[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(42): 17757-17762. DOI:10.1073/pnas.0904583106 |
| [16] |
Binupriya AR, Sathishkumar M, Vijayaraghavan K, et al. Bioreduction of trivalent aurum to nano-crystalline gold particles by active and inactive cells and cell-free extract of Aspergillus oryzae var. viridis[J]. Journal of Hazardous Materials, 2010, 177(1/3): 539-545. |
| [17] |
Das SK, Liang JN, Schmidt M, et al. Biomineralization mechanism of gold by zygomycete fungi Rhizopous oryzae[J]. ACS Nano, 2012, 6(7): 6165-6173. DOI:10.1021/nn301502s |
| [18] |
Xie JP, Lee JY, Ting YP. High-yield synthesis of complex gold nanostructures in a fungal system[J]. The Journal of Physical Chemistry C, 2007, 111(45): 16858-16865. DOI:10.1021/jp0752668 |
| [19] |
Xie JP, Lee JY, Wang DIC, et al. Identification of active biomolecules in the high-yield synthesis of single-crystalline gold nanoplates in algal solutions[J]. Small, 2007, 3(4): 672-682. DOI:10.1002/(ISSN)1613-6829 |
| [20] |
Kalishwaralal K, Deepak V, Pandian SBRK, et al. Biosynthesis of silver and gold nanoparticles using Brevibacterium casei[J]. Colloids and Surfaces B: Biointerfaces, 2010, 77(2): 257-262. DOI:10.1016/j.colsurfb.2010.02.007 |
| [21] |
Liu ZY, Zhou H, Shen E, et al. Recent advances in microbes-mediated biosynthesis of gold nanoparticles[J]. Microbiology China, 2015, 42(8): 1584-1592. (in Chinese) 刘紫嫣, 周豪, 沈娥, 等. 微生物介导的金纳米颗粒合成[J]. 微生物学通报, 2015, 42(8): 1584-1592. |
| [22] |
Balaji DS, Basavaraja S, Deshpande R, et al. Extracellular biosynthesis of functionalized silver nanoparticles by strains of Cladosporium cladosporioides fungus[J]. Colloids & Surfaces B: Biointerfaces, 2009, 68(1): 88-92. |
| [23] |
Kathiresan K, Manivannan S, Nabeel MA, et al. Studies on silver nanoparticles synthesized by a marine fungus, Penicillium fellutanum isolated from coastal mangrove sediment[J]. Colloids & Surfaces B: Biointerfaces, 2009, 71(1): 133-137. |
| [24] |
Syed A, Ahmad A. Extracellular biosynthesis of platinum nanoparticles using the fungus Fusarium oxysporum[J]. Colloids & Surfaces B: Biointerfaces, 2012, 97: 27-31. |
| [25] |
Shang R, Zhu NW, Kang NX, et al. Bio-inspired recovery of platinum nanoparticle and its mechanism[J]. Environmental Science, 2016, 37(7): 2799-2806. (in Chinese) 商儒, 朱能武, 康乃馨, 等. 生物法回收贵金属铂纳米颗粒及其机制[J]. 环境科学, 2016, 37(7): 2799-2806. |
| [26] |
Bunge M, Søbjerg LS, Rotaru AE, et al. Formation of palladium(0) nanoparticles at microbial surfaces[J]. Biotechnology & Bioengineering, 2010, 107(2): 206-215. |
| [27] |
Chen HM, Sun DH, Jiang XD, et al. Fabrication of Au/Pd alloy nanoparticle/Pichia pastoris composites: a microorganism- mediated approach[J]. RSC Advances, 2013, 3(35): 15389-15395. DOI:10.1039/c3ra41215f |
| [28] |
Deplanche K, Merroun ML, Casadesus M, et al. Microbial synthesis of core/shell gold/palladium nanoparticles for applications in green chemistry[J]. Journal of the Royal Society Interface, 2012, 9(72): 1705-1712. DOI:10.1098/rsif.2012.0003 |
| [29] |
de Corte S, Hennebel T, Fitts JP, et al. Biosupported bimetallic Pd-Au nanocatalysts for dechlorination of environmental contaminants[J]. Environmental Science & Technology, 2011, 45(19): 8506-8513. |
| [30] |
Das SK, Dickinson C, Lafir F, et al. Synthesis, characterization and catalytic activity of gold nanoparticles biosynthesized with Rhizopus oryzae protein extract[J]. Green Chemistry, 2012, 14(5): 1322-1334. DOI:10.1039/c2gc16676c |
| [31] |
Wickel SM, Citron CA, Dickschat JS. 2H-Pyran-2-ones from Trichoderma viride and Trichoderma asperellum[J]. European Journal of Organic Chemistry, 2013, 2013(14): 2906-2913. DOI:10.1002/ejoc.201300049 |
| [32] |
Konishi Y, Tsukiyama T, Tachimi T, et al. Microbial deposition of gold nanoparticles by the metal-reducing bacterium Shewanella algae[J]. Electrochimica Acta, 2007, 53(1): 186-192. DOI:10.1016/j.electacta.2007.02.073 |
| [33] |
Pimprikar PS, Joshi SS, Kumar AR, et al. Influence of biomass and gold salt concentration on nanoparticle synthesis by the tropical marine yeast Yarrowia lipolytica NCIM 3589[J]. Colloids and Surfaces B: Biointerfaces, 2009, 74(1): 309-316. DOI:10.1016/j.colsurfb.2009.07.040 |
| [34] |
Mishra A, Tripathy SK, Wahab R, et al. Microbial synthesis of gold nanoparticles using the fungus Penicillium brevicompactum and their cytotoxic effects against mouse mayo blast cancer C2C12 cells[J]. Applied Microbiology and Biotechnology, 2011, 92(3): 617-630. DOI:10.1007/s00253-011-3556-0 |
| [35] |
Husseiny MI, El-Aziz MA, Badr Y, et al. Biosynthesis of gold nanoparticles using Pseudomonas aeruginosa[J]. Spectrochimica Acta Part A: Molecular & Biomolecular Spectroscopy, 2007, 67(3/4): 1003-1006. |
| [36] |
Cai F, Li J, Sun JS, et al. Biosynthesis of gold nanoparticles by biosorption using Magnetospirillum gryphiswaldense MSR-1[J]. Chemical Engineering Journal, 2011, 175: 70-75. DOI:10.1016/j.cej.2011.09.041 |
| [37] |
de Corte S, Hennebel T, Verschuere S, et al. Gold nanoparticle formation using Shewanella oneidensis: a fast biosorption and slow reduction process[J]. Journal of Chemical Technology & Biotechnology, 2011, 86(4): 547-553. |
| [38] |
Verma VC, Kharwar RN, Singh SK, et al. Correction: biofabrication of anisotropic gold nanotriangles using extract of endophytic Aspergillus clavatus as a dual functional reductant and stabilizer[J]. Nanoscale Research Letters, 2011, 6(1): 261. DOI:10.1186/1556-276X-6-261 |
| [39] |
He SY, Guo ZR, Zhang Y, et al. Biosynthesis of gold nanoparticles using the bacteria Rhodopseudomonas capsulata[J]. Materials Letters, 2007, 61(18): 3984-3987. DOI:10.1016/j.matlet.2007.01.018 |
 2018, Vol. 45
2018, Vol. 45